Что такое нейтропения у детей до года
Врожденные нейтропении
Врожденные нейтропении – это группа генетически детерминированных заболеваний, которые характеризуются снижением уровня нейтрофильных лейкоцитов ниже 1500/мкл, а у детей до 1 года – ниже 1000/мкл. Клинически это проявляется частными бактериальными инфекциями, задержкой в психофизическом развитии. Наиболее распространенным признаком врожденных нейтропений являются частые гингивиты и стоматиты. Диагноз выставляется на основании анамнеза, данных осмотра, общего анализа крови и миелограммы. Тактика лечения зависит от формы патологии. Для стимуляции синтеза нейтрофильных гранулоцитов применяется гранулоцитарный колониестимулирующий фактор (Г-КСФ).
Общие сведения
Врожденные нейтропении – это группа наследственных патологий, которые передаются по аутосомно-доминантному или аутосомно-рецессивному типу и проявляются уменьшением количества нейтрофилов в периферической крови. Все заболевания, входящие в эту группу, были описаны в ХХ веке:
Встречаются данные патологии редко. Распространенность колеблется от 1-2:100000 до 1 случая на 1 млн. младенцев. Врожденными нейтропениями с одинаковой частотой болеют как мальчики, так и девочки. Прогноз зависит от формы заболевания, при синдроме Костмана летальность достигает 97-100%, в то время как при семейной доброкачественной нейтропении исход, как правило, благоприятный.
Причины врожденных нейтропений
Врожденные нейтропении – это генетически обусловленные заболевания, которые наследуются по аутосомно-доминантному или аутосомно-рецессивному типу. Синдром Костмана проявляется мутацией в гене ELA2, находящемся на 19р13.3. Данный ген кодирует фермент – нейтрофильную эластазу. Точная роль ее неизвестна, но, вероятнее всего, при ее дефекте у нейтрофилов еще в костном мозге запускается процесс апоптоза.
Реже данная патология может быть вызвана дефектами генов GFII и 6-CSFR, кодирующих фактор активации эластазы нейтрофилов и рецепторы к гранулоцитарно-макрофагальному колониестимулирующему фактору. Циклическая врожденная нейтропения также развивается на фоне мутации ELA2, однако, апоптоз при данной форме проходит не так интенсивно, что обеспечивает менее выраженный дефицит нейтрофилов. Эти две формы врожденных нейтропении наследуются по аутосомно-рецессивному типу.
Синдром «ленивых лейкоцитов» возникает на фоне нарушения процесса выхода гранулоцитов из костного мозга в системный кровоток. Патогенез данной формы врожденной нейтропении основывается на мутации белка, кодирующего клеточную мембрану нейтрофилов, а также их ускоренном апоптозе. При семейной доброкачественной нейтропении у детей нарушается процесс дифференциации гранулоцитов в костном мозге – нейтрофилы остаются на стадии метамиелоцитов. Также существует целый ряд врожденных синдромов, одним из проявлений которых является уменьшение количества нейтрофильных лейкоцитов. Сюда относятся синдром гипер-IgM, ретикулярная дисгенезия, синдром Чедиака-Хигаси, синдром Швахмана-Даймонда, Барта и др.
Классификация
В педиатрии нейтропении разделяются на врожденные и приобретенные формы. К врожденным относятся:
Симптомы врожденных нейтропений
Клинические картины различных форм врожденной нейтропении имеют как общие аспекты, так и определенные различия. При всех видах часто возникают воспалительные заболевания органов, тесно контактирующих с внешней средой и наиболее чувствительных к ослаблению иммунной системы. Сюда относятся кожа, слизистая оболочка рта, трахеобронхиальное дерево, легкие, внешнее и среднее ухо. Также почти всегда присутствуют астеновегетативный и интоксикационный синдромы. Однако возраст, в котором манифестирует врожденная нейтропения, частота и степень тяжести обострений могут существенно варьировать.
Синдром Костмана характеризуется выраженной симптоматикой уже в первые месяцы жизни ребенка. Первичные признаки – лихорадка неясной этиологии, частые бактериальные заболевания кожи и подкожной жировой клетчатки (фурункулы, флегмоны). У таких детей медленно заживают пупочные ранки, плохо поддается лечению омфалит. Может наблюдаться задержка в психическом и физическом развитии. Постепенно присоединяются гепатоспленомегалия и лимфаденопатия. Характерный признак врожденной нейтропении – поражение слизистых оболочек рта и десен (гингивит и стоматит). При синдроме Костмана также отмечаются рецидивирующие пневмонии, абсцессы легких, циститы, отиты, уретриты, пиелонефриты, гастродуодениты, парапроктиты, перитониты и т. д. Все перечисленные патологии склонны к генерализации, что без раннего лечения приводит к развитию сепсиса и смерти.
Циклическая нейтропения проявляется в возрасте до 1 года. Также характеризуется поражением кожи, внешнего уха, слизистых оболочек рта и десен. Типичной особенностью данной формы врожденной нейтропении является периодичность рецидивов. Обострения могут возникать каждые 14-49 дней, зачастую – каждые 3 недели. В тяжелых случаях, особенно при инфицировании анаэробной микрофлорой, развиваются тяжелые осложнения в виде перитонита и сепсиса, однако их вероятность значительно меньше, чем при синдроме Костмана. С возрастом частота и тяжесть рецидивов снижаются.
Семейная доброкачественная нейтропения проявляется в возрасте от 2-3 месяцев до 1 года. В клинической картине этой врожденной нейтропении превалируют редкие гингивиты и стоматиты, фурункулез. Еще реже встречаются отиты и поражения легких. Перечисленные заболевания, как правило, протекают в легкой форме, общее состояние ребенка нарушено мало. Клиническая картина синдрома «ленивых лейкоцитов» наблюдается уже на первых месяцах жизни. Наиболее часто у пациентов диагностируются бактериальные поражения верхних дыхательных путей (ларингиты, фарингиты, трахеиты), пневмонии, гингивиты и стоматиты.
Диагностика
Диагностика врожденных нейтропений основывается на сборе анамнестических данных, физикальном обследовании, результатах лабораторных и инструментальных исследований. Из анамнеза педиатром или неонатологом обязательно устанавливается наличие подобных наследственных заболеваний у родителей или других родственников. Физикальное обследование может выявить умеренное отставание в физическом развитии, лимфаденопатию, гепатоспленомегалию. При развитии бактериальных осложнений будут обнаруживаться другие специфические изменения.
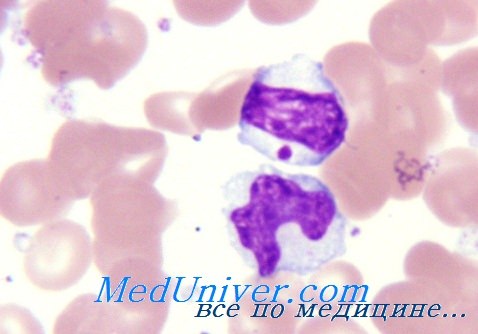
Основа диагностики врожденных нейтропений – общий анализ крови и миелограмма. В ОАК определяется снижение уровня лейкоцитов ниже 4,5х109/л, а нейтрофильных гранулоцитов – до 1000/мкл и ниже у грудных детей и до 1500/мкл и ниже у детей старше 1 года. Врожденные нейтропении почти всегда сопровождаются моноцитозом и эозинофилией. В зависимости от формы уровень нейтрофилов может варьировать, как и изменения в костном мозге при его пункции. В миелограмме при синдроме Костмана выявляются только клетки-предшественники нейтрофилов – миелобласты, промиелоциты, миелоциты.
Циклическая нейтропения также проявляется отсутствием зрелых форм, однако при повторных тестах может обнаруживаться лейкоцитоз. Миелограмма при семейной доброкачественной нейтропении характеризуется большим числом метамиелоцитов и дефицитом зрелых нейтрофилов. Синдром «ленивых лейкоцитов» проявляется чрезмерным насыщением костного мозга клетками всех этапов дифференциации, в том числе и зрелыми. Другие изменения в лабораторных или инструментальных тестах соответствуют возникшим осложнениям врожденных нейтропений. При необходимости выполняется генодиагностика.
Лечение врожденных нейтропений
Лечение врожденных нейтропений зависит от формы патологии. Основу терапии составляет гранулоцитарный колониестимулирующий фактор (Г-КСФ). Данный гормональный препарат стимулирует синтез и дифференциацию нейтрофильных гранулоцитов в костном мозге. При синдроме Костмана и условии отсутствия генной мутации Г-КСФ применяется пожизненно. Также при данной форме врожденной нейтропении может проводиться пересадка костного мозга. При циклической нейтропении Г-КСФ назначается за 2-3 дня до развития агранулоцитоза. Доброкачественная семейная нейтропения и синдром «ленивых лейкоцитов», как правило, не требуют использования Г-КСФ за исключением тяжелых форм.
При развитии бактериальных осложнений на фоне врожденной нейтропении осуществляется массивная антибактериальная терапия. Как правило, назначаются антибиотики широкого спектра действия – цефалоспорины III-IV поколения, макролиды. В тяжелых случаях могут применяться внутривенные иммуноглобулины. При необходимости проводят дезинтоксикационную терапию, по показаниям используют симптоматические средства.
Прогноз и профилактика
Прогноз при разных формах врожденных нейтропений различается. При синдроме Костмана большинство детей умирают от тяжелых, резистентных к лечению бактериальных осложнений на протяжении первых месяцев жизни. Циклическая нейтропения и синдром «ленивых лейкоцитов» имеют более благоприятный прогноз – летальный исход возможен только при тяжелых вариантах течения и отсутствии своевременной диагностики. Семейная доброкачественная нейтропения в большинстве случаев не приводит к смерти ребенка – с возрастом число нейтрофилов возрастает, иммунитет стабилизируется.
Специфической профилактики врожденных нейтропений не существует. Неспецифические превентивные меры включают в себя оценку риска развития генетических мутаций у ребенка еще до его рождения путем медико-генетического консультирования. Данное обследование можно пройти у врача-генетика в специализированных центрах. Уже беременным женщинам проводят кордоцентез, амниоцентез, плаценто- или хориоцентез с последующим кариотипированием. С целью профилактики спонтанных мутаций, которые также могут сопровождаться врожденными нейтропениями, на период беременности следует полностью исключить воздействие всех тератогенных факторов на плод. В их число входят алкоголь, наркотики, табачные изделия, химикаты, ионизирующее излучение, некоторые медикаменты и др.
Что такое нейтропения у детей до года
Об иммунной нейтропении говорят при обнаружении в сыворотке крови антител к нейтрофилам. Эти антитела могут фиксировать комплемент или опсонизировать нейтрофилы, что приводит к их лизису или фагоцитозу в селезенке.
Аллоиммунная нейтропения новорожденных. Эта форма нейтропении обусловлена трансплацентарным переносом материнских аллоантител (класса IgG) к антигенам нейтрофилов ребенка, подобно тому, как при гемолитической болезни из-за несовместимости по антигенам системы Rh. 1 акие антитела обычно фиксируют комплемент и направлены против антигенов, специфических Для нейтрофилов. У детей в первые 2 нед. жизни наблюдаются позднее отпадение пуповины, кожные инфекции, лихорадка и пневмония. Инфекции поддаются лечению антибиотиками.
Нейтропения, часто тяжелая, развивается на фоне лихорадки и обычных для новорожденных микробных инфекциях. К 7-недельному возрасту, когда из крови ребенка исчезают материнские антитела, число нейтрофилов нормализуется. Лечение сводится к поддерживающим мероприятиям и применению антибиотиков при инфекциях.
Аутоиммунная нейтропения. Аутоиммунная нейтропения аналогична аутоиммунной гемолитической анемии и тромбоцитопении. Аутоантитела к нейтрофилам могут обнаруживаться как в отсутствие других признаков аутоиммунных заболеваний, так и у больных с аутоантителами к эритроцитам/тромбоцитам или с заболеваниями соединительной ткани. Аутоиммунная отличается от других форм нейтропении не гистологической картиной костного мозга, а лишь присутствием в крови антител к нейтрофилам. Она часто наблюдается у детей с врожденными или приобретенными иммунодефицитами, в том числе дисгаммаглобулинемией.
Детская аутоиммунная нейтропения. По мере все возрастающей доступности методов выявления антител к нейтрофилам это доброкачественное состояние обнаруживается все чаще. В силу своей доброкачественности оно может быть распространено больше, чем считается в настоящее время. По данным одного из исследований, аутоиммунная нейтропения ежегодно развивается у 1 из 100 000 детей от грудного до 10-летнего возраста. У всех больных в момент обследования имелась тяжелая нейтропения (абсолютное количество нейтрофилов менее 500 в 1 мкл), но общее число лейкоцитов оставалось нормальным.
Иногда наблюдается моноцитоз или эозинофилия, но это, по-видимому, не влияет на частоту инфекций. Заболевание обычно диагностируют в возрасте от 5 до 15 мес; отношение девочек к мальчикам 6:4. В описанных случаях признаков других аутоиммунных заболеваний не было. Среди инфекционных заболеваний отмечались средний отит, гингивит, инфекции дыхательных путей, гастроэнтерит и панникулит. Иногда развиваются и более тяжелые инфекции, включая пневмонии, сепсис и абсцессы. Продолжительность детской аутоиммунной нейтропении составляет в среднем примерно 7-24 мес. Введение рекомбинантного Г-КСФ человека позволяет снизить частоту тяжелых инфекций и отложить необходимые оперативные вмешательства.
Аутоиммунная нейтропения новорожденных. Преходящая нейтропения встречается у новорожденных, матери которых страдают аутоиммунными заболеваниями. Продолжительность этой нейтропении зависит от времени исчезновения материнских аутоантител класса IgG из крови ребенка. В большинстве случаев она сохраняется в течение нескольких недель или месяцев и почти всегда протекает бессимптомно.
Нейтропения при неэффективном миелопоэзе. Причиной неэффективного миелопоэза может быть недостаточность витамина В12, развивающаяся после резекции дистальных отделов подвздошной кишки, или дефицит фолиевой кислоты. Длительное применение антибиотиков, блокирующих обмен фолиевой кислоты (например, триметоприм/сульфаметоксазола), или фенитоина, который нарушает всасывание фолата в тонкой кишке, приводит к мегалобластной панцитопении. Нейтропения у детей развивается также при голодании, маразме, нервной анорексии, а иногда при длительном парентеральном питании.
Нейтропения
Нейтрофилы – это самая многочисленная группа гранулоцитов, основной функцией которых является фагоцитоз (уничтожение) патогенной флоры в организме человека.
Нейтропения – это уменьшение количества нейтрофилов в крови, что приводит к риску возникновения бактериальных и грибковых инфекций.
В здоровом состоянии защиту иммунных «границ» предоставляют зрелые сегментоядерные нейтрофилы. Помогают «контролировать» ситуацию и более молодые – палочкоядерные нейтрофилы, но их намного меньше (это хорошо видно по результату анализа крови, где в норме зрелых нейтрофилов насчитывается от 42-72%, а молодых всего от 1-6%).
Но, в случае возникновения тех или других заболеваний, соотношение всех видов нейтрофилов (сегментоядерных, палочкоядерных, миелоцитов, метамиелоцитов) резко нарушается, что приводит к патологическому повышению нейтрофилов или их уменьшению (нейтропении).
При этом количество нейтрофилов в крови человека — не стабильно, в отличие от других клеточных групп лейкоцитарной формулы. На созревание, развитие и нормальное соотношения данных гранулоцитов, влияют не только врожденные, приобретенные патологии, но и резкое эмоциональное потрясение, стресс нарушение рациона питания и т.д.
Нейтропения у детей должна быть тщательным образом исследована, чтобы предотвратить как тяжелые патологии, так и радикальное лечение без серьезных на то причин.
Классификация степеней тяжести нейтропении:
Если уровень нейтрофилов критически снижается – это приводит к развитию инфекции в кишечнике, во рту, вызывая тем самым расстройство пищеварительной системы, гингивиты, стоматиты, грибковые поражения кожи и т.д.
Тяжелая нейтропения при наличии онкопатологии крайне неблагоприятно влияет на работу иммунной системы, приводя к прогрессирующим воспалениям и инфекциям, вплоть до летального исхода.
Этиология
Нейтрофилы развиваются в костном мозге в течение 15 дней, находятся в кровеносном русле около 8 часов, составляют подавляющую клеточную часть лейкоцитарной формулы и при обнаружении «вредителей» тут же отправляются на их ликвидацию.
Основные причины нейтропении, которые нарушают данный физиологический процесс:
Нейтропения у детей, также может развиться в связи с нарушением работы поджелудочной железы и заторможенным умственным развитием (синдром Швахмана-Даймонда-Оски).
Нейтропения разделяется на:
Острая нейтропения развивается стремительно на фоне быстрого потребления/разрушения нейтрофилов, хроническая — из-за сокращения выработки гранулоцитов или же избыточной селезеночной секреции.
Первичная нейтропения связанная с внутренними нарушениями (врожденные патологии, идиопатическая нейтропения, циклическая нейтропения, доброкачественная этническая), вторичная — обусловлена влиянием внешних факторов на созревание и развитие клеток костного мозга.
Вторичная нейтропения
Вторичная нейтропения чаще всего развивается вследствие:
Вторичная нейтропения провоцирует патологии:
В случае с вторичной нейтропенией лечить нужно не «анализ» крови, а пациента с конкретными симптоматическими проявлениями.
Первичную и вторичную нейтропению стоит различать, так как в первом случае понижение уровня нейтрофилов – это единственное проявление, тогда как вторичные развиваются на основе инфекций, системных аутоиммунных патологий и онко неоплазий.
Клинические проявления
В большинстве случае нейтропения протекает без каких-либо признаков. Симптомы снижения нейтрофилов обычно возникают только тогда, если развилась вторичная нейтропения, на фоне тех или других патологий.
Общая симптоматика нейтропении:
В результате резкого понижения гранулоцитов, также может развиться фебрильная нейтропения. Это лихорадочное состояние отягощенное тахикардией, тремором, ознобом, повышением АД, вплоть до развития сердечно-сосудистого коллапса.
Фебрильная нейтропения обычно развивается вследствие онкопатологий, воздействия лучевой или химиотерапии, в виде гиперергической реакции организма на токсические влияния (цитостатиков, распад здоровых и онкоклеток).
Может проявляться и на фоне тяжелого инфекционного процесса, который провоцируют стафилококки, стрептококки, клостридии, реже грибки и вирусы. В более редких случаях фебрильная нейтропения может развиться на основе первичной аутоиммунной нейтропении.
Диагностика
Диагностика может быть плановой, внеплановой (при наличии специфической симптоматики), а также может проводиться при наличии каких-либо подозрений у лечащего врача (необычные или часто повторяющиеся инфекции).
Плановое исследование крови у детей до 1 года проводится 1 раз в 3 месяца, после года – 1 раз в 6 месяцев (включая взрослых).
Если диагностика засвидетельствовала понижение нейтрофилов в крови, дополнительно должно быть назначено:
Далее проводится оценка динамики показателей лейкоцитарной формулы (после перенесенных инфекций, между ними, после выздоровления), включая СОЭ (скорость оседания эритроцитов), цветовой показатель и т.д.
Определение причины нейтропении может включать такие диагностические манипуляции:
В случае тяжелой нейтропении в острой форме — комплексная диагностика должна быть выполнена максимально оперативно.
Если рассматривается врожденная патология, диагностика включает молекулярно-генетическое исследование нейтропении.
По одному анализу крови, который показал низкий уровень гранулоцитов, невозможно поставить окончательный диагноза. Так как это единственные клетки крови, концентрация которых может меняться ежедневно, ввиду короткой «жизни» в кровяном русле (6-8 часов).
Для точного подтверждения состояния пациента, анализ крови нужно повторить с небольшим интервалом времени (время сдачи анализов устанавливает врач).
Лечение
Интермиттирующая нейтропения обычно проходит без симптомов и тяжелых инфекционных осложнений, поэтому в терапевтическом лечении не нуждается. Особенно в том случае, если пациент тщательно соблюдает правила личной гигиены, употребляет в пищу продукты, которые прошли термическую обработку (блюда из сырой рыбы, мясо с кровью при нейтропении нельзя), пользуется перчатками во время уборки, защищает кожу от длительного воздействия солнца.
При вторичной нейтропении лечение направлено, в первую очередь, на ликвидацию основного заболевания, которое и повлекло за собой патологическое снижение гранулоцитов.
В «Клинике Спиженко» лечение нейтропении проводится с учетом причины возникновения и клинических симптомов и может включать:
Включая лечение ассоциированных состояний (язвы, стоматит, гингивит) с помощью полосканий солевым раствором ротовой полости, применения антисептиков (хлоргексидина), нистатина, клотримазола, флуконазола (при кандидозах).
При острых поражениях слизистых, дополнительно назначается диета (с преобладанием в рационе жидкой пищи) и местное обезболивание. Если снижение нейтрофилов произошло в результате приема лекарственных средств, выход из ситуации – прекратить их использование и перейти на альтернативное лечение.
Включая анальгетики (Ибупрофен, Индометацин, Амидопирин, Ацетилсалициловая кислота, Фенилбутазон).
Лечение фебрильной нейтропении
Фебрильная нейтропения требует незамедлительного медицинского вмешательства (в течение 1 часа!).
При нейтропенической лихорадке назначается:
Основа современного антибактериального лечения ФН (фебрильной нейтропении) — бета-лактамные антибиотики.
В «Клинике Спиженко» вы сможете пройти комплексное исследование нейтропении, установить точную причину и получить наиболее корректное лечение (при необходимости).
Нейтропения – это не «приговор», но и не повод оставлять данную ситуацию без компетентного медицинского внимания.
Заполните всего три поля
и наш специалист Вам перезвонит!
Ваши данные успешно отправлены! Ожидайте нашего звонка.
Анализ крови у детей и прививки
Поделиться:
Клинический анализ крови в РФ входит в стандарт обследования перед вакцинацией. Мое мнение, что чаще всего он совершенно не нужен, если например ребенок с виду здоров и никаких жалоб нет. Тем не менее анализ сдают и нередко трактуют результаты совершенно неадекватно.
Многие лаборатории банально «забивают» на тот факт, что интерпретация результатов анализа крови у ребенка имеет свои особенности. И просто пишут анализы на стандартных бланках, где рядом с результатами анализа в столбике напечатаны «нормы». Но с этими нормами детские показатели сравнивать нельзя!
О детских нормах гемоглобина
Сколько нервотрепки доставляют родителям эти бланки с «отклонениями» от нормы! Сколько тревожных звонков и писем обрушивается на педиатра! Я и мои коллеги ежедневно вынуждены развеивать страхи родителей, которые пытаются самостоятельно оценить полученные анализы своих детей.
Например, гемоглобин. У взрослых его норма составляет от 120 до 150 г/л. У детей же все сложнее. Если сразу после рождения «нормальный» гемоглобин составляет 180–220 г/л, то уже к 2–3 месяцам жизни его уровень стремительно падает до нижней границы нормы, которая начинается от 90 г/л. Это так называемая физиологическая анемия. И поскольку это норма, лечить ее не надо.
Читайте также:
Таблетки для гемоглобина
Тем не менее этот факт почему-то всеми дружно забывается, и вот двухмесячному ребенку с очень неплохим для его возраста уровнем гемоглобина 105 г/л ставится диагноз анемия.
Медотвод от прививок
И ладно если бы все дело ограничилось только назначением препаратов железа. Но некоторые мои коллеги почему-то обожают в этой ситуации назначать медотвод от вакцинации. Мол, человек ослаблен, с прививкой надо повременить.
Читайте также:
Вакцина от коклюша
Но, во-первых, анемии нет, смотрим нормы выше. (Для окончательного решения можно сдать дополнительные анализы.)
Во-вторых, если разобраться, вакцина нам нужна для чего? Чтобы пациента защитить. А кто наиболее подвержен заболеванию? У кого будет протекать инфекция тяжелее? Правильно, у ослабленного. Получается, что даже если у пациента и есть легкая анемия, это не является противопоказанием к вакцинации. Наоборот, ослабленных пациентов нужно прививать в первую очередь.
О детских нормах лейкоцитов
Вообще, благодаря определению концентрации в крови лейкоцитов можно решить, какая у пациента инфекция — бактериальная (если повышены) или вирусная (если понижены). А соответственно, нужен антибиотик или нет.
У взрослых людей содержание лейкоцитов в норме колеблется от 4 до 9 тысяч в мкл. Но у детей опять все по-другому. Так, при рождении верхняя граница нормы лейкоцитов может достигать 30–34 тысяч в мкл, до года содержание лейкоцитов — от 5 до 18 тысяч в мкл, после года — от 4 до 12 тысяч в мкл. И это все — ЗДОРОВЫЕ дети.
Лейкоцитарная формула
Кроме лейкоцитов в лаборатории могут посчитать количество нейтрофилов (палочкоядерных и сегментоядерных) и лимфоцитов. Повышенное содержание нейтрофилов (нейтрофилез) часто свидетельствует о бактериальной инфекции, лимфоцитоз — о вирусной.
У взрослых в норме больше нейтрофилов, чем лимфоцитов. У детей опять же все сложнее. Сразу после рождения лимфоцитов меньше, чем нейтрофилов, как и у взрослого человека. Но уже на пятый день жизни возникает так называемый «первый перекрест», когда количество нейтрофилов становится равным лимфоцитам.
Сразу после этого количество лимфоцитов начинает расти и в норме остается выше, чем содержание нейтрофилов, вплоть до 4–5 лет жизни, когда возникает «второй перекрест». И это не лимфоцитоз, это норма. После 5 лет ситуация меняется и количество лимфоцитов снова начинает уступать нейтрофилам, как и у взрослых людей.
Детская доброкачественная нейтропения
Отдельно остановлюсь на одном отклонении от нормы в анализе крови, при котором снижается количество нейтрофилов. Это так называемая доброкачественная нейтропения детского возраста. В норме у детей до года нейтрофилов должно быть больше 1000 в мкл, после года — больше 1,5 тысяч. Но бывает, что нейтрофилов оказывается «ощутимо» меньше.
Встречается этот феномен очень часто, но клинически себя никак не проявляет. Несмотря на то что нейтрофилы отвечают за сопротивление бактериальным инфекциям, их в организме человека всегда «с запасом», поэтому такое снижение никак не отражается на здоровье.
Безусловно, для дифференциального диагноза с другими нейтропениями может потребоваться осмотр гематолога. Но если диагноз доброкачественной нейтропении подтверждается, то никаких ограничений нет, лечение не требуется.
Тем не менее и эту особенность детского анализа крови зачем-то используют для того, чтобы отсрочить вакцинацию. Хотя опять же возвращаясь к вышесказанному: кого нужно защитить в первую очередь? Ослабленных, со сниженным иммунитетом. А значит, пациентов с доброкачественной нейтропенией нужно прививать в первую очередь, по крайней мере инактивированными вакцинами.







 Читайте также:
Читайте также: 