Что такое ноак в кардиологии
Что такое ноак в кардиологии
Общественная Система
усовершенствования врачей
НОАК в практике кардиолога 5 лет. Что изменилось? Стали ли мы лечить пациентов с ФП лучше?
Арутюнов Григорий Павлович, член-корреспондент РАН, д.м.н., профессор, заведующий кафедрой пропедевтики РНИМУ им. Н.И. Пирогова, Заслуженный врач РФ, расскажет о современных подходах к применению пероральных антикоагулянтов у больных с фибрилляцией предсердий для профилактики тромбоэмболических осложнений.
В ходе передачи будут обсуждаться такие вопросы, как:
— что нового в рекомендациях 2016 года Европейского кардиологического общества?
— можно ли не назначить НОАК если у пациента высокий балл по шкале оценки риска кровотечений HAS-BLED?
— разнообразие доз и режимов дозирования – как ориентироваться практическому врачу?
— что делать после стабилизации пациента, пережившего кровотечение на фоне антикоагулянтной терапии? Есть ли необходимость смены препарата?
В программе примет участие:
21 июня 2017 12:00-13:00 (мск)
В ТРАНСЛЯЦИИ ПРИНИМАЮТ УЧАСТИЕ
Всероссийская Образовательная Интернет-Сессия
Информация и материалы, представленные на настоящем сайте, носят научный, справочно-информационный и аналитический характер, предназначены исключительно для специалистов здравоохранения, не направлены на продвижение товаров на рынке и не могут быть использованы в качестве советов или рекомендаций пациенту к применению лекарственных средств и методов лечения без консультации с лечащим врачом.
Лекарственные препараты, информация о которых содержится на настоящем сайте, имеют противопоказания, перед их применением необходимо ознакомиться с инструкцией и проконсультироваться со специалистом.
Мнение Администрации может не совпадать с мнением авторов и лекторов. Администрация не дает каких-либо гарантий в отношении cайта и его cодержимого, в том числе, без ограничения, в отношении научной ценности, актуальности, точности, полноты, достоверности научных данных представляемых лекторами или соответствия содержимого международным стандартам надлежащей клинической практики и/или медицины основанной на доказательствах. Сайт не несет никакой ответственности за любые рекомендации или мнения, которые могут содержаться, ни за применимость материалов сайта к конкретным клиническим ситуациям. Вся научная информация предоставляется в исходном виде, без гарантий полноты или своевременности. Администрация прикладывает все усилия, чтобы обеспечить пользователей точной и достоверной информацией, но в то же время не исключает возможности возникновения ошибок.
Вторая редакция рекомендаций Европейского Общества Аритмологов по применению новых антикоагулянтов у пациентов с неклапанной фибрилляцией предсердий 2015г (фрагменты).
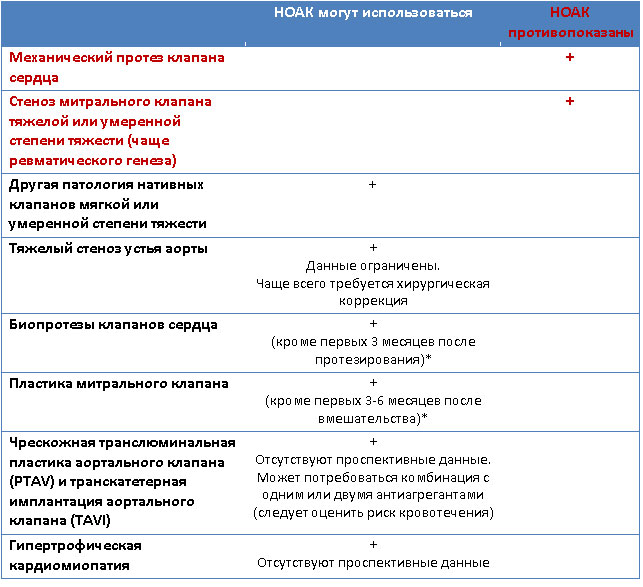
Определение понятия «неклапанная фибрилляция предсердий».
Понятие «клапанная фибрилляция предсердий (ФП)» включает в себя ФП у пациентов с механическими протезами клапанов сердца, либо со стенозом митрального клапана тяжелой или умеренной степени тяжести (чаще ревматического генеза). Пациенты с прочей клапанной патологией могут быть кандидатами для назначения НОАК (см. табл. 1).
Таблица 1. Показания и противопоказания к приему НОАК со стороны клапанной патологии.
*- Американские рекомендации не допускают назначения НОАК после любого протезирования или пластики клапанов сердца.
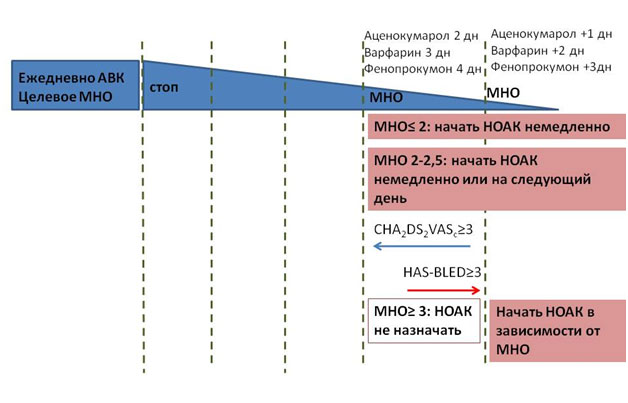
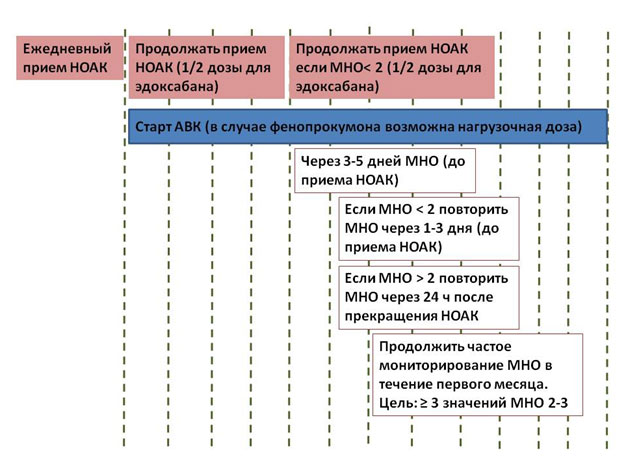
Переход с АВК на НОАК и наоборот
В общем виде рекомендация выглядит так: НОАК могут быть назначены в этот же или на следующий день при значении МНО 2,0-2,5. Ривароксабан может быть назначен при МНО ≤3,0; эдоксабан – при МНО≤2,5; апиксабан и дабигатран – при МНО ≤2,0. При обратном переходе – с НОАК на АВК стоит иметь в виду, что НОАК влияют на МНО. Для более адекватного определения степени антикоагуляции при одновременном приеме НОАК и АВК МНО необходимо определять непосредственно перед приемом очередной дозы НОАК и через 24 часа после приема последней дозы НОАК.
Рисунок 1. Переход с АВК на НОАК и наоборот.
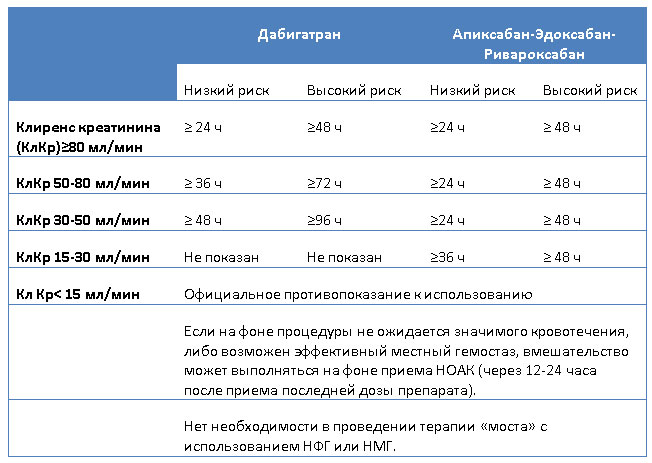
Ведение пациентов, получающих НОАК, во время инвазивных вмешательств
В случае использования НОАК не следует назначать терапию «моста» в виде нефракционированного гепарина (НФГ) или низкомолекулярных гепаринов (НМГ), поскольку это увеличивает риск кровотечений без преимуществ в отношении профилактики тромботических событий. Время последнего приема НОАК перед операцией зависит от её типа: как правило, в случае низкого риска кровотечения (происходит редко и не имеет значимых клинических последствий) препарат отменяют за ≥24 часа; в случае вмешательства с высоким риском кровотечения (происходит часто или грозит серьезными клиническими последствиями) НОАК следует отменять за ≥48 часов. Вторым принципиальным фактором является почечная функция: снижение клиренса креатинина является основанием для более ранней отмены антикоагулянта (подробно см. таблицу 2).
Таблица 2. Время последнего приема НОАК перед плановым инвазивным вмешательством.
Большинство электрофизиологических процедур на фоне НОАК проводятся так же, как и прочие хирургические вмешательства. Исключением является изоляция устьев легочных вен – процедура, характеризующаяся высоким риском и геморрагических, и тромботических осложнений. В случае приема пациентами АВК рекомендуется проводить аблацию на фоне продолжающегося приема препаратов. А вот с НОАК четкого понимания пока нет, поэтому рекомендуется придерживаться протокола, принятого в данном лечебном учреждении. В качестве допустимых вариантов предлагается заблаговременно перевести пациента на АВК и проводить процедуру на их фоне, либо проводить ее на фоне НОАК без их отмены, либо четко спланировать схему перерыва в приеме НОАК. При выборе тактики должны учитываться такие параметры, как почечная функция, значение индекса CHA2-DS2-VASc, опыт оператора, тип и объем аблации помимо вмешательства на устьях легочных вен, а также доступность периоперационной визуализации для контроля проведения транссептальной пункции. Если пациент принял НОАК за 36 часов до аблации и более, либо приверженность к лечению в недели, предшествовавшие аблации, вызывают сомнения, перед аблацией необходимо выполнить ЧП-ЭХОКГ.
В случае экстренного хирургического вмешательства следует проводить специфические и неспецифические мероприятия для прекращения действия НОАК.
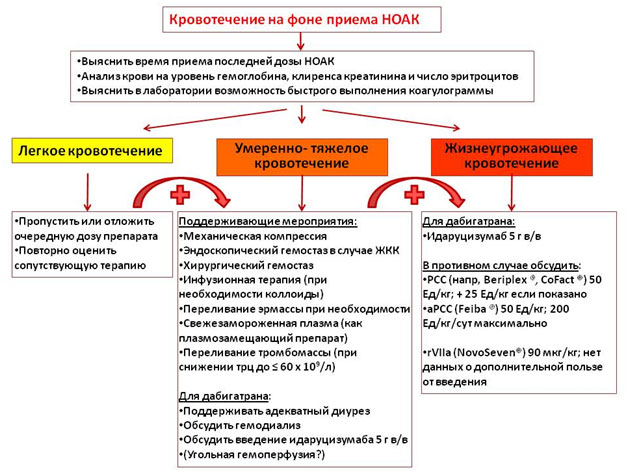
Ведение пациентов с кровотечением на фоне приема НОАК
Рисунок 2. Ведение пациента с кровотечением на фоне приема НОАК (по van Ryn et al.).
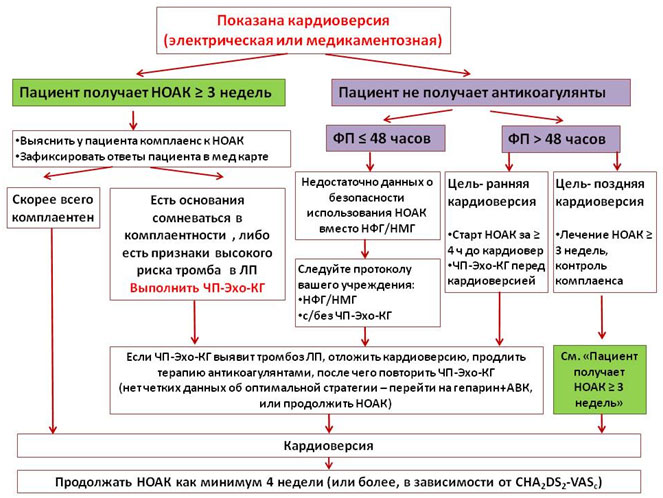
Пациенты, получающие НОАК в течение 3 и более недель до кардиоверсии
В отличие от варфарина, оценить уровень антикоагуляции (и, соответственно, приверженность к терапии) перед кардиоверсией у принимающих НОАК трудно. Поэтому пациента подробно расспрашивают о том, насколько он регулярно принимал НОАК, и его ответы фиксируют в медицинской документации. Если возникают сомнения в том, что пациент был комплаентен, перед кардиоверсией выполняют чреспищеводную эхокардиографию (ЧП-ЭхоКГ).
Пациенты с недавним приступом ФП (не получают НОАК длительно)
Если эпизод ФП длится более 48 часов, а ждать 3 недели для длительной терапии НОАК нецелесообразно, следует за 4 часа и более до кардиоверсии начать прием НОАК, выполнить ЧП-Эхо-КГ, после чего восстановить синусовый ритм. В случае эпизода ФП менее 48 часов нет четкой ясности, достаточно ли принять 1 дозу НОАК перед кардиоверсией. Поэтому на настоящий момент рекомендовано следовать протоколу, принятому в лечебном учреждении с/без предварительным введением НФГ/НМГ и с/без предварительным выполнением ЧП-Эхо-КГ.
Рисунок 3. Ведение пациентов, получающих НОАК, во время кардиоверсии, в зависимости от длительности аритмии и предшествующей антикоагуляции
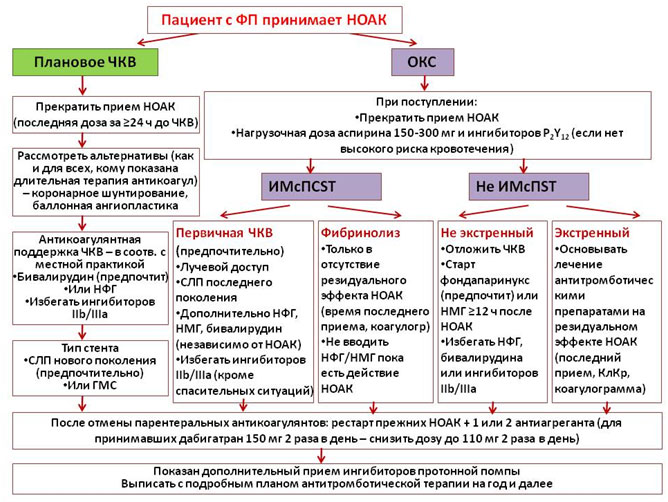
Пациенты с ФП и ИБС, в том числе с показаниями к совместному приему антиагрегантов
«Острый» сценарий касается пациентов, перенесших ОКС на фоне приема НОАК. В случае АВК рекомендуется проводить реваскуляризацию без отмены антикоагулянтов. В случае НОАК прием препаратов лучше прервать. Это позволяет безопасно начать лечение антиагрегантами и проводить общепринятую антикоагулянтную поддержку чрескожного коронарного вмешательства (ЧКВ). После стабилизации состояния (отсутствия рецидива ишемии и/или потребности в повторной реваскуляризации) НОАК могут быть возобновлены после отмены парентеральных антикоагулянтов. Лучше возобновлять тот же препарат, который пациент принимал до манифестации ОКС. Нет достаточных данных о преимуществах того или иного НОАК или перехода на АВК. У получающих дабигатран в комбинации с антиагрегантами на время совместного приема доза дабигатрана должна быть снижена до 110 мг 2 раза в день. У пациентов с нормальной почечной функцией, получающих прочие НОАК, подобное снижение дозы не рекомендовано.
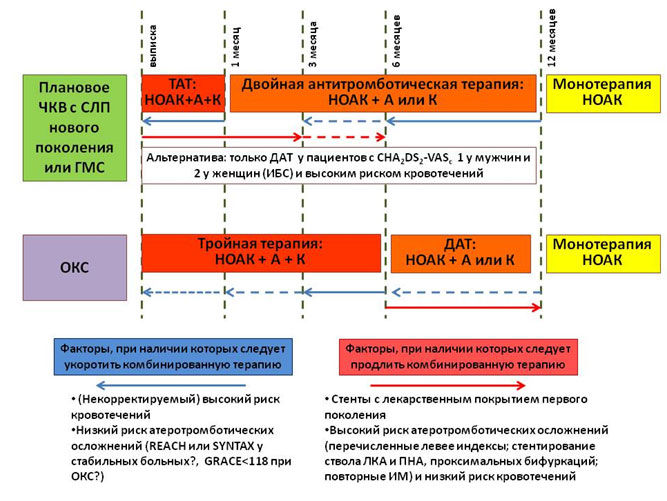
В рамках обсуждения сценария длительной терапии после ОКС и/или реваскуляризации указано, что при выписке пациента целесообразно заранее прописать всю схему перехода от многокомпонентной антитромботической терапии к постоянному лечению пациента. В стандартном случае после ОКС с ЧКВ или планового ЧКВ тройная антитромботическая терапия показана в течение 1 месяца в случае имплантации голометаллического стента (ГМС) и 6 месяцев в случае имплантации стента с лекарственным покрытием (СЛП) последнего поколения с дальнейшим переходом на двойную терапию (НОАК + антиагрегант, аспирин или клопидогрел на выбор). На рисунке 5 указаны факторы, которые могут увеличить или уменьшить продолжительность периодов тройной и двойной терапии. В подгруппе пациентов с ФП и низким риском инсульта (CHA2DS2-VASc 1 у мужчин и 2 у женщин, т.е из факторов риска – только сопутствующая ИБС) возможно сразу назначить двойную антиагрегантную терапию (без антикоагулянтов). Практически у всех пациентов с ИБС через год после ОКС или ЧКВ возможно назначение монотерапии антикоагулянтами (исключение составляют пациенты с очень высоким риском коронарных событий и низким риском кровотечений).
Рисунок 4. Ведение пациентов, принимающих НОАК, во время ЧКВ или эпизода ОКС.
Рисунок 5. Базовый сценарий длительной антитромботической терапии у получающих НОАК после ЧКВ или ОКС, а также условия изменения длительности комбинированной терапии.
(ТАТ – тройная антитромботическая терапия; ДАТ – двойная антитромботическая терапия; А – аспирин 75 – 100 мг 1 раз в день; К – клопидогрел 75 мг 1 раз в день; ЛКА – левая коронарная артерия; ПНА – передняя нисходящая артерия)
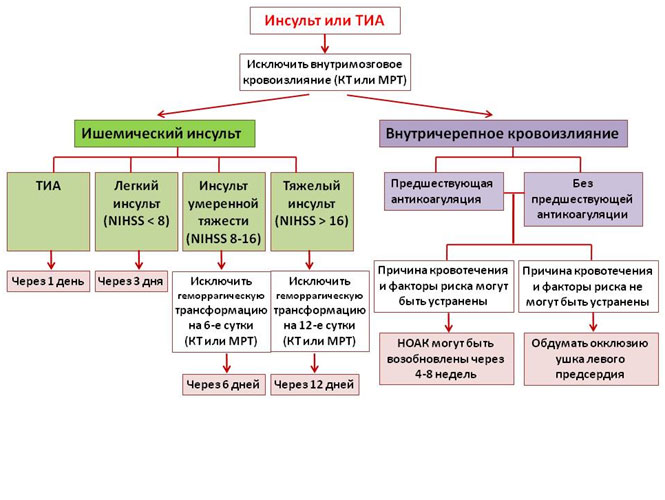
При внутричерепном кровоизлиянии при отсутствии доступных специфических антидотов к НОАК следует использовать неспецифические прокоагулянтные препараты, такие как концентрат комплекса протромбина (PCC) или активированный концентрат комплекса протромбина (aPCC). Влияние этих препаратов на прогноз не известно. Гораздо сложнее в случае развития ишемического инсульта на фоне приема НОАК. Эксперты указывают на то, что в отсутствие точного экспресс-метода, позволяющего оценить уровень антикоагуляции, проведение тромболизиса у таких пациентов невозможно (исключение, по-видимому, составляют пациенты, принявшие НОАК 24-48 часов назад). В общем случае рекомендованной тактикой лечения является механическая реканализация сосуда с использованием стента-ретривера (прим. переводчика: устройство, сочетающее стент и приспособление для удаления тромбов/эмболов).
На рисунке 6 представлены рекомендации о возможности и сроках возобновления терапии НОАК после внутричерепных кровоизлияний и ишемических инсультов.
Рисунок 7. Алгоритм инициации или возобновления антикоагуляции после ТИА, ишемического инсульта или внутричерепного кровоизлияния.
NIHSS – шкала тяжести инсульта Национального Института Здравоохранения США
Пациентам с ФП и бессимптомным каротидным атеросклеротическим поражением легкой и умеренной степени тяжести показана монотерапия НОАК (по аналогии со стабильной ИБС). У пациентов с атеросклеротическим поражением тяжелой степени должна быть выполнена каротидная эндартерэктомия, а не стентирование, что позволит избежать длительной тройной антитромботической терапии с высоким риском кровотечения. В случае проведения операции к лечению должен быть добавлен аспирин (непосредственно перед и в течение 10 дней после операции).
По материалам:
Heidbuchel H, Verhamme P, Alings M, Antz M, Diener H-C, Hacke W, Oldgren J, Sinnaeve P, Camm AJ, Kirchhof P. Updated European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist anticoagulants in patients with non-valvular atrial fibrillation. Europace 2015; 17:1467–1507.
http://europace.oxfordjournals.org/content/17/10/1467.long
Материал подготовлен сотрудником лаборатории клинических проблем атеротромбоза РКНПК им. А.Л.Мясникова к.м.н. Шахматовой О.О.
| НАЦИОНАЛЬНОЕ ОБЩЕСТВО ПО АТЕРОТРОМБОЗУ WWW.NOAT.RU | |||
| 105082, Москва, а/я 8 | email: info@noat.ru | ||
| © 1997—2017 «НОАТ». Все права защищены. Создание сайта: Ай Ти Легион | |||
Уважаемый посетитель NOAT.RU!
Настоящий раздел предназначен исключительно для лиц, имеющих среднее и высшее медицинское образование, а также студентов медицинских ВУЗов.
Никакие из опубликованных материалов не могут служить заменой медицинскому осмотру и не должны быть использованы как руководство к лечению. Только врач, который имеет личный контакт с пациентом, знаком с его историей болезни и наблюдает за состоянием его здоровья, может рекомендовать тот или иной метод лечения. Информация на данном сайте или другие предоставляемые им услуги не могут служить основанием для диагностики или лечения без соответствующего участия врача.
Ни при каких обстоятельствах администрация, составители, консультанты и правообладатели сайта не могут быть ответственны за любой непрямой, случайный или косвенный вред, причиненный здоровью и жизни, а также материальный ущерб или утерю прибыли, наступившую в результате любого использования или доступа или невозможности использования или получения доступа к ресурсу NOAT.RU или его содержимому.
Администрация NOAT.RU не несет ответственности за содержание баннеров и информационных материалов третьих лиц.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом, фельдшером или студентом медицинского ВУЗа.
Сравнение эффективности и безопасности НОАК и варфарина
Исследователи задались целью сравнить эффективность и безопасность новых оральных антикоагулянтов (НОАК), не являющихся антагонистами витамина К (дабигатрана, ривароксабана и апиксабана), с варфарином у пациентов с фибрилляцией предсердий (ФП).
В обсервационное датское исследование были включены 61 678 пациентов с неклапанной ФП, которые ранее не получали оральные антикоагулянты и не имели ранее указаний в анамнезе на развитие клапанной ФП и венозной тромбоэмболии. Из всех больных 35 436, (57%) получали варфарин, 12 701 (21%) 150 мг дабигатрана, 7192 (12%) 20 мг ривароксабана и 6349 (10%) 5 мг апиксабана.
Основными конечными точками эффективности являлись развитие ишемического инсульта и композитная точка (ишемический инсульт, системная эмболия, смерть). В качестве основных точек безопасности были выбраны любые кровотечения, внутримозговые кровотечения и значимые кровотечения.
Если в анализе учитывался только риск развития ишемического инсульта, то НОАК достоверно не различались от варфарина по эффективности. В течение первого года наблюдения ривароксабан был ассоциирован с меньшей частотой развития ишемического инсульта и системной эмболии (3.0% v 3.3%, соответственно) по сравнению с варфарином: HR, 0.83 (95% CI, 0.69-0.99). Частота ишемического инсульта и системной эмболии на фоне применения дабигатрана и апиксабана статистически не отличалась от таковой на фоне приема варфарина.
Годовая смертность была достоверно ниже у пациентов, получавших апиксабан (5.2%) и дабигатран (2.7%) по сравнению с варфарином (8.5%), но не ривароксабаном (7.7.%).
Анализ профиля безопасности продемонстрировал, что годовой риск развития любых кровотечений был значительно ниже при использовании апиксабана (3.3%) и дабигатрана (2.4%) в сравнении с варфарином (5.0%). При этом варфарин и ривароксабан были сравнимы по частоте кровотечений (5.3%).
Все исследуемые НОАК представляют собой эффективную и безопасную альтернативу варфарину. Не было выявлено статистически достоверных различий между НОАК и варфарином по частоте развития ишемического инсульта.
Риск кровотечений и смертельных исходов был значительно ниже для апиксабана и дабигатрана в сравнении с варфарином.
Источник: Torben Bjerregaard Larsen, Flemming Skjøth, Peter Brønnum Nielsen, Jette Nordstrøm Kjældgaard, Gregory Y H Lip. Comparative effectiveness and safety of non-vitamin K antagonist oral anticoagulants and warfarin in patients with atrial fibrillation: propensity weighted nationwide cohort study. BMJ 2016;353:i3189
Особенности применения новых оральных антикоагулянтов у пожилых пациентов после ортопедических операций
Эндопротезированию крупных суставов нижних конечностей в основном подвергаются люди пожилого и старческого возраста. Новые оральные антикоагулянты обладают удобным способом введения, они безопасны, эффективны и не требуют лабораторного мониторинга. В стат
Generally total hip and knee replacement are performed in elderly and very elderly patients. New oral anticoagulants have comfort level of using, a high level of safety and efficacy; laboratory monitoring is not required for these anticoagulants. The article contains an algorithm for selecting new oral anticoagulants, there are guidelines for the perioperative management of patients with atrial fibrillation and for transition between anticoagulants.
Венозный тромбоз и тромбоэмболия легочной артерии (ТЭЛА) остаются важнейшей проблемой клинической медицины и затрагивают профессиональную сферу врачей разных специальностей, начиная от гинекологии, онкологии, сердечно-сосудистой хирургии и заканчивая травматологией и ортопедией. По данным статистических отчетов Министерства здравоохранения Российской Федерации ежегодно регистрируются около 80 000 новых случаев тромбоза глубоких вен (ТГВ), легочную эмболию регистрируют ежегодно с частотой 35–40 на 100 000 человек [1].
В группу высокого риска развития венозного тромбоза, наряду с прочими категориями лиц, входят пациенты ортопедического профиля, перенесшие эндопротезирование крупных суставов нижних конечностей, у которых риск ТГВ в отсутствие медикаментозной тромбопрофилактики может достигать 60% [2]. Фатальная ТЭЛА может развиться примерно у 1 из 500 пациентов после планового эндопротезирования тазобедренного сустава (ЭТБС) [3].
Количество проводимых в РФ плановых эндопротезирований тазобедренного сустава растет с каждым годом, и в настоящее время ежегодно выполняется около 25 ЭТБС на 100 000 населения [4]. Следует отметить, что среди этих пациентов большой процент лиц пожилого и старческого возраста. Согласно Глобальному ортопедическому регистру среди пациентов, перенесших эндопротезирование крупных суставов нижних конечностей, средний возраст составляет около 70 лет [5]. На 2017 г. по данным Росстата численность населения старше трудоспособного возраста в РФ составляет 38 935 300 человек, а по среднему варианту прогноза к 2022 г. увеличится еще примерно на 2,25 млн человек. По мере увеличения средней продолжительности жизни и старения населения возрастет и потребность в эндопротезировании суставов. Так, в США c 2005 до 2030 г. прогнозируется увеличение потребности в первичном ЭТБС на 174%, а в эндопротезировании коленного сустава (ЭКС) — на 673% [6].
Таким образом, старение населения в целом, увеличение потребности в эндопротезировании крупных суставов нижних конечностей и более высокий риск ТГВ в пожилом и старческом возрасте определяют важность проблемы рационального медикаментозного сопровождения с целью тромбопрофилактики и выбора оптимального антикоагулянта, в том числе с учетом возрастных особенностей пациентов, состояния функции почек, наличия и характера коморбидных состояний и сопутствующей лекарственной терапии.
Выбор антикоагулянтов
В РФ в настоящее время для профилактики венозных тромбозов и тромбоэмболий могут применяться следующие антикоагулянты:
Данные лекарственные средства являются эффективными антикоагулянтами, однако обладают различной степенью безопасности.
Особенности профилактики венозных тромбоэмболических осложнений (ВТЭО) при плановом протезировании тазобедренного или коленного суставов
Согласно Российским клиническим рекомендациям по диагностике, лечению и профилактике венозных тромбоэмболических осложнений (ВТЭО) 2015 г. у больных ортопедического профиля при плановом протезировании тазобедренного или коленного суставов могут использоваться практически все из перечисленных выше антикоагулянтов, за исключением варфарина, который для тромбопрофилактики после эндопротезирования крупных суставов не рекомендуется [1].
В клинической практике могут использоваться различные схемы профилактики ВТЭО. Так, НМГ назначают в профилактической дозе, рекомендуемой для больных высокого риска. Особенности применения каждого конкретного препарата изложены в рекомендациях производителя. Целесообразно введение препаратов не позже чем за 12 ч до начала вмешательства и не ранее чем через 12 ч после его завершения.
Фондапаринукс натрия вводят подкожно по 2,5 мг 1 раз в сутки. Первое введение рекомендуется через 6–24 ч после окончания операции.
Апиксабан по 2,5 мг 2 раза в сутки. Первый прием через 12–24 ч после окончания операции.
Дабигатрана этексилат назначают перорально 1 раз в сутки по 220 мг. Первый прием через 1–4 ч после окончания операции и по достижении гемостаза в половинной суточной дозе.
Ривароксабан назначают перорально по 10 мг 1 раз в сутки, первый прием через 6–10 ч после окончания операции.
НФГ характеризуется меньшей эффективностью и безопасностью и может применяться только в случаях, когда использование вышеуказанных препаратов невозможно. Обычная суточная доза НФГ составляет 15 000 ЕД за три введения, первая инъекция за 4–6 ч до или через 6–8 ч после операции. Имеются данные о большей эффективности индивидуально подобранных доз НФГ.
Начинать антикоагулянтную профилактику после операции можно не ранее, чем будет обеспечен первичный гемостаз. Решение о выборе одного из указанных вариантов профилактики ВТЭО должно основываться на планируемой продолжительности профилактики, опасности возникновения геморрагий.
Применение новых оральных антикоагулянтов для тромбопрофилактики у ортопедических пациентов
По данным многочисленных исследований среди пациентов после ЭТБС или ЭКС НОАК оказались более эффективны и не хуже в плане безопасности по сравнению с эноксапарином. К тому же они не требуют титрования дозы и лабораторного контроля, как варфарин, и подкожных инъекций, как НФГ, НМГ, фондапаринукс. При длительном применении они не вызывают развития тромбоцитопении, как гепарины [7].
Ривароксабан и апиксабан являются прямыми ингибиторами фактора свертывания Xa. Ривароксабан достигает максимальной концентрации через 2–4 ч, период полувыведения: 5–9 часов у молодых, 11–13 часов у пожилых [8]. Апиксабан максимальной концентрации достигает через 3–4 ч, период полувыведения — около 12 ч [9]. Для определения противосвертывающей активности ривароксабана и апиксабана надежным способом является определение анти-Xа-активности.
Дабигатрана этексилат является пролекарством, которое после приема внутрь превращается в активную форму дабигатран — прямой ингибитор тромбина. На 80% выводится почками, средний период полувыведения после однократного приема составляет 8 ч, с увеличением его до 12–14 ч после многократного приема [10]. Для оценки уровня активности дабигатрана в настоящее время стандартизированный тест отсутствует, но активированное частичное тромбопластиновое время более чувствительно, чем протромбиновое время [10].
Применение НОАК с целью тромбопрофилактики у особых групп пациентов
.gif)
Лица пожилого и старческого возраста в большинстве случаев могут иметь различные сопутствующие заболевания, такие как артериальная гипертензия, сахарный диабет, хроническая болезнь почек, фибрилляция предсердий (ФП) или другие, по поводу которых назначена лекарственная терапия. В анамнезе у них может быть недавно перенесенный инсульт головного мозга или инфаркт миокарда. Таким пациентам требуется персонализированный подход в подборе НОАК и их дозировании. Учитывая разнообразные факторы, К. Руффом из Гарвардской школы медицины был предложен алгоритм выбора НОАК для тромбопрофилактики (рис.) [12].
У пациентов с ишемической болезнью сердца или инфарктом миокарда в анамнезе предпочтительнее назначать ривароксабан, так как дабигатрана этексилат, по данным метаанализа, может быть связан с небольшим увеличением риска развития острого коронарного синдрома и инфаркта миокарда [13].
Начиная с 30-летнего возраста каждые 10 лет скорость клубочковой фильтрации в среднем снижается на 10 мл/мин [14]. По данным III Национальной программы проверки здоровья и питания в США (III NHANES) у пожилых людей распространенность хронической болезни почек намного выше, чем у лиц более молодого возраста: 39,4% (≥ 60 лет) по сравнению с 12,6% (40–59 лет) и 8,5% (20–39 лет) [15]. В связи с тем что повышение экспозиции лекарственных средств у пациентов пожилого возраста и у пациентов с сахарным диабетом часто обусловлено снижением функции почек, перед назначением антикоагулянтов требуется оценивать ренальную функцию.
НОАК в разной степени выводятся из организма с помощью почек (дабигатрана этексилат на 80%, ривароксабан на 36%, апиксабан на 27%), поэтому функциональное состояние почек имеет определяющее значение для концентрации антикоагулянтов в крови. При умеренном нарушении функции почек (клиренс креатинина 30–50 мл/мин) препаратом выбора должен быть апиксабан в силу его более хорошего профиля безопасности; ривароксабан можно использовать с осторожностью; назначая дабигатрана этексилат, требуется уменьшить дозу до 150 мг 1 раз/сут (2 капсулы по 75 мг).
Среди пациентов, запланированных на эндопротезирование крупных суставов нижних конечностей, могут встречаться лица с сопутствующей ФП, которые с целью профилактики инсульта уже принимают варфарин. Общепринятая практика в отношении варфарина при плановых оперативных вмешательствах обычно подразумевает его отмену за 5 дней до манипуляции. За этот период антикоагулянтное действие препарата прекращается, и когда пациент возобновляет его прием после хирургического вмешательства, восстановление профилактического уровня антикоагуляции занимает около 5–10 дней. В этой связи на этот период было предложено временное назначение НМГ. До настоящего времени велись дискуссии как «за», так и «против» этой тактики, что обусловило необходимость проведения исследования BRIDGE [16]. По результатам данного исследования было обнаружено, что стратегия отмены варфарина без прикрывающей антикоагуляции была не хуже, чем при ее использовании; кроме того, прикрывающая антикоагуляция увеличивала риск развития крупных кровотечений, что почти в три раза превышало риск без ее использования.
Лекарственные взаимодействия НОАК
Важное значение в клинической практике имеют вопросы лекарственных взаимодействий НОАК с препаратами, которые пациенты принимают по поводу прочих сопутствующих заболеваний, что во многом определяется тем, что НОАК метаболизируются с участием различных ферментов, на активность которых могут оказывать влияние принимаемые одновременно лекарственные средства. Так, все НОАК являются субстратами P-гликопротеина (P-gp), мембранного белка, локализующегося в тонком кишечнике, гематоэнцефалическом барьере, печени и почках. Данный белок транспортирует из клеток различные вещества, в том числе лекарственные средства и их метаболиты [17]. Ривароксабан на 18% метаболизируется с помощью CYP3A4 и на 14% — с помощью CYP2J2 [8]. Апиксабан на 25% метаболизируется с помощью CYP3A4. Дабигатрана этексилат не является субстратом для CYP3A4 [17].
Соответственно, лекарственные средства, которые индуцируют P-gp и/или CYP3A4, могут снижать концентрацию НОАК в плазме крови, повышая риск развития тромбоэмболических осложнений, в то время как ингибиторы P-gp и/или CYP3A4 могут увеличивать концентрацию НОАК, тем самым повышая риск развития кровотечения. С учетом этого рекомендуется избегать совместного применения НОАК с ЛС, являющимися ингибиторами или индукторами P-gp и/или CYP3A4. В табл. 2 представлена информация о влиянии сопутствующих лекарственных средств на экспозицию НОАК.
Продолжительность медикаментнозной тромбопрофилактики
В среднем продолжительность госпитального этапа послеоперационного периода у пациентов, перенесших эндопротезирование крупных суставов нижних конечностей, составляет около 7 дней. Далее пациент переводится на амбулаторный этап. Участковому терапевту необходимо помнить о том, что такие пациенты должны продолжать медикаментозную тромбопрофилактику с учетом международных рекомендаций: для ЭТБС продолжительность медикаментозной тромбопрофилактики составляет 35 дней, а для ЭКС — 14 дней [18].
Переход с парентерального антикоагулянта на НОАК
Зачастую в многопрофильных стационарах закупка лекарственных средств (ЛС) осуществляется централизованно и в рамках экономической целесообразности может быть не учтено удобство применения НОАК, в связи с чем НМГ используются как в отделении реанимации и интенсивной терапии, так и в хирургических отделениях стационара. В последующем на амбулаторном этапе послеоперационного периода у поликлинического терапевта может возникнуть необходимость в переводе пациента с парентерального антикоагулянта на НОАК, чтобы повысить приверженность к медикаментозной тромбопрофилактике. При переходе с парентерального антикоагулянта на новый оральный применение НОАК следует начать за 0–2 часа перед очередным введением исходного антикоагулянта, который в последующем отменяется [17].
Нами был проведен ретроспективный анализ историй болезней пациентов (n = 111) травматолого-ортопедического отделения № 1 УКБ № 1 Первого МГМУ им. И. М. Сеченова, перенесших ЭКС (n = 63; 56,8%) или ЭТС (n = 48; 43,2%) за период май–июль 2016 г., с анализом структуры назначения антикоагулянтов, режима дозирования, соответствия инструкциям по применению ЛС и клиническим рекомендациям по профилактике венозных тромбоэмболических осложнений, наличия межлекарственных взаимодействий, потенциально неблагоприятных в плане развития кровотечений, а также с расчетом стоимости курсов антикоагулянтной терапии.
Результаты показали, что среди пациентов преобладали лица старших возрастных групп, средний возраст которых составил 65 ± 9,2 года. Из антикоагулянтов в послеоперационном периоде с целью тромбопрофилактики по частоте назначения преобладал дабигатрана этексилат, который получали 90 пациентов (81,1%) в суточной дозе 220 мг (79,3% — 110 мг 2 раза/сут, 1,8% — 220 мг 1 раз/сут), ривароксабан принимали 11 пациентов (9,9%) в дозе 10 мг 1 раз/сут, эноксапарин натрия — 10 пациентов (8,1% — 0,4 мл п/к 1 раз/сут, 0,9% — 0,2 мл п/к 1 раз/сут). У 14 пациентов (12,6%) с нарушением функции почек (КК = 30–50 мл/мин) дозы НОАК были уменьшены в соответствии с инструкцией. Анализ межлекарственных взаимодействий показал, что наиболее часто встречались комбинации дабигатрана этексилат + кетопрофен (n = 81; 73%), ривароксабан + кетопрофен (n = 11; 9,9%) и эноксапарин натрия + кетопрофен (n = 11; 9,9%), повышающие потенциальный риск развития кровотечения.
Фармакоэкономический анализ показал, что суммарные расходы на тромбопрофилактику у пациентов после ЭТС в случае применения дабигатрана этексилата составляют 2816,0 руб., ривароксабана — 3010,0 руб. и эноксапарина натрия — 8209,5 руб. После ЭКС общие затраты на тромбопрофилактику в случае применения дабигатрана этексилата составляют 894,0 руб., ривароксабана — 1204,0 руб. и эноксапарина натрия — 8209,5 руб. Это свидетельствует о том, что оральные антикоагулянты, назначаемые с целью тромбопрофилактики у пациентов после ЭТС или ЭКС, имеют экономические преимущества по сравнению с эноксапарином натрия.
Заключение
Таким образом, при назначении новых оральных антикоагулянтов с целью тромбопрофилактики у пациентов после эндопротезирования крупных суставов нижних конечностей врачам необходимо учитывать, что в основном это пожилые пациенты, которые могут иметь различные коморбидные состояния и нарушения функционального состояния почек, по поводу которых получают лекарственную терапию. Необходимо избегать клинически значимых лекарственных взаимодействий, которые могут повлиять на эффективность или безопасность медикаментозной тромбопрофилактики. Также требуется соблюдать продолжительность курса тромбопрофилактики, поскольку раннее прекращение приема антикоагулянтов может привести к развитию тромбоза глубоких вен с последующими более серьезными осложнениями.
Литература
ФГБОУ ВО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва

_575.gif)
_575.gif)