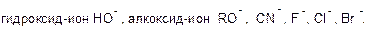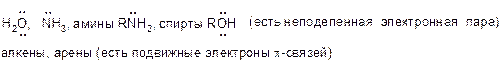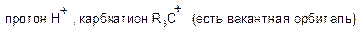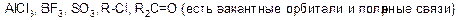Что такое нуклеофилы в химии
Нуклеофил
Амбидентные нуклеофилы имеют два и более реакционных центра. К примеру, тиоцианат-ион SCN − может атаковать электрофил либо атомом серы, либо атомом азота. Реакции галогеноалканов с SCN − часто приводят к образованию смеси RSCN (алкилтиоцианата) и RNCS (алкилизотиоцианата).
Содержание
Примеры
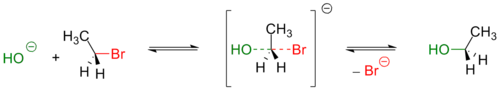
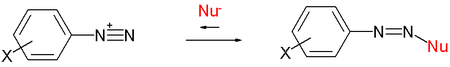
В данной реакции атака нуклеофила происходит со стороны, противоположной уходящей группе. Вследствие этого SN2-процессы сопровождаются обращением (инверсией) конфигурации.
Классификация
Нуклеофилы можно классифицировать несколькими способами: по типу орбитали, с которой донируются электроны, и по природе атома, который образует связь.
По типу реагирующей орбитали
В зависимости от природы орбитали, на которой располагались электроны, пошедшие на образование связи с электрофилом, можно выделить:
По атому, образующему связь
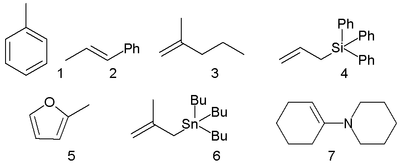
Углеродные нуклеофилы
Нуклеофилами с реакционным центром на атоме углерода являются:
Азотные нуклеофилы
Примерами азотных нуклеофилов являются аммиак (NH3), органические амины (RNH2, R2NH, R3N) и азиды (R−N3).
Кислородные нуклеофилы
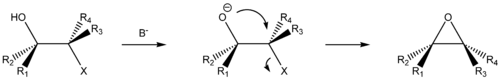
Типичными кислородными нуклеофилами являются вода (H2O), гидроксид-ион (OH − ), спирты (ROH) и алкоксиды (RO − ). В показанной ниже разновидности реакции Вильямсона сильное основание депротонирует спирт с образованием алкоксида. Атом кислорода затем внутримолекулярно замещает уходящую группу, приводя к образованию эпоксида − трёхчленного гетероцикла с одним атомом кислорода:
Серные нуклеофилы
Серосодержащие соединения обычно являются хорошими нуклеофилами, так как атом серы легко поляризуется, что облегчает передачу электронной пары. Типичные нуклеофилы этого класса — тиолы (RSH) и тиоляты (RS − ).
Шкалы нуклеофильности
Известно несколько способов количественного описания реакционной способности нуклеофилов. Приведенные ниже методы основаны на изучении экспериментальных данных о скорости определенных реакций с участием большого количества нуклеофилов и электрофилов. Как правило, реагенты с выраженным альфа-эффектом не включаются в эти корреляции.
Уравнение Свена-Скотта
Уравнение Свена-Скотта было выведено в 1953 году и является первой попыткой количественно описать реакционную способность нуклеофилов в реакциях SN2 [5] [6] :
В этом уравнении k — константа скорости реакции стандартного субстрата с данным нуклеофилом, k0 — константа скорости реакции субстрата со стандартным нуклеофилом (водой), S — параметр чувствительности субстрата к изменению нуклеофила (для CH3Br или CH3I S принимается равным 1), n — параметр нуклеофильности (для воды n = 0, табл. 1, 2).
Таким образом, для реакций
уравнение Свена-Скотта можно записать как
| Нуклеофил | Значение n | Нуклеофил | Значение n | Нуклеофил | Значение n |
|---|---|---|---|---|---|
| SO3 2− | 5,16 | CN − | 5,10 | I − | 5,04 |
| SCN − | 4,77 | HO − | 4,20 | N3 − | 4,00 |
| Br − | 3,89 | HCO3 − | 3,80 | Cl − | 3,04 |
| CH3COO − | 2,72 | SO4 2− | 2,50 | F − | 2,00 |
| NO3 − | 1,03 | CH3OH | 0,70 | H2O | 0,00 |
| Нуклеофил | Значение n | Нуклеофил | Значение n | Нуклеофил | Значение n |
|---|---|---|---|---|---|
| F − | 2,7 | Cl − | 4,37 | Br − | 5,79 |
| I − | 7,42 | N3 − | 5,78 | NC − | 6,70 |
| CH3OH | H2O | 0,00 | CH3CO2 − | 4,3 | |
| PhO − | 5,75 | CH3O − | 6,29 | Пиридин | 5,23 |
| Анилин | 5,70 | Триэтиламин | 6,66 | PhSH | 5,7 |
Уравнение Ричи
Уравнение Ричи было выведено в 1972 году [9] и выражается следующим образом [10] :

где 


| Нуклеофил (растворитель) | Значение N + | Нуклеофил (растворитель) | Значение N + |
|---|---|---|---|
| H2O (H2O) | 0,0 | MeOH (MeOH) | 0,5 |
| CN − (H2O) | 3,8 | CN − (MeOH) | 5,9 |
| HO − (H2O) | 4,5 | MeO − (MeOH) | 7,5 |
| N3 − (H2O) | 5,4 | N3 − (MeOH) | 8,5 |
| PhS − (ДМСО) | 13,1 | PhS − (MeOH) | 10,7 |
Уравнение Майра-Патца
В 1994 г. Г. Майр и М. Патц, на основании исследования реакционной способности диарилметильных катионов и других соединений, предложили уравнение, описывающее реакционную способность достаточно большого количества нуклеофилов и электрофилов [14] :
В этом уравнении константа скорости реакции второго порядка k, измеренная при 20 °C, связывается с параметром электрофильности E (для бис(п-метоксифенил)метильного катиона E = 0), параметром нуклеофильности N и фактором чувствительности s (для реакций 2-метил-1-пентена s = 1). Для реакций незаряженных нуклеофилов константа скорости слабо зависит от растворителя и последний обычно не указывается.
| Нуклеофил | N (s) | Нуклеофил | N (s) |
|---|---|---|---|
| 1 | −4,47 (1,32) | 2 | −0,41 (1,12) |
| 3 | +0,96 (1) | 4 | −0,13 (1,21) |
| 5 | +3,61 (1,11) | 6 | +7,48 (0,89) |
| 7 | +13,36 (0,81) | PhC − (CN)CH3 [16] | 28,95 (0,58) |
Параметр элекрофильности E для некоторых карбокатионов можно грубо оценить по следующему уравнению [14] :

где kw — константа псевдопервого порядка для реакции карбокатиона с водой при 20 °C.
Нуклеофильность N в уравнении Майра-Патца связана с параметром Ричи N+ следующим соотношением:
Объединенное уравнение
В попытке объединить все вышеописанные уравнения Майр с сотрудниками предложили следующее выражение [17] :

где sE — параметр чувствительности электрофила; sN — параметр чувствительности электрофила; N и E имеют такое же значение, как и в уравнении Майра-Патца.
С помощью соответствующих подстановок данное выражение можно превратить в любое описанное ранее уравнение:
См. также
Примечания
Полезное
Смотреть что такое «Нуклеофил» в других словарях:
нуклеофил — nukleofilas statusas T sritis chemija apibrėžtis Dalelė, turinti laisvą elektronų porą ar didesnį elektronų tankį. atitikmenys: angl. nucleophile rus. нуклеофил … Chemijos terminų aiškinamasis žodynas
Значение параметра нуклеофильности n для некоторых реагентов (вода, 25°С) — Нуклеофил Х: n S2O32 6,38 SO32 5,16 CN 5,10 … Химический справочник
Реакции нуклеофильного замещения — (англ. nucleophilic substitution reaction) реакции замещения, в которых атаку осуществляет нуклеофил реагент, несущий неподеленную электронную пару.[1] Уходящая группа в реакциях нуклеофильного замещения называется нуклеофуг. Все … Википедия
ТЕЛЕ-ЗАМЕЩЕНИЕ — замещение (обычно нуклеоф.) в аро матич. или гетероароматич. ряду, при к ром входящая группа вступает в положение, находящееся через один или более атомов от уходящей группы; обозначается … Химическая энциклопедия
НИТРОСОЕДИНEНИЯ — (С нитросоединения), содержат в молекуле одну или неск. нитрогрупп, непосредственно связанных с атомом углерода. Известны также N и О нитро соединения (см. Нитрамины и Нитраты органические). Нитрогруппа имеет строение, промежуточное между двумя… … Химическая энциклопедия
НУКЛЕОФИЛЬНЫЕ РЕАКЦИИ — гетеролитич. р ции орг. соед. с нуклеоф. реагентами (нуклеофилами, от лат. nucleus ядро и греч. phileo люблю). К н у к л е о ф и л а м относят анионы и молекулы (орг. и неорг.), к рые при участии в р ции отдают свою пару электронов на образование … Химическая энциклопедия
Аммиак — Общие Химическая формул … Википедия
Реакции присоединения — (англ. addition reaction) в органической химии так называются химические реакции, в которых одни химические соединения присоединяются к кратным (двойным или тройным) связям другого химического соединения. Присоединение может… … Википедия
БЕНЗОПИРИЛИЯ СОЛИ — (соли хромилия), содержат в молекуле катион бензопирилия структуры I или II. Хим. св ва этих структур различны вследствие фенольного характера кислорода в I и кетонного во II Соед. I не обменивает атом кислорода на др. гетеро атомы и не превращ.… … Химическая энциклопедия
ВАГНЕРА-МЕЕРВЕЙНА ПЕРЕГРУППИРОВКИ — общее назв. р ций, протекающих с 1,2 миграцией группы R(H, алкил или алициклич. фрагмент, арил, ацил, алкоксикарбонил и др.) к карбкатионному центру, возникающему в молекуле при нуклеоф. замещении, присоединении к кратной связи или элиминировании … Химическая энциклопедия
Нуклеофил
СОДЕРЖАНИЕ
История [ править ]
Термины нуклеофил и электрофил были введены Кристофером Келком Ингольдом в 1933 году [1], заменив термины анионоид и катионоид, предложенные ранее AJ Lapworth в 1925 году [2].
Слово нуклеофил происходит от ядра и греческого слова φιλος, «философ», означающего « друг».
Свойства [ править ]
В общем, в группе по периодической таблице, чем более щелочной ион (чем выше pK a конъюгированной кислоты), тем он более реакционноспособен как нуклеофил. В ряду нуклеофилов с одним и тем же атакующим элементом (например, кислородом) порядок нуклеофильности будет соответствовать основности. Сера в целом является лучшим нуклеофилом, чем кислород.
Нуклеофильность [ править ]
Уравнение Суэйна – Скотта [ править ]
Первая такая попытка обнаружена в уравнении Суэйна – Скотта [3] [4], полученном в 1953 году:
Уравнение Ричи [ править ]
Уравнение Ричи, полученное в 1972 году, представляет собой еще одно соотношение свободной энергии: [5] [6] [7]
В исходной публикации данные были получены реакциями выбранных нуклеофилов с выбранными электрофильными карбокатионами, такими как катионы тропилия или диазония :
Уравнение Майра – Патца [ править ]
В уравнении Майра – Патца (1994): [8]
Многие из констант были получены в результате реакции так называемых ионов бензгидрилия как электрофилов : [9]
и разнообразный набор π-нуклеофилов:
Диапазон органических реакций также включает реакции SN2 : [11]
Единое уравнение [ править ]
В попытке унифицировать описанные выше уравнения уравнение Майра переписывается следующим образом: [11]
log ( k ) = s E s N ( N + E ) <\displaystyle \log(k)=s_
Типы [ править ]
Галогены [ править ]
Углерод [ править ]
Кислород [ править ]
Сера [ править ]
Азот [ править ]
Металлические центры [ править ]
Нуклеофил
СОДЕРЖАНИЕ
История [ править ]
Свойства [ править ]
В общем, в группе, входящей в периодическую таблицу, чем более щелочной ион (чем выше pK a конъюгированной кислоты), тем он более реакционноспособен как нуклеофил. В ряду нуклеофилов с одним и тем же атакующим элементом (например, кислородом) порядок нуклеофильности будет соответствовать основности. Сера в целом является лучшим нуклеофилом, чем кислород.
Нуклеофильность [ править ]
Уравнение Суэйна – Скотта [ править ]
Первая такая попытка обнаружена в уравнении Суэйна – Скотта [3] [4], полученном в 1953 году:
Уравнение Ричи [ править ]
Уравнение Ричи, полученное в 1972 году, представляет собой еще одно соотношение свободной энергии: [5] [6] [7]
В исходной публикации данные были получены реакциями выбранных нуклеофилов с выбранными электрофильными карбокатионами, такими как катионы тропилия или диазония :
Уравнение Майра – Патца [ править ]
В уравнении Майра – Патца (1994): [8]
Многие из констант были получены в результате реакции так называемых ионов бензгидрилия как электрофилов : [9]
и разнообразный набор π-нуклеофилов:
Диапазон органических реакций также включает реакции SN2 : [11]
Единое уравнение [ править ]
В попытке унифицировать описанные выше уравнения уравнение Майра переписывается следующим образом: [11]
log ( k ) = s E s N ( N + E ) <\displaystyle \log(k)=s_
Типы [ править ]
Галогены [ править ]
Углерод [ править ]
Кислород [ править ]
Сера [ править ]
Азот [ править ]
Металлические центры [ править ]
СОДЕРЖАНИЕ
История
Характеристики
В общем, в группе по периодической таблице, чем более щелочной ион (чем выше pK a конъюгированной кислоты), тем он более реакционноспособен как нуклеофил. В ряду нуклеофилов с одним и тем же атакующим элементом (например, кислородом) порядок нуклеофильности будет соответствовать основности. Сера в целом является лучшим нуклеофилом, чем кислород.
Нуклеофильность
Уравнение Суэйна – Скотта
Первая такая попытка была обнаружена в уравнении Суэйна – Скотта, полученном в 1953 году:
Уравнение Ричи
Уравнение Ричи, полученное в 1972 году, представляет собой еще одно соотношение свободной энергии:
В исходной публикации данные были получены реакциями выбранных нуклеофилов с выбранными электрофильными карбокатионами, такими как катионы тропилия или диазония :
Уравнение Майра – Патца
В уравнении Майра – Патца (1994):
Многие из констант были получены в результате реакции так называемых ионов бензгидрилия как электрофилов :
и разнообразный набор π-нуклеофилов:
В круг органических реакций также входят реакции SN2 :
Единое уравнение
В попытке унифицировать описанные выше уравнения уравнение Майра переписывается как:
Галогены
Углерод
Кислород
Металлические центры
Нуклеофилы и электрофилы



Понятие кислоты и основания очень близко к понятиям электрофил и нуклеофил, которые широко используются в органической химии для обозначения характера реагирующих частиц.
Нуклеофил – это частица с электронодонорными свойствами, способная образовать связь со своим партнером в реакции (электрофилом), отдавая неподеленую электронную пару или пару связи. Нуклеофилы являются основаниями Льюса.
а) отрицательно заряженные:
Электрофил – это частица с электроноакцепторными свойствами, которая образует связь со своим партнером в реакции (нуклеофилом). У электрофила должна быть вакантная орбиталь или сильнополярная связь. Электрофилы являются кислотами Льюса.
а) положительно заряженные:
Для того чтобы прошла гетеролитическая реакция, нужны два реагента – нуклеофильный (донор электронов) и электрофильный (акцептор электронов).