Что такое нутритивная поддержка
Питание при химиотерапии
10.11.21 Время на чтение: 20 минут
Содержание статьи
Современная медицина развивается с огромной скоростью, постоянно совершенствуя методы борьбы с онкологическими заболеваниями. Так, в 2018 году в США было одобрено рекордное количество препаратов против рака – 59. А Нобелевская премия того же года была вручена за новую модальность иммуноонкологии.
В России на борьбу с онкологическими заболеваниями направлена Национальная программа «Онкология», в рамках которой большое внимание уделяется ранней диагностике рака и повышению качества жизни онкопациентов, что существенно облегчает борьбу с недугом.
Важным элементом лечения онкологических пациентов является нутритивная терапия: проблемы с питанием являются одной из самых распространённых трудностей, сопровождающих возникновение и лечение раковых заболеваний, а также восстановление после них. По данным Европейского общества парентерального и энтерального питания, частота недостаточности питания у онкологических больных колеблется от 46 до 88%. Нутритивная (белково-энергетическая) недостаточность может стать даже причиной смерти.
Одним из ведущих методов борьбы с онкологическими заболеваниями является химиотерапия. Этот системный метод лечения основывается на введении в организм сильнодействующих токсических препаратов, которые уничтожают злокачественные опухоли или останавливают их развитие. К сожалению, такое лечение отражается и на здоровых клетках, например, пациент может временно лишиться волос или испытывать проблемы с пищеварением.
Химиотерапия сложно переносится организмом и может вызывать тяжёлые последствия. Так, она меняет вкус и обоняние: привычная, даже любимая еда, может вызвать у пациента отвращение, а её запах – рвотные позывы. Повреждённые слизистые делают очень сложным процесс пережёвывания и проглатывания пищи. Становятся часты запоры. К тому же часть препаратов, которое принимает больной, может подавлять чувство голода. Из-за всего этого человек начинает мало есть, и у него может возникнуть анорексия. В этом случае нутритивная терапия становится одним из методов лечения: она обеспечивает организм необходимыми питательными веществами, помогая сохранить силы и жизнеспособность даже в самых тяжёлых состояниях.
Это важно!
Нутритивная поддержка для онкологических больных важна, потому что она:
Нутритивная поддержка онкологических пациентов
На любом этапе комплексного лечения онкологических заболеваний – от диагностики заболевания до этапа реабилитации – необходимо уделять должное внимание тому, чем и как питается пациент. Питание – это важный показатель качества жизни пациента.
Что такое нутритивная недостаточность?
Каковы ее причины?
Как определить нутритивную недостаточность самостоятельно?
Кому нужна нутритивная поддержка?
Что нужно знать о нутритивной поддержке?
Ответы на эти и другие вопросы в статье Надежды Александровны Бриш, врача-онколога отделения краткосрочной химиотерапии НМИЦ онкологии им. Н.Н. Петрова.
Значимость питания в жизни пациента
Питание важно для здорового функционирования организма человека. И в особенности для онкологических пациентов.
На любом этапе комплексного лечения онкологических заболеваний – от диагностики заболевания до этапа реабилитации – необходимо уделять должное внимание тому, чем и как питается пациент. Питание – это важный показатель качества жизни пациента.
Качество жизни пациента – это интегральная характеристика. Она включает в себя его физическое, психологическое и социальное функционирование.
Цель врача не просто вылечить человека, но и сохранить социальную адаптацию и психологическое благополучие, чтобы пациент мог себя максимально комфортно чувствовать в период лечения и после него.
Нутритивная недостаточность и риск ее возникновения
Важно, чтобы пациент и врач понимали, о чем они говорят друг другу. Поэтому ознакомимся с некоторыми терминами.
Нутритивный статус – комплекс клинических, антропометрических и лабораторных показателей, характеризующих количественное соотношение мышечной и жировой массы человека.
Также важным понятием является нутритивная или питательная недостаточность. Это состояние, которое обусловлено несоответствием между поступлением питательных веществ в организм и их расходом, что приводит к снижению массы тела и изменению компонентного состава организма.
Риск развития нутритивной недостаточности у онкологических пациентов высок. Он зависит от локализации опухоли и стадии процесса.
Причины нутритивной недостаточности
1. Снижение потребления пищи.
Оно может быть связано как с проявлениями самого заболевания (затруднения при проглатывании пищи, тошнота, рвота), так и с осознанным ограничением потребления пищи пациентом.
2. Нарушение усвоения питательных веществ.
Часто это связано с органическими и структурными изменениями органов ЖКТ.
3. Потеря питательных веществ.
Это может происходить на фоне рвоты или диареи в связи с основным заболеванием или в результате лечения.
4. Нарушения метаболизма (обмена веществ).
Нарушение метаболизма на фоне онкологического заболевания может быть связано с недостатком определенных питательных веществ, например, витаминов. Они участвуют во многих биологических реакциях организма. Если происходит нарушение всасывания или поступления витаминов в организм, нарушается обмен веществ в целом.
5. Психологический стресс.
Во-первых, на фоне стресса может снижаться аппетит, и, как следствие, снижаться количество потребляемой пищи. Замыкается порочный круг. Во-вторых, в организме могут запускаться механизмы, которые ускоряют распад питательных веществ.
Медицинский скрининг нутритивной недостаточности
Специалистам в контроле динамики и состояния нутритивного статуса пациента помогают следующие методы:
1. Контроль массы тела.
Контроль массы тела – задача не только врача, но и самого пациента. Необходимо следить за своим весом, питанием и обращать внимание на происходящие изменения.
2. Клинический и биохимический анализы крови.
По данным анализа крови (например, по уровню белка, альбумина в крови, по количеству лимфоцитов) врачи могут отслеживать и фиксировать наличие и динамику нутритивной недостаточности у пациента.
3. Биоимпедансметрия.
Это один из инструментальных методов в арсенале врачей. Он основан на изучении количественного соотношения мышечной и жировой массы тела, оценке их соотношения в динамике. В его основе лежат физические законы различной электропроводимости тканей организма.
4. Компьютерная томография.
Используется также для оценки количества мышечной и жировой массы тела. Она выполняется каждому пациенту на этапе постановки диагноза и при дальнейшем лечении.
Скрининг нутритивной недостаточности: самостоятельный тест
Пациент может самостоятельно осуществить скрининг нутритивной недостаточности.
Для этого нужно ответить на три простых вопроса:
Если за 3 вопроса в сумме набралось более 2х баллов, то пациенту необходимо проведение нутриционной поддержки.
Необходимо своевременно выявлять пациентов из группы риска нарушения питательного статуса. Это позволяет защитить их от прогрессирующей потери массы тела и развития связанных с этим осложнений.
Скрининг и мониторинг недостаточности питания должны проводиться на протяжении всего лечения, что важно для оценки динамики нутритивного статуса онкологических пациентов.
Профилактика саркопении
Саркопения – понятие, которое тесно связано с нарушением питательного статуса.
Саркопения – изменение скелетной мускулатуры, приводящее к постепенной потере мышечной массы тела и снижению функции мышц. Обычно такое состояние обусловлено возвратными изменениями метаболических процессов, нарушением питания и усиленным мышечным катаболизмом (расщеплением питательных веществ).
Помочь в профилактике саркопениии могут следующие методы:
Если говорить о конкретных показателях, то можно обратить внимание на следующие элементы и придерживаться указанных значений:
Синдром анорексии-кахексии
Следующее важное понятие – синдром анорексии-кахексии. Это многофакторный синдром, характеризующийся потерей массы тела, анорексией (в том числе снижением или отсутствием аппетита) и различными метаболическими нарушениями (усиленный распад питательных веществ, распад белков в мышцах, синдром хронического воспаления).
Выделяют 3 степени этого синдрома: прекахексия, кахексия и рефрактерная кахексия.
Синдром анорексии-кахексии тесно связан с общим самочувствием пациента. При нарастании явлений синдрома анорексии-кахексии ухудшается общее самочувствие пациента, что влечет за собой невозможность продолжения специализированного противоопухолевого лечения.
В широком смысле кахексия не равняется потере массы тела. Потеря массы тела – это только часть, одно из звеньев, которое приводит к ее развитию.
Раковая кахексия — это:
Нутритивная поддержка как вид сопроводительной терапии
Нутритивная поддержка – это лечебное питание, цель которого обеспечить организм всеми необходимыми питательными веществами с помощью питательных смесей. Это оптимизирует процессы метаболизма, а также увеличивает резервы организма.
Цели и задачи нутритивной поддержки:
Методы нутритивной поддержки:
Сипинговое питание
Энтеральное питание (сипинг) — питание, физиологичное для организма. Применяется обычно в дополнение к обычному рациону пациента. Это пероральный прием питательной смеси через трубочку маленькими глотками.
Следует соблюдать простые правила относительно сипинга: пить необходимо строго через трубочку (чтобы глоток был небольшим) и пить медленно (примерно в течение 30 минут). При этом предпочтительно использовать специализированные смеси, содержащие максимальное количество питательных веществ в минимальном объеме.
Особое внимание следует обращать на количество в смеси белка – строительного материала для восстановления организма, повышения его сопротивляемости. При развитии нутритивной недостаточности в первую очередь усиливается распад именно белков, нарушается их синтез в организме.
Смеси для сипинга имеют различные вкусовые особенности, и часто пациенты могут индивидуально выбирать тот вкус, который им нравится.
Зондовое питание
Еще один из методов нутритивной поддержки – зондовое питание. Оно представляет собой энтеральное питание. Такое питание осуществляется посредством постановки зонда в желудок или тонкий кишечник.
При невозможности постановки зонда необходимо формирование гастро- или энтеростомы, при которых питание поступает непосредственно в соответствующий орган.
Данный подход применим в трех случаях: когда пациенты не могут, не хотят или не должны получать питание перорально (через рот).
Парентеральное питание
Парентеральное питание предполагает использование смесей, которые специально разработаны для их введения в периферические или центральные вены.
Показания к применению такого метода:
Кому нужна нутритивная поддержка?
К принципам нутритивной поддержки принято относить следующие:
Важно, чтобы этапы оценки нутритивного статуса пациента, разработка плана питательной поддержки пациента совпадали с диагностикой и лечением основного заболевания. Тем самым можно добиться увеличения эффективности обоих методов.
Абсолютными показаниями к назначению активной нутритивной поддержки являются:
Начало и продолжительность нутритивной поддежки
Период, когда назначается нутритивная поддержка:
Продолжительность проведения нутритивной поддержки:
Критерии продолжительности нутритивной поддержки или показатели того, что она может быть завершена:
Лишний вес и нутритивная поддержка
Очень важным вопросом является оценка того, нуждаются ли пациенты с повышенной массой тела в нутритивной поддержке.
Нормальная или повышенная масса тела не означает того, что у пациента не имеется признаков саркопении (снижения объема мышечной массы).
При нарастающей потере массы тела в первую очередь уменьшается не жировая ткань, а теряется именно мышечная ткань. Это ведет к потере белка и развитию различных осложнений. Данный процесс не зависит от исходной массы тела человека.
Кроме того, во многих исследованиях доказано, что наличие саркопенического ожирения (сочетание уменьшения мышечной массы тела с повышенной жировой массой) также неблагоприятно сказывается на прогнозе заболевания, т.к. ухудшает переносимость противоопухолевого лечения.
Развитие опухоли и нутритивная поддержка
Еще один часто задаваемый вопрос от пациентов: влияет ли проведение нутритивной поддержки на рост и распространение опухоли?
В настоящее время данных, подтвержденных какими-либо научными исследованиями, которые говорили бы о воздействии нутритивного («искусственного») питания на рост опухоли у пациентов, нет.
Нормальные неизмененные клетки организма (точно также, как и злокачественные) нуждаются в питательных веществах, чтобы лучше функционировать, чтобы иметь возможность сопротивляться активному противоопухолевому лечению.
Жесткое ограничение в питательных веществах и каких-либо продуктах не только не поможет в лечении, но и может нанести вред.
Рекомендации нутритивной поддержки от russco
Рекомендации по проведению нутритивной поддержки являются неотъемлемой частью многих руководств по лечению различных заболеваний, в том числе и онкологических.
Так, в руководстве российского общества клинической онкологии RUSSCO даны четкие указания по поводу проведения нутритивной поддержки:
Что нужно знать о нутритивной поддержке?
Подходит ли спортивное питание для пациентов?
Некоторые пациенты интересуются возможностью использования питания для спортсменов, поскольку оно содержит много питательных веществ.
Спортивное питание рассчитано на спортсменов, которые получают повышенную физическую нагрузку. В таком питании очень высоки дозы всех питательных веществ, не только витаминов. Это питание создано из расчета на то, что человек будет испытывать большую физическую нагрузку.
Пациенты, как правило, в период лечения в спортивный зал не ходят, поэтому все-таки лучше обратиться к медицинскому питанию. Оно более сбалансировано и рассчитано на потребности именно пациентов, которые на данный момент получают лечение.
Рекомендации по лечебному питанию должен давать онколог. Также есть и другие специалисты – диетологи и нутрициологи, которые могут помочь с подбором питания. Кроме того, можно также проконсультироваться с гастроэнтерологом, который учтет имеющиеся гастроэнтерологические проблемы, связанные с нарушением питания.
Лечебное голодание и лечение опухоли
Бытует мнение, что при онкологических заболеваниях полезно лечебное голодание, чтобы не «кормить» опухоль.
Специалисты с этим категорически не согласны. Опухоль, которая имеется в организме, получает только часть питательных веществ, которые поступают в организм. При голодании организму не хватает сил, строительного материала для быстрого и успешного восстановления после химиотерапии, лучевой терапии или хирургического лечения. Поэтому ограничений в рационе быть не должно.
Конечно, этот вопрос должен решаться индивидуально: многие пациенты имеют сопутствующую патологию. В этом случае врач должен подобрать определенную диету. Но целенаправленно ограничивать себя в употреблении белка, рыбы, молочных и других продуктов и не стоит. Весь организм, кроме злокачественной опухоли, настроен на борьбу с заболеванием и нуждается в питательных веществах.
В организме ежесекундно образуются опухолевые клетки – клетки, над которыми организм теряет контроль – у кого-то они эффективно уничтожаются, у кого-то активно делятся. Наивно думать, что ограничение употребления белка приведет к гибели опухоли. При голодании организм запускает альтернативный синтез и начинает «брать» белок из здоровых тканей. В таком случае в теле человека происходят необратимые процессы, что приводит к ограничению использования современных методов противоопухолевого лечения.
Можно ли оценить недостаточность питания только по индексу массы тела?
Недостаточность питания также оценивается по ИМТ. Индекс массы тела – это соотношение веса к росту в квадрате. Но у онкологических больных ИМТ не является однозначным показателем для оценки нутритивного статуса.
Для оценки состояния нутритивного гомеостаза у пациента нужно оценивать все в комплексе: и клинические данные, и жалобы пациента на потерю массы тела, и показатели клинического и биохимического анализов крови, а также рассчитывать соотношение мышечной и жировой массы тела по компьютерной томографии и биоимпедансметрии.
Следует обращать большое внимание на стабильность массы тела. О любом снижении массы тела пациент должен сообщить лечащему врачу. Очень важно учитывать за какой период и сколько килограммов было потеряно.
Когда нет необходимости в нутритивной поддержке?
Нутритивная поддержка нужна не всем пациентам.
Питание должно быть полноценным и в процессе лечения, и в период реабилитации, и на протяжении всей жизни. Рацион должен стать гармоничным.
Витаминные комплексы и нутритивную поддержку (лечебное, специальное питание) должен назначать только лечащий врач. Существует целая линейка такого питания, и специалист выбирает именно то, что необходимо для поддержки и лечения конкретному пациенту.
Роль обычных продуктов питания при лечении онкологических заболеваний
Не существует каких-либо общих рекомендаций по рациону онкологических пациентов.
На основании исследований, в том числе зарубежных, врачи приходят к выводу, что «ненужных» продуктов как таковых не существует. Например, нет обоснованных запретов относительно употребления сахара.
Что касается белка, то он должен присутствовать в рационе – как растительный, так и животный. Некоторое отклонение в вегетарианство на фоне достаточно тяжелого и сложного лечения врачами не очень приветствуется, так как этим резко ограничивается разнообразие рациона пациентов.
В лечении онкологического заболевания важна стабильность. В том числе и в питании. Не стоит резко переходить на другой тип питания (например, вегетарианство, если вы всегда если мясо), или садиться на любую другую диету. Это ‒ стресс для организма.
Нутритивная поддержка у пациентов в хирургической клинике
В лекции представлены актуальность целенаправленного обеспечения нутритивной поддержки у пациентов в предоперационном и послеоперационном периодах. Рассмотрены вопросы определения потребности пациентов в энергии, макро- и микронутриентах. Отдельно представлены современные технологии обеспечения пациентов нутриентами, сообразно конкретной клинической ситуации.
Нутритивная поддержка пациентов в хирургическом отделении в наше время перестала быть абсолютной прерогативной специалистов нутрициологов или врачей отделений интенсивной терапии и стала обязательным компонентом ведения пациента в пред- и послеоперационном периоде врачами-хирургами. В настоящее время тезис о том, что белково-энергетическая недостаточность и связанные с ней осложнения и летальные исходы являются важнейшей составляющей тяжелого хирургического заболевания или травматического повреждения уже не является оригинальным утверждением. Хорошо известно, что ранняя адекватная нутритивная поддержка, представленная различными сочетаниями методик парентерального и энтерального питания, является на настоящем этапе развития медицины наиболее эффективным методом коррекции расстройств белкового и энергетического обмена. На сегодняшний день в большинстве ретроспективных и проспективных исследований, представленных ESPEN (European Society Parenteral and Enteral Nutrition) и ASPEN (American Society Parenteral and Enteral Nutrition) убедительно продемонстрирована связь нутритивного статуса пациентов как с непосредственными результатами оперативного лечения – послеоперационными осложнениями и летальностью, так и с затратами на обеспечение лечебного процесса (рис. 1). В анализе, проведенном M. Isabel (2003) и охватывавшем исходы лечения 709 оперированных больных, было показано, что расходы на лечение больных с нутритивной недостаточностью за счет дополнительных затрат на коррекцию осложнений превышали таковые при лечении пациентов с нормальным нутритивным статусом на 308%. Учитывая, что от 30 до 60% поступающих в хирургические клиники пациентов имеют в различной степени выраженное состояние нутритивной недостаточности, возможно именно целенаправленная нутритивная поддержка способна принципиально улучшить результаты оперативного лечения и вывести хирургию на новый уровень достижений.
Современная концепция «улучшенной послеоперационной реабилитации» (Enhanced recovery after surgery – ERAS), становящаяся все более популярной и направленная на минимизацию времени пребывания пациента в стационаре, рассматривает периоперационную нутритивную поддержку пациента как неотъемлемую составляющую мультимодального «fast track» подхода наряду с лимитированием объема инфузионной терапии, адекватным обезболиванием с применением регионарной анестезии при ограничении введения опиоидных анальгетиков. Одно из средств достижения ранней реабилитации – восстановление обычного режима питания и подвижности уже в первые дни послеоперационного периода.
Говоря о нутритивной поддержке хирургических больных, следует подчеркнуть, что принципиальных отличий в показаниях к проведению им лечебного питания от пациентов других категорий нет. Стратегическим вектором нутритивной поддержки в хирургической клинике является предупреждение или коррекция нарушений нутритивного статуса пациента, ассоциируемых с изначально имеющимися как следствие основного заболевания, а также закономерно возникающими после операции гиперметаболизмом и катаболизмом. При этом известно, что выраженность катаболических нарушений имеет прямую зависимость с тяжестью основного заболевания и травматичностью оперативного вмешательства. Метаболический стресс, обусловленный активацией симпато-адреналовой системы и выделением колоссального числа биологически активных субстанций (биогенные амины, эйкозаноиды, интерлейкины, свободные радикалы), определяет нарушение всех видов обмена с избыточной мобилизацией энергетических субстратов в процессах гликогенолиза, липолиза, протеолиза и глюконеогенеза, что имеет своим следствием развитие инсулинорезистентной гипергликемии и отрицательного азотистого баланса.
Очевидно, что элементами патогенеза гиперкатаболического состояния и нутритивной недостаточности у пациентов с трахеопищеводными свищами являются факторы, связанные как с длительной невозможностью адекватного по объему питания per os, так и с развитием локальной и системной воспалительной реакции, а также с проведением травматичных резекционных и восстановительно-реконструктивных оперативных вмешательств и с потенциально возможным развитием послеоперационных осложнений. Дополнительным фактором развития гиперкатаболического состояния может являться опухолевый генез трахеопищеводного свища.
Основными задачами нутритивной поддержки вне зависимости от профиля пациента являются снижение катаболической реакции организма, восполнение энергетических затрат и обеспечение реализации эндогенного пластического потенциала. В зависимости от степени выраженности питательной недостаточности, тяжести метаболических нарушений и от функционального состояния желудочно-кишечного тракта (ЖКТ) нутритивная поддержка может быть реализована путем использования энтерального зондового питания и парентерального питания. В большинстве клинических ситуаций эти методы могут использоваться совместно или последовательно, дополняя друг друга.
Постельный режим – 1,1
Палатный режим – 1,2
Не менее важной задачей при планировании нутритивной поддержки является выбор оптимального в той или иной клинической ситуации способа доставки энергии и пластических субстанций в организм пациента. Как показывает опыт решение именно данной задачи, вне зависимости от профиля пациента, вызывает наибольшие затруднения как у хирурга, так и у врача ОРИТ.
Безусловно, оптимальным во всех отношениях вариантом доставки питательных субстратов является обеспечение их поступления в просвет пищеварительной трубки пероральным приемом или зондовым введением: восстанавливается моторика и гемоперфузия пищеварительной трубки, поддерживается морфо-функциональная целостность ее эпителиального слоя, что препятствует развитию синдрома энтеральной недостаточности, наилучшим образом в количественном и качественном аспектах происходит абсорбция питательных веществ. Необходимость проведения раннего энтерального питания, так называемый «fast track – протокол», в настоящее время является одним из важнейших компонентов концепции ERAS, рассматривающей уход от традиционной модели предоперационного голодания и максимально раннее начало послеоперационного введения специальных нутриентов в просвет пищеварительной трубки как основополагающие методы контроля метаболических и гиперкатаболических девиаций у оперированных больных, а, значит, и как основное средство улучшения исходов ближайшего послеоперационного периода. Известно, что любая стрессорная реакция организма, возникающая в том числе и в ответ на операционную травму, сопровождается в различной степени выраженной ишемией и реперфузионным поражением стенки кишечника, что может приводить к ряду послеоперационных осложнений. Вводимое в этой ситуации энтеральное питание компенсирует энергопотребность кишечного эпителия, усиливает мезентериальный кровоток и защищает стенку кишки от реперфузионных осложнений. При длительном отсутствии энтерального питания происходит атрофия слизистой оболочки кишечника, а также атрофия ассоциированной с кишечником лимфоидной ткани, что играет ключевую роль в снижении защиты от транслокации микроорганизмов кишечника в портальный и системный кровоток. Именно энтеральное питание поддерживает ассоциированную с кишечником лимфоидную ткань, что становится профилактикой избыточной колонизации тонкой кишки и транслокации бактерий и эндотоксинов в портальный кровоток. Многократно доказано, что введение питательных смесей в просвет тонкой кишки во многом определяет адекватное функционирование иммунной системы организма. A. Welmann (2006), F. Bozetti (2007), J. Waters (2011) указывают, что именно раннее начало энтерального введения пищевых субстанций (1 сутки послеоперационного периода) является основным средством разрешения пареза пищеварительной трубки, ранней активизации пациентов, уменьшения числа послеоперационных осложнений и сокращения длительности госпитализации.
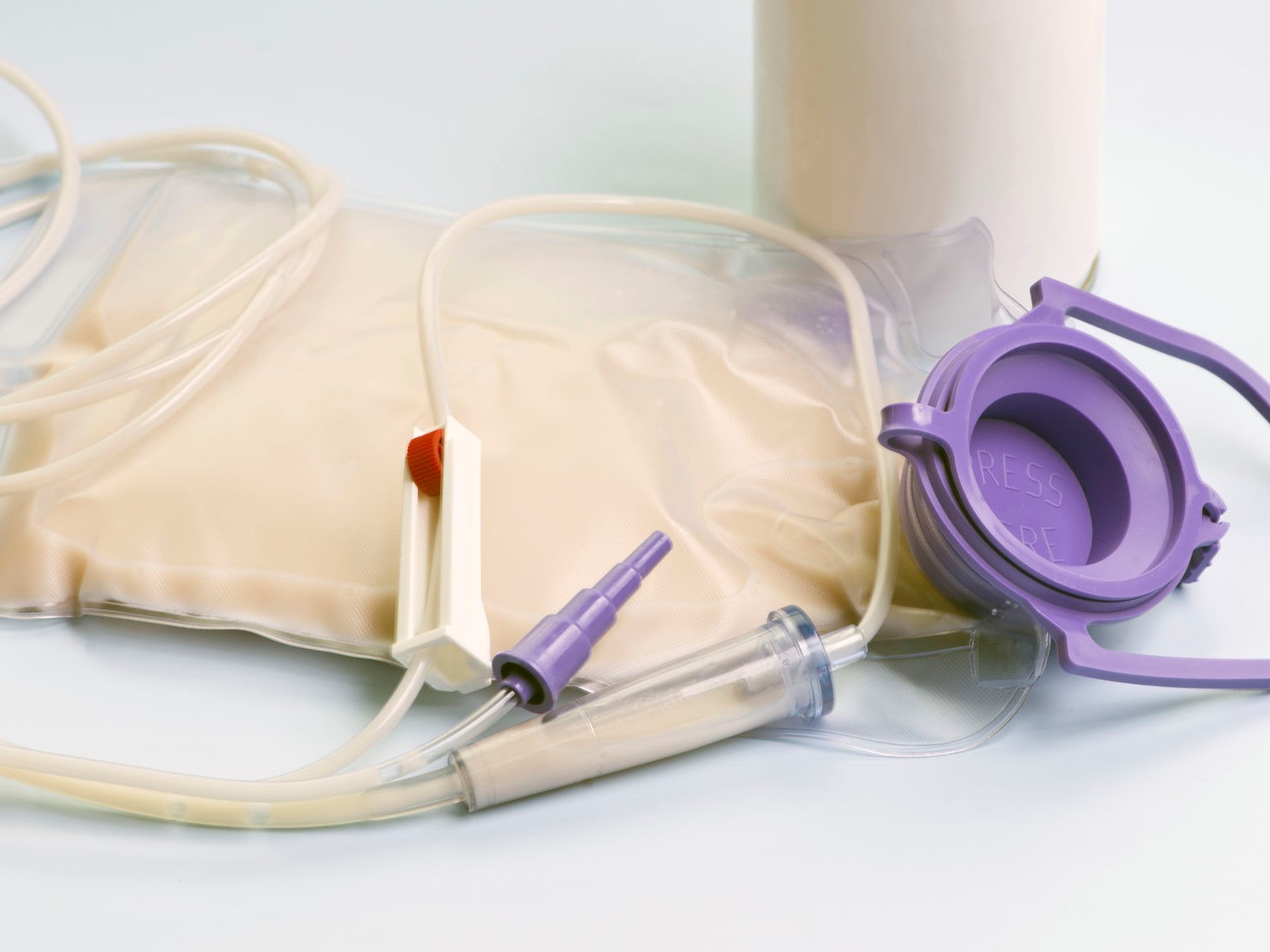
Очевидно, что наличие у пациента пищеводного, желудочного или высокого тонкокишечного свища или резко сокращает, или, что значительно чаще, полностью исключает возможность перорального приема пищевых субстанций: заживление и выздоровление при вышеуказанных свищах возможны только при исключении перорального приема пищи. Питание через рот может быть возобновлено только при рентгенологическом подтверждении полного заживления свища и прекращения выхождения содержимого из просвета пищеварительной трубки. В данном случае нутритивная поддержка осуществляется комбинацией парентерального и энтерального питания, либо парентеральным питанием в моноварианте. Энтеральное введение питательных смесей проводится с помощью установленного назо-энтерального или (что менее предпочтительно) назо-гастрального зонда.
Выбор конкретной смеси для энтерального питания зависит от целого ряда факторов. Тем не менее общие требования, предъявляемые к современным энтеральным смесям, сводятся к достаточной энергетической плотности (не менее 1 ккал/мл), отстутствию лактозы и глютена, низкой осмолярности (не более 300–340 мосм/л), низкой вязкости, отстутствию избыточной стимуляции кишечной моторики, содержанию достаточных данных о составе и производителе питательной смеси, а также указания на наличия генетической модификации нутриентов (белков). Все смеси для энтерального питания принято разделять на стандартные, полуэлементные, модульные и смеси направленного действия (органспецифические).
Стандартные смеси содержат все необходимые макро– и микронутриенты в соответствии с суточными потребностями организма. Белки содержатся в цельном, негидролизованном виде (молочные, соевые). Жиры представлены растительными маслами (подсолнечное, соевое, кукурузное и др.). Углеводы – в виде мальтодекстринов (гидролизаты крахмала). Стандартные смеси используются в большинстве клинических ситуаций, когда имеются показания для энтерального питания, за исключением выраженных нарушений пищеварения и всасывания нутриентов, а также органной патологии (печеночной, почечной и др.). Примерами стандартных смесей для энтерального питания являются Нутризон Стандарт, Нутрикомп Стандарт, Нутрикомп Энергия Файбер, Нутризон Энергия, Нутрикомп Файбер.
Полуэлементные смеси представляют собой также полностью сбалансированные нутриенты, в которых белки представлены в виде пептидов и аминокислот (белковых гидролизатов), которые усваиваются даже при выраженных нарушениях пищеварения и кишечного всасывания. Большая часть жиров представлена среднецепочечными триглицеридами, которые перевариваются без участия липазы поджелудочной железы. Полуэлементные смеси назначаются при выраженных расстройствах пищеварительной и всасывательной функций (мальабсорбции, диарее), в том числе в раннем послеоперационном периоде. В российских клиниках используются полуэлементные смеси Нутриэн Элементаль и Нутрилон Пепти ТСЦ, Альфаре, Пептамен. Многие авторы справедливо полагают, что использование полуэлементных смесей является реальной альтернативой парентеральному питанию.
Модульные смеси содержат только один из нутриентов (белок, жир) или отдельные аминокислоты (глутамин), регуляторы метаболизма (L-карнитин). Они используются для дополнения рациона искусственного или обычного лечебного питания. Протеиновые модули (белковые гидролизаты) направлены на увеличение белковой квоты в суточном рационе и используются при повышении белковой потребности или потере белка. Энергетический модуль (состоящий из мальтодекстрина) позволяет увеличить энергетическую ценность диеты. Модуль среднецепочечных триглицеридов (МСТ – medium chain triglycerides) содержит жирные кислоты с 6-12 атомами углерода (капроновую, каприловую и др.), которые всасываются без участия липазы и желчных кислот и всасываются в тонкой кишке в кровь воротной вены, а не в лимфу. Этот модуль назначается при нарушениях переваривания, всасывания и усвоения жиров. Модуль L-карнитина способствует окислению жиров в митохондриях клеток и назначается при алиментарном истощении любого происхождения.
Смеси направленного действия созданы таким образом, чтобы корригировать нарушения метаболизма, типичные для данной патологии (печеночной, почечной, дыхательной недостаточности, нарушениях иммунитета, сахарном диабете).
При нарушениях функции почек (острая или хроническая почечная недостаточность) назначаются смеси с измененным белковым компонентом, представленным в основном незаменимыми аминокислотами и гистидином, и пониженным содержанием калия, натрия, хлоридов, фосфора и витамина D: Нутрикомп АД Н ренал, Нутриэн Нефро, Ренамин.
При нарушениях иммунитета, угрозе инфекции или сепсиса назначаются смеси с высоким содержанием глутамина, аргинина, рибонуклеиновой кислоты, омега-З жирных кислот, L-карнитина, такие как Нутрикомп Иммунный, Нутриэн Иммун.
При сахарном диабете и гипергликемических состояниях назначаются смеси, содержащие фруктозу, пектин и микрокристаллическую целлюлозу. К таким энтеральным смесям относят Нутрикомп АДН диабет, Нутриэн Диабет, Диазон.
Как было указано выше смеси для энтерального питания можно вводить через зонд на разных уровнях пищеварительной трубки. Мотивация выбора того или иного сегмента пищеварительной трубки для введения питательных субстанций имеет определяется рядом факторов, сообразно конкретной клинической ситуации. Так, более простой и физиологичный доступ на уровне желудка позволяет уменьшить риск неаспирационных осложнений (диарея, запор) и осуществить декомпрессию желудка. При этом крайне желательно, чтобы пациент находился в сознании и не имел нарушений моторной функции желудка. Доступ в проксимальные отделы тонкой кишки (двенадцатиперстную, тощую) снижает риск аспирации желудочного содержимого и питательной смеси, может применяться при нарушениях сознания, парезе желудка. Для краткосрочного энтерального питания в сроки до 3 недель обычно используются назогастральный или назоеюнальный доступы. При проведении нутриционной поддержки средней продолжительности (от 3 недель до 1 года) или длительной (более 1 года) принято использовать чрескожную эндоскопическую гастростомию или традиционную гастро– или еюностомию.
Существует два основных технических способа введения питательных смесей: пассивный (гравитационно-капельный) и активный (ручной или аппаратный). При пассивном методе непрерывная инфузия смеси через зонд осуществляется через стандартные системы для внутривенных инфузий с разрушенным фильтром или через специальные системы, поставляемые с контейнерами для зондового питания и регулируется дозатором. К преимуществам капельного способа введения энтеральной смеси, по сравнению с ручным и аппаратным способами, относят: снижение риска аспирации и расширения желудка, снижение потерь тепла пациентом на 100 ккал/сутки, лучшую переносимость больным, снижение риска диареи, лучшую усвояемость питания, более эффективную профилактику стрессового эрозивно-язвенного поряжения пищеварительной трубки, меньшие экономические затраты и занятость медперсонала.
Ручной метод подразумевает дробное дозированное введение питательной смеси с помощью шприцев типа Жане. Наиболее эффективно введение смесей с помощью насосов-инфузоров, обеспечивающих автоматическую подачу смеси непрерывным, капельным или болюсным путем (Питон 101, Flexio, Enteroport, Frenta-System, Kangaroo, Nutromat и др.). Преимущества аппаратного метода очевидны: возмочность точного дозирования вводимого в единицу времени объема смеси (соответственно, энергии и пластических субстанций), гарантированное введение смеси вне зависимости от ее дисперсности и вязкости, что, в свою очередь, исключает необходимость постоянного контроля процесса инфузии смеси медперсоналом.
При любом техническом способе введение энтеральной смеси начинают со скорости 50 мл/час в первые сутки. Каждые последующие сутки скорость введения увеличивают на 25 мл/час. При этом максимальный темп подачи смеси не должен составлять более чем 125 мл/час. Введение нужно осуществлять в течение 18-20 часов в течение суток с обязательным последующим перерывом.
С учетом представленной выше скорости зондовой инфузии питательных смесей нетрудно подсчитать, что максимально возможный калораж энтерального питания, введенного в первые сутки (стандартная энергоемкость смеси — 1 ккал/мл), составляет 1000 ккал, во вторые сутки — 1500 ккал, в третьи сутки максимально возможный калораж энтерального питания составит 2000 ккал. В этой связи становится очевидным, что только проведением энтерального питания потребности организма, находящегося в стрессовом состоянии, в энергии (а также в белке и жидкости) удовлетворить невозможно. Для адекватного возмещения дефицита энергоносителей и субстратов пластических процессов наряду с энтеральным питанием необходимо проведение парентеральной нутритивной поддержки.
В общем случае показанием для назначения полного или частичного парентерального питания является или отсутствие возможности применения энтерального питания, или его неадекватность потребностям организма пациента. На наш взгляд совершенно неудивительно, что ситуации, когда пероральный прием или энтеральное введение питательных субстратов оказывается крайне затруднительным или вообще невозможным, встречаются наиболее часто именно у хирургических пациентов. К абсолютным противопоказаниям для проведения энтерального (перорального) питания относятся механическая обструкция пищеварительной трубки на любом уровне, парез пищеварительного тракта с динамической кишечной непроходимостью, полная неспособность к абсорбции тонкой кишкой питательных веществ – синдром мальабсорбции (такая ситуация наиболее часто в хирургической практике развивается после обширных резекций кишечника). К относительным противопоказаниям для проведения энтерального питания принято относить наличие динамической кишечной непроходимости, высокого тонкокишечного свища, нарушения мезентериального кровообращения, синдрома короткой кишки, выраженных абдоминальных болей, рвоты и диареи на фоне введения энтеральных смесей. В случае, когда пероральный прием или энтеральное введение питательных смесей возможны, как указывалось выше, далеко не всегда они способны полностью компенсировать имеющиеся потребности в энергии и пластических субстанциях: объем смеси, который может быть абсорбированным в кишечнике (например, в первые дни после восстановления перистальтики) весьма лимитирован, а бесконечное повышение концентрации и, следовательно, осмолярности питательной смеси невозможно.
В условиях ограниченной возможности поступления и абсорбции питательных веществ в пищеварительной трубке или полного отсутствия такой возможности единственным способом введения питательных веществ становится парентеральная нутритивная поддержка (табл. 3).Согласно формальному определению, парентеральное питание – это способ введения необходимых организму нутриентов непосредственно в кровь, минуя желудочно-кишечный тракт. Бесспорным преимуществом парентерального питания является возможность избирательного обеспечения организма необходимыми нутриентами и восполнения белково-энергетического дефицита даже при наличии органических или функциональных нарушений деятельности ЖКТ. Парентеральное питание может быть дополнительным (частичным), когда оно применяется в сочетании с зондовым или оральным энтеральным, и полным, когда все нутриенты вводятся только внутривенно.
Современные технологии полного парентерального питания позволяют скорригировать гиперметаболическую реакцию организма на стресс, полностью устранить или значительно сократить проявления недостаточности питания, обусловленные травмой, хирургическим вмешательством или заболеванием. С этих позиций парентеральное питание можно рассматривать как метод выбора коррекции метаболических нарушений при тяжелых заболеваниях. Последние разработки в области парентеральной нутритивной поддержки позволяют широко использовать этот метод не только для коррекции питательной недостаточности при функциональных нарушениях ЖКТ, кахексии, но и для длительной поддержки питательного статуса у больных с поражениями головного мозга (кома, кровоизлияния), соматическими, онкологическими, психическими или инфекционными заболеваниями, а также у получающих химио- и лучевую терапию.
Поскольку парентеральное питание является по своей сути отдельным лечебным мероприятием, к его применению существуют противопоказания. К ним относят:
1. Метаболическая непереносимость отдельных составляющих парентерального питания.
2. Рефрактерный шоковый синдром.
3. Гипергидратация пациента.
4. Диагностированная жировая эмболия (для жировых эмульсий).
5. Непереносимость или анафилаксия на составляющие питательных сред.
По режиму проведения парентерального питания различают: