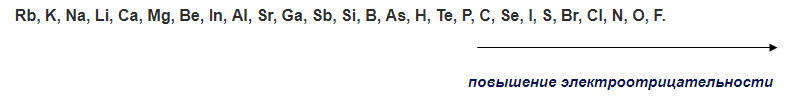Что такое обменный механизм
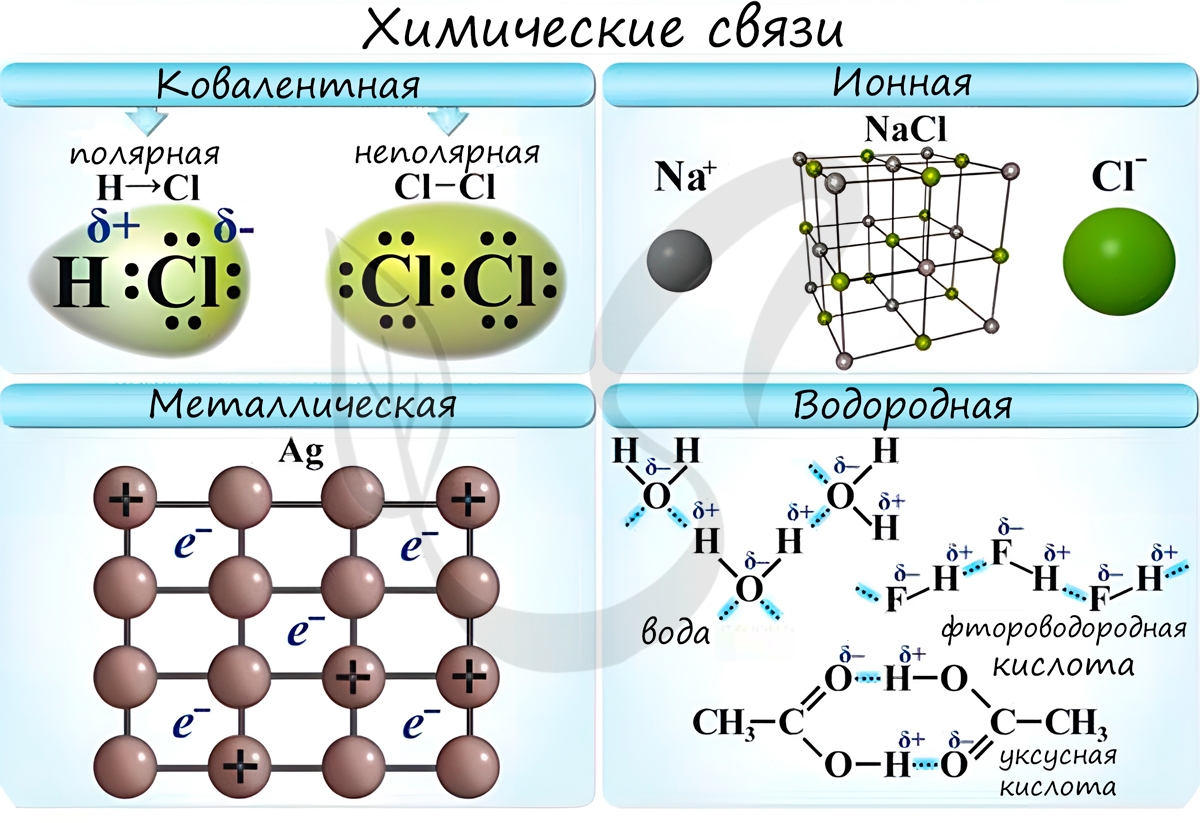
Химические связи
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2), а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
Ионная связь
В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4. Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.
Металлическая связь
«Облако» электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.
Водородная связь
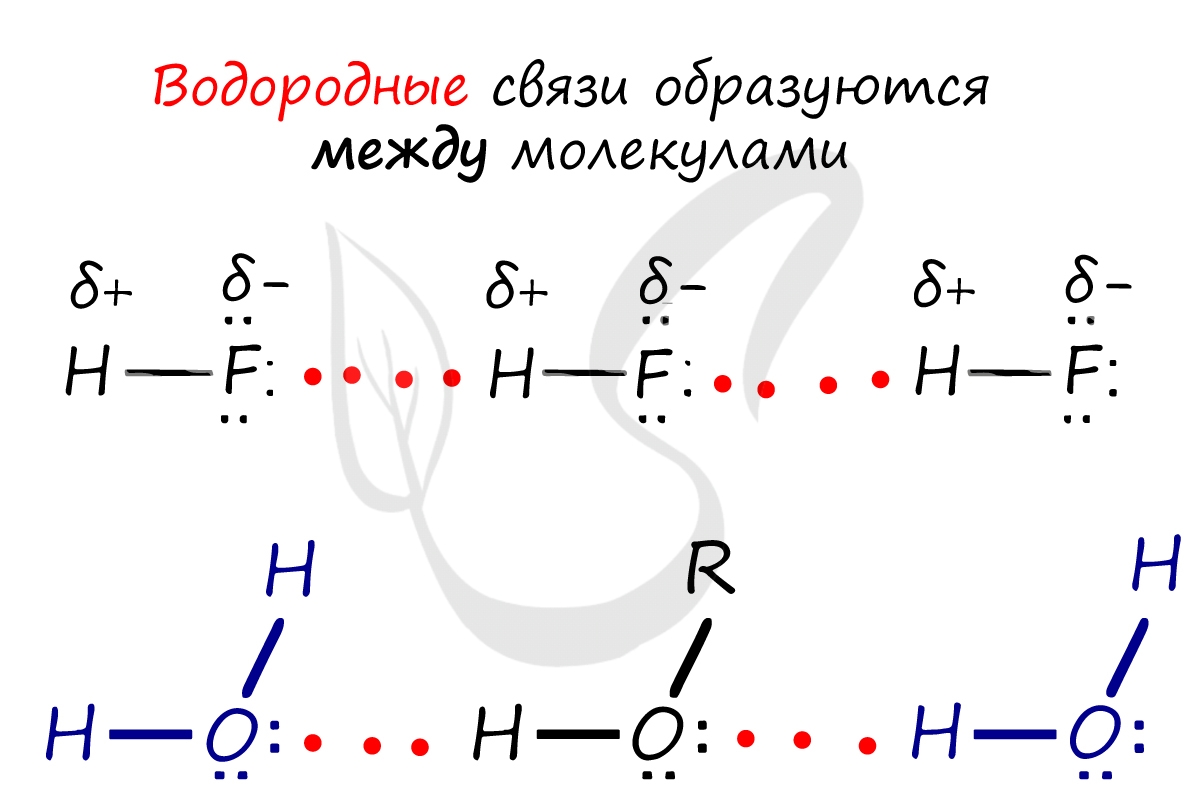
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Ковалентная связь



Химическая связь между атомами, осуществляемая обобществленными электронами, называется ковалентной. Ковалентная связь (означает – «совместно действующая») возникает за счет образования общих электронных пар между атомами в молекуле.
Идея об образовании химической связи с помощью пары электронов, принадлежащих обоим соединяющимся атомам, была высказана в 1916г американским физико-химиком Дж. Льюисом.
Ковалентная связь существует между атомами как в молекулах, так и в кристаллах. Она возникает как между одинаковыми атомами (например, в молекулах Н2, Cl2, О2, в кристалле алмаза), так и между разными атомами (например, в молекулах Н2О и NН3, в кристаллах SiC). Почти все связи в молекулах органических соединений являются ковалентными (С-С, С-Н, С-N, и др.).
Различают два механизма образования ковалентной связи:
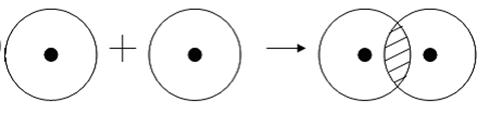
Обменный механизм образования ковалентной связи заключается в том, что каждый из соединяющихся атомов предоставляет на образование общей электронной пары (связи) по одному неспаренному электрону. Электроны взаимодействующих атомов должны при этом иметь противоположные спины.
Рассмотрим для примера образование ковалентной связи в молекуле водорода. При сближении атомов водорода происходит проникновение их электронных облаков друг в друга, которое называется перекрыванием электронных облаков (рис. 3.2), электронная плотность между ядрами возрастает. Ядра притягиваются друг к другу. Вследствие этого снижается энергия системы. При очень сильном сближении атомов возрастает отталкивание ядер. Поэтому имеется оптимальное расстояние между ядрами (длина связи l), при котором система имеет минимальную энергию. При таком состоянии выделяется энергия, называемая энергией связи Есв.
Рис. 3.2. Схема перекрывания электронных облаков при образовании молекулы водорода
Схематично образование молекулы водорода из атомов можно представить следующим образом (точка означает электрон, черта – пару электронов):
В общем виде для молекул АВ других веществ:
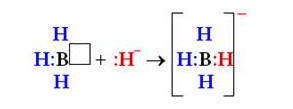
Донорно-акцепторный механизм образования ковалентной связи заключается в том, что одна частица – донор – представляет на образование связи электронную пару, а вторая – акцептор – свободную орбиталь:
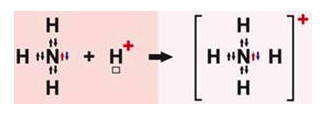
Рассмотрим механизмы образования химических связей в молекуле аммиака 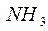
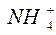
1. Образование
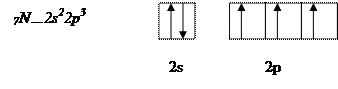
Атом азота имеет на внешнем энергетическом уровне два спаренных и три неспаренных электрона:
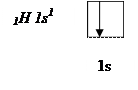
Атом водорода на s – подуровне имеет один неспаренный электрон.
В молекуле аммиака неспаренные 2р – электроны атома азота образуют три электронные пары с электронами 3-х атомов водорода:
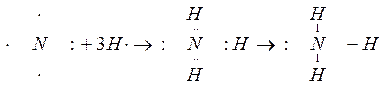
В молекуле NH3 образованы 3 ковалентных связи по обменному механизму.
2. Образование комплексного иона – иона аммония.
У атома азота остается неподелённая пара электронов 
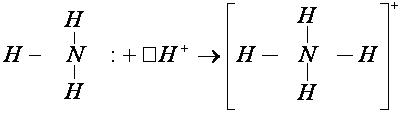
Следует отметить, что в ионе NH4 + все четыре связи равноценны и неразличимы, следовательно, в ионе заряд делокализован (рассредоточен) по всему комплексу.
Рассмотренные примеры показывают, что способность атома образовывать ковалентные связи обусловливается не только одноэлектронными, но и 2-электронными облаками или наличием свободных орбиталей.
Ковалентная связь обладает следующими свойствами:
Электроотрицательность. Виды химических связей
Начнем с того, почему вообще важна электроотрицательность. Все химические связи образуются за счет нее. В зависимости от того, какие атомы вступают в образование химической связи, она делится на определенные виды. Поэтому для того, чтобы понять суть этого деления, нам нужно разобраться:
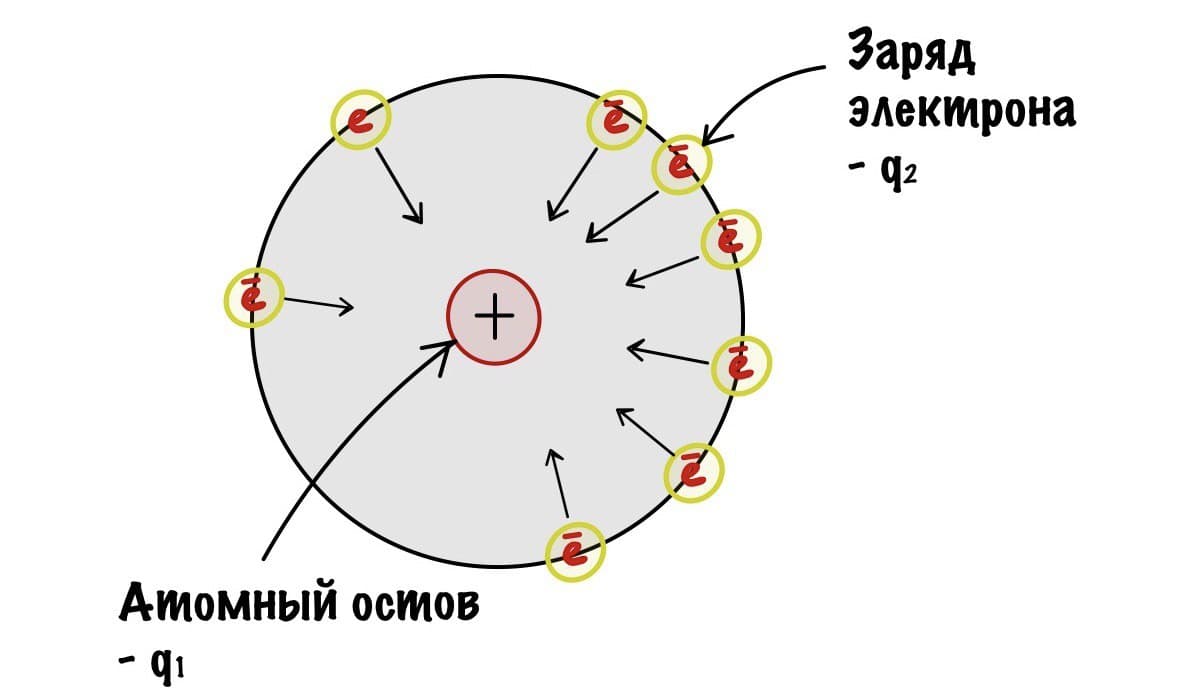
Для того чтобы понять это, нам понадобится понятие атомного остова из прошлой статьи.
Электроотрицательность
Электроотрицательность — это способность атома оттягивать на себя электроны с внешнего электронного слоя.
Да-да, ЕГЭ вы сдали хорошо — электроотрицательность увеличивается слева направо и сверху вниз, но почему? Выделим две причины, но для второй нам потребуется немного физики. Ну все, ты закрываешь статью и говоришь: «Какая физика?»
Так, начнем с закона Кулона — он показывает силу взаимодействия между двумя электрическими зарядами. Наши заряды разноименные. Атомный остов — положительный, а электрон — отрицательный. Значит они притягиваются друг к другу.
Сразу скажу, что ничего считать мы не будем. Коэффициент — k нас не интересует. Нам просто нужно понять, что чем больше q1 и q2, тем больше сила притяжения между зарядами. Радиус, как я писал до этого, примерно одинаковый в одном периоде. Теперь мы можем сравнить электроотрицательность атомов второго периода с помощью небольшого рисунка. Для этого мы предположим, что электроны находятся примерно на одном расстоянии атомного остова.
Получается, что q1 — это заряд атомного остова, а q2 — заряд электрона, который всегда одинаковый. Вот мы и нашли легкую зависимость — чем больше заряд атомного остова, тем с большей силой он притягивает электрон, и тем больше электроотрицательность. У кислорода заряд ядерного остова 6, а у азота только 5. Самый большой заряд у фтора — 7. С увеличением периода возрастает радиус атома — электроотрицательность становится меньше. Получается, что максимальная электроотрицательность у элементов второго периода и растет она слева направо, так как увеличивается заряд атомного остова.. Хоть мы это и знали, но прикольно же понять почему такое происходит?
Виды химических связей
Напишу про все, кроме металлической связи, она не особо интересует нас в биохимии. Химическая связь нужна для того, чтобы придать дополнительную стабильность системе. Что за система? Ну это просто атомы, которые вступают в образование связей — при образовании связи энергия системы уменьшается, и она становится стабильнее, а значит стабильнее и состояние атома.
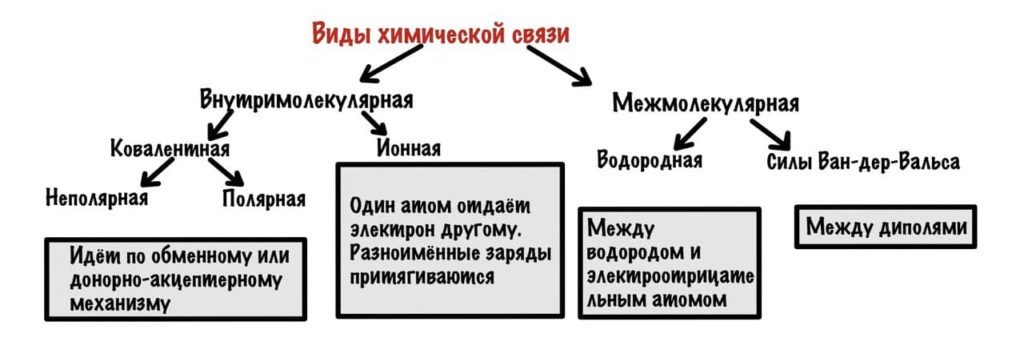
Можно разделить химические связи на две группы: внутримолекулярные и межмолекулярные. Начнем с внутримолекулярных.
Внутримолекулярные химические связи
Всего два варианта: ионная и ковалентная. Правда последняя делится на две, но разберемся с этим в процессе.
Ковалентная химическая связь
Она возникает, если атомы образуют общие электронные пары. Может идти по двум механизмам: обменному и донорно-акцептерному.
Обменный механизм
У атомов на внешнем слое есть неспаренные электроны. Они решают поделиться ими с другими атомами и образовать связь.
Донорно-акцепторный механизм
У одного атома есть неподеленная электронная пара — два электрона на одной орбитали, а у другого есть пустая орбиталь. Если первый атом очень щедрый, то он может отдать свой электрон другому атому и образовать связь. Так образуются ионы аммония и гидроксония — аммиак и вода присоединяют протон водорода (у него нет электрона).
Ну это все понятно, но для чего нужна была электроотрицательность? А вот для чего — ковалентная связь бывает неполярной и полярной.
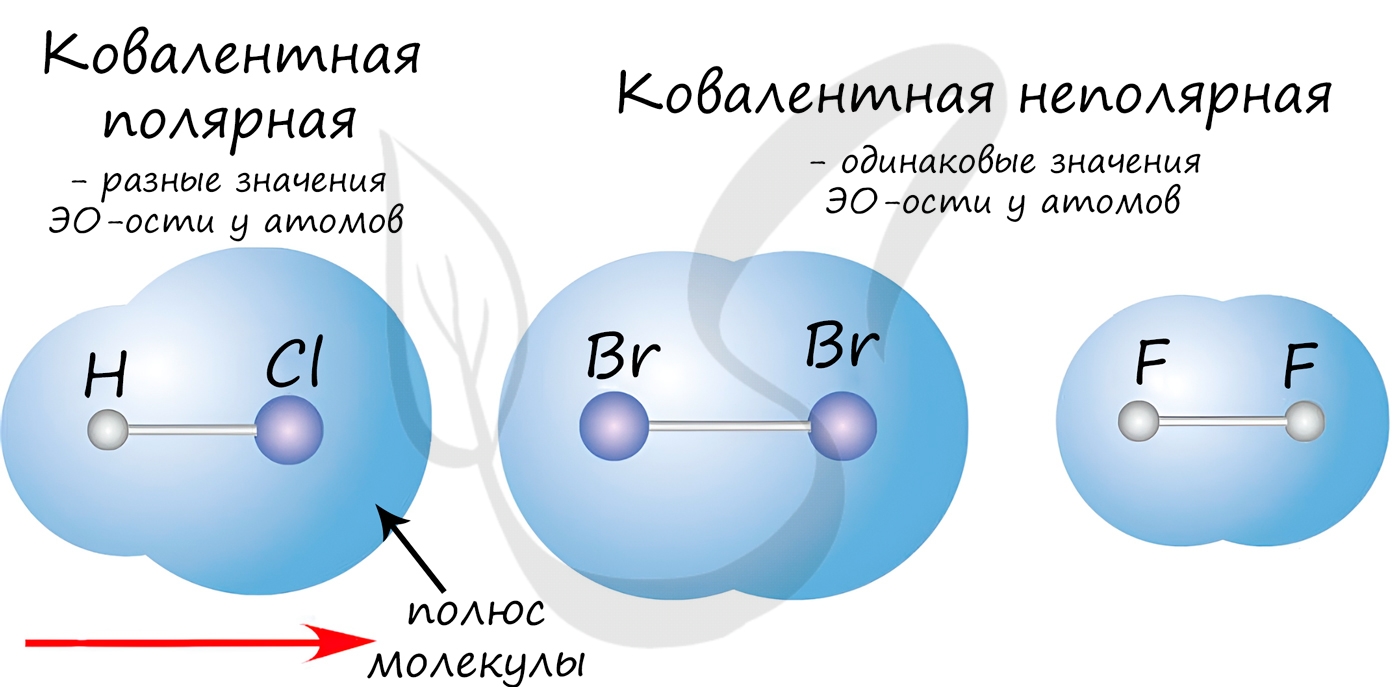
Ковалентная неполярная химическая связь
Здесь в образовании связи участвуют два атома с одинаковой электроотрицательностью, например — два водорода, два кислорода и так далее.
Нам подойдет один из прошлых рисунков с образованием водорода. Так как электроотрицательность у атомов одинаковая, то общая электронная пара не смещается к какому-либо атому, а лежит посерединке.
Ковалентная полярная химическая связь
После образования связи атом кислорода начинает тянуть электронную пару на себя. Она проводит больше времени с его стороны, так как у электронов отрицательный заряд, то и заряд на кислороде становится частично отрицательным — δ-заряд. Можно нарисовать это попроще.
Мы можем сделать вывод, что чем больше разность электроотрицательности у атомов, тем больше полярность связи. Если возьмем какой-нибудь оксид азота, то кислород будет меньше оттягивать на себя электроны, так как электроотрицательность у них не слишком различается. А это значит, что и дельта заряд на кислороде и азоте будет меньше.
Но если мы возьмем молекулу воды, то разница в электроотрицательности кислорода и водорода большая. Значит дельта заряды и полярность связи будут побольше
Полярность молекулы
Раз уж мы здесь, то давайте сразу определимся от чего зависит полярность молекулы. Это важно для понимания того, какие молекулы свободно пройдут через биологическую мембрану, а какие нет. Полярность молекулы зависит от полярности связей между атомами и геометрии молекулы. Если все связи в молекуле неполярные, то и молекула неполярная, например O2. Такие молекулы легко проходят через мембрану.
Посложнее с полярными связями. Здесь все зависит от геометрии молекулы. Геометрия молекулы может быть симметричной — у нее нет неподеленных электронных пар и неспаренных электронов, например CO2. Значит CO2 тоже легко пройдет через мембрану.
Но если у молекулы есть неподеленные электронные пары или неспаренные электроны, то она асимметрична. Значит она полярна, например H2O и NH3.
Такие молекулы будут хуже проходить через мембрану. Вода транспортируется через специальные белки — поры (аквапорины). Кстати, возможно аквапорины еще нужны потому, что вода в растворе переходит в ион гидроксония. Ион гидроксония — это полярная и заряженная молекула, которая практически не будет проходить через мембрану.
Ионная связь
Она образуется в случае, когда разница в электроотрицательности между двумя атомами просто огромная! Мы знаем, что атомы стараются полностью заполнить свои энергетические слои. Как это можно сделать? Можно отдать лишний электрон или присоединить электрон к себе. Когда два таких атома встречаются, то один из них отдает электроны, а другой принимает — отдает обычно щелочной/щелочно-земельный металл или водород. В итоге один атом становится заряжен отрицательно — анион, а другой положительно — катион. Они удерживаются друг с другом благодаря силам электростатического взаимодействия — разноименные заряды притягиваются. Да, да, я опять пишу эту банальщину.
Или вот ионная связь между молекулами аминокислот.
Сведем все в табличку.
Межмолекулярные химические связи
Здесь взаимодействуют не атомы, а молекулы. Капитан очевидность. В таких связях очень маленькое количество энергии, но их настолько много, что они придают стабильность большим системам — белок, ДНК. Два варианта — водородные связи и и силы Ван-дер-Ваальса.
Водородная связь
Водородная связь — это связь атома водорода одной молекулы с атомом другой молекулы. Звучит просто, но она может образоваться не всегда. Есть условия, о которых мы сейчас поговорим:
С помощью водородных связей образуются вторичная структура белка и вторичная структура ДНК.
Основной вклад в образование таких связей вносит электростатическое взаимодействие. Еще пишут про донорно-акцепторный механизм, но если бы он тут был, то образовывались ионы гидроксония, мы уже разобрали это выше.
Силы Ван-дер-Ваальса
Там три варианта, но я остановлюсь только на двух — ориентационных и индукционных взаимодействиях. Сначала ориентационные, с ними полегче. Проще будет просто показать это.
Такие молекулы называют диполями — у них есть положительно и отрицательно заряженные части. Молекулы ориентируются друг на друга: положительные части располагаются рядом с отрицательными и между ними образуются слабые связи. Ну вы поняли, что такая тема может идти только в соединениях с ковалентной полярной связью.
Теперь индукционные. Смотрите, есть одна молекула — HCl, у нее есть дельта-положительно заряженный водород. Вдруг такая молекула подходит к молекуле, где связь неполярная, например водороду. Что было дальше? А вот что, дельта-положительный водород начинает оттягивать на себя электронную пару из молекулы. Тут то и образуется диполь.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.
Ковалентная связь
Ковалентная связь — самый распространенный тип химической связи, осуществляемой при взаимодействии атомов элементов с одинаковыми или близкими значениями электроотрицательности.
Ковалентная связь — это связь атомов с помощью общих электронных пар.
После открытия электрона проводилось много попыток разработать электронную теорию химической связи. Наиболее удачными стали работы Льюиса (1916 г.), который предложил рассматривать образование связи как следствие возникновения общих для двух атомов электронных пар. Для этого каждый атом предоставляет одинаковое количество электронов и пытается окружить себя октетом или дублетом электронов, характерным для внешней электронной конфигурации инертных газов. Графически образования ковалентных связей за счет неспаренных электронов по методу Льюиса изображают с помощью точек, обозначающих внешние электроны атома.
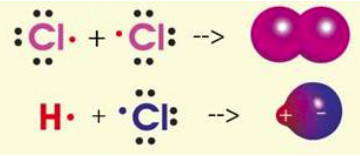
Механизм образования ковалентной связи
Основным признаком ковалентной связи является наличие общей электронной пары, принадлежащей обоим химически соединенным атомам, поскольку пребывание двух электронов в поле действия двух ядер энергетически выгоднее, чем нахождение каждого электрона в поле своего ядра. Возникновение общей электронной пары связи может проходить по разным механизмам, чаще — по обменному, а иногда — по донорно-акцепторных.
по принципу обменного механизма образования ковалентной связи каждый из взаимодействующих атомов поставляет на образование связи одинаковое количество электронов с антипараллельными спинами. К примеру:
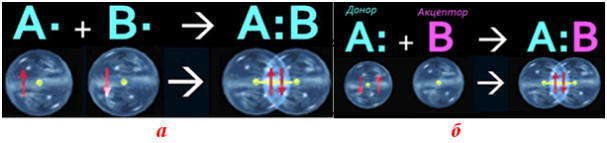
по донорно-акцепторному механизму двухэлектронная связь возникает при взаимодействии различных частиц. Одна из них — донор А: имеет неразделенную пару электронов (то есть такую, что принадлежит только одному атому), а другая — акцептор В — имеет вакантную орбиталь.
Частица, которая предоставляет для связи двухэлектронное облако (неразделенную пару электронов), называется донором, а частица со свободной орбиталью, которая принимает эту электронную пару, — акцептором.
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома и вакантной орбитали другого называется донорно-акцепторным механизмом.
Донорно-акцепторный связь иначе называется семиполярной, поскольку на атоме-доноре возникает частичный эффективный положительный заряд δ+ (за счет того, что его неразделенная пара электронов отклонилась от него), а на атоме-акцепторе — частичный эффективный отрицательный заряд δ- (благодаря тому, что происходит смещение в его сторону неразделенной электронной пары донора).
Метод валентных связей
Первая квантово-механическая теория ковалентной связи была создана Гейтлером и Лондоном (в 1927 г.) для описания молекулы водорода, а затем была применена Полингом к многоатомным молекулам. Эта теория называется методом валентных связей, основные положения которого кратко можно изложить так:
Гибридизация атомных орбиталей
Несмотря на то, что в образовании ковалентных связей участвуют электроны s-, p- или d-орбиталей, имеющие различные форму и различную ориентацию в пространстве, во многих соединениях эти связи оказываются равноценными. Для объяснения этого явления было введено понятие «гибридизация».
Гибридизация — это процесс смешивания и выравнивания орбиталей по форме и энергии, при котором происходит перераспределение электронных плотностей близких по энергии орбиталей, в результате чего они становятся равноценными.
Основные положения теории гибридизации:
При образовании молекул (или отдельных фрагментов молекул) чаще всего встречаются такие типы гибридизации:
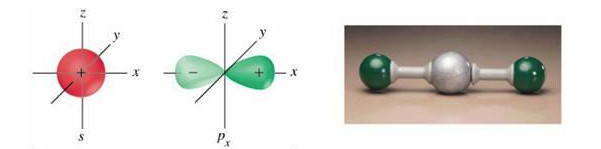
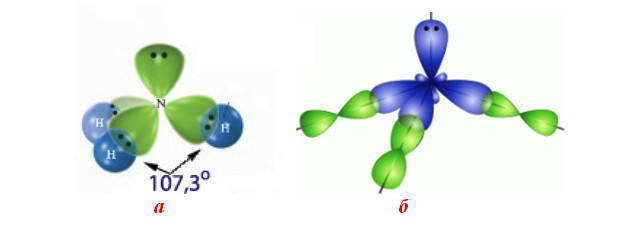
Следовательно, число несвязанных электронных пар центрального атома и их размещения на гибридизованных орбиталях влияет на геометрическую конфигурацию молекул.
Характеристики ковалентной связи
Ковалентная связь имеет набор определенных свойств, которые определяют ее специфические особенности, или характеристики. К ним, кроме уже рассмотренных характеристик «энергия связи» и «длина связи», относятся: валентный угол, насыщенность, направленность, полярность и тому подобное.
1. Валентный угол — это угол между соседними осями связей (то есть условными линиями, проведенными через ядра химически соединенных атомов в молекуле). Величина валентного угла зависит от природы орбиталей, типа гибридизации центрального атома, влияния неразделенных электронных пар, которые не участвуют в образовании связей.
2. Насыщенность. Атомы имеют возможности для образования ковалентных связей, которые могут формироваться, во-первых, по обменному механизму за счет неспаренных электронов невозбуждённого атома и за счет тех неспаренных электронов, которые возникают в результате его возбуждения, а во-вторых, по донорно акцепторному механизму. Однако общее количество связей, которые может образовывать атом, ограничено.
Насыщенность — это способность атома элемента образовывать с другими атомами определенное, ограниченное количество ковалентных связей.
Так, атомы элементов второго периода, которые имеют на внешнем энергетическом уровне четыре орбитали (одну s- и три р-), образуют связи, число которых не превышает четырех. Атомы элементов других периодов с большим числом орбиталей на внешнем уровне могут формировать больше связей.
3. Направленность. В соответствии с методом, химическая связь между атомами обусловлена перекрытием орбиталей, которые, за исключением s-орбиталей, имеют определенную ориентацию в пространстве, что и приводит к направленности ковалентной связи.
Направленность ковалентной связи — это такое размещение электронной плотности между атомами, которое определяется пространственной ориентацией валентных орбиталей и обеспечивает их максимальное перекрытие.
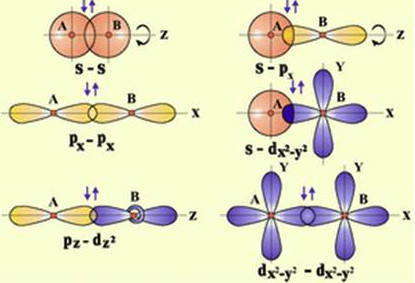
Поскольку электронные орбитали имеют различные формы и различную ориентацию в пространстве, то их взаимное перекрытие может реализоваться различными способами. В зависимости от этого различают σ-, π- и δ- связи.
Сигма-связь (σ-связь) — это такое перекрытие электронных орбиталей, при котором максимальная электронная плотность концентрируется вдоль воображаемой линии, соединяющей два ядра.
Сигма-связь может образовываться за счет двух s-электронов, одного s- и одного р электрона, двух р-электронов или двух d-электронов. Такая σ-связь характеризуется наличием одной области перекрытия электронных орбиталей, она всегда одинарная, то есть образуется только одной электронной парой.
Разнообразие форм пространственной ориентации «чистых» орбиталей и гибридизованных орбиталей не всегда допускают возможность перекрывания орбиталей на оси связи. Перекрывания валентных орбиталей может происходить по обе стороны от оси связи — так называемое «боковое» перекрывания, которое чаще всего осуществляется при образовании π-связей.
Пи-связь (π-связь) — это перекрытие электронных орбиталей, при котором максимальная электронная плотность концентрируется по обе стороны от линии, соединяющей ядра атомов (т.е. от оси связи).
Пи-связь может образоваться при взаимодействии двух параллельных р-орбиталей, двух d-орбиталей или других комбинаций орбиталей, оси которых не совпадают с осью связи.
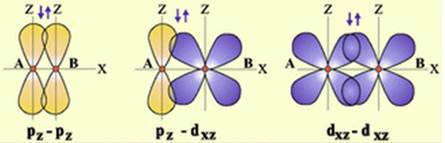
Кратность связи влияет на энергию: с повышением кратности растет ее прочность. Повышение кратности приводит к уменьшению межъядерного расстояния (длины связи) и увеличению энергии связи.
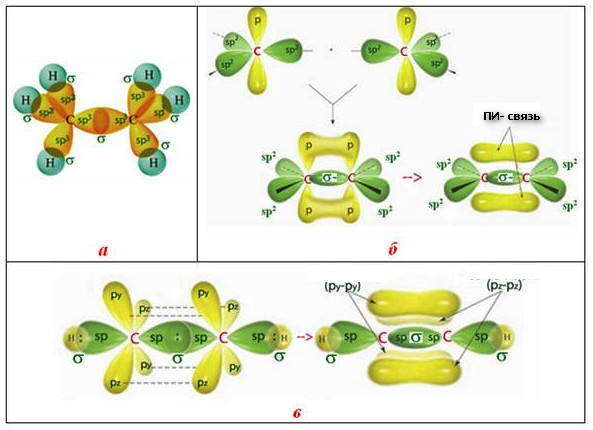
5. Полярность и поляризуемость. Электронная плотность ковалентной связи может по-разному располагаться в межъядерном пространстве.
Полярность — это свойство ковалентной связи, которое определяется областью расположения электронной плотности в межъядерном пространстве относительно соединенных атомов.
В зависимости от размещения электронной плотности в межъядерном пространстве различают полярная и неполярная ковалентные связи. Неполярной связью называется такая связь, при которой общее электронное облако размещается симметрично относительно ядер соединенных атомов и одинаково принадлежит обоим атомам.
Молекулы с полярной связью называются полярными, или гетероядерными. В молекулах с полярной связью обобщенная электронная пара смещается в сторону атома с большей электроотрицательностью. В результате на этом атоме возникает некоторый частичный отрицательный заряд (δ-), который называется эффективным, а у атома с меньшей электроотрицательностью — одинаковый по величине, но противоположный по знаку частичный положительный заряд ( δ+ ). Например, экспериментально установлено, что эффективный заряд на атоме водорода в молекуле хлорида водорода HCl — δH=+0,17, а на атоме хлора δCl=-0,17 абсолютного заряда электрона.
Чтобы определить, в какую сторону будет смещаться электронная плотность полярной ковалентной связи, необходимо сравнить электроны обоих атомов. По возрастанию электроотрицательности наиболее распространенные химические элементы размещаются в такой последовательности:
Полярные молекулы называются диполями — системами, в которых центры тяжести положительных зарядов ядер и отрицательных зарядов электронов не совпадают.
Диполь — это система, которая представляет собой совокупность двух точечных электрических зарядов, одинаковых по величине и противоположных по знаку, находящихся на некотором расстоянии друг от друга.
Расстояние между центрами притяжения называются длина диполя и обозначаются буквой l. Полярность молекулы (или связи) количественно характеризуется дипольным моментом μ, который в случае двухатомной молекулы равен произведению длины диполя на величину заряда электрона: μ=el.
Совместная электронное облако в молекуле может смещаться под действием внешнего электрического поля, в том числе и поля другой молекулы или иона.
Поляризуемость — это изменение полярности связи в результате смещения электронов, образующих связь, под действием внешнего электрического поля, в том числе и силового поля другой частицы.
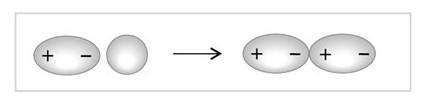
В отличие от постоянных, индуцированные диполи возникают лишь при действии внешнего электрического поля. Поляризация может вызывать не только поляризуемость связи, но и ее разрыв, при котором происходит переход связующего электронной пары к одному из атомов и образуются отрицательно и положительно заряженные ионы.
Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Свойства соединений с ковалентной связью
Вещества с ковалентными связями делятся на две неравные группы: молекулярные и атомные (или немолекулярные), которых значительно меньше, чем молекулярных.
Низкие температуры плавления, возгонки и кипения молекулярных веществ объясняются очень слабыми силами межмолекулярного взаимодействия в кристаллах. Именно поэтому для молекулярных кристаллов не присуща большая прочность, твердость и электрическая проводимость (лед или сахар). При этом вещества с полярными молекулами имеют более высокие температуры плавления и кипения, чем с неполярными. Некоторые из них растворимы в воде или других полярных растворителях. А вещества с неполярными молекулами, наоборот, лучше растворяются в неполярных растворителях (бензол, тетрахлорметан). Так, йод, у которого молекулы неполярные, не растворяется в полярной воде, но растворяется в неполярной CCl4 и малополярном спирте.
Кристаллы алмаза, кремния, кварца и подобные им по структуре — это атомные кристаллы, они представляют собой огромные «супермолекулы», поэтому их структурные формулы можно изобразить не полностью, а только в виде отдельного фрагмента, например:
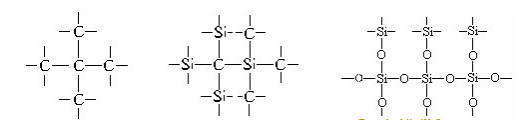
Немолекулярные (атомные) кристаллы, состоящие из соединенных между собой химическими связями атомов одного или двух элементов, относятся к тугоплавким веществам. Высокие температуры плавления обусловлены необходимостью затраты большого количества энергии для разрыва прочных химических связей при плавлении атомных кристаллов, а не слабого межмолекулярного взаимодействия, как в случае молекулярных веществ. По этой же причине многие атомные кристаллов при нагревании не плавятся, а разлагаются или сразу переходят в парообразное состояние (возгонка), например, графит сублимируется при 3700 o С.
Немолекулярные вещества с ковалентными связями нерастворимые в воде и других растворителях, большинство из них не проводит электрический ток (кроме графита, которому присуща электропроводность, и полупроводников — кремния, германия и др.).