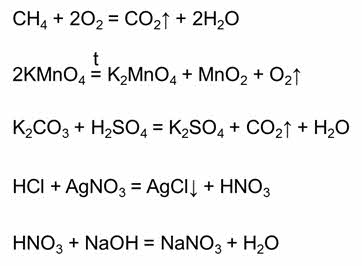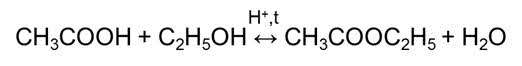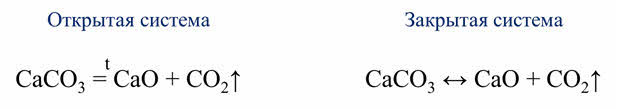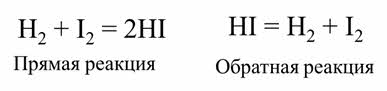Что такое обратимые химические реакции
Необратимые и обратимые реакции
Все химические реакции делятся на два типа: обратимые и необратимые.
Необратимыми называются реакции, которые протекают только в одном направлении, т. е. продукты этих реакций не взаимодействуют друг с другом с образованием исходных веществ.
Необратимая реакция заканчивается тогда, когда полностью расходуется хотя бы одно из исходных веществ. Необратимыми являются реакции горения; многие реакции термического разложения сложных веществ; большинство реакций, в результате которых образуются осадки или выделяются газообразные вещества, и др. Например:
Обратимыми называются реакции, которые одновременно протекают в прямом и в обратом направлениях:
В уравнениях обратимых реакций используется знак обратимости 
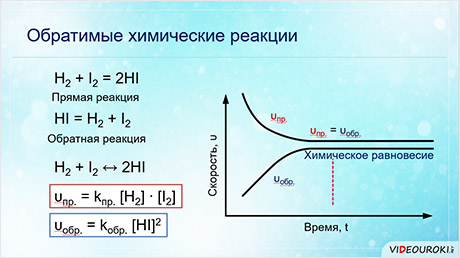
Примером обратимой реакции является синтез йодоводорода из водорода и йода:
Через некоторое время после начала химической реакции в газовой смеси можно обнаружить не только конечный продукт реакции НI, но и исходные вещества —H2 и I2. Как бы долго ни продолжалась реакция, в реакционной смеси при 350 o С всегда будет содержаться приблизительно 80% HI,10% Н2 и 10% I2. Если в качестве исходного вещества взять НI и нагреть его до той же температуры, то можно обнаружить, что через некоторое время соотношение между количествами всех трех веществ будет таким же. Таким образом, при образовании йодоводорода из водорода и йода одновременно осуществляются прямая и обратная реакции.
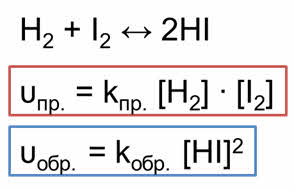
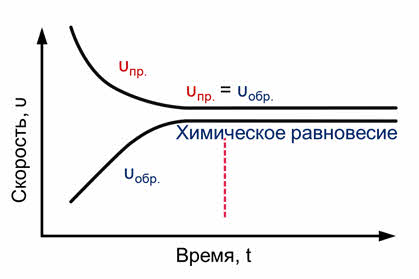
Если в качестве исходных веществ взяты водород и йод в концентрациях [H2] и [I2], то скорость прямой реакции в начальный момент времени была равна: vпр = kпр[H2] ∙ [I2]. Скорость обратной реакции vобр = kобр[HI] 2 в начальный момент времени равна нулю, так как йодоводород в реакционной смеси отсутствует ([HI] = 0). Постепенно скорость прямой реакции уменьшается, так как водород и йод вступают в реакцию и их концентрации понижаются. При этом скорость обратной реакции увеличивается, потому что концентрация образующегося йодоводорода постепенно возрастает. Когда скорости прямой и обратной реакций станут одинаковыми, наступает химическое равновесие. В состоянии равновесия за определенный промежуток времени образуется столько же молекул НI, сколько их распадается на Н2 и I2.
Состояние обратимой реакции, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием.
Химическое равновесие является динамическим равновесием. В равновесном состоянии продолжают протекать и прямая, и обратная реакции, но так как скорости их равны, концентрации всех веществ в реакционной системе не изменяются. Эти концентрации называются равновесными концентрациями.
Смещение химического равновесия
Принцип Ле-Шателье
Химическое равновесие является подвижным. При изменении внешних условий скорости прямой и обратной реакций могут стать неодинаковыми, что обусловливает смещение (сдвиг) равновесия.
Если в результате внешнего воздействия скорость прямой реакции становится больше скорости обратной реакции, то говорят о смещении равновесия вправо (в сторону прямой реакции). Если скорость обратной реакции становится больше скорости прямой реакции, то говорят о смещении равновесия влево (в сторону обратной реакции). Результатом смещения равновесия является переход системы в новое равновесное состояние с другим соотношением концентраций реагирующих веществ.
Направление смещения равновесия определяется принципом, который был сформулирован французским ученым Ле-Шателье (1884 г):
Если на равновесную систему оказывается внешнее воздействие, то равновесие смещается в сторону той реакции (прямой или обратной), которая противодействует этому воздействию.
Важнейшими внешними факторами, которые могут приводить к смещению химического равновесия, являются:
а) концентрации реагирующих веществ;
б) температура;
в) давление.
Влияние концентрации реагирующих веществ
Если в равновесную систему вводится какое-либо из участвующих в реакции веществ, то равновесие смещается в сторону той реакции, при протекании которой данное вещество расходуется. Если из равновесной системы выводится какое-либо вещество, то равновесие смещается в сторону той реакции, при протекании которой данное вещество образуется.
Например, рассмотрим, какие вещества следует вводить и какие вещества выводить из равновесной системы для смещения обратимой реакции синтеза аммиака вправо:
Для смещения равновесия вправо (в сторону прямой реакции образования аммиака) необходимо в равновесную смесь вводить азот и водород (т. е. увеличивать их концентрации) и выводить из равновесной смеси аммиак (т. е. уменьшать его концентрацию).
Влияние температуры
Прямая и обратная реакции имеют противоположные тепловые эффекты: если прямая реакция экзотермическая, то обратная реакция эндотермическая (и наоборот). При нагревании системы (т. е. повышении ее температуры) равновесие смещается в сторону эндотермической реакции; при охлаждении (понижении температуры) равновесие смещается в сторону экзотермической реакции.
Например, реакция синтеза аммиака является экзотермической: N2(г) + 3H2(г) → 2NH3(г) + 92кДж, а реакция разложения аммиака (обратная реакция) является эндотермической: 2NH3(г)→ N2(г) + 3H2(г) — 92кДж. Поэтому повышение температуры смещает равновесие в сторону обратной реакции разложения аммиака.
Влияние давления
Давление влияет на равновесие реакций, в которых принимают участие газообразные вещества. Если внешнее давление повышается, то равновесие смещается в сторону той реакции, при протекании которой число молекул газа уменьшается. И наоборот, равновесие смещается в сторону образования большего числа газообразных молекул при понижении внешнего давления. Если реакция протекает без изменения числа молекул газообразных веществ, то давление не влияет на равновесие в данной системе.
Например, для увеличения выхода аммиака (смещение вправо) необходимо повышать давление в системе обратимой реакции 
Обратимые и необратимые реакции. Химическое равновесие. Смещение равновесия
Темы кодификатора: обратимые и необратимые реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов.
По возможности протекания обратной реакции химические реакции делят на обратимые и необратимые.
Обратимые химические реакции – это реакции, продукты которых при данных условиях могут взаимодействовать друг с другом.
Процесс протекает при высокой температуре, под давлением и в присутствии катализатора (железо). Такие процессы, как правило, обратимые.
Необратимые реакции – это реакции, продукты которых при данных условиях взаимодействовать друг с другом не могут.
Более подробно про классификацию химических реакций можно прочитать здесь.
Вероятность взаимодействия продуктов зависит от условий проведения процесса.
Например , при прокаливании твердого гидрокарбоната натрия:
выделяется газообразный углекислый газ и улетучиватся из зоны проведения реакции. Следовательно, такая реакция будет необратимой при данных условиях.
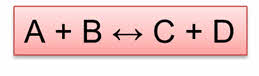
Рассмотрим обратимые реакции. Пусть обратимая реакция протекает по схеме:
aA + bB ⇔ cC + dD
Скорость прямой реакции по закону действующих масс определяется выражением:
Скорость обратной реакции:
Здесь k1 и k2 – константы скорости прямой и обратной реакции соответственно, СA, CB, CC, CD – концентрации веществ А, В, С и D соответственно.
Если в начальный момент реакции в системе нет веществ C и D, то сталкиваются и взаимодействуют преимущественно частицы A и B, и протекает преимущественно прямая реакция.
Исследования в области подвижного равновесия начались еще в XIX веке. В трудах Анри Ле-Шателье были заложены основы теории, которые позже обобщил ученый Карл Браун. Принцип подвижного равновесия, или принцип Ле-Шателье-Брауна, гласит:
Если на систему, находящуюся в состоянии равновесия, воздействовать внешним фактором, который изменяет какое-либо из условий равновесия, то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Иными словами: при внешнем воздействии на систему равновесие сместится так, чтобы компенсировать это внешнее воздействие.
Этот принцип, что очень важно, работает для любых равновесных явлений (не только химических реакций). Однако мы сейчас рассмотрим его применительно к химическим взаимодействиям. В случае химических реакций внешнее воздействие приводит к изменению равновесных концентраций веществ.
На химические реакции в состоянии равновесия могут воздействовать три основных фактора – температура, давление и концентрации реагентов или продуктов.
2. В случае равновесных реакций, когда хотя бы одно из веществ находится в газовой фазе, на равновесие также существенно влияет изменение давления в системе. При повышении давления химическая система пытается компенсировать это воздействие, и увеличивает скорость реакции, в которой количество газообразных веществ уменьшается. При понижении давления система увеличивает скорость реакции, в которой образуется больше молекул газообразных веществ. Таким образом: при увеличении давления равновесие смещается в сторону уменьшения числа молекул газов, при уменьшении давления — в сторону увеличения числа молекул газов.
Обратите внимание! На системы, где число молекул газов-реагентов и продуктов одинаково, давление не оказывает воздействие! Также изменение давления практически не влияет на равновесие в растворах, т.е. на реакции, где газов нет.
3. Также на равновесие в химических системах влияет изменение концентрации реагирующих веществ и продуктов. При повышении концентрации реагентов система пытается их израсходовать, и увеличивает скорость прямой реакции. При понижении концентрации реагентов система пытается их наработать, и увеличивается скорость обратной реакции. При повышении концентрации продуктов система пытается их также израсходовать, и увеличивает скорость обратной реакции. При понижении концентрации продуктов химическая система увеличивает скорость их образования, т.е. скорость прямой реакции.
повышение давления приводит к увеличению скорости реакции, в которой образуется меньшее число молекул газов, т.е. прямой реакции (число молекул газов-реагентов равно 4, число молекул газов в продуктах равно 2). При повышении давления равновесие смещается вправо, в сторону продуктов. При повышении температуры равновесие сместится в сторону эндотермической реакции, т.е. влево, в сторону реагентов. Увеличение концентрации азота или водорода сместит равновесие в сторону их расходования, т.е. вправо, в сторону продуктов.
Катализатор не влияет на равновесие, т.к. ускоряет и прямую, и обратную реакции.
Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Обратимость химических реакций. Химическое равновесие
Урок 17. Химия 11 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Обратимость химических реакций. Химическое равновесие»
Все химические реакции делятся на обратимые и необратимые. Необратимые реакции – это реакции, которые идут только в одном направлении. Необратимыми являются реакции горения (например, реакция горения метана), большинство реакций тэрмического разложения сложных веществ (например, реакция разложения перманганата калия), необратимыми являются большинство реакций, в результате которых образуется газ (например, реакция карбоната калия с серной кислотой), образуется осадок (например, в реакции соляной кислоты с нитратом серебра один), или если образуется малодиссоциирующее вещество (например, в реакции азотной кислоты и гидроксида натрия).
Обратимыми называются реакции, которые одновременно протекают в прямом и обратном направлении. В уравнениях обратимых реакций используют знак обратимости.
Реакция образования веществ Цэ и Дэ является прямой, а реакция образования А и Бэ является обратной.
Обратимыми являются также реакции этэрификации – это реакции взаимодействия карбоновых кислот со спиртами.
Одни и те же реакции при различных условиях могут быть обратимыми и необратимыми. Например, реакция разложения карбоната кальция. В открытой системе эта реакция является необратимой, так как углекислый газ выходит из зоны реакции, а в замкнутой системе эта реакция является обратимой, так как углекислый газ не уходит из зоны реакции.
Обратимой является реакции синтеза йодоводорода из водорода и йода.
После некоторого времени после начала реакции в газовой смеси можно обнаружить не только йодоводород, но и исходные вещества – водород и йод. Если взять в качестве исходного вещества йодоводород, то через некоторое время также наряду с образовавшимися водородом и йодом в смеси будет содержаться йодоровород.
Если в качестве исходных веществ взять водород и йод, то скорость прямой реакции будет равна произведению концентраций водорода и йода.
Скорость обратной реакции будет равна концентрации йодоводорода взятой в квадрате.
Постепенно скорость прямой реакции уменьшается, потому что водород и йод начинают реагировать и их концентрации уменьшаются.
Скорость же обратной реакции увеличивается, потому что концентрация образующегося йодоводорода увеличивается. Как только скорость прямой реакции окажется равной скорости обратной реакции, наступит химическое равновесие. Это равновесие считается динамическим, так как идут и прямая, и обратная реакции, скорости их также равны, а значит и концентрации веществ не изменяются. То есть их концентрации являются равновесными.
Если рассмотреть реакцию образования веществ Цэ и Дэ из А и Бэ, то скорость прямой реакции будет равна произведению равновесных концентраций А и Бэ с учётом их стехиометрических коэффициентов.
Скорость обратной реакции будет равна произведению равновесных концентраций Цэ и Дэ с учётом их стереохимических коэффициентов.
Так как в состоянии химического равновесия скорость прямой реакции равна скорости обратной реакции, то предыдущие выражения можно приравнять.
Константа скорости прямой и обратной реакции является величиной постоянной. А отношение констант скоростей прямой и обратной реакции является величиной постоянной, которая называется константой равновесия.
Константа равновесия зависит от температуры и давления, но не зависит от концентрации реагирующих веществ. Катализатор также не влияет на константу равновесия, но уменьшает время достижения равновесия.
Химическое равновесие является подвижным. То есть изменения внешних условий ведёт к смещению или сдвигу химического равновесия. Состояние же химического равновесия при неизменных внешних условиях может сохраняться бесконечно долго. Для многих химических производств состояние равновесия является нежелательным, так как не приводит к нужному выходу продукции. И поэтому для таких химических реакций нужно создавать условия, когда равновесие будет смещаться в нужную сторону.
Направление смещения равновесия определяется принципом, который сформулировал французский учёный Ле Шатэлье в 1884 году.
Согласно этому принципу, если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие, то равновесие смещается в сторону той реакции, которая противодействует этому воздействию.
На смещение химического равновесия влияют такие факторы, как концентрация реагирующих веществ, температура и давление.
Рассмотрим влияние концентрации на смещение химического равновесия. Как правило, при увеличении концентрации исходных веществ, равновесие смещается в сторону прямой реакции, при увеличении концентрации продуктов реакции равновесие смещается в сторону обратной реакции.
Так, в реакции получения оксида серы шесть из оксида серы четыре и кислорода, при увеличении концентрации оксида серы четыре равновесие смещается вправо, то есть в сторону прямой реакции.
Аналогично, при увеличении концентрации кислорода, равновесие смещается в сторону прямой реакции, то есть в сторону образования оксида серы шесть. При увеличении концентрации оксида серы шесть равновесие смещается в сторону обратной реакции, то есть влево.
Следовательно, при уменьшении концентрации оксида серы четыре и кислорода равновесие смещается влево, то есть в сторону обратной реакции, при уменьшении концентрации оксида серы шесть равновесие смещается в сторону образования оксида серы шесть, то есть в сторону прямой реакции.
Рассмотрим пример реакции взаимодействия хлорида железа три и роданида калия. В результате реакции образуется роданид железа три и хлорид калия. Эта реакция является обратимой. Если к хлориду железа три добавить роданид калия, то образуется раствор кроваво-красного цвета.
Разделим этот раствор на три равные части. В первую пробирку добавим роданид калия и раствор приобретает ещё более насыщенный кроваво-красный цвет, так как равновесие сместилось в сторону продуктов реакции. К третьей пробирки добавим твёрдый хлорид калия, раствор стал более светлым, то есть равновесие сместилось, в данном случае, в сторону исходных веществ.
Из этого опыта понятно, что при увеличении концентрации исходных веществ равновесие смещается в сторону продуктов реакции, а при увеличении концентрации продуктов реакции, равновесие смещается в сторону исходных веществ.
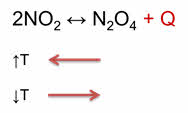
Рассмотрим, как влияет изменение температуры на смещение химического равновесия. Для начала большинства химических реакций необходимо нагреть исходные вещества, чтобы частицы получили необходимую энергию. Однако скорость прямой и обратной реакции зависит от того, являются ли эти реакции экзотэрмическими или эндотэрмическими.
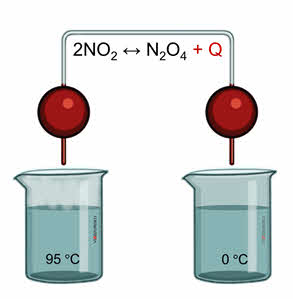
Как правило, увеличение температуры ведёт к увеличению скорости реакции. Для того, чтобы узнать как температура повлияет на смещение равновесия нужно знать тепловой эффект реакции. Так реакция превращения оксида азота четыре в его димер, является экзотэрмической.
При увеличении температуры равновесие смещается в сторону эндотэрмической реакции, а при уменьшении температуры равновесие смещается в сторону экзотэрмической реакции.
Для подтверждения этого проведём следующий эксперимент. В одну ёмкость нальём горячую воду, в другую – холодную. Опустим в две ёмкости колбы с бурым газом – оксидом азота четыре. Во второй колбе, которая опущена в холодную воду, газ бледнеет, так как оксид азота четыре переходит в его димер, который является бесцветным.
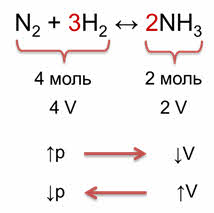
Как же влияет давление на смещение химического равновесия? Давление газов в системе при постоянной температуре определяется числом молекул газообразных веществ, или химическим количеством этих веществ. Поэтому для оценки влияния изменения давления необходимо подсчитать число молей газообразных веществ в левой и правой частях уравнения. При увеличении давления увеличивается концентрация газообразных веществ.
Например, в реакции синтеза аммиака из азота и водорода образуется 2 моль аммиака из исходных четырёх моль азота и водорода. Следовательно, было 4 объёма исходных веществ и образовалось 2 объёма аммиака. При увеличении давления объём уменьшается, поэтому идёт реакция образования аммиака. При уменьшении давления, объём увеличивается, что способствует реакции разложения аммиака на исходные вещества.
Таким образом, при увеличении давления равновесие смещается в сторону той реакции, при которой объём образующихся газообразных веществ уменьшается, и, наоборот, при уменьшении давления равновесие смещается в сторону той реакции, которая приводит к увеличению объёма. То есть, при увеличении давления равновесие смещается в сторону образования аммиака (вправо), а при уменьшении давления равновесие смещается в сторону исходных веществ (влево).
Катализаторы не влияют на смещение химического равновесия, так как они одинаково ускоряют как прямую, так и обратную реакцию. То есть катализаторы только ускоряют наступление химического равновесия. Например, дрова быстрее загораются, если их порубить (то есть увеличить площадь поверхности соприкосновения реагирующих веществ; на сильном огне быстрее закипит вода (потому то увеличивается температура), смазанные маслом детали автомобилей не ржавеют, так как не будет доступа кислорода.