Что такое обратимые процессы
Обратимый процесс
Обратимый процесс (то есть равновесный) — термодинамический процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния, причем система возвращается в исходное состояние без затрат энергии, и в окружающей среде не остается макроскопических изменений.
Обратимый процесс можно в любой момент заставить протекать в обратном направлении, изменив какую-либо независимую переменную на бесконечно малую величину.
Обратимые процессы дают наибольшую работу. Бо́льшую работу от системы вообще получить невозможно. Это придает обратимым процессам теоретическую важность. На практике обратимый процесс реализовать невозможно. Он протекает бесконечно медленно, и можно только приблизиться к нему.
Следует отметить, что термодинамическая обратимость процесса отличается от химической обратимости. Химическая обратимость характеризует направление процесса, а термодинамическая — способ его проведения.
Понятия равновесного состояния и обратимого процесса играют большую роль в термодинамике. Все количественные выводы термодинамики применимы только к равновесным состояниям и обратимым процессам.
Примеры
Выпечка пирога — необратимый процесс. Гидролиз солей — обратимый процесс.
См. также
Ссылки
Полезное
Смотреть что такое «Обратимый процесс» в других словарях:
ОБРАТИМЫЙ ПРОЦЕСС — в термодинамике, процесс перехода термодинамич. системы из одного состояния в другое, допускающий возможность возвращения её в первонач. состояние через ту же последовательность промежуточных состояний, что и в прямом процессе, но проходимых в… … Физическая энциклопедия
ОБРАТИМЫЙ ПРОЦЕСС — в термодинамике процесс, который возможно осуществить в обратном направлении, последовательно повторяя в обратном порядке все промежуточные состояния прямого процесса. Обратимым процессом может быть только равновесный процесс. Реальные процессы,… … Большой Энциклопедический словарь
ОБРАТИМЫЙ ПРОЦЕСС — ОБРАТИМЫЙ ПРОЦЕСС, всякий процесс, который может при определенных условиях протекать в обратном направлении, т.е. так, что параметры, определяющие систему, изменяются в обратном порядке относительно их первоначальных значений. Если при прямом… … Научно-технический энциклопедический словарь
обратимый процесс — Термодинамический процесс, после которого система и взаимодействующие с ней системы (окружающая среда) могут возвратиться в начальное состояние без того, чтобы в системе и окружающей среде возникали какие либо остаточные изменения. [Сборник… … Справочник технического переводчика
обратимый процесс — – процесс, протекающий в данных условиях равновесно в прямом и обратном направлении. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
обратимый процесс — в термодинамике, процесс, который возможно осуществить в обратном направлении, последовательно повторяя в обратном порядке все промежуточные состояния прямого процесса. Обратимый процесс может быть только равновесный процесс. Реальные процессы,… … Энциклопедический словарь
обратимый процесс — [reversible process] процесс перехода термодинамической системы из одного состояния в другое, допускающее возможность возвращения ее в первоначальное состояние через ту же последовательность промежуточных состояний, но в обратном порядке.… … Энциклопедический словарь по металлургии
обратимый процесс — Термодинамический процесс, после которого система и взаимодействующие с ней системы (окружающая среда) могут возвратиться в начальное состояние без того, чтобы в системе и окружающей среде возникали какие либо остаточные изменения. обратимый… … Политехнический терминологический толковый словарь
обратимый процесс — grįžtamasis vyksmas statusas T sritis Standartizacija ir metrologija apibrėžtis Sistemos būsenos kitimas, kuris gali vykti įprastine ir atvirkštine tvarka, nekeisdamas aplinkos. atitikmenys: angl. reversible process vok. reversibler Prozess, m;… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
обратимый процесс — grįžtamasis procesas statusas T sritis chemija apibrėžtis Sistemos būsenos kitimas, kuris gali vykti įprastine ir atvirkštine tvarka, nekeisdamas aplinkos. atitikmenys: angl. reversible process rus. обратимый процесс … Chemijos terminų aiškinamasis žodynas
Обратимые процессы







Обратимые процессы
промежуточное состояние. Однако это нельзя сделать напрямую, так как параметры состояния системы, такие как температура, строго определяются только как характеристики системы в равновесном состоянии. Тем не менее, при таком рассмотрении этой трудности можно избежать, создав общую классификацию процессов. В термодинамике процессы делятся на 2 категории: обратимые
и irreversible. An примером необратимого процесса является выравнивание перепадов температуры, давления, концентрации и др., то есть переход в термодинамическое равновесное состояние. Если необратимые процессы протекают очень интенсивно, например, газ
Такие процессы не могут осуществляться в обратном направлении, не вызывая изменений в состоянии окружающего организма. Людмила Фирмаль
устремляется в вакуум, то происходит макроскопическое движение. Кинетическая энергия такого движения под действием сил трения превращается в тепло, а турбулентный поток, создаваемый в Газе в промежуточном состоянии, затухает, и в конечном итоге его заменяет равновесное состояние. Только после этого Состояние системы снова определяется термодинамическими переменными. Можно представить себе ограничительный случай процесса, который может полностью сохранить значение параметров состояния
системы. Это процесс, который выполняется таким образом, что каждое промежуточное состояние практически не отклоняется от равновесного состояния до Infinity. As как правило, вы можете подойти к этому делу и выполнить процесс очень медленно или разбить его на очень маленькие части stages. At предел, это обратимый процесс, так как он может осуществляться в обратном направлении на каждом этапе и осуществлять бесконечно малые
изменения внешних условий, не вызывая других воздействий. Понятие обратимого процесса идеализировано, но»спонтанный»процесс, который мы наблюдаем в макроскопическом масштабе, протекает только в одном направлении, то есть в направлении равновесия, как мы видим, очень важно для понимания термодинамики. Заметим, однако, что отправной точкой этого равномерного движения является механическое движение. Движение полностью определенной динамической системы может быть обращено вспять, не вызывая никакого другого эффекта, если все направления скорости reversed.
или малыми шагами обрабатывает непрерывное состояние, бесконечно близкое к равновесию. Некоторые авторы, имея в виду это различие, называют соответствующий термодинамический процесс квазистатическим и сохраняют чисто механическое значение термина «обратимый».Эти характеристики. Термодинамическое и механическое описание отсутствуетЕсли принять во внимание противоречие, то ситуация уже отмеченная, то термодинамическое описание очень малого состояния определяет величину
механической variable. In 1932, Нильс Бор выразил это в своей лекции о памяти Фарадея: Например, термодинамическая необратимость, которая выражается в выравнивании температуры, не означает, что невозможно повернуть ход событий вспять, но показывает, что невозможно сделать описание такого обратного процесса, используя только понятие температуры различных тел. Потери энергии в необратимых процессах. Рассмотрим работу, которую выполняет
Для простоты будем считать, что система представляет собой идеальный газ 1 моль, расположенный в цилиндре, закрытом поршнем Людмила Фирмаль
организм, преодолевая действие внешних сил, и тем самым С. С. Г-1.—、 Шшшш: P = RT / V от t.. 1. Его поверхность смещается. (Рис.4).Во-первых, предположим, что роль внешних сил играет постоянное давление еше, которое представляет собой сумму атмосферного давления и веса поршня на единицу поверхности, а вся система
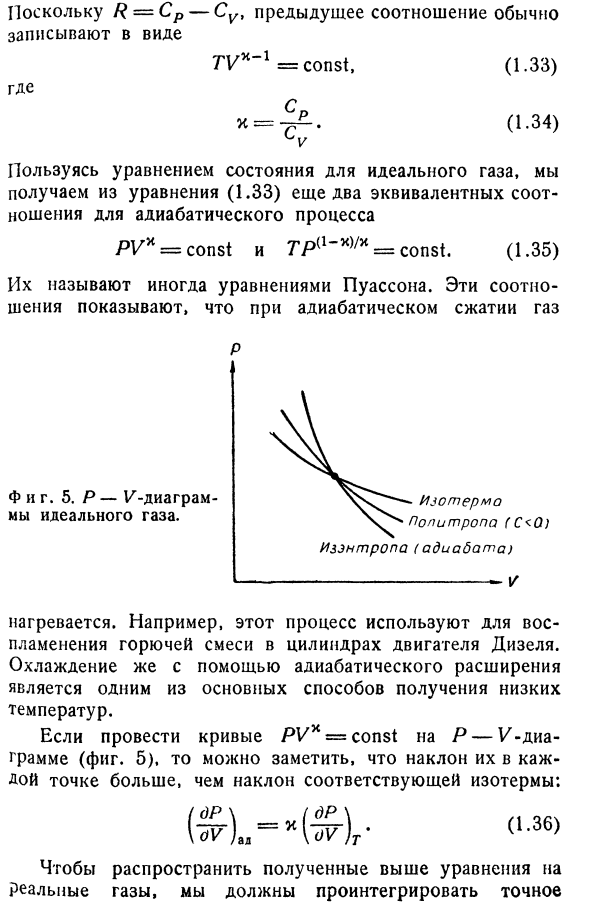
погружена в термостат, который поддерживает температуру системы постоянной до Т. С момента поршня начинает работать система охлаждения. consider. At равновесное давление газа поршня P = RTjV фиксируется в положении, соответствующем объему V в. при отпускании поршня он начинает двигаться вверх и останавливается в положении, соответствующем объему V ^(возможно, после определенного числа колебаний). Давление Pf балансирует точно
с внешним давлением Pb, 1esh. Однако первоначально кинетическая энергия передается в piston. In кроме того, в Газе происходит макроскопическое движение. Эти сложные промежуточные состояния исчезают под действием различных сил трения, в результате чего кинетическая энергия преобразуется в heat. So, независимо от предыдущего состояния газа, немедленно
устанавливается новое равновесное состояние(VT). Единственной особенностью процесса, важной с точки зрения термодинамики, является то, что была проведена определенная работа. ^ необр = Лшеш(Ы Ф-Ви) — (1.25) Эта работа, по-видимому, не равна всей энергии, высвобождаемой при расширении, поскольку часть энергии уходила на преодоление силы трения, как это всегда бывает при
необратимом processes. In в этом эксперименте система выполняет работу, которая определяется соотношением (1.25). Как увеличить эту работу? Очевидно, для этого необходимо оказывать внешнее давление на СЗ. Но мы В этом случае поршень движется в противоположном направлении, поэтому он не может быть выше равновесного давления газа I. В зависимости от расположения поршня, например, с помощью устройства из пружин и блоков, когда
внешнее давление поддерживается равным Явнеш = Р (1л Т), достигается оптимальный вариант. И, конечно же, движение будет бесконечным slow. It достигает ограничительного случая, который соответствует обратимому процессу. Работа в этом случае будет равной Up = J Pvnesh (Y)dV = ya J — = RT в ZL. (1.26) Это наибольшая ценность работы за счет изотермического расширения газов. Необратимо process. It может выполняться по-разному, между
фиксированными значениями. Объем Vi и Vf>в любом случае ^ необр С тех пор как/? = CP-Su, предыдущее соотношение обычно TV * ’1 = const, (1.33) Куда? С тех пор к = Соотечественник попиропа(с
Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Физика Б1.Б8.
Молекулярная физика и термодинамика
1. Введение
Основы молекулярной физики были заложены трудами Ломоносова, Джоуля, Больцмана, Клаузиуса, Максвелла и других ученых. Благодаря их трудам молекулярная физика прочно утвердилась в науке. Непосредственным опытным подтверждением молекулярно-кинетической теории являются процесс диффузии, броуновского движения, распространения запаха и многие другие явления.
Движение каждой молекулы в веществе может быть описано законами классической механики. Однако число молекул в веществе чрезвычайно велико, направления и величины скоростей молекул совершенно случайны и непрерывно изменяются так, что становится невозможным охватить уравнениями движения всю совокупность молекул и сделать какие-либо выводы об их поведении.
Тем не менее, состояние вещества и его изменение определяется заданием небольшого числа определенных параметров, как температура, давление, объем, плотность и т.д., значения которых невозможно указать на основе решений уравнений классической механики. Дело в том, что свойства огромного числа молекул подчиняется особым, статистическим закономерностям. Статистическая физика изучает статистические закономерности, описывающие поведение большой совокупности объектов. Она основывается на теории вероятностей и позволяет вычислять средние значения величин, характеризующих движение всей совокупности молекул (средние скорости молекул, средние кинетические энергии, средние значения импульса и т. д.) и на этой основе истолковывает свойства вещества, непосредственно наблюдаемые на опыте (давление, температура и т.д.). В этом состоит суть молекулярно-кинетического изучения вещества.
Наряду со статистическим, существует термодинамический метод изучения вещества. В отличие от статистического метода термодинамический метод не интересуется строением вещества. Термодинамика изучают условия превращения энергии и характеризует их с количественной стороны.
В основе термодинамики лежит небольшое число закономерностей, установленных на основе большого числа опытных фактов и получивших название начала термодинамики.
У статистической физики и термодинамики общий предмет изучения – свойства вещества и происходящие в нем процессы. Подходя к изучению этих свойств с разных точек зрения, эти методы взаимно дополняют друг друга.
Совокупность тел, могущих обмениваться энергией между собой и с внешними телами, не входящими в эту систему, называется термодинамической системой. Одним из основных понятий термодинамики является понятие состояния системы. Состояние системы определяется совокупностью значений всех величин, характеризующих физические свойства системы и называемых термодинамическими параметрами (температура, давление плотность, теплоемкость, электропроводность и т. д.). Состояние системы называется стационарным, если значения всех термодинамических параметров не изменяются во времени. Стационарное состояние называется равновесным, если его неизменность не обусловлена протеканием каких-либо процессов во внешних по отношению к данной системе телах.
Исследования показывают, что параметры состояния тел взаимно связаны и могут быть выражены друг через друга. Поэтому термодинамическое состояние задается только ограниченным числом параметров состояния. Такие параметры называются основными параметрами состояния. Важнейшими параметрами состояния химически однородных систем являются плотность, объем, давление, температура. И между этими параметрами существует связь, выражаемая в виде математического уравнения 
Обратимые и необратимые процессы в термодинамике
Вы будете перенаправлены на Автор24
Обратимый процесс считается в физике процессом, который возможен для проведения в обратном направлении таким образом, что система будет подвержена прохождению тех же состояний, но в обратных направлениях.
Рисунок 1. Обратимые и необратимые процессы. Автор24 — интернет-биржа студенческих работ
Необратимый процесс считается процессом, самопроизвольно протекающим исключительно в одном направлении.
Термодинамический процесс
Рисунок 2. Термодинамические процессы. Автор24 — интернет-биржа студенческих работ
Термодинамический процесс представляет непрерывное изменение состояний системы, которое происходит в итоге ее взаимодействий с окружающей средой. Внешним признаком процесса будет считаться в таком случае изменение хотя бы одного параметра состояния.
Реальные процессы изменения состояния проистекают при условии присутствия значительных скоростей и разностей потенциалов (давлений и температур), существующих между системой и средой. В подобных условиях появится сложное неравномерное распределение параметров и функций состояния, исходя из объема системы, пребывающей в неравновесном состоянии. Термодинамические процессы, предусматривающие прохождение системы через ряд неравновесных состояний, будут называться неравновесными.
Готовые работы на аналогичную тему
Изучение неравновесных процессов считается сложнейшей для ученых задачей, поскольку разработанные в рамках термодинамики методы приспособлены в основном для исследования равновесных состояний. К примеру, неравновесный процесс весьма сложно рассчитывается посредством уравнений состояния газа, применимых для равновесных условий, в то время, как в отношении всего объема системы давление и температура обладают равными значениями.
Возможно было бы выполнять приближенный расчет неравновесного процесса путем подстановки в уравнение средних значений параметров состояния, но в большинстве случаев осреднение параметров по объему системы становится невозможным.
В технической термодинамике в рамках исследования реальных процессов условно принимают распределение параметров состояния равномерным образом. Это, в свою очередь, позволяет воспользоваться уравнениями состояния и иными расчетными формулами, полученными с целью равномерного распределения в системе параметров.
В некоторых конкретных случаях погрешности, обусловленные подобным упрощением, незначительны и при расчете реальных процессов их возможно не учитывать. Если в результате неравномерности процесс ощутимо отличается от идеальной равновесной модели, то в расчет внесут соответствующие поправки.
Условия равномерно распределенных параметров в системе при изменении ее состояния, по существу подразумевают взятие идеализированного процесса в качестве объекта исследования. Подобный процесс при этом состоит из бесконечно большого количества равновесных состояний.
Такой процесс возможно представить в формате протекающего настолько медленно, что в каждый конкретный момент времени в системе установится практически равновесное состояние. Степень приближения такого процесса к равновесному окажется тем большей, чем меньшей будет при этом скорость изменения системы.
В пределе мы приходим к бесконечно медленному процессу, предоставившему непрерывную смену для состояний равновесия. Подобный процесс равновесного изменения состояния будет называться квазистатическим (или как бы статическим). Такому виду процесса будет соответствовать бесконечно малая разность потенциалов между системой и окружающей средой.
При обратном направлении квазистатического процесса система будет проходить через состояния, аналогичные тем, что происходят в прямом процессе. Такое свойство квазистатических процессов называют обратимостью, а сами процессы при этом являются обратимыми.
Обратимый процесс в термодинамике
Рисунок 3. Обратимый процесс в термодинамике. Автор24 — интернет-биржа студенческих работ
Обратимый процесс (равновесный) – представляет термодинамический процесс, способный к прохождению и в прямом, и в обратном направлении (за счет прохождения через одинаковые промежуточные состояния), система при этом возвращается в исходное состояние без энергетических затрат, а в окружающей среде не остается никаких макроскопических изменений.
Обратимый процесс возможно в абсолютно любой момент времени заставить протекать в обратном направлении, за счет изменения какой-либо независимой переменной на бесконечно малую величину. Обратимые процессы могут давать наибольшую работу. Большую работу от системы получить невозможно ни при каких условиях. Это придает теоретическую важность обратимым процессам, реализовать которые на практике также нереально.
Такие процессы протекают бесконечно медленно, и становится возможным лишь приблизиться к ним. Важно отметить существенное отличие термодинамической обратимости процесса от химической. Химическая обратимость будет характеризовать направление процесса, а термодинамическая – способ, при котором он будет проводиться.
Понятия обратимого процесса и равновесного состояния играют очень значимую роль в термодинамике. Так, каждый количественный вывод термодинамики будет применим исключительно в отношении равновесных состояний и обратимых процессов.
Необратимые процессы термодинамики
Необратимый процесс невозможен к проведению в противоположном направлении посредством все тех же самых промежуточных состояний. Все реальные процессы считаются в физике необратимыми. В качестве примеров таких процессов выступают следующие явления:
Переход кинетической энергии (для макроскопического движения) в теплоту через трение (во внутреннюю энергию системы) будет представлять собой необратимый процесс.
Все осуществляемые в природе физические процессы подразделяются на обратимые и необратимые. Пусть изолированная система вследствие некоего процесса осуществит переход из состояния А в состояние В и затем возвратится в свое изначальное состояние.
Процесс, в таком случае, станет обратимым в условиях вероятного осуществления обратного перехода из состояния В в А через аналогичные промежуточные состояния таким путем, чтобы при этом не оставалось совершенно никаких изменений в окружающих телах.
Если осуществление подобного перехода невозможно и при условии сохранения по окончании процесса в окружающих телах или внутри самой системы каких-либо изменений, то процесс окажется необратимым.
Любой процесс, сопровождающийся явлением трения, станет необратимым, поскольку, в условиях трения, часть работы всегда превратится в тепло, оно рассеется, в окружающих телах сохранится след процесса – (нагревание), что превратит процесс (с участием трения) в необратимый.
Идеальный механический процесс, выполняемый в консервативной системе (без сил трения), стал бы обратимым. Примером подобного процесса можно считать колебания на длинном подвесе тяжеловесного маятника. По причине незначительной степени сопротивления среды, амплитуда маятниковых колебаний становится практически неизменной на протяжении продолжительного времени, кинетическая энергия колеблющегося маятника при этом оказывается полностью переходящей в его потенциальную энергию и обратно.
В качестве важнейшей принципиальной особенности всех тепловых явлений (где участвует громаднейшее количество молекул), будет выступать их необратимый характер. Примером процесса такого характера можно считать расширение газа (в частности, идеального) в пустоту.
Итак, в природе наблюдается существование двух видов принципиально различных процессов:
Согласно заявлению М. Планка, сделанного однажды, различия между такими процессами, как необратимые и обратимые, будут лежать значительно глубже, чем, к примеру, между электрическими и механическими разновидностями процессов. По этой причине, его с большим основанием (сравнительно с любым другим признаком) имеет смысл выбирать как первейший принцип в рамках рассмотрения физических явлений.
Обратимый процесс
Обратимый процесс можно в любой момент заставить протекать в обратном направлении, изменив какую-либо независимую переменную на бесконечно малую величину.
Обратимые процессы имеют максимальный КПД. Бо́льший КПД от системы получить невозможно. Это придает обратимым процессам теоретическую важность. На практике обратимый процесс реализовать невозможно. Он протекает бесконечно медленно, и можно только приблизиться к нему.
В термодинамике примером тепловой машины, работающей только по обратимым процессам, является машина Карно, состоящая из двух адиабат и двух изотерм. В адиабатических процессах никакого обмена энергией с окружающей средой не происходит. В изотермических процессах теплообмен между окружающей средой (нагревателем, при расширении, и холодильником, при сжатии) и рабочим телом проходит между телами, имеющими одну и ту же температуру. Это важный момент, так как если теплообмен происходит между телами с разной температурой, он является необратимым (второе начало термодинамики).
Следует отметить, что термодинамическая обратимость процесса отличается от химической обратимости. Химическая обратимость характеризует направление процесса, а термодинамическая — способ его проведения.
Понятия равновесного состояния и обратимого процесса играют большую роль в термодинамике. Все количественные выводы термодинамики применимы только к равновесным состояниям и обратимым процессам.
В состоянии химического равновесия скорость прямой реакции равна скорости обратной реакции!
Между тем опыт показывает, что существуют определенные ограничения, связанные с направлением протекания процессов в природе. Так, энергия путем теплообмена самопроизвольно переходит от горячего тела к более холодному, а обратный процесс сам по себе не происходит, т.е. он необратим.



