Что такое обратная генетика
Генетика: основные понятия и диагностика
Специализация: генетика, гинекология
Основные понятия
Геном – совокупность наследственного материала, заключенного в клетке организма [1]. Геном содержит биологическую информацию, необходимую для построения организма и поддержания его функций.
Первоначальный смысл этого термина указывал на то, что понятие генома, в отличие от генотипа, является генетической характеристикой вида в целом, а не отдельной особи. С развитием молекулярной генетики значение данного термина изменилось, и сегодня под «геномом» понимают совокупность наследственного материала конкретного представителя вида.
Большинство геномов, в том числе геномы человека и геномы всех остальных клеточных форм жизни, построены из ДНК*. Практически у всех эукариотических организмов все гены организованы в более крупные макромолекулярные комплексы – хромосомы.
У человека наследственный материал соматической клетки представлен 23 парами хромосом (22 пары аутосом и пара половых хромосом), находящихся в ядре, а также клетка обладает множеством копий митохондриальной ДНК. 22 аутосомы, половые хромосомы Х и Y, митохондриальная ДНК человека содержат вместе примерно 3,1 млрд пар оснований [1].
В настоящее время в молекулярной биологии установлено, что гены – это участки ДНК, несущие какую-либо целостную информацию о строении одной молекулы белка или одной молекулы РНК. Эти и другие функциональные молекулы определяют развитие, рост и функционирование организма.
Изначально термин «ген» появился как теоретическая дискретная единица передачи наследственной информации. История биологии помнит споры о том, какие молекулы могут являться носителями наследственной информации. Большинство исследователей считали, что такими носителями могут быть только белки, так как их строение из 20 аминокислот позволяет создать больше вариантов, чем ДНК, состоящая всего из четырех видов
нуклеотидов. Позже было экспериментально доказано, что именно ДНК включает в себя наследственную информацию, что было выражено в виде центральной догмы молекулярной биологии.
Мономеры, составляющие каждую из цепей ДНК, представляют собой сложные органические соединения, включающие в себя азотистые основания: аденин (А), тимин (Т), цитозин (Ц), гуанин (Г), пятиатомный сахар (пентозу) – дезоксирибозу, а также остаток фосфорной кислоты. Эти соединения носят название нуклеотидов (Рис. 1).
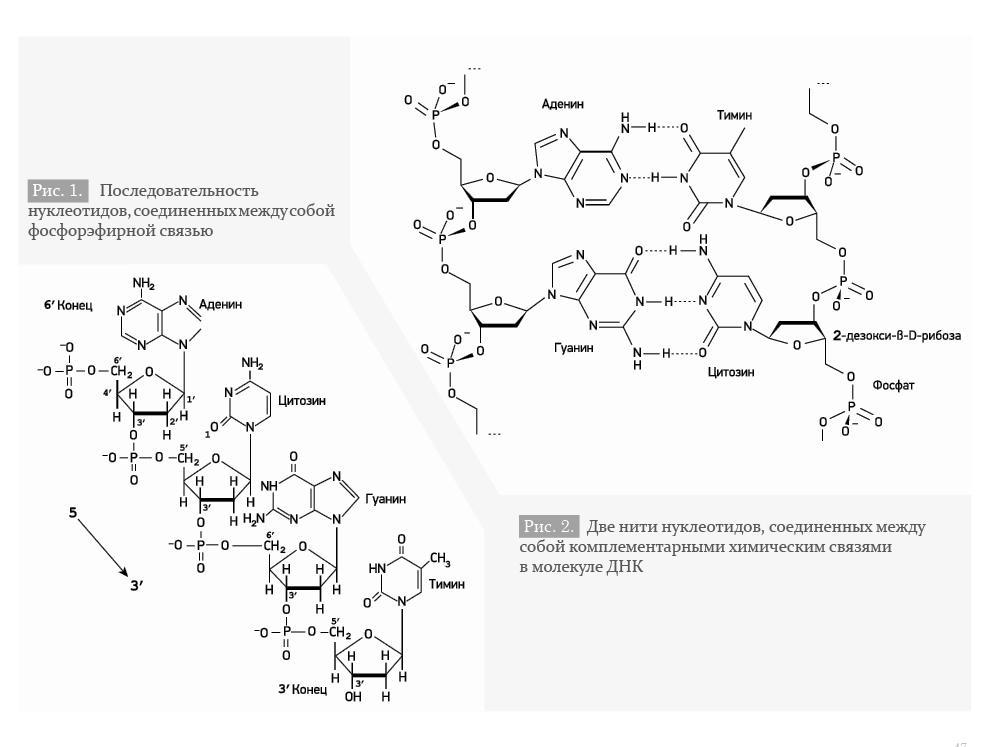
Гены могут подвергаться мутациям – случайным или целенаправленным изменениям последовательности нуклеотидов в цепи ДНК. Мутации могут приводить к изменению последовательности, а следовательно, изменению биологических характеристик белка или РНК, что, в свою очередь, может привести к их общему или локальному изменению или аномальному функционированию. Такие мутации являются патогенными, так как их результатом является заболевание, или летальными на эмбриональном уровне. Однако далеко не все изменения последовательности нуклеотидов приводят к изменению структуры белка или к существенному изменению последовательности и не являются патогенными. В частности, геном человека характеризуется такими особенностями, как однонуклеотидные полиморфизмы и вариации числа копий генов (англ. copynumbervariations), которые составляют около 1% всей ДНК человека [2].
Однонуклеотидный полиморфизм (Single nucleotide polymorphism, SNP) – отличие последовательности ДНК размером в один нуклеотид. Если две последовательности ДНК – AAGCCTA и AAGCTTA – отличаются на один нуклеотид, в таком случае говорят о существовании двух аллелей: C и T. SNP возникают в результате точечных мутаций (как правило, типа замен) и, в частности, определяют различные аллели одного гена.
Разнообразием последовательностей ДНК у людей, возможно, объясняется то, как у них происходит течение различных заболеваний, реакции в ответ на патогены, прием лекарств, вакцин и т. п. Знание об однонуклеотидном полиморфизме, вероятно, поможет в понимании фармакокинетики и фармакодинамики действия различных лекарств на человека. Этиология широкого спектра заболеваний, таких как рак, инфекционные, аутоиммунные заболевания, серповидноклеточная анемия и многие другие, включает однонуклеотидные полиморфизмы [3].
Полиморфизмы генов
Именно полиморфизмы генов в большой степени определяют индивидуальные различия в развитии тех или иных физических и психических качеств индивидума. Масштабы полиморфизмов генов у человека таковы, что между последовательностями ДНК двух людей существуют миллионы различий. Эти различия условно подразделяют на четыре основные категории: а) фенотипически не выраженные; б) вызывающие фенотипические различия; в) играющие роль в патогенезе заболевания (при полигенных болезнях); г) играющие основную роль в развитии заболевания (при моногенных болезнях).
На сегодняшний день сформированы обширные базы полиморфизмов, очень гибкие и быстро растущие.
Они постоянно обновляются за счет информации, которую поставляют в клиники и лаборатории по всему миру научные организации, в которых работает множество специалистов в области системной и молекулярной биологии, биоинформатики.
Вариантные формы некоторых генов в определенных условиях могут привести к развитию болезней. Сочетания вариантных генов предрасположенности несут в себе генетические риски множества заболеваний. Тестирование генетических предрасположенностей помогает выявить индивидуальный риск возможности заболевания и установить подверженность влиянию и воздействию негативных факторов окружающей среды.
По клиническим группам полиморфизмов различают патологии систем свертывания крови, обмена фолиевой кислоты, обмена белков костной ткани, гормонов щитовидной железы, стероидных гормонов и еще десятки других групп полиморфизмов.
В настоящее время в лаборатории CL определяются генетические полиморфизмы генов системы свертывания крови: ген F2 (20210_G>A), ген F5 (1691_G>A), ген F7 (10976_G>A), ген F13 (103_G>Т), ген FGB (455_G>A), ген ITGA 2/интегрин α-2/(807_С>Т), ген ITGВ 3/интегрин β-3/ (1565_Т>С), ген PAI-1 (675_5G>4G). Результат исследования содержит интерпретацию и описание рисков, связанных с тем или иным сочетанием. В ближайшее время планируется значительное расширение спектра определяемых полиморфизмов в CL.
Детекция результатов ПЦР проходит в режиме реального времени. Управление прибором осуществляет программное обеспечение. Программа позволяет использовать простое и интуитивное управление с использованием функции «Тест», что значительно сокращает время создания протоколов исследований. Программное обеспечение содержит приложения для количественной оценки ДНК/кДНК, анализа кривых, определения уровня экспрессии генов, исследования биоценозов и SNP-анализа, позволяет использовать функцию «дополнительных стандартов» и формировать протоколы исследования с автоматической трактовкой полученных результатов.
Научно-технический прогресс привел к одному незаменимому открытию в области молекулярной биологии – открытию метода полимеразной цепной реакции (ПЦР), который позволяет обнаружить даже небольшой фрагмент искомого генома. Полимеразная цепная реакция поначалу применялась исключительно в научных лабораториях. Однако вскоре метод нашел свое место в медицине. В 1993 году, Kary Mullis, ученому, открывшему метод ПЦР, была присуждена Нобелевская премия в области химии.
Диагностика полиморфизмов генов в медицинской лаборатории CL
Выявлять полиморфизмы сегодня позволяют методы современной молекулярно-генетической диагностики. В лаборатории CL исследования полиморфизмов проводят с 2012 года методом полимеразной цепной реакции (ПЦР), c помощью детектирующего амплификатора DtPrime производства российской компании «ДНК-Технология». Принцип ПЦР построен на методе многократного комплементарного достраивания матрицы нуклеиновой кислоты до двухцепочечной структуры, которую способен «увидеть» прибор и распознать полиморфизм. Метод ПЦР, помимо быстроты выполнения и манипулятивной простоты, является еще и весьма чувствительным и специфичным. Очень наглядно принцип метода охарактеризован в среде лабораторных работников так: «найти иглу в стоге сена, а затем построить стог из этих игл».
Для того чтобы исключить неточности, один и тот же участок гена исследуется многократно. Вся цепь ДНК разбивается на участки, затем ведется поиск участков, где прогнозируются полиморфизмы. После чего эти участки вырезаются и сопоставляются. С помощью ПЦР количество таких участков увеличивается до 10 в 36–40 степени. Каждый участок вновь прочитывается десятки раз. Только после этого можно выстроить статистически верную кривую.
Результаты и интерпретация
Информация о наличии полиморфизмов, знание их влияния на определенные виды обмена и уровень чувствительности к лекарственным препаратам позволяют оценить риск развития заболевания, предупредить его развитие и назначить верное лечение.
Важным фактом является то, что генные полиморфизмы в течение жизни не меняются и определяются один раз! Результаты не изменяются в течение жизни и не зависят от физиологического состояния организма.
Генетическое тестирование позволяет в досимптомный период выявить существующие пока только в геноме наследственные тенденции к развитию болезней и наметить пути их ранней профилактики.
Для врачей важна интерпретация результатов анализа полиморфизмов: необходимо понять, как связан тот или иной полиморфизм с вероятностью развития патологического состояния. Следует учитывать, что ни один полиморфизм не является нозологией как таковой, только ее элементом, но зачастую решающим.
Наличие полиморфизмов можно учесть при назначении лекарственных средств. Так, врач-клиницист, руководствуясь рекомендациями генетика, может изменить концентрацию или дозу препарата, который будет влиять на компонент свертывания крови. Безусловно, важны также режим, диета, физиопроцедуры, но основная роль отведена медикаментозному лечению. А это – область фармакогенетики, которая изучает реакции организма на определенные препараты согласно особенностям генома человека.
Интеграция наук
15 лет назад было заявлено, что расшифрован геном человека. Это открытие стало возможным благодаря многолетней работе ученых различных отраслей науки, уровень которой достиг тех высот, в которых информация и знания из одной области проникают в другую. Такая «интеграция наук» выводит на качественно новый уровень дальнейшее развитие биотехнологий, медицины, генетики, геномики. Каких горизонтов достигнут ученые при детальном знании генома человека, прогнозировать трудно. Можно быть готовым лишь к тому, что природа поставит перед человеком новые, не менее сложные задачи и амбициозные цели.
СОДЕРЖАНИЕ
Используемые методы
Направленные делеции и точечные мутации
В некоторых случаях можно использовать условные аллели, чтобы ген функционировал нормально до тех пор, пока условный аллель не будет активирован. Это может повлечь за собой «выбивание» сайтов рекомбиназы (таких как сайты lox или frt), что вызовет делецию в интересующем гене, когда индуцируется специфическая рекомбиназа (такая как CRE, FLP). Рекомбиназы Cre или Flp могут быть индуцированы химическими обработками, обработками тепловым шоком или ограничены определенным подмножеством тканей.
В области вирусологии методы обратной генетики могут использоваться для восстановления полноразмерных инфекционных вирусов с желаемыми мутациями или вставками в вирусные геномы или в специфические вирусные гены. Технологии, которые позволяют эти манипуляции, включают реакцию кольцевого удлинения полимеразы (CPER), которая впервые была использована для создания инфекционной кДНК для вируса Кунджин, близкого родственника вируса Западного Нила. CPER также успешно использовался для создания ряда вирусов с положительной РНК, таких как SARS-CoV-2, возбудитель COVID-19.
Подавление гена
РНКи создает специфический нокаутный эффект без фактической мутации интересующей ДНК. У C. elegans РНКи использовались для систематического вмешательства в экспрессию большинства генов в геноме. РНКи действует, заставляя клеточные системы разрушать информационную РНК-мишень (мРНК).
РНКи-интерференция, особенно подавление гена, стала полезным инструментом для подавления экспрессии генов и выявления и анализа их фенотипа с потерей функции. Когда мутации происходят в аллелях, функция, которую он представляет и кодирует, также мутирует и теряется; это обычно называется мутацией потери функции. Способность анализировать фенотип потери функции позволяет анализировать функцию гена, когда нет доступа к мутантным аллелям.
Вмешательство с использованием трансгенов
В качестве альтернативы можно сверхэкспрессировать мутантные формы гена, которые мешают нормальной функции гена ( дикого типа ). Например, сверхэкспрессия мутантного гена может привести к высоким уровням нефункционального белка, что приведет к доминантному отрицательному взаимодействию с белком дикого типа. В этом случае мутантная версия будет конкурировать за белки-партнеры дикого типа, что приведет к мутантному фенотипу.
Синтез вакцины
Вакцина против гриппа
Преимущества и недостатки
Вакцины, созданные на основе обратной генетики, обладают рядом преимуществ по сравнению с традиционными вакцинами. В первую очередь это скорость производства. Из-за высокой антигенной изменчивости гликопротеинов HA и NA обратный генетический подход позволяет быстро сформулировать необходимый генотип (т.е. тот, который содержит белки HA и NA, взятые из циркулирующих в настоящее время штаммов вирусов). Кроме того, поскольку конечным продуктом производства ослабленной вакцины с использованием обратной генетики является живой вирус, проявляется более высокая иммуногенность, чем у традиционных инактивированных вакцин, которые должны быть уничтожены с помощью химических процедур перед переносом в качестве вакцины. Однако из-за живой природы аттенуированных вирусов у пациентов с иммунодефицитом могут возникнуть осложнения. Также существует вероятность того, что мутация вируса может привести к тому, что вакцина снова превратится в живой незатухающий вирус.
обратная генетика
Смотреть что такое «обратная генетика» в других словарях:
Обратная генетика — * зваротная генетыка * reverse genetics or surrogate g. 1. Современное направление генетики, сочетающее в себе направленные изменения структуры ДНК () с изучением их фенотипического проявления в конкретной биологической тест системе. Одно из… … Генетика. Энциклопедический словарь
Генетика — Фрагмент ДНК Генетика (от греч. γενητως … Википедия
Обратная транскрипция — Обратная транскрипция это процесс образования двуцепочечной ДНК на матрице одноцепочечной РНК. Данный процесс называется обратной транскрипцией, так как передача генетической информации при этом происходит в «обратном», относительно… … Википедия
обратная полимеразная цепная реакция — Модификация метода полимеразной цепной реакции, при которой амплифицируемый участок ДНК получают с помощью рестриктаз endonucleases с последующим замыканием фрагмента в кольцо; О.п.ц.р. позволяет амплифицировать участки ДНК с неизвестной… … Справочник технического переводчика
обратная транскрипция — Синтез ДНК на матрице РНК, осуществляемый с участием обратной транскриптазы. [Арефьев В.А., Лисовенко Л.А. Англо русский толковый словарь генетических терминов 1995 407с.] Тематики генетика EN reverse transcription … Справочник технического переводчика
генетика — [нэ], и; ж. [от греч. genētikos относящийся к рождению, происхождению]. Наука о законах наследственности и изменчивости организмов. Г. человека. Г. растений. Медицинская г. Космическая г. * * * генетика (от греч. génesis происхождение), наука о… … Энциклопедический словарь
Молекулярная генетика — раздел генетики (См. Генетика) и молекулярной биологии (См. Молекулярная биология), ставящий целью познание материальных основ наследственности (См. Наследственность) и изменчивости (См. Изменчивость) живых существ путём исследования… … Большая советская энциклопедия
Список генетических терминов — Эта страница глоссарий. См. также: Список генетических пороков развития и заболеваний Термины генетики в алфавитном поряд … Википедия
Гаплогруппы — Гаплогруппа (в популяционной генетике человека науке, изучающей генетическую историю человечества) группа схожих гаплотипов, имеющих общего предка, у которого в обоих гаплотипах имела место одна и та же мутация однонуклеотидный… … Википедия
Аллели — (от греч. ἀλλήλων друг друга, взаимно) различные формы одного и того же гена, расположенные в одинаковых участках (локусах) гомологичных хромосом и определяющие альтернативные варианты развития одного и того же признака. В диплоидном… … Википедия
Генетические нарушения у человека и методы их выявления
Генами называются участки ДНК, в которых закодирована структура всех белков в теле человека или любого другого живого организма. В биологии действует правило: «один ген – один белок», то есть в каждом гене содержится информация только об одном определенном белке.
В 1990 году большая группа ученых из разных стран начала проект под названием «Геном человека». Он завершился в 2003 году и помог установить, что человеческий геном содержит 20–25 тысяч генов. Каждый ген представлен двумя копиями, которые кодируют один и тот же белок, но могут немного различаться. Большинство генов одинаковые у всех людей – различается всего 1%.
ДНК находится в клетке внутри ядра. Она особым образом организована в виде хромосом – эти нитеподобные структуры можно рассмотреть в микроскоп с достаточно большим увеличением. Внутри хромосомы ДНК намотана на белки – гистоны. Когда гены неактивны, они расположены очень компактно, а во время считывания генетического материала молекула ДНК расплетается.
В клетках человека есть структуры, которые называются митохондриями. Они выполняют роль «электростанций» и отвечают за дыхание. Это единственные клеточные органеллы, у которых есть собственная ДНК. И в ней тоже могут возникать нарушения. 
Весь набор хромосом в клетке называется кариотипом. В норме у человека он представлен 23 парами хромосом, всего их 46. Выделяют два вида хромосом:
Методы исследования хромосом
Для исследования кариотипа применяют специальный метод – световую микроскопию дифференциально окрашенных метафазных хромосом культивированных лимфоцитов периферической крови.
Этот анализ применяется для диагностики различных хромосомных заболеваний. Он позволяет выявлять такие нарушения, как:
Однако с помощью исследования кариотипа можно выявить не все генетические нарушения. Оно не способно обнаружить такие изменения, как:

Для получения дополнительной информации, не видимой в световой микроскоп, используют хромосомный микроматричный анализ (ХМА). С его помощью можно изучить все клинически значимые участки генома и выявить изменения в количестве и структуре хромосом, а именно микрополомки (микроделеции и микродупликации).
Во время хромосомного микроматричного анализа применяют технологию полногеномной амплификации и гибридизации фрагментов опытной ДНК с олигонуклеотидами, нанесенными на микроматрицу. Если объяснять простыми словами, то сначала ДНК, которую необходимо изучить, копируют, чтобы увеличить ее количество, а затем смешивают ее со специальными ДНК-микрочипами, которые помогают выявлять различные нарушения.
Эта методика позволяет в одном исследовании выявлять делеции и дупликации участков ДНК по всему геному. Разрешающая способность стандартного ХМА от 100 000 пар нуклеотидов – «букв» генетического кода (в отдельных регионах от 10 000 п. н.).
С помощью ХМА можно выявлять:
Однако, как и предыдущий метод, хромосомный микроматричный анализ имеет некоторые ограничения. Он не позволяет выявлять или ограничен в выявлении таких аномалий, как:
Мутации в генах и заболевания, к которым они способны приводить
Мутации – это изменения, которые происходят в ДНК как случайным образом, так и под действием разных факторов, например химических веществ, ионизирующих излучений. Они могут затрагивать как отдельные «буквы» генетического кода, так и большие участки генома. Мутации происходят постоянно, и это основной двигатель эволюции. Чаще всего они бывают нейтральными, то есть ни на что не влияют, не приносят ни вреда, ни пользы. В редких случаях встречаются полезные мутации – они дают организму некоторые преимущества. Также встречаются вредные мутации – из-за них нарушается работа важных белков, наоборот, происходят достаточно часто. Генетические изменения, которые происходят более чем у 1% людей, называются полиморфизмами – это нормальная, естественная изменчивость ДНК Полиморфизмы ответственны за множество нормальных отличий между людьми, таких как цвет глаз, волос и группа крови.
Все внешние признаки и особенности работы организма, которые человек получает от родителей, передаются с помощью генов. Это важнейшее свойство всех живых организмов называется наследственностью. В зависимости от того, как проявляются гены в тех или иных признаках, их делят на две большие группы.
Например, карий цвет глаз у человека является доминантным. Поэтому у кареглазых родителей с высокой вероятностью родится кареглазый ребенок. Если у одного из родителей глаза карие, а у другого голубые, то вероятность рождения кареглазых детей в такой семье тоже высока. У двух голубоглазых родителей, скорее всего, все дети тоже будут голубоглазыми. А вот у кареглазых родителей может родиться ребенок с голубыми глазами, если у обоих есть рецессивные «гены голубоглазости», и они достанутся ребенку. Конечно, это упрощенная схема, потому что за цвет глаз отвечает не один, а несколько генов, но на практике эти законы наследования зачастую работают. Аналогичным образом потомству могут передаваться и наследственные заболевания.
Как выявляют рецессивные мутации?
Для выявления мутаций, которые передаются рецессивно, используют целый ряд исследований.
Секвенирование по Сэнгеру – метод секвенирования (определения последовательности нуклеотидов, буквально – «прочтение» генетического кода) ДНК, также известен как метод обрыва цепи. Анализ используется для подтверждения выявленных мутаций. Это лучший метод для идентификации коротких тандемных повторов и секвенирования отдельных генов. Метод может обрабатывать только относительно короткие последовательности ДНК (до 300–1000 пар оснований) одновременно. Однако самым большим недостатком этого метода является большое количество времени, которое требуется для его проведения.
Если неизвестно, какую нужно выявить мутацию, то используют специальные панели.
Панель исследования — тестирование на наличие определенных мутаций, входящих в перечень конкретной панели исследования. Анализ позволяет выявить одномоментно разные мутации, которые могут приводить к генетическим заболеваниям. Анализ позволяет компоновать мутации в панели по частоте встречаемости (скрининговые панели, направленные на выявление носительства патологической мутации, часто встречаемой в данном регионе или в определенной замкнутой популяции) и по поражаемому органу или системе органов (панель «Патология соединительной ткани»). Но и у этого анализа есть ограничения. Анализ не позволяет выявить хромосомные аберрации, мозаицизм и мутации, не включенные в панель, митохондриальные заболевания, а также эпигенетические нарушения.
Не в каждой семье можно отследить все возможные рецессивные заболевания. Тогда на помощь приходит секвенирование экзома – тест для определения генетических повреждений (мутаций) в ДНК путем исследования в одном тесте практически всех областей генома, кодирующих белки, изменения которых являются причиной наследственных болезней.
Секвенирование следующего поколения-NGS – определение последовательности нуклеотидов в геномной ДНК или в совокупности информационных РНК (транскриптоме) путем амплификации (копирования) множества коротких участков генов. Это разнообразие генных фрагментов в итоге покрывает всю совокупность целевых генов или, при необходимости, весь геном.
Анализ позволяет выявить точечные мутации, вставки, делеции, инверсии и перестановки в экзоме. Анализ не позволяет выявить большие перестройки; мутации с изменением числа копий (CNV); мутации, вовлеченные в трехаллельное наследование; мутации митохондриального генома; эпигенетические эффекты; большие тринуклеотидные повторы; рецессивные мутации, связанные с Х-хромосомой, у женщин при заболеваниях, связанных с неравномерной Х-деактивацией, фенокопии и однородительские дисомии, и гены, имеющие близкие по структуре псевдогены, могут не распознаваться.
Что делать, если в семье есть наследственное заболевание?
Существуют два способа выявить наследственные генетические мутации у эмбриона:
Предимплантационное генетическое тестирование (ПГТ) в цикле ЭКО. Это диагностика генетических заболеваний у эмбриона человека перед имплантацией в слизистую оболочку матки, то есть до начала беременности. Обычно для анализа проводится биопсия одного бластомера (клетки зародыша) у эмбриона на стадии дробления (4–10 бластомеров). Существует несколько видов ПГТ: на хромосомные отклонения, на моногенные заболевания и на структурные хромосомные перестройки. Данные Simon с соавторами (2018) говорят о том, что в случае проведения ЭКО с ПГТ у пациентки 38–40 лет результативность ЭКО составляет 60%. Но при исследовании эмбриона есть ряд ограничений. Так, из-за ограниченного числа клеток можно не определить мозаицизм.
Если нет возможности провести ЭКО с ПГТ, то используют второй вариант – исследование плодного материала во время беременности.
Для забора плодного материала используют инвазивные методы:
Далее эти клетки исследуют при помощи одного или нескольких генетических тестов (которые имеют свои ограничения). Проведение инвазивных методов может быть связано с риском для беременности порядка 1%.
Таким образом, проведя дополнительные исследования, можно значительно снизить риск рождения ребенка с генетическим заболеванием в конкретной семье. Но привести этот риск к нулю на сегодняшний день, к сожалению, невозможно, так как любой генетический тест имеет ряд ограничений, что делает невозможным исключить абсолютно все генетические болезни.

Автор статьи
Пелина Ангелина Георгиевна
Ведёт генетическое обследование доноров Репробанка, осуществляет подбор доноров для пар, имеющих ранее рождённых детей с установленной генетической патологией.





