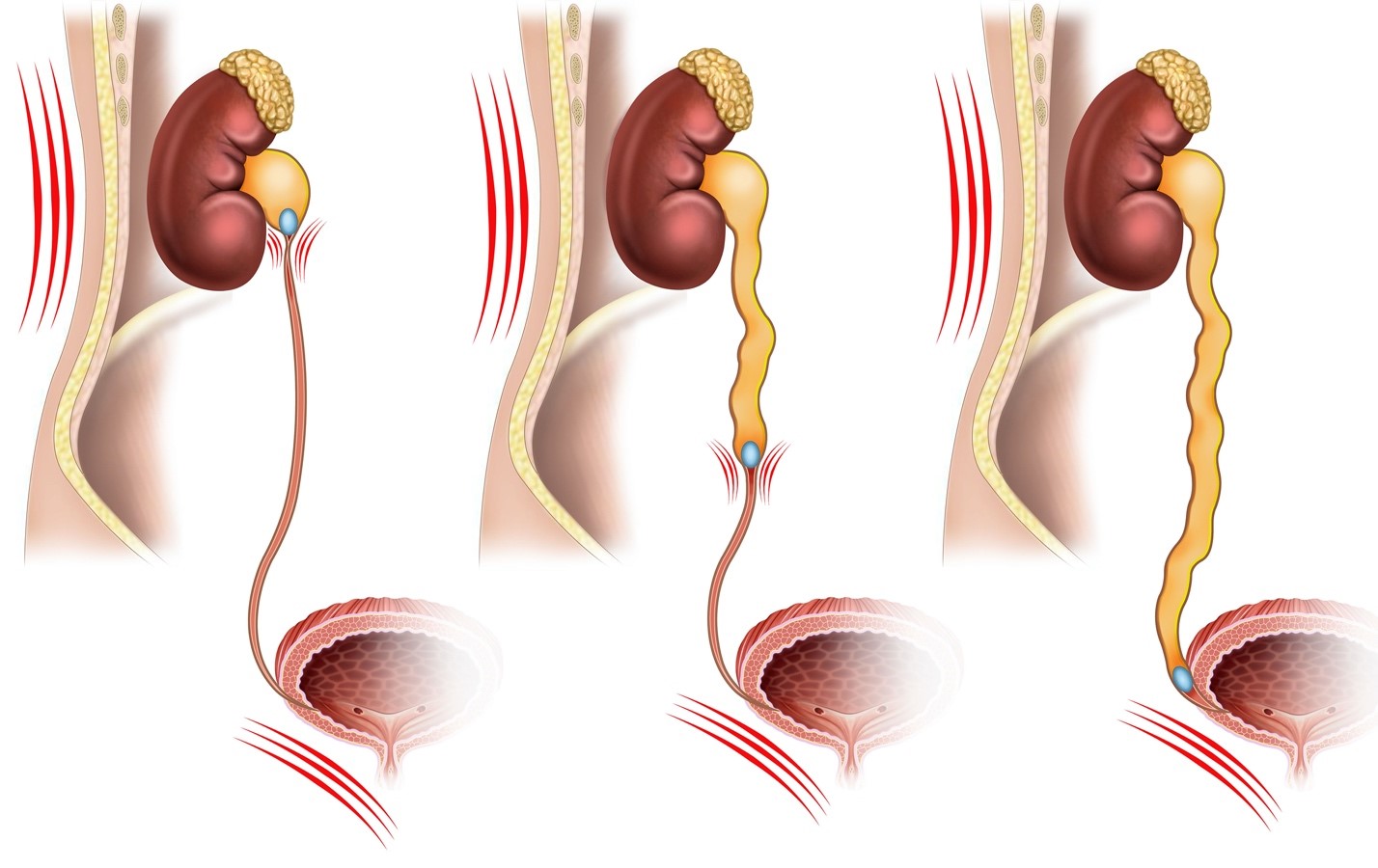
Что такое обструкция шейки мочевого пузыря
Непроходимость мочевыводящих путей (обструктивная уропатия)
Непроходимость мочевыводящих путей — это закупорка, препятствующая прохождению мочи по мочевыводящих путям, включая почки, мочеточники, мочевой пузырь и мочеиспускательный канал. Непроходимость в любом месте мочевыводящих путей — от почек, где образуется моча, до мочеиспускательного канала, через который моча выходит из организма, может повысить давление внутри мочевыводящих путей и замедлить выделение мочи.
Непроходимость может возникнуть внезапно или развиваться постепенно в течение нескольких дней, недель или даже месяцев. При непроходимости мочевыводящие пути могут блокироваться полностью или только частично. В некоторых случаях поражается только одна почка, в других случаях — обе почки.
Причины
Симптомы
Непроходимость может остановить мочеиспускание или уменьшить объем выводимой при мочеиспускании мочи, если закупорка затронет мочеточники обеих почек или мочеиспускательный канал. Непроходимость мочеиспускательного канала или выходного отверстия мочевого пузыря может причинять боль, давление и растяжение мочевого пузыря.
У лиц с медленно прогрессирующей непроходимостью, которая вызывает гидронефроз, может не быть никаких симптомов, или же у них могут быть приступы тупой боли в боку на пораженной стороне. Иногда камень в почках временно блокирует мочеточник и причиняет периодически возникающую боль.
Непроходимость, которая приводит к гидронефрозу, может стать причиной общих симптомов со стороны пищеварительного тракта (тошнота, рвота и боль в животе). У лиц с инфекциями мочевыводящих путей (ИМП) может быть гной в моче, лихорадка и дискомфорт в области мочевого пузыря или почек.
Возможные осложнения
Диагностика
С учетом причины заболевания и имеющихся симптомов врач может назначить следующие виды обследования:
Лечение
Как правило, лечение направлено на снятие симптомов непроходимости и зависит от причины и симптомов болезни, тяжести течения, а также наличия сопутствующих заболеваний и медикаментозной терапии, получаемой по сопутствующей патологии. С учетом этого врач может назначить:
Обструктивная уропатия – когда нужно срочно обращаться к врачу
Обструктивная уропатия – состояние, при котором закупорка препятствует прохождению мочи по мочевыводящему каналу. Возникает в любом участке системы – от почек, где моча образуется, до канала, через который она покидает организм. Состояние повышает давление в мочевыделительном канале и угрожает осложнениями, если вовремя не будет диагностировано.
Причины
Причины развития обструктивной уропатии и рефлюкс-уропатии отличаются в разных возрастных группах:
Обструктивная уропатия у мужчин встречается чаще, у женщин же она часто встречается во время беременности. Это связано с давлением плода и матки на мочевыводящий канал.
Дополнительно причинами заболевания становятся:
Новообразования в простате у мужчин и в матке у женщин способны сужать просвет мочеточника, потому врач проводит дифференциальную диагностику с определением сопутствующих заболеваний и первопричин.
Непроходимость мочевыводящих путей – симптомы
Признаки уропатии зависят от локализации, продолжительности состояния. Пациентов беспокоят такие симптомы:
Если непроходимость возникает быстро, она причиняет боль и описанные состояния. При медленно прогрессирующей уропатии болезненность не отмечается на первых стадиях. В этом случае заболевание угрожает гидронефрозом.
Нарушение оттока мочи – повод немедленно обратиться к урологу! Патология может развиваться критически быстро, но своевременная диагностика и лечение предотвратят острые состояния и осложнения.
Диагностика
Для обнаружения обструктивной уропатии у мужчин и женщин назначаются лабораторные и инструментальные обследования:
В клинике урологии имени Р. М. Фронштейна Первого Московского Государственного Медицинского Университета имени И.М. Сеченова можно пройти диагностику и получить консультацию опытного уролога. Современные диагностические аппараты, врачи высшей категории помогут справиться с заболеванием на любой стадии в короткие сроки. Не откладывайте визит к врачу, позаботьтесь о здоровье сегодня!
Склероз шейки мочевого пузыря
Что такое?
Склероз шейки мочевого пузыря (стеноз или фиброз) – это процесс замещения функционально активной ткани уретро-везикального перехода на соединительную ткань. Другими словами, в месте перехода мочевого пузыря в мочеиспускательный канал образуется рубец. Фиброзное перерождение тканей полых органов сопровождается огрубением и уплотнением их стенок, нарушением перистальтики, а также снижением эластичности. Замещение эпителия на коллагеновые волокна имеет тенденцию к генерализации процесса, поэтому в месте склерозирования зачастую возникают деформации, разрастание рубцов с возможным перекрытием просвета полого органа.
Образование рубцовой ткани в шейке запускают воспалительные процессы, микроциркуляторные нарушения и травмы. Гибель клеток и вялотекущее воспаление сопровождается активизацией специальных клеток – фибробластов, которые активизируют синтез коллагеновых волокон. В норме лишние волокна рассасываются после купирования воспалительного процесса. Однако в условиях недостатка кислорода и нарушений метаболических процессов в клетках коллагенолизис значительно замедляется. Соединительная ткань образуется в избытке, изменяет структуру изначально поврежденной стенки. В результате развивается стеноз (сужение или стриктура) верхнего отдела мочеиспускательного канала или его облитерация (полное перекрытие).
Склероз шейки мочевого пузыря чаще обнаруживается у мужчин, что обусловлено анатомическими особенностями расположения уретрального канала. В большинстве случаев разрастание фиброзной ткани начинается после хирургических вмешательств по поводу опухолей простаты (аденомэктомии или простатэктомии).
Заболевание проявляется нарушениями мочеиспускания. В тяжелых случаях провоцирует задержки мочи, расширение мочеточников, почечную недостаточность. При своевременной диагностике и правильном лечении прогноз для пациента благоприятный.
Виды склероза шейки мочевого пузыря
В зависимости от степени нарушений и интенсивности проявлений заболевания выделяют 3 степени стеноза мочевого пузыря:
Симптомы склероза шейки мочевого пузыря
На начальных этапах развития патологии наблюдается сужение шейки пузыря, что проявляется слабыми признаками дизурии. В начале микции пациенту приходится тужиться, струя мочи становится слабой. Компенсированная стадия длится до 3 лет.
На субкомпенсированной стадии стеноз шейки становится более выраженным, что сопровождается застоем урины. Позывы в туалет возникают чаще, мочеиспускание затрудненное, после микции у пациента остается ощущение неполноценного опорожнения. Застойные явления создают благоприятные условия для развития инфекционных осложнений (цистита, уретрита).
На поздних этапах прогрессии заболевания зачастую присоединяется бактериальная инфекция. У пациента поднимается температура, возникают болезненные позывы, мочеиспускание сопровождается резями, иногда наблюдаются боли в надлобковой области. Возможно неконтролируемое выделение мочи.
При сильном фиброзе шейки ее просвет перекрывается, возникает острый застой мочи, когда самостоятельное опорожнение пузыря становится невозможным. При этом урина вытекает небольшими порциями самопроизвольно, однако попытки помочиться контролируемо оказываются безрезультатными.
Причины склероза шейки мочевого пузыря
Для разрастания рубцовой ткани в области перехода пузыря в уретру есть анатомические предпосылки. Здесь более плотная соединительнотканная выстилка под эпителием, из-за чего шейка лишена складок и менее эластична, что плохо сказывается на компенсации склеротических изменений. Формирование рубцов быстро приводит к выраженному сужению просвета. Причин, которые могут спровоцировать фиброзное перерождение тканей, несколько:
Склонность к стенозу пузырной шейки есть у пациентов, которые проходили лучевую терапию по поводу опухолей пузыря или простаты, а также у людей с системными заболеваниями соединительной ткани и патологиями иммунитета.
Получить консультацию
Почему «СМ-Клиника»?
Диагностика склероза шейки мочевого пузыря
Подозрения на стеноз шейки мочевого пузыря возникают у уролога еще на этапе сбора жалоб и анамнеза. В пользу данного диагноза говорит факт о перенесенных вмешательствах на органах мочеполовой системы, инвазивных диагностических процедурах, хронических воспалительных заболеваниях. Для врача важно объективно выявить склероз шейки и исключить другие патологии, которые могут привести к застою мочи. С этой целью назначают инструментальные методы диагностики:
Лабораторную диагностику применяют с целью выявления осложнений, а также на этапе подготовки пациента к операции. Проводят анализы мочи, общий и биохимический анализ крови. При подозрениях на онкопатологии назначают тесты на специфические онкомаркеры.
Мнение эксперта
Иногда мужчины годами лечат простатит, полагая, что нарушения мочеиспускания являются следствием именно этого заболевания. Естественно, противовоспалительные препараты, свечи и растительные средства не дают никакого эффекта.
Практика показывает, что пациенты приходят к врачу уже в запущенных случаях, когда имеет место острая задержка мочи и серьезные проблемы с почками. Промедление с обращением за помощью ведет не только к пиелонефриту. Следствием хронического застоя урины может стать формирование дивертикулов пузыря, расширение мочеточников, гидронефроз и даже почечная недостаточность. Постоянные проблемы с мочеиспусканием провоцируют у больного тревожность, неврозоподобные состояния и даже депрессию. На самом деле всего этого можно избежать – стеноз мочепузырной шейки поддается лечению и большинство осложнений можно предотвратить, если вовремя провести операцию.
Мингболатов Аятулла Шахболатович,
врач уролог-андролог высшей категории, к.м.н.
Методы лечения склероза шейки мочевого пузыря
Фиброзное перерождение тканей шейки мочевого пузыря невозможно устранить консервативными способами. Чтобы восстановить нормальный пассаж мочи, необходимо избавиться от рубцовой деформации. С этой целью проводят хирургическое вмешательство.
Консервативное лечение
Медикаменты назначают на этапе подготовки к операции, а также в послеоперационном периоде для профилактики инфекционных осложнений. В составе комплексного лечения применяют антибиотики, обезболивающие и противовоспалительные препараты.
Хирургическое лечение склероза шейки мочевого пузыря
Предпочтительно проведение малотравматичных вмешательств по удалению склерозированых тканей шейки. В современной урологии чаще используется трансуретральная резекция (ТУР), однако методику применяют на ранних этапах развития заболевания при небольшом объеме фиброзной ткани. Рубцы иссекают с помощью специального оборудования (резектоскопа), который вводят через уретральный канал.
Инцизия пузырной шейки подразумевает рассечение рубцовой ткани для формирования просвета. Применяется при значительных рубцовых изменениях и острой задержке мочи. В отверстие вводят временный катетер, который удаляют через некоторое время после операции.
Профилактика
Чтобы предотвратить формирование рубца на шейке мочевого пузыря, необходимо своевременно лечить инфекционно-воспалительные патологии урогенитального тракта. Важно вовремя обращаться за помощью при нарушениях уродинамики и первых признаках заболеваний простаты.
Предупредить постоперационный стеноз шейки мочевого пузыря помогают современные методы оперирования, которые активно практикуются в специализированных центрах, в т.ч. в «СМ-Клиника». Манипуляции по иссечению тканей проводят с помощью гольмиевого лазера и биполярного плазменно-кинетического оборудования. Практика показывает, что после их применения риск развития склероза шейки сводится к минимуму.
Реабилитация
После трансуретрального рассечения рубцов на шейке пузыря пациент находится в стационаре около 3 дней. На протяжении месяца нельзя заниматься сексом, поднимать тяжести, подвергать себя тяжелым физическим нагрузкам, запрещается купание в открытых водоемах, посещение сауны и бани.
Склероз шейки мочевого пузыря
Склероз шейки мочевого пузыря подразумевает под собой разрастание соединительной (рубцовой) ткани в области перехода мочевого пузыря в уретру (мочеиспускательный канал). В результате происходит уменьшение диаметра шейки, пузырь полностью не опорожняется, моча застаивается, что приводит к различным негативным последствиям. Как правило, появление симптомов заболевания приводит пациента к врачу-урологу.
Причины
Различают врожденный и приобретенный характер заболевания. Часто рубцевание шейки мочевого пузыря является следствием перенесенной урологической операции по поводу аденомы предстательной железы. Врожденная патология встречается крайне редко, и носит название «болезнь Мариона».
Вследствие значительного сужения мочевыводящих протоков, их диаметр становится на порядок меньше, вплоть до полной обтурации шейки. Тогда становится вопрос об искусственном выведении мочи путем проведения цистостомии. Данный подход не может не отразиться на психологическом состоянии мужчин и часто приводит к дезадаптации в обществе. Кроме того, развивается хронический воспалительный процесс мочевыделительной системы.
Симптоматика
Вне зависимости от причин, жалобы пациентов однотипны.
Выделяют три стадии заболевания:
При появлении первых симптомов следует незамедлительно посетить врача-уролога, ведь начальная стадия заболевания намного лучше поддается лечебной коррекции и способствует полному выздоровлению.
Наши врачи
Диагностика
Специалист клиники ЦЭЛТ внимательно выслушает пациента, соберет жалобы, уточнит, с чего начиналось заболевание, что этому предшествовало, и как протекала патология. Часто склероз шейки мочевого пузыря развивается в ранний период после операции на предстательной железе.
Следующим важным этапом, после объективного осмотра, является инструментальная диагностика. Для установки точного диагноза у мужчин проводятся следующие методы обследования:
Полноценное исследование позволяет провести дифференциальную диагностику с другими, имеющими сходную клиническую картину, заболеваниями мочевыделительной системы: стриктурой уретры, ложными ходами, «предпузырём», склерозом предстательной железы и т. д.
Лечебная тактика
Основным подходом к лечению является проведение оперативного вмешательства. Его следует осуществить как можно раньше с момента установления диагноза, чтобы избежать развития серьезных осложнений в дальнейшем.
При наличии цистостомы, установленной в результате задержки мочи, необходимо тщательным образом промыть мочевой пузырь антисептическими растворами и заменить дренаж.
Наилучшие результаты дают малоинвазивные оперативные вмешательства путем осуществления доступа через естественное отверстие — уретру. В мочеиспускательный канал вводится видеоэндоскоп, который позволяет визуализировать состояние уретры и диагностировать склероз шейки мочевого пузыря. Специальным инструментом осуществляется рассечение ткани, добиваясь максимального расширения шейки мочевого пузыря. Иногда приходится прибегать к трансуретральной электрорезекции, которая дает практически стопроцентный эффект от лечения. В клинике применяется и лазерное воздействие.
Современный подход к лечению позволяет без разрезов и крови осуществить оперативное вмешательство. Таким образом, происходит скорейшая реабилитация после операции, а также осуществляется профилактика последующих рецидивов заболевания. Применяемая методика высокоэнергетического воздействия существенным образом снижает возможность повторного разрастания рубцовой ткани.
В течение некоторого времени после хирургического вмешательства проводится промывка мочевого пузыря через уретральный катетер. Пациентам назначаются антибиотики и противовоспалительная терапия с целью профилактики развития инфекционно-воспалительных осложнений — уретрита, эпидидимита, орхоэпидидимита.
В дальнейшем осуществляется динамическое наблюдение за состоянием больного, которое включает в себя периодический осмотр у врача, а также проведение лабораторных и инструментальных методов обследования. В случае рецидива заболевания проводится повторная ТУР рубцов.
Прогноз
При склерозе шейки мочевого пузыря прогноз для выздоровления удовлетворительный. Возможные осложнения и рецидивы заболевания, которые чаще наблюдаются при полном заращении шейки, поддаются коррекции. Если отмечается полное недержание мочи, проводится операция имплантации искусственного мочевого сфинктера.
Профилактика заболевания
О профилактике склероза шейки мочевого пузыря необходимо задуматься еще на этапе после операции по поводу аденомы предстательной железы. Для этого врачи-урологи многопрофильной клиники ЦЭЛТ проводят ряд мероприятий:
Если у больного уже развилось заболевание, предпринимаются действия, направленные на предотвращение рецидива после проведения трансуретральной электрорезекции. В таком случае профилактика включает в себя:
Наши услуги в урологии
Администрация АО «ЦЭЛТ» регулярно обновляет размещенный на сайте клиники прейскурант. Однако во избежание возможных недоразумений, просим вас уточнять стоимость услуг по телефону: +7 (495) 788 33 88
Пузырно-мочеточниковый рефлюкс у детей: лечебная тактика
Среди детей и подростков пузырно-мочеточниковый рефлюкс (ПМР) встречается в 1% случаев, доля билатерального рефлюкса составляет до 50,9% [1]. При этом в 50% случаев степень рефлюкса с разных сторон различна.
Среди детей и подростков пузырно-мочеточниковый рефлюкс (ПМР) встречается в 1% случаев, доля билатерального рефлюкса составляет до 50,9% [1]. При этом в 50% случаев степень рефлюкса с разных сторон различна. Распространенность ПМР и последствия этого заболевания (хронический пиелонефрит, отставание в развитии, артериальная гипертензия, хроническая почечная недостаточность), неизбежно приводящие к инвалидизации, диктуют необходимость поиска путей улучшения лечебной тактики. Среди причин развития ПМР у мальчиков основное место занимают пороки развития устьев мочеточников, в то время как у девочек преобладают вторичные формы ПМР, обусловленные инфекцией мочевых путей и нейрогенными дисфункциями мочевого пузыря (НДМП). Так, на первом году жизни соотношение страдающих ПМР мальчиков и девочек составляет 6:1, а по мере взросления это соотношение изменяется с точностью до наоборот [2].
Чтобы понять причины развития ПМР, необходимо иметь представление о нормальном строении пузырно-мочеточникового сегмента (ПМС) (рис.). Анатомически замыкательная функция ПМС осуществляется благодаря определенному соотношению длины и ширины внутрипузырного отдела мочеточника (5:1), косому прохождению мочеточника через стенку мочевого пузыря. Длинный подслизистый тоннель является пассивным элементом уретеро-везикального «клапана». Активный элемент клапанного механизма представлен мышечно-связочным аппаратом мочеточника, который при сокращении детрузора смыкает устье.
К причинам антифизиологичного тока мочи относятся патологические состояния, приводящие к нарушению замыкательной функции ПМС и высокое внутрипузырное давление мочи. К первым можно отнести врожденные пороки ПМС и воспалительный процесс поверхностного и глубокого слоев треугольников мочевого пузыря (циститы), нарушающий работу детрузора или непосредственно самого ПМС.
Аномалии ПМС являются следствием неправильного развития мочеточникового выроста вольфова протока на 5-й неделе эмбриогенеза [3, 4]. Представить аномалии ПМС можно следующим образом:
Утрата замыкательной функции ПМС встречается при воспалении стенки мочевого пузыря или зоны ПМС. Наиболее часто вторичный ПМР является следствием (осложнением) гранулярной, буллезной или фибринозной форм цистита. Инфекция мочевых путей встречается у 1–2% мальчиков и у 5% девочек. Чаще мочевые пути колонизируются условно-патогенной (кишечной) флорой, среди которой основное место занимает кишечная палочка (40–70%) [3].
В норме ПМС способен противостоять внутрипузырному давлению жидкости до 60–80 см водного столба [5]. Высокое гидростатическое давление является следствием интравезикальной обструкции или функциональных расстройств мочевого пузыря. Интравезикальная обструкция развивается при клапанах задней уретры, рубцовом фимозе у мальчиков, склерозе шейки мочевого пузыря (болезни Мариона), меатальном стенозе у девочек.
НДМП встречаются у 20% детей в возрасте 4–7 лет. К 14 годам число страдающих этими дисфункциями сокращается до 2% [6]. НДМП проявляют себя ирритативной или обструктивной симптоматикой. Основные формы НДМП: гиперактивность детрузора, гипотония детрузора и детрузорно-сфинктерная диссинергия. При этих состояниях ПМР также считается вторичным и является следствием повышения давления жидкости в мочевом пузыре. Гиперактивность детрузора характеризуется резкими скачками внутрипузырного давления и нарушением накопительной функции мочевого пузыря. Гипотония детрузора характеризуется снижением чувствительности стенки пузыря, его переполнением и нарастанием давления мочи в его просвете выше критических цифр. Детрузорно-сфинктерная диссинергия представляет собой нарушение синхронной работы детрузора и сфинктерного аппарата, приводящее к функциональной инфравезикальной обструкции при микции.
С возрастом отмечается тенденция к уменьшению встречаемости первичного и увеличению вторичного ПМР. При этом частота регрессии первичного ПМР находится в обратной зависимости от степени ПМР. При I и II степенях ПМР регрессия отмечается в 80%, а при III — всего в 40% случаев. Объяснение этому дает теория «матурации» ПМС (Hutch, 1961), которая приобрела себе сторонников позднее (Kellerman, 1967; King, 1974). Суть теории заключается в том, что с развитием ребенка происходит физиологическая трансформация ПМС — удлиняется внутрипузырный отдел мочеточника, уменьшается его диаметр относительно длины и изменяется угол впадения в мочевой пузырь.
Современная лечебная стратегия при ПМР включает в себя комплекс мероприятий (терапевтических и хирургических), направленных на устранение причины рефлюкса и ликвидацию его последствий. Выбор метода коррекции ПМР, безусловно, определяется его формой.
Суть консервативной терапии должна сводиться к эрадикации инфекции мочевых путей и устранению функциональных расстройств мочевого пузыря и профилактике гибели почечной паренхимы. По данным Ю. Ф. Исакова, эффективность консервативной терапии при I–III степени ПМР составляет 60–70%. Основными осложнениями (проявлениями) ПМР являются хронический пиелонефрит (50–70%) и рефлюксогенная нефропатия (60–70%) [2]. Этиологическая структура хронического пиелонефрита (по А. Ф. Возианову и др., 2002) представлена следующим образом: кишечная палочка — 40–60%, протей — 9–16%, клебсиелла — 7–20%, стрептококк — 4–10%, L-формы — 15%, микробные ассоциации — 10–15%, энтерококк — 2–5%, синегнойная палочка — 2–7%, энтеробактер — 5–15%, стафилококк — 5–14%.
Антимикробная терапия должна носить длительный характер (6–12 мес) и применяться по результатам посевов мочи. Наиболее удобными для детей являются препараты пероральных форм. При лечении в стационаре применяются внутримышечные или внутривенные формы. Для эрадикации возбудителя нашли применение следующие препараты:
– аугментин, 25–50 мг/кг/сут, перорально в течение 7–10 сут;
– амоксиклав, 20–40 мг/кг/сут, перорально в течение 7–10 сут;
– цефуроксим (зиннат), 20–40 мг/кг/сут (в два приема) в течение 7–10 сут;
– цефаклор (цеклор), 20–40 мг/кг/сут (в три приема) в течение 7–10 сут;
– цефиксим (супракс), 8 мг/кг/сут (в 1 или 2 приема) в течение 7–10 сут;
– цефтибутен (цедекс), 7–14 мг/кг/сут (в 1 или 2 приема) в течение 7–10 сут;
После использования бактерицидных препаратов (антибиотиков) длительным курсом назначается уросептическая терапия:
– налидиксовая кислота — 60 мг/кг/сут, перорально, в течение 3–4 нед;
– пипемидовая кислота (пимидель, палин) — 200–400 мг/сут, перорально, в течение 3–4 нед;
– нитроксолин (5-НОК) — 10 мг/кг/сут, перорально, в течение 3–4 нед.
С целью купирования аллергического компонента назначаются десенсибилизирующие средства:
Важную роль играет применение лекарственных средств, улучшающих внутриклеточный обмен. С антиоксидантной целью назначаются:
С целью коррекции митохондриальной недостаточности применяются:
Обязательным компонентом консервативной терапии является применение фитопрепаратов: листья и плоды брусники, клюквы, смородины, кора дуба, зверобой, крапива, ромашка, черника, мать-и-мачеха и др.
Для повышения эффективности лечения циститов у детей старшего возраста применяется местная терапия — внутрипузырные инстилляции, к которым надо относиться с осторожностью у больных с высокими степенями ПМР. Важно помнить, что объем растворов не должен превышать 20–50 мл. Используются растворы: протаргол; солкосерил; гидрокортизон; хлоргексидин; фурациллин.
Курс лечения рассчитан на 5–10 инстилляций, при буллезном цистите повторяют 2–3 курса. Эффективно дополнение местной терапии физиотерапевтическим лечением.
Особое место в лечении инфекции мочевых путей у детей следует уделять нормализации функции кишечника. Нарушение нормального ритма опорожнения толстой кишки приводит к компрессии нижней трети мочеточника, нарушению васкуляризации, застою в области малого таза, инфицированию мочевых путей (лимфогенный путь).
НДМП наблюдается у пациентов с миелодисплазией и различными ее проявлениями: менингомиелоцеле, рахишизисе, Spina bifida (неполное закрытие позвоночного канала) и др. Лечению НДМП отводится важное звено в комплексной терапии. Устранение функциональных расстройств мочевых путей является сложнейшей задачей и требует длительного времени.
При гипорефлекторном детрузоре рекомендуются:
При гиперактивности детрузора назначаются:
Физиотерапевтическое лечение носит вспомогательный характер, однако значительно повышает эффективность терапии. Этот метод применяется как при НДМП, так и при воспалительных заболеваниях мочевых путей.
Отдельное место в лечении ПМР отводится эндоскопическим методам. Так, согласно опросу, проведенному итальянскими урологами, 80% родителей выбирают эндоскопическое лечение в качестве альтернативы открытым операциям и длительной медикаментозной терапии [7].
Приоритет в медицинском применении тефлоновой пасты принадлежит отоларингологу Arnold, использовавшему ее с целью коррекции голосовой щели (1962). Внедрение в урологическую практику тефлона состоялось в 1974 г., когда V. Politano выполнил парауретральную инъекцию по поводу недержания мочи. Впервые о малоинвазивном эндоскопическом способе коррекции ПМР заявил Е. Маtouschek. В 1981 г. он с положительным результатом выполнил инсуфляцию тефлоновой пасты ребенку 8 лет в область устья рефлюксирующего мочеточника [8]. Впоследствии O. Donnel совместно с P. Puri (1984) описали методику эндоскопического лечения ПМР [9]. За 25 лет опробовано большое количество имплантируемых материалов, начиная с тефлона и заканчивая культурами аутогенных клеток [8–16]. Наиболее полная классификация инъецируемых материалов выглядит следующим образом [17]:
Первый опыт применения антирефлюксных имплантантов настораживал специалистов в связи с возможностью развития нежелательных побочных эффектов: возникновения в месте инъекции некроза, малигнизации, миграции материала с формированием гранулем в регионарных лимфатических узлах и/или паренхиматозных органах [18–20]. Современными экспериментальными и клиническими работами доказана инертность и гипоаллергенность, безопасность используемых в настоящее время биоматериалов [12, 13]. Положительные результаты эндоскопического лечения ПМР, по данным недавних исследований, (Chertin, 2003; Kirsch, 2004) достигают 70–90%.
Показаниями к эндоскопическому способу коррекции ПМР являются неэффективность консервативной терапии в сроки от 6 до 12 мес. Отсутствие острой фазы воспаления мочевого пузыря — обязательное условие для эндоколлагенопластики.
Эндоскопический способ коррекции ПМР благодаря простоте выполнения и достаточно высокой при этом эффективности прочно входит в алгоритм лечебной тактики. Несомненно, важная роль должна отводиться правильному выбору показаний к этому методу. Коллагенизация устья мочеточника оправдана при нормальном его строении, т. е. отсутствии зияния устья и латеральной дистопии. При IV и V степенях ПМР и снижении секреторной функции почки > 50% показано выполнение открытой реимплантации мочеточника.
Метод эндоскопического лечения, направленный на удлинение интрамурального отдела мочеточника и уменьшение диаметра устья, выполняется по следующей методике. Производится цистоскопия, в ходе которой определяется клинико-анатомическая картина мочевого пузыря: состояние мочепузырного треугольника, форма и расположение устьев мочеточника, наличие парауретральных дивертикулов и уретероцеле, воспалительных изменений. Через рабочий канал тубуса цистоскопа проводится длинный инъектор (диаметр 5Сh), присоединенный к шприцу с коллагеном. Коллаген представлен субстанцией в виде геля. Стандартный объем коллагена в шприце — 2 мл. Вкол иглы инъектора (длина 6 мм) осуществляется под устье мочеточника — на 6 ч условного циферблата, на всю глубину. Для профилактики осложнений перед коллагенопластикой возможна катетеризация устья мочеточниковым катетером 5Сh. При давлении на поршень шприца с коллагеном в зоне вкола иглы постепенно образуется валик. В зависимости от степени зияния устья и длины подслизистого отдела мочеточника, вводится от 1 до 2 мл субстанции. При этом устье мочеточника приобретает точечную или щелевидную форму, после чего инструмент удаляется. Мочевой пузырь на сутки дренируется двупросветным уретральным катетером Фоли 8–14Сh, баллон которого наполняется на 5 мл.
Самым эффективным способом коррекции ПМР остается оперативный — 93–97% случаев [21]. Известно более 80 способов открытого оперативного лечения ПМР — это различные модификации уретероцистоанастомоза. Принципиальным механизмом всех видов открытых вмешательств является удлинение интрамурального отдела мочеточника с целью создания клапанного механизма, способного пропускать мочу в одном направлении из мочеточника в мочевой пузырь. Наиболее удачной признана техника тоннельного анастомоза, благодаря способности тоннеля противостоять высокому гидростатическому давлению внутри мочевого пузыря (как при наполненном мочевом пузыре, так и при мочеиспускании), препятствуя рефлюксу мочи в мочеточник.
Показаниями к хирургическому лечению являются: рефлюксирующий мегауретер (при ПМР IV, V степени), рецидивирующий характер ПМР при более низких степенях и отсутствии положительного эффекта от консервативного или эндоскопического лечения, сочетание рефлюкса с обструктивным компонентом в зоне ПМС.
В послеоперационный период всем пациентам обязательно проводится профилактическая антибиотикотерапия в течение 3–4 сут с последующим переходом на уросептическую терапию в течение 2–3 нед.
Публикации, касающиеся первого опыта использования тоннельной техники уретероцистоанастомоза, принадлежат D. Williams и J. Hutch и появились они в 60-х годах прошлого столетия [3]. По разным данным, известны от 80 до 120 способов открытого оперативного лечения ПМР — это различные модификации уретероцистоанастомоза. Одни выполняются со вскрытием мочевого пузыря (операции Коэна, Политано-Лидбеттера и др.) [22], другие без цистотомии (операции Лича–Грегуара [23, 24], Барри [22]). В любом возрасте эти операции проводятся с применением эндотрахеального наркоза. Осложнения открытых операций в большинстве случаев общие — кровотечение, развитие стриктуры анастомоза, нарушение эвакуации мочи на уровне пузырно-мочеточникового соустья в результате ангуляции и как следствие развитие ретенции верхних мочевых путей, рецидив ПМР, послеоперационный цистит и пиелонефрит [25].
В России наиболее часто выполняются операции Коэна и Политано–Лидбеттера. Уретероцистоанастомоз по Коэну выполняется через разрез передней стенки мочевого пузыря и основан на принципе удлинения внутрипузырной части мочеточника путем его реимплантации во вновь сформированный подслизистый тоннель. Специфичными осложнениями данного способа являются кровотечение из мочепузырного треугольника (Льето) и юкставезикального отдела мочеточника, развитие послеоперационного цистита. Послеоперационное кровотечение из треугольника Льето связано с формированием подслизистого тоннеля в наиболее кровоснабжаемой зоне мочевого пузыря, что обусловлено анатомическими особенностями. Послеоперационное кровотечение из юкставезикального отдела мочеточника возникает вследствие разрыва регионарных артериальных и венозных сплетений во время его слепой тракции для проведения через подслизистый тоннель. Оба варианта кровотечений требуют повторной ревизии операционной раны, гемостаза и ухудшают результат реконструктивно-пластической операции. Из-за чреспузырного доступа, особенностями и слабыми сторонами уретероцистоанастомоза по Коэну являются пересечение всех слоев стенки мочевого пузыря с развитием рубца, препятствующего нормальной сократительной способности пузыря; невозможность расправления перегибов расширенного мочеточника и выполнения его моделирования перед реимплантацией, необходимость в которых возникает при IV и V степенях ПМР (на долю IV и V степеней приходится до 60% среди всех оперативных вмешательств).
В основе принципа уретероцистоанастомоза по Политано–Лидбеттеру лежит создание подслизистого тоннеля мочевого пузыря. Особенностью техники является широкое вскрытие мочевого пузыря и рассечение слизистой оболочки мочевого пузыря в трех местах для создания тоннеля, при этом отсечение мочеточника производится с внешней стороны мочевого пузыря, так как данный способ предполагает резекцию расширенного мочеточника. Специфичными осложнениями операции по Политано-Лидбеттеру являются развитие рубца в месте вскрытия пузыря; развитие ангуляции предпузырного отдела мочеточника из-за использования техники анастомозирования и образование стриктур пузырно-мочеточникового анастомоза, не поддающихся эндоскопической коррекции. Характерным рентгенологическим симптомом ангуляции мочеточника является его трансформация в виде рыболовного крючка. На практике это значительно снижает возможность катетеризации почки при возникающей необходимости (например, при мочекаменной болезни). Применение столь травматичного способа уретероцистоанастомоза при отсутствии расширения мочеточника ограничено или неоправданно.
Экстравезикальный способ уретероцистоанастомоза является максимально эффективным оперативным вмешательством у детей с ПМР (98%). В задачи уретероцистоанастомоза входит создание надежного клапанного механизма ПМС, формирование адекватного просвета мочеточника, не препятствующего свободному пассажу мочи. Экстравезикальная методика уретероцистоанастомоза в полной мере отвечает предъявляемым требованиям. Использование экстравезикальной методики позволяет избежать вскрытия мочевого пузыря (широкого рассечения детрузора) и в то же время дает возможность сформировать подслизистый тоннель на любом участке стенки мочевого пузыря, выбрав бессосудистую зону. Длина тоннеля также может быть выбрана хирургом произвольно.
Появление новых эффективных препаратов при фармакологическом консервативном лечении ПМР у детей, с одной стороны, и внедрение в практическую медицину новых оперативных способов лечения, включая лапароскопическую хирургию, робототехнику — с другой, безусловно, в будущем изменит значение обычных открытых способов коррекции ПМР. Но сегодня в стратегии лечения ПМР открытые оперативные вмешательства играют ключевую роль, так как они позволяют ликвидировать самые сложные формы ПМР.
В заключение хотелось бы подчеркнуть, что выбор метода коррекции ПМР должен быть строго индивидуальным и основываться на объективном анализе врачом данных обследования и оценке возможности применения всех имеющихся способов устранения ПМР у данного конкретного больного.
Литература
А. Ю. Павлов, доктор медицинских наук
С. А. Маслов
Н. В. Поляков, кандидат медицинских наук
А. А. Лисенок, кандидат медицинских наук
Г. В. Симонян
НИИ урологии, Москва