Что такое обызвествление легких
Причины и лечение кальцификации
Кальций – макроэлемент, участвующий в обменных процессах, является строительным материалом для крепких костей и зубов. Избыточное поступление минерала на фоне нарушения усвоения приводит к его отложению в мягких тканях, внутренних органах и кровеносных сосудах. Такой патологический процесс получил название кальциноз. Кальцификация продолжительное время может протекать бессимптомно и привести к необратимым последствиям в организме.
Классификация кальцификации
Кальцификация – патологический процесс, для которого характерно отложение кальция. В зависимости от локализации макроэлемент может накапливаться и поражать:
В зависимости от этиологии кальцификация бывает 3 типов:
Также кальциноз может быть системным, поражая все органы человека или местным, с локализацией в одном органе или системе.
Причины кальцификации
Отложение кальция в мягких тканях, внутренних органах происходит в результате нарушения метаболизма, что приводит к нарушению усвоения важного макроэлемента для человеческого организма. Чаще всего, сбои в обменных процессах вызваны эндокринными патологиями, болезнями почек инфекционного и аутоиммунного характера, нарушением выработки ферментов при печеночных патологиях и заболеваний поджелудочной железы.
К нарушению обмена кальция может привести недостаточное поступление магния и избыток витамина Д, которые принимают непосредственное участие в усвоении организмом макроэлемента.
Кальцификация отдельного органа может развиваться при образовании кист, опухолей доброкачественного и злокачественного характера, дистрофии тканей.
Процесс образования кальциевых конгломератов также затрагивает соединительную и хрящевую ткань, атеросклеротические бляшки, погибшие паразитирующие микроорганизмы, импланты.
Признаки кальцификации
На начальных этапах распознать патологию крайне сложно в связи с ее бессимптомным течением. Однако некоторые виды имеют достаточно выраженную клиническую картину.
При системном виде кальциноза или при поражении кожных покровов, суставов, эпидермис покрывается небольшими пузырьками, изменения структуры и окраса не наблюдается. По мере прогрессирования патологии кальциевые конгломераты разрастаются и становятся более плотными на ощупь, изменяют свой окрас. Возможно образование свищей.
Известковые отложения в ходе плановых осмотров специалистами или при инструментальном исследовании могут обнаруживаться на зубах, костях, сосудах, мышечных и нервных волокнах. Скопление макроэлемента на тканях органов приводит к нарушению их функционирования.
При поражении сердечной мышцы и сосудистой системы, у больного появляется болевой синдром в грудине, руке, шее, спине, который сохраняется продолжительное время. Также происходит нарушение кровотока, что приводит к скачкам артериального давления, появлению чувства холода в конечностях.
При поражении почек нарастают симптомы интоксикации, нарушается диурез, кожные покровы становятся сухими, вялыми. При кальцификации органов пищеварительного тракта, нарушается их работа, что приводит к возникновению тошноты, рвоты, чувства тяжести в абдоминальной области, запоров.
При поражении и скоплении большого количества кальция в головном мозге больной испытывает частые приступы головной боли и головокружения, скачки внутричерепного давления, нарушение координации движения, ухудшение памяти, проблемы со зрением и слухом. По мере прогрессирования болезни возможны обмороки.
Вместе с этим кальциноз приводит к снижению работоспособности, постоянной вялости и усталости, слабости, снижению массы тела.
Диагностика
Для подтверждения диагноза используется рентгенологическая диагностика. Данный метод позволяет определить характер и размер отложений, а также степень поражения органа, в котором локализуется кальциевый конгломерат. В качестве дополнительных методов исследования назначается:
Для выявления причины кальцификации тканей назначаются дополнительные исследования, в виде общеклинического и биохимического анализа крови. Последний способ позволяет определить уровень кальция, фосфора и магния в крови. При нарушении функций почек назначается общеклинический и бактериологический анализ мочи для оценки работоспособности почек.
Для исключения злокачественного характера новообразований в пораженном органе назначается биопсия тканей. Данный метод предполагает забор биологического материала и его исследования под микроскопом в лабораторных условиях. Биопсия помогает также дифференцировать доброкачественное и злокачественное новообразование.
Лечение
Для лечения кальциноза назначается терапевтический курс, который поможет справиться с заболеванием-первопричиной. Так, если к избыточному отложению кальция привело воспаление инфекционной природы, назначаются антибактериальные препараты.
При нарушении усвоения кальция назначаются медикаменты, содержащие магний, который является антагонистом кальция. Достаточное поступление магния с продуктами питания и медикаментозными препаратами позволяет растворить конгломераты и вывести избыток кальция из организма. В ходе лечения важно принимать диуретики, которые помогут ускорить процесс выведения макроэлемента.
В процессе усвоения кальция принимает участие витамин Д, избыточное поступление которого также отрицательно сказывается на состоянии организма. Поэтому в ходе лечения необходимо соблюдать специальную диету, которая исключает употребление в большом количестве продуктов питания, богатых кальцием и витамином Д. К таким относят рыбу жирных сортов, листовую зелень, молочные продукты, яичный желток, орехи.
При неэффективности консервативных методов лечения, а также образовании конгломератов больших размеров назначается их оперативное удаление. Выбор метода хирургического вмешательства проводится в зависимости от размеров скоплений кальция, а также их локализации.
Кальциноз в период беременности
Отложение кальция во время вынашивания ребенка чаще всего диагностируется в конце третьего триместра гестационного периода. С медицинской точки зрения такой процесс допустим и связан с видоизменением плаценты.
Если кальцификация диагностируется на более ранних сроках, это может привести к преждевременному созреванию плаценты. Как правило, кальциноз у беременных связан с употреблением большого количества продуктов, богатых кальцием, инфекционными процессами и метаболическими нарушениями.
Избыток макроэлемента в организме беременной женщины также опасен, как и его недостаток. Может стать причиной травм ребенка и матери в период родоразрешения.
Профилактика
Чтобы предупредить кальцификацию мягких тканей и внутренних органов следует особое внимание уделить правильному питанию. Важно обеспечить достаточное поступление всех минералов и витаминов в организм, чтобы предупредить развитие патологий различной этиологии.
Также людям с врожденными и приобретенными заболеваниями сердечно-сосудистой системы, почек, эндокринными патологиями важно регулярно проходить плановые осмотры у специалистов, что поможет своевременно предупредить развитие осложнений.
Лечение различных заболеваний стоит проводить только под контролем специалиста и в соответствии с его рекомендациями. Некоторые группы лекарственных препаратов, в том числе для снижения уровня холестерина в крови, артериального давления, а также антибактериальные и гормональные средства могут привести к повышению уровня кальция в организме и нарушению его обмена.
Для предупреждения кальциноза следует вести активный образ жизни, который помогает восстановить нормальный метаболизм, отказаться от употребления алкогольных напитков и табакокурения.
Кальцификация тканей – патологический процесс, связанный с высокой концентрацией кальция в организме. Поражает сердечно-сосудистую, нервную, опорно-двигательную, пищеварительную и мочевыделительную системы. Для предупреждения болезни необходимо правильно питаться и вести здоровый образ жизни. В качестве терапии назначается курс медикаментозных препаратов для устранения причины патологического процесса и нормализации уровня кальция и магния в крови.
Эксперт статьи:
Татаринов Олег Петрович
Врач высшей категории, врач невролог, физиотерапевт, специалист УВТ, ведущий специалист сети «Здоровье Плюс»
Медицинский опыт более 40 лет
Кальциноз
Кальциноз – это заболевание, которое характеризуется выпадением из жидкостей организма солей кальция и отложением их в тканях. В медицине заболевание известно также под следующими названиями: обызвествление, кальцификация и известковая дистрофия. Развивается оно под воздействием изменения уровня кислотности и белкового состава крови, нарушения в крови регуляции уровня кальция, а также местных ферментативных и неферментативных факторов. Обменная активность клеток повышается, синтез белка, ДНК и РНК увеличивается, ряд ферментных систем активизируются – именно эти факторы и приводят к обызвествлению.
Симптомы кальциноза
Симптомы кальциноза – мелкие узелки, которые появляются в толще кожи. На ощупь они плотные, болезненные, а кожа над ними имеет нормальный цвет и структуру. В дальнейшем эти узелки могут выходить на поверхность, в этом случае на их месте образовываются свищи, постоянно выделяющие массу кашеобразной консистенции. Такое состояние причиняет больным сильное беспокойство. Распространившиеся по телу известковые узелки могут затруднять суставную подвижность, что приводит к искривлениям позвоночника или формы таза, отсутствию движения в пальцах рук, а также коленных, голеностопных и тазобедренных суставах.
Лечение кальциноза
Лечение кальциноза заключается в приеме лекарственных препаратов в тщательно подобранной дозировке. Назначать терапию должен только опытный, высококвалифицированный специалист, в противном случае нередки случаи отравления и тяжелых осложнений. В нашей клинике больные находятся под наблюдением грамотных врачей, которые в дополнение к медикаментозной терапии порекомендуют комплекс лечебной гимнастики, назначат физпроцедуры, массаж и соответствующую диету. Иногда может потребоваться хирургическое вмешательство, необходимость которого определяет специалист.
Консультация и прием врача
Более подробную информацию Вы можете узнать по телефонам указанным на сайте или обратиться в наш Медицинский Центр. Мы работаем Без Выходных с 8.00 до 22.00 по адресу: г.Москва ВАО (Восточный Административный Округ) Сиреневый Бульвар 32А
Кальцинаты в легких
Здравствуйте! В 2016 году на кт были обнаружены многочисленные кальцинаты в легких. Повторные кт 2017 и 2019 года без динамики. В анамнезе хронический бронхит. В 1995, 2002, 2007, 2013 перенес пневмонию. В сентябре 2019 года в общем анализе крови были повышены лейкоциты, температура 37,3 и хрипы. Терапевт назначил лечение в том числе вильпрофен. В ноябре ситуация повторилась. Пульмонолог назначил клацид и консультацию фтизиатра. Фтизиатр назначил т спот и пцр. Т спот положительный, пцр отрицательный. По кт рентгенолог, которого привлек фтизиатр, увидел мелкие плотные очаги и немногочисленные кальцинаты в обоих легких и дал заключение: остаточные изменения, вероятно после диссеменированного туберкулеза легких и вглу (или микобактериоза). Рентгенологи, которые делали кт, писали заключение множественные кальцинаты без динамики. На момент обращения к фтизиатру, Общий анализ крови, после клацид, в норме, лейкоциты норма, соэ норма, только моноциты 0,8. Вес постоянно стабильный, сильного кашля, болей в груди, отдышки, ночной потливости нет, мокроты мало и без крови. Фтизиатр собирается поставить диагноз туберкулез легких и внести в реестр туберкулезных больных с сообщением по месту работы и жительства, либо предлагает пройти дообследование у них в клинике. подскажите, пожалуйста, насколько законно ставить диагноз туберкулез в данном случае и вносить в реестр, если кальцинаты были обнаружены в 2016 году случайно, динамики нет, пцр отрицательный. Насколько корректно было назначать т спот, если он не показывает закрытую форму и открытую. А кальцинаты в легких явно дают понять, что т спот априори будет положительным.
Хронические болезни: Хронический бронхит
Доброкачественные опухоли легких
1. Что такое доброкачественная опухоль легких и ее симптомы?
Опухоли легких во многих случаях не являются злокачественными, т.е диагноз рак легких при наличии опухоли ставится не всегда. Нередко опухоль легких имеет характер доброкачественной.
Узелки и точки в легких можно увидеть на рентгеновском снимке или компьютерной томографии. Они представляют собой плотные небольшие участки ткани круглой или овальной формы, окруженные здоровыми тканями легких. Узелок может быть один или несколько.
По статистике, новообразования в легких чаще всего оказываются доброкачественными, если:
Доброкачественная опухоль легких появляется в результате аномального роста тканей и может развиваться в различных частях легких. Определить, является ли опухоль легких доброкачественной или злокачественной очень важно. И сделать это нужно как можно раньше, ведь раннее выявление и лечение рака легких существенно повышает вероятность полного излечения и, в итоге, выживания пациента.
Симптомы доброкачественной опухоли легких
Доброкачественные узелки и опухоли в легких обычно не вызывают никаких симптомов. Именно поэтому ни практически всегда диагностируются случайно во время рентгена грудной клетки или компьютерной томографии.
Однако они могут стать причиной следующих симптомов болезни:
2. Причины доброкачественных опухолей
Причины того, почему появляются доброкачественные опухоли легких, мало изучены. Но в целом они часто появляются после таких проблем со здоровьем, как:
Воспалительные процессы, возникшие из-за инфекции:
Воспаление, не связанное с инфицированием:
3. Виды опухолей
Вот некоторые из наиболее распространенных типов доброкачественных опухолей легких:
4. Диагностика и лечение
Диагностика доброкачественных опухолей легких
Помимо рентгеновского обследования и компьютерной томографии для диагностики опухолей легких, о которых мы уже говорили, диагностика состояния здоровья пациента может заключаться в контроле динамики развития опухоли в течение нескольких лет. Обычно такая практика используется, если размер узелка не превышает 6 мм и пациент не входит в группу риска по заболеванию раком легких. Если узелок остается того же размера, по крайней мере, два года, он считается доброкачественным. Это связано с тем, что доброкачественные опухоли легких растут медленно, если вообще растут. Раковые опухоли, напротив, удваиваются в размере каждые четыре месяца. Дальнейшее ежегодной наблюдение, по меньшей мере, в течение пяти лет поможет окончательно убедиться, что опухоль легких доброкачественная.
Доброкачественные узелки в легких обычно имеют гладкие края и более равномерный цвет по всей поверхности. Они более правильной формы, чем раковые узелки. В большинстве случаев для проверки скорости роста, формы и других характеристик опухоли (к примеру, кальцификации), достаточно рентгена грудной клетки или компьютерной томографии (КТ).
Но возможно, что Ваш врач назначит и другие исследования, особенно если опухоль изменила размер, форму или внешний вид. Это делается для того, чтобы исключить рак легких или определить основную причину появления доброкачественных узелков.
Для диагностики может потребоваться:
Биопсия может быть выполнена при помощи различных методов, например, аспирации иглой или бронхоскопии.
Лечение доброкачественных опухолей легких
Во многих случаях специфическое лечение доброкачественной опухоли легких не требуется. Тем не менее, удаление новообразования может быть рекомендовано в том случае, если:
Если для лечения опухоли легких требуется операция, ее проводит торакальный хирург. Современные методики и квалификация торакального хирурга позволяют выполнить операцию с небольшими разрезами, и сокращают время пребывания в стационаре. Если удаленные узелок был доброкачественным, дальнейшее лечение не потребуется, за исключением тех случаев, когда наличие опухоли осложнялось другими проблемами, к примеру, пневмонией или обструкцией.
Иногда для лечения требуется более сложная инвазивная операция, в ходе которой удаляется узелок или часть легких. Какая именно операция будет необходима, решает врач, учитывая местоположение и тип опухоли.
Заболевания плевры: диагностика и лечение
Заболевания плевры часто встречаются в общей практике и могут отражать широкий диапазон лежащих в их основе патологических состояний, затрагивающих легкие, грудную стенку, а также системных болезней. Самое распространенное их проявление
Заболевания плевры часто встречаются в общей практике и могут отражать широкий диапазон лежащих в их основе патологических состояний, затрагивающих легкие, грудную стенку, а также системных болезней. Самое распространенное их проявление заключается в образовании плеврального выпота, и у подавляющего большинства таких больных необходимы рентгенологическое подтверждение и дальнейшее обследование. Последние достижения, касающиеся методов получения изображения органов грудной клетки, терапии и хирургии, позволили усовершенствовать диагностику и лечение больных с патологией плевры.
Плевра дает грудной клетке возможность придавать легким необходимую форму и приводить их в движение с минимальными затратами энергии. Для чего два плевральных листка (париетальный и висцеральный) должны скользить один по другому — этому процессу способствует небольшое количество (0,3 мл/кг) жидкости.
Плевральная жидкость фильтруется из мелких сосудов париетальной плевры в плевральную полость и реабсорбируется лимфатическими сосудами этого же листка. Экспериментальные данные показывают, что объем и состав плевральной жидкости в норме очень стабильны, и выпот возникает только в тех случаях, если скорость фильтрации превышает максимальный отток лимфы либо нарушено обратное всасывание [1].
Плевральный выпот
Плевральные выпоты традиционно подразделяются на транссудаты (общий белок 30 г/л). В промежуточных случаях (а именно, когда содержание протеина составляет 25–35 г/л) разграничить экссудат и транссудат помогает определение содержания в плевральной жидкости лактатдегидрогеназы (ЛДГ) и градиента альбумина между сывороткой и плевральной жидкостью.
Наиболее часто встречающиеся причины и характерные признаки плевральных выпотов приведены в таблицах 1 и 2. Их дифференциация важна потому, что «низкобелковые» выпоты (транссудаты) не требуют дальнейших диагностических мероприятий; необходимо лишь лечение вызвавшей их патологии, в то время как при обнаружении плеврального экссудата, безусловно, нужна дополнительная диагностика.
Выпоты могут быть односторонними или двусторонними. Последние часто выявляются при сердечной недостаточности, но могут также возникать при гипопротеинемических состояниях и при коллагенозах с поражением сосудов. Имеют очень большое значение тщательный сбор анамнеза, включая профессию, данные о путешествиях за границу и о факторах риска тромбоэмболии, а также внимательное полноценное физикальное обследование.
При физикальном обследовании обнаруживается ограничение дыхательных движений грудной клетки, «каменная» тупость при перкуссии, приглушение дыхания при аускультации и часто — зона бронхиального дыхания сверху от уровня жидкости.
Небольшие выпоты следует дифференцировать с утолщением плевры. Помочь в этом может выполнение рентгенограммы в положении лежа (при этом жидкость движется под действием силы тяжести), а также ультразвуковое исследование (УЗИ) или рентгеновская компьютерная томография (КТ).
И УЗИ, и КТ являются ценными методами, которые все чаще используются для дифференциации между плевральной жидкостью, «окутанным» легким (плевральными бляшками, обычно возникающими при воздействии асбеста) и опухолью. Эти методы позволяют также выяснить, является ли плевральная жидкость осумкованной, и наметить оптимальное место для плевральной пункции и биопсии.
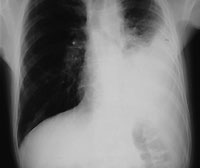 |
| Рисунок 1. Рентгенограмма органов грудной клетки: виден расширенный пищевод с уровнем жидкости и левосторонний плевральный выпот. Эти изменения были расценены как вторичная эмпиема, возникшая на фоне аспирационной пневмонии |
Плевральная пункция с аспирацией и биопсия показаны всем больным с выпотом, при этом удается получить гораздо больше диагностической информации, чем только при аспирации, и избежать проведения повторной инвазивной процедуры (см. рис. 1).
Другие исследования, помогающие в установлении диагноза, включают повторную рентгенографию органов грудной клетки после аспирации для выявления лежащей в основе выпота патологии легких, КТ, изотопное сканирование легких (с определением соотношения вентиляции и перфузии), внутрикожные пробы с туберкулином, серологические исследования на ревматоидные и антиядерные факторы.
Если вышеперечисленные методы не позволяют выявить причину возникновения плевральных выпотов, проводится торакоскопия с помощью видеотехники. Она позволяет не только осмотреть плевру, но также выявить опухолевые узлы и осуществить прицельную биопсию. Эта процедура наиболее ценна для диагностики мезотелиомы. Как бы то ни было, у 20% больных с экссудативными плевральными выпотами посредством обычных исследований не удается диагностировать причину развития данного состояния.
Лечение патологии, провоцирующей развитие плеврального выпота, например сердечной недостаточности или тромбоэмболии легочных артерий, часто приводит к его исчезновению. Некоторые состояния, включая эмпиему и злокачественные опухоли, требуют особых мер, о которых речь пойдет ниже.
Парапневмонические выпоты и эмпиема
Приблизительно у 40% больных с бактериальными пневмониями развивается сопутствующий плевральный выпот [11]; в таких случаях необходимо провести плевральную пункцию, чтобы удостовериться, что нет эмпиемы, и предотвратить либо уменьшить степень последующего утолщения плевры.
Однако у 15% пациентов парапневмонические выпоты вторично инфицируются, развивается эмпиема, то есть образуется гной в плевральной полости (см. рис. 2).
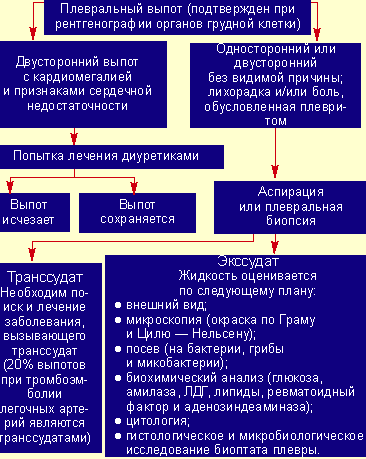 |
| Рисунок 2. Исследования при плевральном выпоте |
Другие причины эмпиемы включают хирургические вмешательства (20%), травмы (5%), перфорации пищевода (5%) и субдиафрагмальные инфекции (1%) [12].
 |
| Таблица 3. Микроорганизмы: возбудители эмпиемы |
При эмпиемах большая часть высеваемых культур представлена аэробными микроорганизмами. Анаэробные же бактерии высеваются в 15% случаев эмпием, обычно являющихся осложнением аспирационных пневмоний; остальные случаи обусловлены разнообразными другими микроорганизмами (см. табл. 3). Если до плевральной пункции назначались антибиотики, посевы часто не дают роста.
Диагноз подтверждается на основании рентгенологических признаков осумкованного плеврита или в случае обнаружения гноя в плевральном пунктате (см. табл. 2).
Кроме того, под контролем УЗИ или КТ следует наладить дренаж из наиболее низкой части эмпиемы и соединить его с подводным клапанным механизмом. В прошлом рекомендовалось использовать дренажи относительно большого диаметра, однако сегодня применение более узких трубок признано эффективным при меньшей травматичности для пациентов.
Рекомендации относительно целесообразности применения фибринолитиков основаны на результатах небольших неконтролированных исследований, согласно которым частота ликвидации спаек составила 60–95% [13, 14], а потребность в хирургических вмешательствах значительно уменьшилась. Тем, что до сих пор не проведено контролированных исследований, объясняется некоторая неопределенность относительно того, когда, как долго и в каких дозах следует применять фибринолитические препараты. В настоящее время под эгидой Совета медицинских исследований (Medical Research Council) проводится работа, результаты которой позволят ответить на эти вопросы.
Если в результате дренирования из межреберного доступа (с фибринолитиками или без них) не удается добиться адекватного отведения жидкости, если эмпиема сохраняется, организуется и сопровождается утолщением плевры и сдавлением легкого, то показано хирургическое вмешательство.
Торакоскопия обычно успешна на ранних стадиях заболевания, но при обширных плевральных спайках может окончиться неудачей. В этих случаях показана торакотомия и декортикация. Хотя такое хирургическое вмешательство высокоэффективно в отношении лечения эмпиемы (>90%), с ним связан существенный операционный риск, особенно у ослабленных больных.
Открытый дренаж, при котором требуется резекция ребра, — довольно малопривлекательная процедура, она проводится только в том случае, когда больной не может перенести более инвазивную операцию.
Без лечения эмпиема может прорваться наружу через грудную стенку («прободающая» эмпиема) или в бронхиальное дерево с образованием бронхоплеврального свища либо вызвать обширный плевральный фиброз, который ограничивает подвижность легких. К редким осложнениям относятся абсцесс головного мозга и амилоидоз, может также возникнуть деформация фаланг типа «барабанных палочек».
Поражение плевры при злокачественных новообразованиях
Рак легких — это наиболее частая причина возникновения злокачественного плеврального выпота, особенно у курильщиков. Лимфома может возникнуть в любом возрасте и составляет 10% от всех злокачественных выпотов. Метастазы в плевру наиболее часто встречаются при раках молочной железы (25%), яичников (5%) или желудочно-кишечного тракта (2%) (см. рис. 3). В 7% случаев первичная опухоль остается неизвестной.
Важно понимать, что при первичном бронхогенном раке наличие плеврального выпота не обязательно исключает операбельность. У 5% таких больных выпот развивается вследствие обструкции бронхов и дистальной инфекции, и заболевание остается потенциально излечимым.
Поэтому, когда встает вопрос о возможности проведения операции, чрезвычайно важно установить причину плеврального выпота.
Выпоты, обусловленные злокачественной инфильтрацией плевры, обычно быстро накапливаются вновь. Для того чтобы избежать необходимости проведения повторных плевральных пункций, выпот необходимо полностью («насухо») удалить при первичном дренировании через межреберную трубку, а плевральная полость должна быть облитерирована путем введения вызывающих воспаление препаратов, например талька, тетрациклина или блеомицина, при этом в конце концов развивается плевродез. В настоящее время наиболее эффективным средством в этом отношении считается тальк: при его применении успех достигается у 90% больных [17].
Однако эффективный плевродез приводит к значительному болевому синдрому в послеоперационном периоде, который часто требует применения сильных анальгетиков; рекомендуется при этом избегать нестероидных противовоспалительных препаратов, поскольку они снижают эффективность операции.
Непосредственная абразия плевры во время операции с плеврэктомией или без нее применяется у молодых пациентов с довольно длительным сроком выживания, у которых не удался химический плевродез.
При обширном, мучительном для больного плевральном выпоте и неэффективности химического плевродеза альтернативным методом является установка плевроперитонеального шунта по Denver. Удивительно то, что при такой операции не наблюдается обсеменения опухоли по брюшине, однако в реальную проблему могут вылиться развитие инфекции и окклюзия шунта.
Патология плевры, связанная с асбестом
В 2002 году в Великобритании смертность от мезотелиомы, согласно прогнозам, достигнет пика в 2020 году и составит 3000 [5].
В большинстве стран среди заболевших преобладают мужчины, что подтверждает ведущую роль профессионального фактора в развитии этого заболевания.
Возраст на момент контакта с асбестом, а также продолжительность и интенсивность этого контакта тоже имеют важное значение. Наибольшему риску подвергаются представители профессий, требующих непосредственного контакта с асбестом, особенно рабочие строительной индустрии, в то время как для людей, проживающих в зданиях, содержащих асбест, риск гораздо ниже.
Заболевание проявляется болями в груди и плевральным выпотом, который имеет кровянистую окраску и вызывает одышку. В Великобритании пациенты с этой болезнью имеют право на компенсацию, как и при других заболеваниях и увечьях, полученных на производстве (см. табл. 4).
Во всех случаях необходимо гистологическое исследование, в ходе которого используются либо материал, получаемый при аспирации плеврального содержимого и биопсии под контролем УЗИ (что позволяет подтвердить диагноз у 39% таких больных), либо ткань, взятая при торакоскопии (диагноз подтверждается у 98% пациентов) [6]. Торакоскопия также позволяет определить степень распространенности опухоли в плевральной полости, поскольку очень ограниченное заболевание на ранней стадии может быть излечено хирургическим путем, в то время как при поражении висцеральной плевры прогноз неблагоприятный.
После таких диагностических вмешательств часто наблюдается обсеменение опухоли по плевре, профилактика этого состояния предполагает облучение области биопсии или дренажа.
Большинство пациентов впервые поступают к врачу уже с неоперабельной опухолью. В такой ситуации ни один из методов не обеспечивает возможности излечения больного, однако сегодня проводятся попытки применения радикальной операции, фотодинамической терапии, внутриплевральной системной химиотерапии и лучевой терапии. И хотя генная терапия пока не приносит успеха, иммунотерапия может признана перспективной. Неблагоприятными диагностическими факторами являются: низкие функциональные резервы сердечно-сосудистой и дыхательной систем, лейкоцитоз, перерождение в саркому (по данным гистологического исследования) и мужской пол. В течение одного года выживают от 12 до 40% больных, в зависимости от перечисленных прогностических факторов.
Спонтанный пневмоторакс
Спонтанный пневмоторакс может быть первичным (без явного предшествующего заболевания легких) или вторичным (когда имеются признаки легочного заболевания, например легочного фиброза). К малораспространенным причинам пневмоторакса относятся: инфаркт легкого, рак легкого, ревматоидные узелки или абсцесс легкого с образованием полости. Субплевральные эмфизематозные буллы, обычно расположенные в области верхушек легкого, или плевральные буллы обнаруживаются у 48–79% больных с якобы спонтанным первичным пневмотораксом [18].
Среди курильщиков частота пневмоторакса гораздо выше. Относительный риск развития пневмоторакса в девять раз выше у женщин-курильщиц и в 22 раза — у курящих мужчин. Более того, выявлена зависимость «доза — эффект» между числом выкуренных за день сигарет и частотой пневмоторакса [19].
В диагностике небольших по объему, преимущественно верхушечных, пневмотораксов могут помочь снимки на выдохе, которые, однако, используются редко. Следует различать большие эмфизематозные буллы и пневмоторакс.
Алгоритм лечения представлен на рисунке 5. Чрескожная аспирация — это простая, хорошо переносимая, альтернативная по отношению к межреберному дренажу по трубке процедура, в большинстве случаев ей следует отдавать предпочтение. Аспирация позволяет достичь удовлетворительного расправления легкого у 70% больных с нормальной легочной функцией и только у 35% пациентов с хроническими заболеваниями легких [20].
Средняя частота рецидивов после единственного первичного спонтанного пневмоторакса, независимо от первичного лечения, составляет 30%, большинство их возникает в первые 6–24 месяцев.
Пациентов следует предупреждать о возможности развития повторных пневмотораксов: в частности, им не рекомендуется летать на самолетах в течение шести недель после полного разрешения пневмоторакса. Операция обычно требуется в тех случаях, когда в течение недели наблюдается упорное накопление воздуха.
Рецидивирующий пневмоторакс, особенно если поражены оба легких, следует лечить либо путем химического плевродеза или, что более предпочтительно, с помощью париетальной плеврэктомии либо плевральной абразии.
Последние из названных операций можно проводить с помощью торакоскопии под контролем видеоизображения, которая позволяет проследить за ходом процедуры с помощью монитора, сократить пребывание в стационаре и ускорить возвращение пациента к нормальному образу жизни. Хирургическое лечение позволяет уменьшить частоту рецидивов до 4% в сравнении с 8% после плевродеза тальком [22].
В представленной статье мы рассказали о нескольких аспектах, связанных с заболеваниями плевры, в том числе о последних достижениях в этой области. Плевральный выпот — это самое частое проявление патологии плевры, требующее тщательного обследования. Если после обычных методов исследования причина заболевания остается неясной, нужно предпринять все необходимые меры для исключения тромбоэмболии легочных артерий, туберкулеза, реакции на введение лекарств и поддиафрагмальных патологических процессов.
Хелен Парфри, бакалавр медицины, бакалавр химии, член Королевской коллегии врачей
Больница Западного Саффолка
Эдвин Р. Чайлверс, бакалавр медицины, бакалавр естественных наук, доктор философии, профессор
Кембриджский университет, Школа клинической медицины, отделение терапии больницы Адденбрука и Папворта