Что такое очаговая симптоматика
Что такое ишемический инсульт (инфаркт мозга)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Кричевцов В. Л., кинезиолога со стажем в 31 год.
Определение болезни. Причины заболевания
Инсульт — это собирательный термин, обозначающий несколько типов нарушения мозгового кровообращения: ишемический инсульт (он же инфаркт мозга), геморрагический инсульт (кровоизлияние в мозг), венозный инфаркт, субарахноидальное кровоизлияние (кровотечение в пространство между внутренним и средним слоем тканей, покрывающих головной мозг).
Первая помощь при инсульте
Помощь человеку с подозрением на инсульт необходимо оказать как можно скорее.
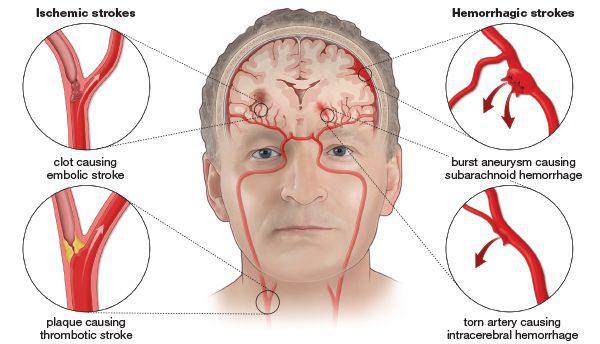
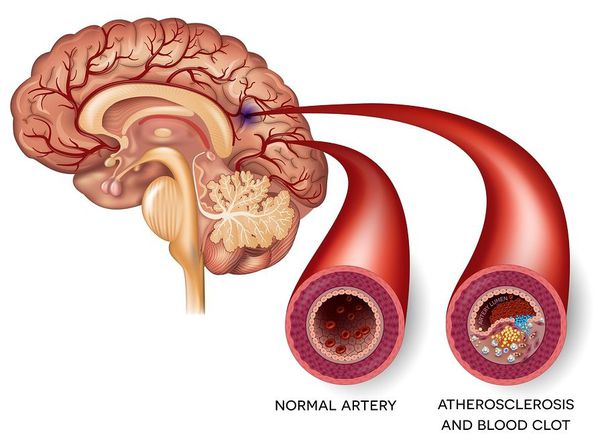
Ишемический инсульт — это отмирание участка ткани головного мозга в результате недостаточного снабжения головного мозга кровью и кислородом вследствие закупорки артерии.
Поражения сосудов головного мозга принято делить на две группы:
Далее в этой статье будет рассмотрена первая группа — ишемические инсульты.
Атеротромботический ишемический инсульт — этот инсульт возникает вследствии закупорки сосуда головного мозга тромбом.
Тромбоэмболический ишемический инсульт — развивается в случае закупорки сосуда тромбом из периферического источника. Тромб чаще образуется в сердце.
Причины инсульта
Причины возникновения ишемического инсульта:
Причины инсульта в молодом возрасте: диссекции артерий, коагулопатии на фоне, например, антифосфолипидного синдрома или приёма оральных контрацептивов, церебральные артерииты на фоне системных ревматических заболеваний или инфекционных процессов, тромбоэмболы от вегетаций на клапанах сердца у наркоманов с эндокардитом.
Симптомы ишемического инсульта
Инсульт всегда внезапен и скоротечен, к нему нельзя быть готовым. Очаговые (нарушения движения, чувствительности, речи, координации, зрения) и общемозговые (нарушение сознания, тошнота, рвота, головная боль), неврологические симптомы ишемического инсульта возникают неожиданно и мгновенно, длятся более суток, могут стать причиной смерти.
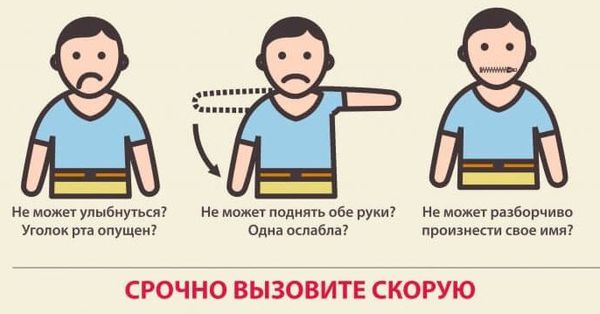
Как распознать инсульт у человека
Первые признаки инсульта:
При появлении любого из перечисленных признаков следует вызвать скорую помощь. С момента появления первых симптомов инсульта до введения препаратов должно пройти не более 4,5 часов, поэтому важна быстрая госпитализация.
Изменения глаз:
Также при инсульте могут наблюдаться и другие симптомы:
В тяжёлых случаях врачи отмечают такие признаки инсульта, как кратковременная потеря памяти и коматозное состояние.
По глубине неврологического дефекта и времени регрессирования неврологической симптоматики выделяют:
Клиническая картина инсульта зависит от пострадавшего сосуда и уровня развившейся закупорки.
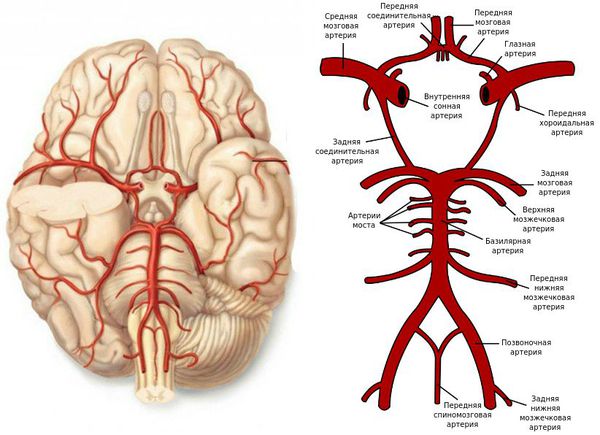
Поражение средней мозговой артерии (СМА)
Непроходимость СМА по причине эмболии или стеноза нарушает движение крови во всём регионе данной артерии и выражается:
Если непроходимы нижние ветви СМА, то развивается нарушение восприятия речи (афазия Вернике) с нарушением движений руки и мимических мышц нижней трети лица контрлатерально от поражённого полушария головного мозга.
Поражение передней мозговой артерии (ПМА)
Эмболия ПМА вызывает:
Иногда обе ПМА отходят от единого ствола, и если происходит его закупорка, то развиваются тяжёлые неврологические расстройства.
Бывают клинические случаи, когда непроходимость ПМА не проявляется неврологической симптоматикой, так как есть анастомоз (соединения артерий внутри черепа между собой и соединение внутренних и наружных артерий).
Поражение сонной артерии (СА)
Стенозирование СА и разрушение атеросклеротических бляшек становится причиной эмболов.
Иногда окклюзия СА не вызывает неврологическую симптоматику по причине компенсированного коллатерального кровообращения.
Если же очаговые неврологические нарушения возникли, то они являются следствием падения кровотока в бассейне СМА или её части.
Выраженный стеноз ВСА и дефицит коллатерального кровообращения поражают конечные отделы СМА, ПМ, а иногда и ЗМА.
Поражение задней мозговой артерии (ЗМА)
Причиной закупорки ЗМА может быть как эмболия, так и тромбоз. Чаще возникают неврологические симптомы:
Поражение артерий вертебро-базилярного бассейна (ВББ)
Причиной ухудшения кровотока в ВББ становится атеросклероз, тромбоз или эмболия.
Окклюзия ветвей основной (базилярной) артерии (БА) вызывает дисфункцию моста ствола мозга и мозжечка с одной стороны.
На стороне инсульта развивается атаксия, слабость мимических мышц лица, мышц глаза, нистагм (неконтролируемые колебательные движения глаз), головокружение, гиперкинез мягкого нёба, ощущение движения предметов в пространстве, а противоположно — слабость конечностей и гипестезия. При полушарном инсульте на своей стороне — парез взора, с противоположной — слабость конечностей, на стороне очага — слабость мимических мышц лица, мышц глаза, нистагм, головокружение, тошнота, рвота, потеря слуха или шум в ушах, гиперкинез мягкого нёба и ощущение движения предметов в пространстве.
Стенозирование и закупорка позвоночных артерий(ПА), проходящих в черепе, даёт неврологическую очаговую симптоматику, свойственную клинике дисфункции продолговатого мозга, в виде головокружения, дисфагии (расстройства глотания), сиплости голоса, симптома Горнера и падением чувствительности на своей стороне, а с противоположной стороны нарушена болевая и температурная чувствительность. Похожая симптоматика возникает и при поражении задненижней мозжечковой артерии (ЗМА).
Инфаркт мозжечка (ИМ)
Инфаркт мозжечка проявляется нистагмом ( неконтролируемыми колебательными движениями глаз ), нарушением координации движений, головокружением, тошнотой, рвотой.
Лакунарные инфаркты (ЛИ)
ЛИ в большинстве случаев возникают у людей, страдающих сахарным диабетом и гипертонической болезнью, по причине липогиалинозного поражения с закупоркой лентикулостриарных артерий головного мозга.
Закупорка таковых сосудов ведёт к формированию небольших глубинно расположенных ЛИ с последующим образованием кисты на этом месте.
Эмболия или атеросклеротическая бляшка может также перекрыть сосуд. Течение ЛИ может быть бессимптомным или проявляться собственным симптомокомплексом.
Инсульт спинного мозга
Состояние, при котором нарушается кровообращение спинного мозга, называют инсультом спинного мозга. Это заболевание редкое, также имеет геморрагическую и ишемическую разновидности. Предвестники инсульта:
Признаки комы
В некоторых случаях после болезни развивается кома, её симптомы:
Инсульт может привести к непоправимым последствиям, свидетельствовать о которых будут:
Патогенез ишемического инсульта
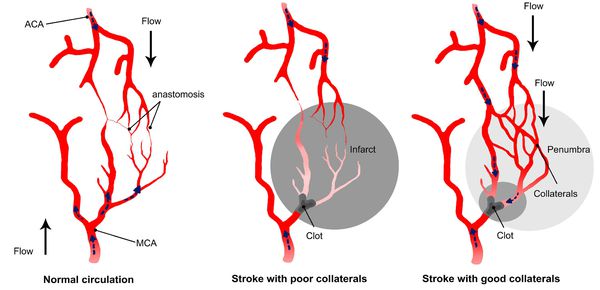
Главным фактором, определяющим последствия окклюзирующего процесса питающих мозг артерий, является не величина выключенной артерии и даже не её роль в кровоснабжении мозга, а состояние коллатерального кровообращения.
При хорошем его состоянии полная закупорка даже нескольких сосудов может протекать почти бессимптомно, а при плохом стеноз сосуда вызывает выраженные симптомы. [11]
Последовательность изменений ткани мозга после инсульта принято некоторыми авторами рассматривать как «ишемический каскад», который заключается в:
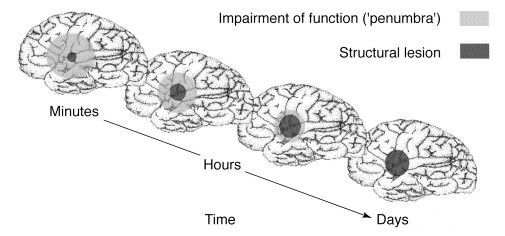
При локальной ишемии мозга происходит формирование зоны вокруг участка с необратимыми изменениями — «ишемической полутени» (пенумбра). Кровоснабжение в ней ниже уровня, который необходимим для нормального функционирования, но выше, чем критический порог необратимых изменений. Морфологические изменения в области пенумбры не наблюдаются. Гибель клеток приводит к расширению зоны инфаркта. Однако эти клетки на протяжении определённого времени способны сохранять свою жизнеспособность. Окончательно зона инфаркта формируется спустя 48-56 часов.
Классификация и стадии развития ишемического инсульта
Согласно МКБ-10 выделяют следующие виды ишемического инсульта (по причине):
По локализации инсульта выделяют:
По стороне поражения:
По характеру поражения:
Осложнения ишемического инсульта
Возникающие осложнения при инсульте определены тяжёлым состоянием больного и ограниченной его возможностью к самостоятельному обслуживанию и передвижению.
Возможные осложнениями ишемического инсульта:
Также необходимо следить за мочеиспусканием, вовремя катетеризировать мочевой пузырь. В случае запора назначают клизму.
При стабилизации общего состояния проводят пассивную гимнастику, общий массаж мышц. По мере стабилизации переходят к обучению больных сидению, самостоятельному стоянию, ходьбе и навыкам самообслуживания.
Диагностика ишемического инсульта
Анамнез и клиническая картина дают достаточно данных для постановки диагноза, но для дифференциального диагноза необходимы дополнительные исследования, так как правильно выставленный диагноз в случае инсульта — залог своевременной и квалифицированной помощи.
Важно на ранней стадии заболевания отличить ишемический инсульт от кровоизлияния, а также от кровоизлияния в область ишемического инсульта. Для достижения этих целей проводят компьютерную томографию (КТ).
Высокочувствительным методом диагностики ишемического инсульта в начале заболевания является магнитно-резонансная томография (МРТ), но, по сравнению с КТ, она менее чувствительна к острым состояниям, особенно если есть кровоизлияние. С помощью МРТ можно увидеть артерии головного мозга, не используя контраст, что значительно безопасней, чем контрастная ангиография.
КТ в остром периоде (до суток) ишемического инсульта менее чувствительна, так как с её помощью в этом периоде невозможно оценить ишемический инсульт, его часто просто не видно. КТ при поступлении пациента в стационар проводят с целью исключения геморрагического инсульта и проведения тромболитической терапии. А вот с помощью МРТ можно распознать как ишемический, так и геморрагический инсульты на любых сроках.
Спинномозговая пункция может дать диагностическую информацию, если нет аппаратов МРТ или КТ. Субарахноидальные кровоизлияния и внутримозговые кровоизлияния могут дать кровь в спинномозговой жидкости (СМЖ). Однако она не всегда попадает в СМЖ. Например, при небольших паренхиматозных или геморрагических кровоизлияниях кровь появится в СМЖ через двое-трое суток. Иногда при спинномозговой пункции в ликвор попадает сопутствующая кровь, поэтому при сомнении следует набрать ликвор в несколько пробирок. При лабораторном анализе выявится уменьшение эритроцитов в каждой последующей пробирке.
При планировании операции используют церебральную ангиографию. Это надёжный и хорошо апробированный метод, особенно если используется доступ через плечевую или бедренную артерии.
Позитронно-эмиссионная томография позволяет увидеть инсульт до КТ по мозговому метаболизму, но метод малодоступен.
Чреспищеводная ЭхоКГ (исследование сосудов и сердца посредством ввода специального датчика в пищевод) обнаруживает источник эмболии в крупном сосуде: изъязвленную бляшку, пристеночный тромб.
Мерцательная аритмия с пароксизмами может спровоцировать эмболию, но не проявляться клинически — выявляется холтеровским мониторингом ЭКГ.
Лечение ишемического инсульта
Общие мероприятия
При лечении ишемического инсульта принято не снижать артериальное давление быстро, если оно высокое, особенно в первые дни заболевания. Низкое артериальное давление следует повысить — этим занимаются врачи, не давайте самостоятельно пациенту никаких лекарств.
Несдерживаемая сильная рвота — частая проблема в периоде сразу после инсульта, особенно при поражении в бассейне основной артерии. Это создаёт проблемы в питании больного. Если рвота не прекращается, или есть дисфагия, то ставят зонд для питания. Нехватку электролитов восполняют инфузионной терапией. Следует внимательно отслеживать проходимость дыхательных путей.
Тромболитическая терапия
Тромболитическая терапия — это единственная терапия ишемического инсульта в о стром периоде, эффективность которой доказана в крупных исследованиях.
С момента появления первых симптомов инсульта до введения тромболитика должно пройти не более 4,5 часов, поэтому важна быстрая госпитализация.
Окклюзия сосудов происходит в артериальном или венозном русле. Тромботические лекарства растворяют тромб, но препарат необходимо доставить в зону тромбоза.
Тромболитические средства впервые появились в 40-х годах XX века. Активная разработка лекарств этой группы привела к тому, что в настоящее время выделяют пять поколений тромболитиков:
В фазе восстановления, когда состояние больного практически всегда в той или иной степени улучшается, важное значение имеет логопедическая помощь, а также трудотерапия и ЛФК.
Инфузионная терапия
Антикоагулянты
Лечение антикоагулянтами может быть начато только после исключения внутримозгового кровотечения.
Прямые коагулянты: гепарин и его производные, прямые ингибиторы тромбина, а также селективные ингибиторы фактора Х (Фактор Стюарта — Прауэра — одного из факторов свёртывания крови).
Непрямые антикоагулянты:
Антиагреганты
Антиагреганты не позволяют тромбоцитам склеиваться, тем самым препятствуют формированию тромбов.
Классификация антиагрегантов по механизму действия:
Аспирин — часто используемый препарат из этой группы. Если антикоагулянты противопоказаны, то можно использовать антиагреганты.
Хирургическое лечение
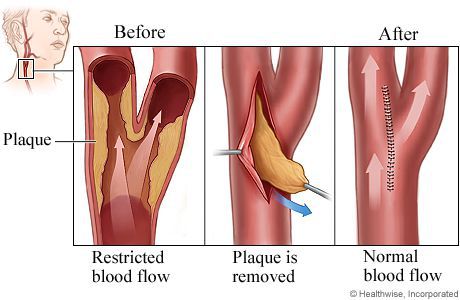
Каротидная эндартерэктомия — это профилактическая хирургическая операция, которая проводится с целью удаления атеросклеротических бляшек из arteria carotis communis (общей сонной артерии).
При развитии мозжечкового инсульта со сдавлением ствола мозга с целью сохранить жизнь больного выполняют хирургическую операцию для снятия внутричерепного давления в задней черепной ямке.
Противоотёчная терапия
По поводу применения кортикостероидов при ишемическом инсульте существуют разные и достаточно противоположные мнения, но всё же они активно пользуются врачами для уменьшения отёка мозга: назначают дексаметазон 10 мг внутривенно струйно или внутримышечно, затем по 4 мг внутривенно или внутримышечно каждые 4-6 часов.
Осмотические средства. Маннитол — повышает осмолярность плазмы, тем самым жидкость из тканей, в том числе и из головного мозга, перемещается в кровяное русло, создаётся выраженный мочегонный эффект, и из организма выводится большое количество жидкости. Отмена может дать рикошетный эффект.
Противосудорожные средства
Их необходимо назначать при развитии ишемического инсульта с эпилептическими припадками.
Реабилитация после инсульта
Реабилитационные мероприятия начинают уже в раннем периоде заболевания и продолжают после выписки из стационара. Они включают в себя не только проведение медикаментозного лечения, массажа, лечебной физкультуры, логопедических занятий, но и требуют привлечения других специалистов по психологической, социальной и трудовой реабилитации.
Наряду с восстановлением нарушенных функций, реабилитация включает:
Основные принципы реабилитации после инсульта:
Длительность реабилитации определяется сроками восстановления нарушенных функций. Восстановление двигательных функций происходит в основном в первые 6 месяцев после инсульта. В этот период проведение интенсивной двигательной реабилитации наиболее эффективно. Восстановительное лечение больных с афазией должно быть более длительным и проводиться в течение первых 2-3 лет после инсульта.
Комплексность реабилитации состоит в использовании не одного, а нескольких методов, направленных на преодоление дефекта.
При двигательных нарушениях комплекс реабилитации включает:
При речевых нарушениях основным являются регулярные занятия со специалистом по восстановлению речи, чтения и письма (логопедом-афазиологом или нейропсихологом).
Наиболее оптимальна следующая модель этапной реабилитации после инсульта:
1-й этап — реабилитация начинается в ангионеврологическом (или в обычном неврологическом отделении клинической больницы), куда больной доставляется машиной скорой помощи;
2-й этап — по окончании острого периода (первые 3-4 недели) возможны следующие варианты направления больных:
3-й этап — амбулаторная реабилитация: реабилитация в специальных реабилитационных санаториях и на дому.
Амбулаторную реабилитацию осуществляют на базе реабилитационных отделений поликлиник или восстановительных кабинетов или в форме «дневного стационара» при реабилитационных отделениях больниц и реабилитационных центрах. В реабилитационных санаториях могут находиться больные, полностью себя обслуживающие и самостоятельно передвигающиеся не только в помещении, но и вне его. Тем больным, которые не могут самостоятельно добраться до поликлиники или дневного стационара, реабилитационную помощь (занятия с методистом лечебной физкультуры и занятия по восстановлению речи) оказывают на дому, обязательно обучая родственников.
Противопоказания и ограничения к проведению активной реабилитации
Следующие сопутствующие заболевания ограничивают или препятствуют проведению активной двигательной реабилитации:
Психозы, выраженные когнитивные нарушения (деменция) являются ограничением для проведения не только двигательной, но и речевой реабилитации.
Существуют ограничения для восстановительного лечения в обычных реабилитационных центрах: крайне ограниченная подвижность больных (отсутствие самостоятельного передвижения и самообслуживания), нарушение контроля функций тазовых органов, нарушение глотания. Реабилитацию таким больным, а также пациентам с выраженными сердечной и лёгочной патологиями проводят в реабилитационных отделениях, расположенных на базе крупных клинических многопрофильных больниц, по специальным реабилитационным программам.
Прогноз. Профилактика
Прогноз для жизни больного зависит от:
Профилактика. Принято считать, что здоровый образ жизни, нормированный труд и своевременный отдых значительно снижают риск заболевания ишемическим инсультом.
К факторам, провоцирующим инсульт, относят гипертоническую болезнь, курение табака, атеросклероз, сахарный диабет, кардиальную патологию, боле зни свёртывающей системы крови, системные заболевания соединительной ткани.
Своевременно начатая реабилитация, снижает риск инвалидизации и значительно улучшает качество жизни.
Что такое очаговая симптоматика
Нейросаркоидоз, гранулематоз с полиангиитом (гранулематоз Вегенера)
Наследственная оптическая нейропатия Лебера
Как правило, многоочаговое поражение ЦНС обнаруживают при нейровизуализации у симптомного пациента, хотя случайные находки при проведении МРТ головного мозга также распространены в общей популяции и чаще всего представляют собой цереброваскулярную патологию (болезнь малых сосудов), инфаркты головного мозга, аневризмы и первичные доброкачественные опухоли [2]. При отсутствии ургентности, т.е. острого и/или нарастающего неврологического дефицита и общемозговой симптоматики, МРТ головного мозга предпочтительнее КТ [3, 4]. Это справедливо как для опухолей головного мозга, так и для демиелинизирующих заболеваний, типичная МР-картина которых является одним из критериев постановки диагноза [5, 6].
Впервые выполненная нейровизуализация у симптомного пациента позволяет оценить информацию о локализации, размерах, структуре очаговых изменений, взаимоотношении их с важными анатомическими областями головного мозга, магистральными сосудами. МР-семиотика поражений ЦНС весьма вариабельна и позволяет как различать опухолевые и неопухолевые процессы, так и предположить тот или иной гистологический диагноз. Известно, что различные заболевания ЦНС, сопровождающиеся очаговым поражением головного мозга, имеют характерные нейровизуализационные критерии, которые наиболее проработаны для демиелинизирующих и наследственных заболеваний. В то же время практически не существует патогномоничных признаков, позволяющих различать очаги в головном мозге только на основании МР-картины.
Что касается лабораторной диагностики, то большинство очаговых поражений головного мозга не сопровождается изменениями в периферической крови. Важным исключением являются антитела к аквапорину 4 (anti-AQP4), которые представляют собой специфические биомаркеры заболеваний спектра оптикомиелита. В случае других демиелинизирующих заболеваний ЦНС такие маркеры еще не найдены. Следует отдельно отметить синдром anti-MOG, который проявляется различными видами демиелинизации (острый рассеянный энцефаломие-лит, двусторонний неврит зрительного нерва, поперечный миелит) и который следует подозревать у пациентов с клинической картиной оптического неврита и/или миелита и отрицательным результатом анализа на наличие антител к аквапорину [7].
Важное место в постановке диагноза занимает определение типа синтеза иммуноглобулинов в цереброспинальной жидкости (ЦСЖ) и крови. Известно 5 типов синтеза, что позволяет различать воспалительные заболевания (1-й тип синтеза), рассеянный склероз (2-й тип синтеза), системные аутоиммунные заболевания с поражением ЦНС (3-й тип синтеза), вирусные поражения ЦНС (4-й тип синтеза), парапротеинемии при гемобластозах (5-й тип синтеза).
В дополнение к стандартным методам нейровизуализации по показаниям выполняют дополнительные методы нейровизуализации. При подозрении на первичный васкулит ЦНС (первичный, изолированный, ангиит ЦНС) требуется выполнение КТ-ангиографии как наиболее специфичного метода нейровизуализации для диагностики данной патологии [8]. По сравнению с МР-ангиографией она позволяет определить патологические изменения в мелких сосудах. Типичные ангиографические проявления при первичном васкулите ЦНС включают множественные изменения по типу бус или сегментарные расширения и сужения крупных, средних или мелких сосудов. Чувствительность КТ-ангиографии для выявления патологических изменений при первичном васкулите ЦНС варьирует от 20 до 90%, специфичность — от 20 до 60% [9]. Анализ ЦСЖ является патологическим примерно в 90% случаев у пациентов с гистологически доказанным васкулитом и обычно характеризуется повышенным содержанием белка и умеренным лимфоцитарным плеоцитозом [8]. Биопсия головного мозга — единственный способ подтвердить первичный васкулит ЦНС, однако при подозрении на него в большинстве случаев по результатам биопсии устанавливается альтернативный диагноз.
ПЭТ-КТ является сочетанным диагностическим методом, позволяющим не только проводить визуализацию органов, но и определять тканевый метаболизм различных веществ. ПЭТ-КТ головного мозга применяют для ранней и дифференциальной диагностики деменций, объемных образований, эпилепсии, экстрапирамидных заболеваний [10, 11]. Обязательной является оценка изменений вещества головного мозга методами КТ или МРТ до проведения ПЭТ-КТ [10].
К наиболее распространенным в клинической практике радиофармпрепаратам (РФП) относят 18 F-фтордез оксиглюкозу (ФДГ) и 11 С-метионин [10]. Выбор РФП зависит от цели проведения ПЭТ-КТ. Следует отметить, что ПЭТ-КТ головного мозга с ФДГ часто дает ложноотрицательные результаты в связи с высоким физиологическим поглощением РФП, что может маскировать поражения головного мозга [10, 12]. К заболеваниям с высоким уровнем поглощения РФП относят глиомы, первичные лимфомы ЦНС (ПЛЦНС), а также атипичные варианты демиелинизации, при этом степень поглощения РФП новообразованиями существенно выше, чем у очагов демиелинизации. Классические очаги демиелинизации имеют низкий уровень поглощения РФП [13]. Применение ПЭТ-КТ для оценки очаговых изменений головного мозга помогает выделить очаги с максимальной метаболической активностью для последующей стереотаксической биопсии (СТБ) [10]. Результаты ПЭТ-КТ при неопухолевых многоочаговых изменениях головного мозга менее специфичны и отражают морфофункциональное состояние патологических очагов. Накопление РФП по ПЭТ-КТ при таких заболеваниях, как саркоидоз, абсцесс головного мозга, прогрессирующая мультифокальная лейкоэнцефалопатия и туберкулез, является частой причиной ложноположительных результатов [10]. Современные данные не подтверждают высокую диагностическую ценность применения одного ПЭТ-КТ для диагностики воспалительных заболеваний. Что касается метастазов головного мозга, то ПЭТ-КТ с ФДГ не является чувствительным методом, а «золотым стандартом» в обычной практике остается МРТ с контрастным усилением [14].
Состояния, вызывающие очаговое и многоочаговое поражение головного мозга
1. Коллагенозы, включая системную красную волчанку и нейросаркоидоз. Эти заболевания могут дебютировать в молодом возрасте с поражения ЦНС. Другие маркеры системного воспаления, такие как антиядерные антитела, двухцепочечные ДНК-антитела, повышенная активность ангиотензинпревращающего фермента и наличие антифосфолипидных антител, помогают диагностировать данные системные заболевания.
2. Ряд невоспалительных заболеваний, способных поражать белое вещество головного мозга. К наиболее частым из них относят злокачественные новообразования, митохондриальные заболевания и некоторые лейкодистрофии.
Митохондриальное заболевание может проявляться остро в условиях интеркуррентной инфекции. Типичные признаки МРТ головного мозга включают повышенный сигнал Т2 в области базальных ганглиев, преобладание симметричного поражения теменно-затылочной области. К другим особенностям митохондриальных заболеваний относят повышение уровня лактата в сыворотке крови и ЦСЖ.
Лейкодистрофии — гетерогенная группа наследственных заболеваний с крайне вариабельной клинической картиной. Существует около 20 вариантов лейкодистрофий со взрослым началом. К наиболее распространенным из них относят метахроматическую лейкодистрофию, Х-сцепленную адренолейкодистрофию, болезнь Александера, болезнь Краббе. Наследственные лейкодистрофии в ряде случаев бывает сложно отличить от приобретенных поражений белого вещества головного мозга, главным образом, от воспалительных демиелинизирующих заболеваний ЦНС [15, 16]. Основной особенностью лейкодистрофий обычно является симметричность поражения белого вещества головного мозга.
3. Первичные опухоли мозга. Это гетерогенная группа опухолей, развивающихся из клеток, присутствующих в ЦНС. До 75% первичных злокачественных опухолей головного мозга у взрослых представлено глиомами [17].
ПЛЦНС — редкая экстранодальная форма неходжкинской лимфомы, локализованная в головном мозге, оболочках головного мозга, глазах, спинном мозге без признаков системного поражения во время постановки диагноза. На ПЛЦНС приходится 2—4% всех интракраниальных образований и 4—6% всех экстранодальных лимфом. Около 90% ПЛЦНС представляют собой диффузные В-крупноклеточные лимфомы. Иммунодефицит (врожденный или приобретенный) ассоциирован с повышенным риском развития ПЛЦНC [18].
Распространенность метастазов в головном мозге примерно в 10 раз превышает таковую у первичных опухолей ЦНС. Примерно в 30% случаев у пациентов с онкологическими заболеваниями происходит метастазирование в ЦНС [17]. При подозрении на паранеопластический или метастатический характер поражения выполняют онкопоиск: КТ органов грудной клетки, брюшной полости, малого таза, эзофагогастродуоденоскопию, колоноскопию.
Следует отметить, что особую проблему представляет дифференциальная диагностика между злокачественными новообразованиями головного мозга и псевдотуморозными вариантами демиелинизирующих заболеваний [19, 20]. Большие области демиелинизации белого вещества головного мозга должны вызывать настороженность в отношении возможных лимфом или глиом ЦНС.
Диагностика многоочагового поражения ЦНС при подозрении на опухолевое поражение
При подозрении на первичную опухоль или метастатическое поражение ЦНС стандартом диагностического обследования является выполнение МРТ головного мозга с контрастным усилением в режимах Т1, Т2, Т2 FLAIR, либо в трех проекциях, либо тонкими срезами в аксиальной проекции (в режиме SPGR) [21].
Нейровизуализационные признаки лимфом ЦНС
ПЛЦНС обычно представляет собой единичную паренхиматозную массу. Множественные поражения регистрируют у 20—40% пациентов с ПЛЦНС без признаков иммунодефицита. Данный характер поражения отличается от вторичного поражения ЦНС лимфомами, для которых в 2 /3 случаев характерно лептоменингеальное распространение и только в 1 /3 случаев — паренхиматозные очаги [20].
Кровоизлияния и внутренняя кальцификация опухоли тоже являются атипичными признаками и встречаются довольно редко, чаще у пациентов с иммунодефицитом, а также получавших цитостатическую или радиотерапию [23].
ПЛЦНС в типичных случаях имеют характерные черты при нейровизуализации, отражающие гиперцеллюлярность и высокое ядерно-цитоплазматическое отношение данных опухолей. Для них свойственна изоинтенсивность по отношению к серому веществу в режимах T1 и T2 для большинства поражений (около 70%). Интенсивное гомогенное накопление контраста характерно для лимфом, в то же время кольцевидное накопление контраста характерно для пациентов, страдающих иммунодефицитом [18, 23]. В отличие от глиобластом для лимфом не показателен грубый некроз [20]. Отек является типичной характеристикой очагов ПЛЦНС, а его выраженность варьирует от умеренного до тяжелого. Обычно отек при ПЛЦНС выражен меньше, чем при злокачественных глиомах или метастазах [3].
К атипичным нейровизуализационным проявлениям ПЛЦНС относят лимфоматоз головного мозга — редкий вариант ПЛЦНС, для которого характерна диффузная инфильтрация вещества головного мозга без образования опухолевых масс, что радиологически проявляется в виде гиперинтенсивности белого вещества на Т2ВИ без накопления контраста [24, 25].
При невозможности определить характер поражения ЦНС по данным нейровизуализации и лабораторным показателям, а также при необходимости гистологического подтверждения новообразования необходимо проведение СТБ [26]. Следует отметить, что при подозрении на злокачественные новообразования биопсию не следует откладывать ввиду необходимости как можно более раннего начала специфической терапии. СТБ является общепринятой процедурой для диагностики внутричерепных поражений, к преимуществам которой относят малую инвазивность в сравнении с открытыми операциями и соответственно низкий риск осложнений, а также высокую диагностическую информативность [26]. По данным различных исследований, СТБ головного мозга дает положительные результаты в 40—99% случаев и обеспечивает точное нацеливание на любой поврежденный участок головного мозга с точностью в диапазоне от 1,2 до 2,8 мм [27]. Кроме того, этот метод применим у пациентов, которые не смогут перенести открытую операцию на головном мозге в связи с соматической отягощенностью. Тем не менее, и СТБ имеет противопоказания, среди которых следует отметить выраженный неврологический дефицит (гемиплегия, афатические расстройства), признаки повышенного внутричерепного давления, дислокации структур головного мозга, а также нарушения свертываемости крови [27].
Существуют протоколы, позволяющие увеличить диагностическую ценность данного метода. В частности, рекомендуется нацеливание по меньшей мере на две разные точки по двум различным траекториям и забор по меньшей мере шести образцов из каждой точки, что также не вызывает большего числа осложнений [27].
Тем не менее в ряде случаев результаты СТБ остаются отрицательными. К факторам, повышающим риск неудачной СТБ, относят небольшой размер пораженного участка, его глубинное расположение в веществе мозга, не-неопластический характер поражения, наличие некроза и низкую дифференцированность опухоли, а также низкое накопление контраста по нейровизуализации [27, 28].
В настоящее время не существует алгоритмов дальнейшей диагностической тактики в случае неинформативной СТБ, однако в литературе имеются данные о необходимости повторной биопсии у всех пациентов с подозрением на онкологическую или инфекционную природу заболевания [28]. В случае отказа от проведения повторной СТБ или невозможности ее проведения рекомендованы повторная оценка полученного гистологического материала в сторонней лаборатории, а также наблюдение в динамике. Осложнения СТБ головного мозга встречаются нечасто и обычно включают в себя геморрагические осложнения, инфекции и абсцессы в месте биопсии [26, 29].
Клинический случай
Пациентка М., 39 лет. С декабря 2017 г. беспокоили диффузные головные боли и нечеткость зрения, по поводу которых наблюдалась у офтальмолога с диагнозом «спазм аккомодации». При проведении скрининговой МРТ головного мозга патологии выявлено не было. В июле 2018 г. возникли выраженная головная боль, головокружение, нарушение зрения справа, двоение в глазах, общая слабость, затруднения при формулировке мыслей. По данным МСКТ головного мозга было выявлено объемное образование левой гемисферы с перифокальным отеком. Ввиду вышеуказанной симптоматики и результатов нейровизуализации пациентка в экстренном порядке была госпитализирована в отделение неврологии ФМБЦ им. А.И. Бурназяна для дообследования и лечения.
При осмотре больная была ажитирована, плаксива, с трудом подбирала слова. В неврологическом статусе были выявлены правосторонняя гомонимная гемианопсия, легкая неустойчивость в пробе Ромберга без четкой латерализации.
По данным МРТ с контрастным усилением, выполненной при поступлении в отделение неврологии (рис. 1), в левой гемисфере большого мозга супратенториально и интрааксиально визуализировался патологический МР-сигнал (DWI, FLAIR, Т2) измененного миелина, неоднородно повышенный от валика мозолистого тела (с признаками рестрикции), смежных отделов лимбической доли (ленточной, частично поясной извилин), перивентрикулярного и субкортикального белого вещества задневисочно-затылочно-теменной области; активное накопление контрастного препарата перивентрикулярным белым веществом и смежными отделами валика мозолистого тела; слабо выраженная дислокация срединных структур слева направо. Согласно заключению, объемное поражение левой задневисочно-теменной области могло соответствовать псевдотуморозной унилатеральной воспалительной демиелинизации, опухолевым изменениям (глиома низкой степени злокачественности, лимфома), токсоплазмозу.
Рис. 1. МРТ головного мозга, выполненная при поступлении в стационар.
1, 2, 3 — в последовательности Т2ВИ определяется перивентрикулярная неоднородная зона, полуциркулярно охватывающая задний рог левого бокового желудочка, с размерами 4,7×3,1 см в поперечнике, выраженным перифокальным отеком, умеренной компрессией задних отделов левого бокового желудочка и небольшим передним смещением; 4, 5 — в режиме FLAIR определяются изменения в левой гемисфере большого мозга, супратенториально, интрааксиально определяется патологический МР сигнал, неоднородно повышенный от валика мозолистого тела (с признаками рестрикции) и смежных отделов лимбической доли (ленточной, частично поясной извилин), перивентрикулярного и субкортикального белого вещества задневисочно-затылочно-теменной области; 6 — при внутривенном контрастном усилении визуализируется активное накопление контрастного препарата перивентрикулярным белым веществом и смежными отделами валика мозолистого тела.
По результатам проведенного обследования признаков системных и инфекционных заболеваний обнаружено не было. В ЦСЖ отмечено повышение белка до 0,55 г/л при нормальных значениях других показателей.
В связи с подозрением на злокачественное образование ЦНС, невозможностью достоверной верификации опухоли мозга по данным неинвазивных обследований 11.08.18 была проведена СТБ очага левой задневисочно-теменной области. По данным гистологического исследования, в полученных биоптатах были выявлены фрагменты ткани головного мозга с сохраненной структурой строения, очаговые периваскулярные инфильтраты из малых лимфоцитов с примесью плазматических клеток, небольшие по размеру очаговые внутримозговые инфильтраты. Согласно заключению, в биоптатах головного мозга злокачественного опухолевого роста, в том числе признаков лимфопролиферативного заболевания, не обнаружено; морфологические признаки энцефалита; клинически необходимо дифференцировать демиелинизирующие заболевания и энцефалит.
Пациентке была проведена пульс-терапия солумедролом 1000 мг, 5 курсов с положительной динамикой в виде уменьшения выраженности речевых и зрительных нарушений, положительная динамика также отмечена по данным МРТ головного мозга (рис. 2). 02.09.18 получены результаты анализа типа синтеза иммуноглобулинов в крови и ЦСЖ — 1-й тип синтеза, что соответствует воспалительному процессу. 03.09.18 пациентка была выписана из стационара с рекомендациями динамического наблюдения.
Рис. 2. МРТ головного мозга от 27.08.18.
1—4 — по сравнению с предыдущим исследованием отмечается значительная положительная динамика в виде уменьшения перифокального отека, уменьшения дислокации срединных структур в 2 раза (ранее 11 мм, при настоящем исследовании 5 мм); 5, 6 — ограничение диффузии в задних отделах левой гемисферы.
12.09.18 остро возникло ухудшение состояния в виде нарастания речевых нарушений, расширения границ выпадения правого поля зрения, невозможности сфокусировать зрение. В неврологическом статусе отмечено нарастание когнитивных и аффективных расстройств со снижением критики к своему состоянию, сохранялась правосторонняя гемианопсия, появились оживление сухожильных рефлексов с ног, клонусы левой стопы. 13.09.18 повторно была проведена МРТ головного мозга с контрастным усилением, данные которой показали отрицательную динамику по сравнению с предыдущим исследованием, а МР-признаки образования соответствовали множественной лимфоме головного мозга. 14.09.18 пациентка была повторно госпитализирована в отделение неврологии ФМБЦ, заочно консультирована специалистами НМИЦ нейрохирургии им Н.Н. Бурденко, которые рекомендовали повторное проведение СТБ для верификации лимфомы.
С целью выделения очагов образования с наиболее высокой метаболической активностью для повышения диагностической ценности последующей СТБ 17.09.18 была проведена ПЭТ-КТ головного мозга, согласно которой выявленные множественные очаги повышенного патологического накопления РФП супра- и инфратенториально были расценены как многоочаговое поражение головного мозга с высокой метаболической активностью 11 С-метионина. Учитывая недостаточную информативность проведенной ранее СТБ, 18.09.18 была проведена открытая биопсия.
По результатам гистологического исследования биоптата (19.09.18) в материале была выявлена ткань мозга с фокусами некроза, периваскулярным лимфоидным инфильтратом с соотношением CD20/CD3=1/1, невыраженной пролиферацией и реактивными изменениями глиальных клеток, отсутствовали признаки гранулематозного воспаления и опухолевого поражения. Полученный гистологический материал был отправлен для повторного исследования в две сторонние лаборатории. При повторном гистологическом исследовании в НМИЦ нейрохирургии им. акад. Н.Н. Бурденко в материале были выявлены фрагменты мозговой ткани с периваскулярной лимфоидной инфильтрацией и глиальной ткани со скоплениями лимфоидных клеток. Согласно заключению, указанные изменения могут встречаться при воспалительном и (менее вероятно из-за наличия плазматических клеток) при демиелинизирующем процессах; кроме того, подобная морфологическая картина характерна или для перитуморозной зоны, или для опухолевой ткани лимфомы после проведенного лечения, несмотря на то что убедительных данных об опухолевой патологии в представленном на исследование материале не выявлено. Было рекомендовано проведение очередной (третьей по счету) биопсии головного мозга. Альтернативное мнение было получено в НИИ детской гематологии им. Д. Рогачева, согласно которому убедительных морфологических признаков неопластического процесса и демиелинизирующего заболевания обнаружено не было. Иммуногистохимическое исследование полученных образцов выявило морфологическую картину, соответствующую продуктивному воспалению, в связи с чем было рекомендовано в первую очередь исключить вирусное поражение.
С учетом данных иммуногистохимии в качестве наиболее вероятных причин многоочагового поражения головного мозга пациентки стали рассматриваться энцефалит (вирусный, аутоиммунный) и злокачественное течение демиелинизирующего заболевания.
Учитывая положительный эффект проведенной при первой госпитализации пульс-терапии, был проведен повторный курс с положительной, но кратковременной клинико-нейровизуализационной динамикой. По данным МРТ головного мозга с контрастным усилением от 02.10.18, выявленные изменения (с учетом положительной динамики процесса от предыдущего исследования от 13.09.18) могут соответствовать демиелинизации, однако полностью исключить лимфому нельзя.
В качестве эмпирической терапии по поводу возможного вирусного поражения ЦНС с 12.10.18 пациентка получала терапию ацикловиром и внутривенными иммуноглобулинами (иммуновенин внутривенно капельно 1,25 мг (50 мл) — 45 флаконов на курс). Данные МРТ головного мозга с контрастным усилением от 16.10.18: отрицательная динамика по сравнению с предыдущим исследованием; в дифференциальном ряду рассматриваются демиелинизирующее заболевание, лимфома, инфекционная (паразитарная) природа выявленных изменений. Было принято решение о проведении КТ-перфузии головного мозга (рис. 3, рис. 4 см. на цв. вклейке), была выбрана зона интереса на уровне затылочных рогов боковых желудочков. Заключение: очаговое образование перивентрикулярно справа, а также образование в виде перивентрикулярной инфильтрации слева демонстрируют значительное увеличение объема и скорости кровотока. При сравнении с белым веществом лобных долей повышены показатели CBV (Cerebral Blood Volume — объем перфузии) более чем в 7 раз, CBF (Cerebral Blood Flow — скорость перфузии) более чем в 2 раза, MTT (Mean Transit Time — время транзита) более чем в 2 раза. В различных отделах больших полушарий головного мозга выявлены несколько образований, которые накапливают контрастный препарат до 60HU; очаговые образования в больших полушариях, отрицательная динамика очага в левой теменной доле. Повышение перфузии в исследованных очагах не позволяет исключить их опухолевый характер.
Рис. 3. КТ головного мозга (10.10.18).
1, 2 — мультипланарные реконструкции. Выделен раневой канал после биопсии, который распространяется на всю толщу образования в левой затылочной доле; 3 — аксиальная проекция. В парасагиттальных отделах затылочных долей определяются васкуляризованные образования.
Рис.4.КТ-перфузия головного мозга (24.10.18).
Признаки гиперперфузии парасагиттальных образований в затылочных долях.
В связи со сложностями в дальнейшей тактике лечения пациентка дополнительно проконсультирована различными специалистами.
Гематолог (16.10.18): учитывая отсутствие данных, свидетельствующих о лимфопролиферативном заболевании по результатам двух биопсий головного мозга в двух независимых лабораториях, судить о наличии гемобластоза невозможно. На фоне проведенных двух линий терапии (глюкокортикостероиды — ГКС, высокие дозы иммуноглобулина) отмечено клиническое ухудшение состояния пациентки. Ввиду невозможности установления диагноза необходимо рассмотреть вопрос о целесообразности выполнения повторной биопсии головного мозга.
Инфекционист (17.10.18): учитывая длительность заболевания, постепенное развитие неврологических симптомов, отсутствие интоксикационного синдрома, головных болей, временную положительную динамику на пульс-терапию, отсутствие воспалительных изменений в анализах крови и ЦСЖ, инфекционный генез заболевания маловероятен.
Результаты исследований на возбудителей нейроинфекций (17—22.10.18) (Mycobacterium tuberculosis complex, ДНК к вирусу Эпштейна—Барр, цитомегаловируса, вируса герпеса 6-го типа, вируса простого герпеса 1-го и 2-го типов, ДНК Candida albicans, Candida glabrata, Candida krusei, Candida parapsilosis/tropicans, ДНК Varicella Zoster virus, ДНК Toxoplasma gondii, ДНК Cryptococcus neoformans, ДНК JC-вируса), а также антитела к NMDA-рецептору отрицательные.
На фоне проводимой терапии состояние пациентки продолжало ухудшаться как клинически в виде постепенного нарастания очагового неврологического дефицита (появление и усугубление левостороннего гемипареза, нарастание когнитивных и аффективных нарушений), так и по данным нейровизуализации.
Рис. 5. МРТ головного мозга от 20.11.18.
По сравнению с предыдущим исследованием отмечается увеличение зоны отека в области ствола мозга с переходом на правую среднюю ножку и полушарие мозжечка, а также увеличение отека в перивентрикулярных отделах, подкорковых структурах и лучистом венце правого полушария. При контрастировании отмечается увеличение всех ранее описываемых очагов.
14.01.19 по данным аутопсии посмертно был установлен диагноз: ПЛЦНС с мультицентрическим характером поражения с локализацией в белом веществе обеих затылочных долей, лобно-теменных областях, правом полушарии и ножках мозжечка, стволе головного мозга (МКБ-10 С71.8).
Обсуждение
По нашему мнению, приведенный клинический случай демонстрирует трудности, возникающие при дифференциальной диагностике многоочаговых образований головного мозга. У данной пациентки проводили дифференциальный диагноз между злокачественными заболеваниями, в первую очередь ПЛЦНС, демиелинизирующими заболеваниями, инфекционным поражением ЦНС, аутоиммунным энцефалитом.
Одной из главных трудностей в постановке диагноза ПЛЦНС является то, что она не является частой патологией ЦНС. В исследовании I. Haldorsen и соавт. [23] было продемонстрировано, что среднее время между нейровизуализацией и постановкой диагноза у иммунокомпетентных пациентов с ПЛЦНС составляет в зависимости от паттерна поражения мозга 32, 3, 5, и 3 нед для пациентов без, с одним, множественными и диссеминированными очагами соответственно. Пациенты без очагов или с диссеминированными очагами чаще были диагностированы по результатам аутопсии. В представленном клиническом случае длительность диагностического поиска до летального исхода составила около 6 мес.
ПЛЦНС имеют ряд особенностей, отличающих их от других злокачественных опухолей головного мозга. В первую очередь это касается подходов к терапии, поэтому ранняя постановка диагноза является критически важной.
Признаки объемного поражения головного мозга, обнаруженные по данным нейровизуализации, должна в первую очередь вызывать подозрение на лимфому ЦНС. Для уточнения этого диагноза рекомендованы СТБ и проточная цитометрия ЦСЖ [18, 20]. Стоит отметить, что в некоторых случаях изменения в гистологическом материале, приводящие к недиагностической биопсии, могут носить ятрогенный характер [18]. Назначаемые с противоотечной целью ГКС, в первую очередь дексаметазон, являются одними из препаратов в рамках полихимиотерапии лимфом, а в случае лимфом ЦНС могут улучшать состояние за счет уменьшения отека вещества головного мозга [19]. Хотя начальная терапия ГКС может вызвать быстрое симптоматическое улучшение с драматическим улучшением при нейровизуализации примерно у 40% пациентов, ГКС-индуцированные улучшения могут увеличить риск биопсии головного мозга [30, 31]. ГКС-индуцированная отсрочка постановки диагноза может составлять от нескольких недель до месяцев. После первоначального эффекта повторное применение ГКС иногда приводит к более слабому лимфоцитотоксическому ответу [18, 30, 31]. В настоящее время рекомендуется, если это возможно, ограничить эмпирическое применение ГКС до постановки диагноза. Для предотвращения ложнонегативного результата СТБ вещества мозга следует проводить через 7—10 дней после отмены ГКС [18]. Если лимфома ЦНС подтверждена, ГКС должны быть отменены как можно быстрее, кроме случаев симптоматического масс-эффекта, связанного с опухолью [30].
Пациентка в представленном клиническом случае получала дексаметазон в рамках противоотечной терапии до первой биопсии образования головного мозга, что вначале привело к клинико-радиологическому улучшению, но при повторных курсах не показало своей эффективности. Обе СТБ образований головного мозга оказывались недиагностическими, хотя полученный материал был пересмотрен в 2 независимых лабораториях. Диагноз был установлен посмертно.
Неубедительная патоморфологическая картина также встречается при атипичных формах заболевания. По данным К. Rollins и соавт. [24], при лимфоматозе головного мозга диффузный паттерн поражения сопровождается периваскулярным скоплением как клеток лимфомы, так и ненеопластических лимфоцитов, что может имитировать энцефалитический паттерн поражения. В представленном нами клиническом случае результаты нейровизуализации, а также гистологических исследований не позволяли исключить наличие энцефалита.
У лиц с установленным диагнозом ПЛЦНС должна быть исключена системность заболевания, которая отмечается у 8% пациентов с изначально диагностированной ПЛЦНС [18, 32]. Таким образом, всем пациентам с ПЛЦНС необходимо определение стадии заболевания, что достигается при помощи КТ, ПЭТ-КТ в режиме «все тело» и биопсии костного мозга. При обнаружении ПЛЦНС следует также исследовать глаза, так как у 10—20% пациентов отмечается поражение органа зрения, которое только у 50% пациентов является симптоматичным [18, 30].
Проведение ПЭТ-КТ головного мозга не рекомендуется в качестве стандартного исследования для постановки диагноза. ПЭТ-КТ с 18 F-ФДГ, обладая высокой чувствительностью, помогает дифференцировать ПЛЦНС от других злокачественных опухолей ЦНС (глиобластомы, метастазы) [32, 33]. В нашем случае ПЭТ-КТ с 11 С-метионином было рекомендовано с целью выделения очагов с наиболее активной метаболической активностью для получения более информативных результатов СТБ.
Таким образом, дифференциальный диагноз многоочагового поражения головного мозга часто вызывает затруднения, особенно при атипичной клинической и магнитно-резонансной картине заболевания. На рис. 6 представлен диагностический алгоритм, который можно использовать при многоочаговом поражении головного мозга. Своевременная церебральная биопсия, особенно при подозрении на опухолевые или лимфоматозные процессы, остается методом выбора для верификации патологического процесса в диагностически сложных случаях.
Рис. 6. Алгоритм постановки диагноза у пациента с многоочаговым поражением мозга.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.