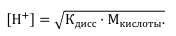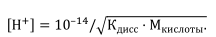Что такое одноцветный и двухцветный индикатор
ИНДИКАТОРЫ в химии
ИНДИКАТОРЫ в химии (лат. indicator указатель) — вещества, изменяющие свой цвет в присутствии тех или иных химических соединений в исследуемой среде (в растворе, в воздухе, в клетках, в тканях), а также при изменении pH или окислительно-восстановительного потенциала среды; широко применяются в биохимических, клинических и санитарно-гигиенических лабораториях.
И. применяют для определения конца реакции (точки эквивалентности) при титровании, для колориметрического определения величин pH или окислительно-восстановительных потенциалов, для обнаружения различного рода веществ в тех или иных исследуемых объектах. Для всех этих целей И. применяют в виде водных или спиртовых р-ров или в виде индикаторных бумажек, представляющих собой полоски фильтровальной бумаги, пропитанные И.
В зависимости от назначения и механизма действия И. подразделяют на ряд групп.
Кислотно-основные индикаторы представляют собой сложные органические соединения, изменяющие окраску (двухцветные И.) или ее интенсивность (одноцветные И.) в зависимости от pH среды. Двухцветным И. является, напр., лакмоид: в щелочной среде он имеет синюю окраску, а в кислой — красную. Примером одноцветных И. может служить фенолфталеин, бесцветный в кислой среде и малиновый в щелочной.
По теории Оствальда (W. Ostwald) кислотно-основные И. представляют собой слабые органические к-ты или основания, недиссоциированные молекулы которых имеют в р-ре иную окраску, чем образуемые ими анионы и катионы. Фенолфталеин, напр., является слабой к-той, не диссоциированные молекулы к-рой бесцветны, а анионы окрашивают р-ры в малиновый цвет. В р-рах И., представляющие собой слабые к-ты, диссоциируют по уравнению
Константа ионизации таких И. равна
(квадратными скобками обозначены молярные концентрации соответствующих частиц).
И., представляющие собой слабые основания, диссоциируют по уравнению
где ВОН — не диссоциированные молекулы И., В+ — катионы И., а OH- — гидроксильные ионы.
Константа диссоциации этих И. равна
Кислотно-основные И. широко применяют при титровании к-т и щелочей, а также для колориметрического измерения величины pH биол, жидкостей, клеток, тканей и др.
Титрование к-т и щелочей должно быть закончено в момент достижения точки эквивалентности, т. е. в момент, когда к титруемому р-ру к-ты (щелочи) добавлен такой объем титранта, в к-ром содержится эквивалентное количество к-ты (щелочи). Для этого необходимо применять такой И., точка перехода к-рого равна величине pH титруемого р-ра в точке эквивалентности (см. Нейтрализации метод). В табл. перечислены И., наиболее употребляемые при титровании к-т и оснований.
Качественное определение кислотности и щелочности производят с помощью так наз. нейтральных И., точка перехода которых находится практически при pH 7,0. К ним относятся, напр., лакмус, имеющий в кислой среде (pH меньше 7,0) красный, а в щелочной среде (pH больше 7,0) синий цвет; нейтральный красный, окрашивающийся в кислой среде в красный цвет, а в щелочной — в желтый цвет.
Приближенное измерение величины pH среды (с точностью до 0,5— 1,0 ед. pH) обычно производят с помощью универсального (комбинированного) И., представляющего собой смесь нескольких И., интервалы перехода которых близки друг к другу и охватывают широкую область значений pH.
К 0,5 мл испытуемой жидкости добавляют 1—2 капли р-ра универсального И. и появляющуюся при этом окраску сравнивают с прилагаемой цветовой шкалой, на к-рой указаны значения pH, отвечающие различным окраскам И. Применяют также полоски фильтровальной бумаги, пропитанные универсальным И.
Для более точного (0,1—0,5 ед. pH) колориметрического определения величины pH обычно пользуются одноцветными И. ряда динитро- и нитрофенолов, предложенными Михаэлисом (L. Michaelis) и представляющими собой слабые к-ты, изменяющие окраску от бесцветной (в кислой среде) до желтой (в щелочной). С этой же целью пользуются рядом двухцветных И., предложенных Кларком (W. М. Clark) и Лабсом (H. A. Lubs), представляющих собой сульфофталеины. Кислотная и щелочная формы этих И. резко различаются по цвету, в этом состоит их преимущество по сравнению с индикаторами Михаэлиса.
Окислительно-восстановительные, или редоксиндикаторы, представляют собой органические красители, цвет которых в окисленном и восстановленном состоянии различен. Такие И. применяют при оксидиметрическом титровании (см. Оксидиметрия), а также для колориметрического определения величин окислительно-восстановительных потенциалов жидкостей (см. Окислительно-восстановительный потенциал), отдельных клеток и тканей в цитохим, и цитол, лабораториях. Большинство редокс-индикаторов при восстановлении превращается в бесцветные соединения, а при окислении окрашивается. Окисленная и восстановленная формы И. находятся в р-рах в состоянии динамического равновесия:
окисленная форма + ne восстановленная форма, где n — число электронов.
Соотношение между равновесными концентрациями двух форм данного И., а следовательно, и цвет р-ра, в к-ром находится И., зависят от величины окислительно-восстановительного потенциала р-ра. Если величина потенциала р-ра больше нормального окислительно-восстановительного потенциала (Е0) данного редокс-индикатора, то большая часть И. в этом р-ре переходит в окисленную форму (обычно окрашенную), если же окислительно-восстановительный потенциал исследуемой среды меньше Е0, то И. превращается в восстановленную форму (обычно бесцветную). При равенстве значений окислительно-восстановительного потенциала среды и Е0 индикатора концентрации окисленной и восстановленной форм И. равны друг другу. Имея ряд И. с различными значениями Е0, можно по их окраске в данной среде судить о величине окислительно-восстановительного потенциала данной среды. Редокс-индикаторы, предложенные Михаэлисом, имеющие общее название «виологены» и представляющие собой производные гамма- и гамма’-дипиридилов, обладают малой токсичностью и широко применяются для измерения окислительно-восстановительных потенциалов в биол, системах; у этих И. окрашена восстановленная форма.
Нормальный окислительно-восстановительный потенциал виологенов не зависит от величины pH р-ра. Этим они отличаются от других редокс-индикаторов.
Комплексонометрические индикаторы (металлоиндикаторы) представляют собой хорошо растворимые в воде органические красители, способные образовывать с ионами металлов окрашенные комплексные соединения. Эти И. применяются для установления точки эквивалентности при комплексонометрическом титровании (см. Комплексонометрия).
Адсорбционные индикаторы — это органические красители, адсорбирующиеся на поверхности осадков, образующихся при титровании по методу осаждения, и изменяющие свой цвет при достижении точки эквивалентности. Напр., тропеолин 00 при титровании хлоридов р-ром азотнокислого серебра меняет окраску в точке эквивалентности с желтой на розовую.
Хемилюминесцентныe (флюоресцентные) индикаторы — органические соединения (например, люменол, люцегинин, силаксен и др.), обладающие способностью люминесцировать при естественном освещении или при облучении ультрафиолетовым светом. Интенсивность и цвет люминесценции зависят как от величины pH среды, так и от величины ее окислительно-восстановительного потенциала; эти И. применяются при титровании (при нейтрализации и оксидиметрии) сильно окрашенных или мутных жидкостей, когда изменение окраски обычных И. незаметно.
И. используются во многих биохим. методах, применяемых в клин.-биохим. лабораториях. Наиболее употребимыми из них являются бромтимоловый синий (при определении активности фруктозодифосфатальдолазы в сыворотке крови, активности ацетилхолинэстеразы и холинэстеразы в сыворотке крови по А. А. Покровскому, а также активности карбоксилэстеразы в крови по А. А. Покровскому и Л. Г. Пономаревой), бромфеноловый синий (при электрофоретическом разделении различных белков для окраски электрофореграмм наряду с амидочерным и кислотным сине-черным), универсальный И., феноловый красный (при определении активности аспартат- и аланин-аминотрансфераз в сыворотке крови, активности холинэстеразы в сыворотке крови и т. д.), фенолфталеин, нитросиний тетразолий, используемый для качественной и количественной оценки активности различных дегидрогеназ (см. Дегидрогеназы), и др.
Таблица. Краткая характеристика индикаторов, наиболее часто используемых при титровании кислот и оснований
Интервал перехода индикатора, в единицах pH
Что такое одноцветный и двухцветный индикатор
КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ. СУЩНОСТЬ МЕТОДА И ЕГО ВОЗМОЖНОСТИ. ИНТЕРВАЛ ПЕРЕХОДА ОКРАСКИ КИСЛОТНО-ОСНОВНЫХ ИНДИКАТОРОВ. КРИВЫЕ ТИТРОВАНИЯ.
Метод кислотно-основного титрования основан на реакциях взаимодействия между кислотами и основаниями, то есть на реакции нейтрализации:
Точку эквивалентности устанавливают различными способами, например по изменению окраски индикатора, приба-вляемого в титруемый раствор. Момент, при котором происходит наблюдаемое изменение цвета индикатора, называют конечной точкой титрования. Очень часто конечная точка титрования не совсем совпадает с точкой эквивалентности. Как правило, они отличаются друг от друга не более чем на 0,02-0,04 мл (1-2 капли) титранта. Это то количество титранта, которое необходимо для взаимодейcтвия с индикатором.
ИНДИКАТОРЫ В МЕТОДЕ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
Типичным одноцветным индикатором является фенол-фталеин. При рН
Дальнейшее увеличение рН до 13-14 вызывает другую пере-группировку, в результате чего получается трехзамещенная соль, лишённая хиноидной группировки и поэтому бесцветная:
Вследствие этого фенолфталеин обесцвечивается при действии большого избытка щелочи, например, натрия гидроксида. Типичным двухцветным индикатором является метиловый оранжевый:
[ (CH3)2N N═N SO3 ] + Н2 О
Ионно-хромофорная теория индикаторов. Согласно дополняющим друг друга ионной и хромофорной теориям, в раст-ворах кислотно-основных индикаторов одновременно сосущест-вуют равновесия, обусловливаемые диссоциацией молекул, и равновесия, связанные с внутримолекулярными перегруппировками (ионно-хромофорная теория). Для кислотно-основных индика-торов наиболее характерными факторами, вызывающими измене-ние окраски, являются изменение соотношения количеств молеку-лярной и ионной форм индикатора, происходящее под влиянием кислот и щелочей, и появление или исчезновение хромофорных групп или же превращение одних хромофорных групп в другие.
Известно, что прибавление к любому раствору любой кислоты или щелочи влечет за собой изменение концентрации ионов Н+ в нем, а следовательно, и величины рН. Перемена окраски у индика-торов также связана с изменением рН раствора. Однако каждый индикатор изменяет окраску только в определенном, характерном для него интервале значений рН. Объясняется это тем, что окраска индикатора зависит от соотношения концентраций его диссоци-ированной и недиссоциированной форм, то есть от отношения:
Когда KHInd = [Н+], то [Ind-] / [HInd] = 1.
Если КHInd / [Н+] > 1, то в растворе превалирует диссоцииро-ванная форма индикатора, а если КHInd / [Н+]
Для фенолфталеина КHInd = [Н+] [Ind-] / [HInd] ≈ 10-9.
Таким образом, переходная окраска индикатора появляется при рН среды, равном рКHInd, но так как изменение цвета индикатора происходит постепенно, цвет недиссоциированных молекул индикатора начинает маскироваться цветом ионов задолго до достижения соотношения [HInd] / [Ind-] = 1.
Следовательно, цвет водного раствора индикатора определяется соотношением концентрации его молекулярной и ионной форм, отличающихся различной окраской, и зависит от [Н+]. Величину рН, до которой титруют раствор с данным индикатором, называют показателем титрования этого индикатора рТ.
Важнейшие индикаторы имеют следующие области перехода и показатели титрования:
Показатель титрования рТ Область перехода рН
КРИВЫЕ ТИТРОВАНИЯ. ВЫБОР ИНДИКАТОРА
Титрование сильной кислоты сильным основанием.
Когда 90 % соляной кислоты будет оттитровано, ионов Н+ останется 10 % от первоначального количества, то есть 0,01 (или 10-2) моль-ион в 1 дм3, а рН раствора станет равен 2. При нейтрализации 99,0 % соляной кислоты рН = 3; при нейтрализации 99,9 % кислоты рН = 4 и т. д. В момент полной нейтрализации соляной кислоты титруемый раствор содержит только натрия хлорид и имеет рН = 7. Прибавление избытка натрия гидроксида ведет к увеличению рН раствора, как это показано в табл. 3.1.
Изменение рН раствора при титровании сильной кислоты сильным основанием
В результате резкого изменения рН раствора от последней капли раствора основания происходит и резкое изменение окраски индикатора. При отсутствии скачка рН на кривой титрования окраска индикатора изменялась бы постепенно и определить точку эквивалентности было бы невозможно.
Титрование слабой кислоты сильным основанием
Кривую титрования слабой кислоты сильным основанием рассчитывают несколько иначе, так как при этом концентрацию ионов Н+ уже нельзя приравнивать к общей концентрации кислоты. Ее приходится вычислять с учетом константы диссоциации кислоты. Не вдаваясь в подробности вычислений, приведем кривую титрования раствора 0,1 моль/дм3 уксусной кислоты раствором 0,1 моль/дм3 NaOH (рис.3.2). Интервал скачка рН на ней значительно уже, чем в первом случае. Он простирается от рН = 7,8 (остатка кислоты в 0,1 %) до рН = 10 (∆pH = 2,2 избытка щелочи в 0,1 %). Слабая уксусная кислота посылает в раствор гораздо меньше ионов Н+, чем хлороводородная. Поэтому перед началом титрования рН раствора 0,1 моль/дм3 уксусной кислоты равен 3, а не 1, как в случае с хлороводородной кислотой. В ходе титрования рН раствора уксусной кислоты все время остается выше, чем при тех же концентрациях хлороводородной кислоты. Поэтому и скачок на кривой начинается с более высокого значения рН. Заканчивается он, как и впервом случае, при рН = 10, так как титрование производят тем же раствором 0,1 моль/дм3 NaOH.
Для титрования слабой кислоты сильным основанием пригоден индикатор фенолфталеин. Его показатель титрования входит в пределы скачка рН на кривой и почти совпадает с точкой эквивалентности. Другие индикаторы (метиловый оранжевый, метиловый красный и даже лакмус) не могут быть использованы в этом случае, так как показатели титрования их не входят в интервал скачка.
Нейтрaлизация слабой кислоты слабым основанием
Выше было показано, что при титровании слабой кислоты сильным основанием сужается интервал скачка на кривой в области кислот-ных значений рН. И наоборот, при титровании слабого основания сильной кислотой интервал скачка уменьшается в щелочной обла-сти рН. Если попытаться титровать слабую кислоту слабым основа-нием (или наоборот), то сужение интервала скачка происходит и в кислотной, и в щелочной областях рН. Вследствие этого интервал скачка рН на кривой вовсе исчезает. На рис. 3.4 показан ход изменения рН раствора при нейтрализации раствора 0,1 моль/дм3 СН3СООН раствором 0,1 моль/дм3 NН4ОН. Приведенная кривая не имеет скачка рН. Поэтому в данном случае нельзя ожидать и резкого изменения окраски индикаторов Титрование слабой кислоты слабым основанием вообще невозможно.
ВЫБОР ИНДИКАТОРА ПО ПРОДУКТАМ РЕАКЦИИ
Н2С2О4 + 2NaOH → Na2C2О4 + 2Н2О
Продуктами данной реакции являются вода (рН = 7) и гидролизующаяся соль сильного основания и слабой кислоты, гидролиз которой идет по аниону. Следовательно, в точке эквивалентности рН > 7. Значит, в данном случае подойдет индикатор, интервал перехода окраски которого лежит в щелочной среде (например, фенолфталеин).
Для уменьшения индикаторной ошибки титрование проводят с так называемым «свидетелем». В запасную коническую колбу (или стакан) наливают дистиллированную воду в количестве, приблизительно равном объему жидкости, получающейся в конце титрования. Прибавляют к воде столько же капель индикатора, например метилового оранжевого, сколько и к титруемому раствору, и приливают из бюретки 1-2 капли кислоты, вызывающей слабое порозовение раствора. Приготовленный таким образом «свидетель» используют в качестве образца при титровании, добиваясь, чтобы окраска анализируемого раствора и «свидетеля» была одинакова. С помощью «свидетеля» вводят также поправку в результаты титрования на прибавленный избыток кислоты, то есть из затраченного ее объема вычитают объем двух капель ( ≈ 0,04 мл), использованных на окрашивание индикатора в «свидетеле».
Таким образом, результат объемного определения зависит не только от выбора индикатора, но также от взятого количества его и от принятого порядка титрования.
главная > справочник > химическая энциклопедия:
Индикаторы
Индикаторы применяют чаще всего для установления конца какой-либо химической реакции, главным образом конечной точки титрования (к. т. т.). В соответствии с титриметрическими методами различают кислотно-основные, адсорбционные, окислительно-восстановительные и комплексонометрические индикаторы.
Индикаторы для титрования подбирают таким образом, чтобы интервал перехода окраски включал значение рН, какое должен иметь раствор в точке эквивалентности. Часто это значение рН не совпадает с рТ используемого индикатора, что приводит к так называемой индикаторной ошибке. Если в к. т. т. остается избыток неоттитрованного слабого основания или кислоты, ошибка наз. соотв. основной или кислотной.
Индикаторы бывают с одной или двумя окрашенными формами; такие индикаторы называют соотв. одноцветными и двухцветными. Наиболее четкое изменение окраски наблюдалось бы у тех индикаторов, кислотная и основная формы которых окрашены в дополнительные цвета. Однако таких индикаторов существует. Поэтому, добавляя краситель, изменяют соответствующим образом окраски обеих форм. Так, у метилового красного переход от красного к желтому происходит в интервале 2 единиц рН, а если к раствору добавить метиленовый синий, то переход окраски от красно-фиолетовой к зеленой наблюдается резко и отчетливо при рН 5,3. Подобного эффекта можно добиться, если использовать смесь двух индикаторов, цвета которых дополняют дру. друга. Такие индикаторы называют смешанными (табл. 2).
Смеси индикаторов, которые непрерывно изменяют свой цвет во всей области значений рН от 1 до 14, называют универсальными. Их используют для приблизительной оценки рН растворов. На изменение окраски индикатора оказывают влияние его концентрации. Для двухцветных индикаторов чем выше концентрация, тем изменение окраски менее резко, так как спектры поглощения обеих форм накладываются друг на друга в большей степени и становится труднее определить изменение окраски. Обычно используют одно и то же минимальное (несколько капель раствора) количество индикатора.
В качестве кислотно-основных индикаторов используют также люминесцентные индикаторы. меняющие цвет и интенсивность флуоресценции в зависимости от рН и позволяющие титровать сильно окрашенные и мутные растворы.
Для определения органических кислот и оснований в воде в присутствии несмешивающегося с ней растворителя применяют так называемые амфииндикаторы, которые представляют собой соли индикаторов-кислот (например, тропеолина 00) с разл. орг. основаниями (напр., алкалоидами). Эти индикаторы хорошо растворимы в органических растворителях, плохо в воде; отличаются высокой чувствительностью.
Применяются также так называемые неокрашенные комплексонометрические индикаторы, избирательно взаимодействующие с ионами определяемого металла с образованием слабо окрашенных (e l 10 3 ) комплексов, например, сульфосалициловая кислота при титровании Fe (III). Флуоресцентные комплексонометрические индикаторы(или металлофлуоресцентные индикаторы) взаимодействуют с катионами металлов с образованием интенсивно флуоресцирующих хелатов.
Впервые об индикаторах сообщил английский физик и химик Р. Бойль в 1664.
Лит.: Индикаторы, пер. с англ., т. 1-2, М., 1976; Денеш И., Титрование в неводных средах, пер. с англ., М., 1971; Коренман И.М., Новые титриметрические методы, М., 1983. Л. Н. Симонова.
Кислотно-основное титрование. Индикаторы, техника титрования
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Кислотно-основное титрование
Основные понятия кислотно-основного титрования
Индикаторы метода кислотно-основного титрования. Теории индикаторов
Техника титрования
Основные понятия кислотно-основного титрования
Метод кислотно-основное титрование базируется на реакциях взаимодействия между кислотами и основаниями, т. е. на реакции нейтрализации:
Рабочими растворами метода являются растворы сильных кислот (HCl, H2S, НNО3 и др.) или сильных оснований (NaOH, КОН, Ва(ОН)2 и др.). В зависимости от титрованного раствора (титранта) кислотно-основное титрование подразделяют на ацидиметрию, если титрантом является раствор кислоты, и алкалиметрию, если используют в качестве титранта раствор основания.
Согласно правилу эквивалентности титрование необходимо продолжать до тех пор, пока количество прибавленного реагента не станет эквивалентным содержанию определяемого вещества. Наступающий в процессе титрования момент, когда количecтвo вещества в растворе титранта становится строго эквивалентным количеству определяемого вещества согласно уравнению химической реакции, называют точкой эквивалентности.
Точку эквивалентности устанавливают различными способами. В методах ручного анализа преимущественно используют изменение окраски индикатора, добавляемого в титруемый раствор. Момент, при котором происходит наблюдаемое изменение цвета индикатора, называют конечной точкой титрования. Очень часто конечная точка титрования не совсем совпадает с точкой эквивалентности. Как правило, они отличаются друг от друга не более чем на 0,04 мл (2 капли) титранта. Это то количество вещества в растворе титранта, которое необходимо для взаимодейcтвия его с индикатором.
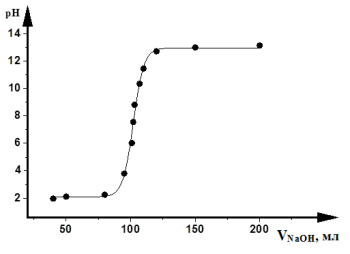
Кривые кислотно-основного титрования выражают зависимость изменения рН раствора от объема добавленного титранта (рис. 3.4).
Рис. 3.4. Кривая кислотно-щелочного титрования
При расчете рН необходимо знать состав титриметрической смеси. Для упрощения вычислений (что не приводит к заметным ошибкам) не учитывают разбавление раствора в процессе титрования и используют понятие «концентрация», а не «активность». Кривые титрования представляют в виде графика зависимости рН от объема добавленного титранта или объема избытка определяемого вещества и избытка титранта.
В начале титрования рН изменяется очень медленно. Кривая (см. рис. 3.4) показывает, в частности, что если оттитровать половину имеющегося количества кислоты (50 мл), рН раствора изменится незначительно по сравнению с исходным, если оттитровать 90 % (90 мл), то и тогда уменьшение рН составит лишь одну единицу. С уменьшением концентрации оставшейся кислоты изменение рН при титровании становится более резким. Оттитровывание кислоты от 90 до 99 % вызывает изменение рН на три единицы. Также на единицу возрастает рН при оттитровывании от 99 до 99,9 %, т. е. на 0,9 %. Титрование остатка кислоты (0,1%) приводит к изменению рН на целых 3 единицы. Введение избытка в 0,1 % NaOH по сравнению с эквивалентным количеством вызывает изменение рН также на 3 единицы, и рН раствора становится равным 13,0.
Кривая титрования сильного основания сильной кислотой представляет собой зеркальное отображение кривой титрования сильной кислоты сильным основанием. При титровании сильной кислотой сильного основания и наоборот до точки эквивалентности рН раствора определяется концентрацией неоттитрованной щелочи или кислоты, а после точки эквивалентности — концентрацией добавленной кислоты или щелочи. В точке эквивалентности раствор нейтрален.
Скачок титрования — это резкое изменение рН в области точки эквивалентности. Факторы, влияющие на величину и положение скачка титрования (на величину скачка титрования влияют все факторы, от которых зависят значения рН):
Чем меньше концентрация титруемого вещества и титранта, тем меньше скачок. Практически невозможно оттитровать сильные протолиты концентрацией 10 –4 М, а слабые — концентрацией 10 –2 М. При изменении температуры сильно изменяется константа автопротолиза воды, входящая во многие формулы расчета рН. В результате при увеличении температуры скачок уменьшается и смещается в более кислую область. Ионная сила влияет незначительно.
В рассматриваемом случае расчет рН проводят по следующим формулам:
● Для сильной кислоты, например HCl, рН определяется концентрацией ионов водорода: [H+] = M кислоты.
● Для сильного основания, например КОН [H+] = 10 –14 / Mщелочи. Часто проводят титрование с использованием слабых электролитов.
При титровании слабой кислоты сильным основанием чем слабее кислота, тем больше значение рН в начале титрования. Следовательно, ветвь кривой титрования (рис. 3.5) до точки эквивалентности смещается в щелочную область. После достижения точки эквивалентности образуется сильное основание, следовательно, значение рН резко смещается в щелочную область. При дальнейшем титровании кривая изменяется незначительно.
В ходе титрования раствора уксусной кислоты сильным основанием значение pH все время остается выше, чем при тех же концентрациях соляной кислоты. В результате этого скачок на кривой начинается с более высокого значения рН. Заканчивается он, как и в первом случае, при рН = 10, так как титрование производят тем же раствором 0,1 моль/л NaOH.
Рис. 3.5. Ход титрования слабой кислоты сильным основанием
При титровании слабой кислоты сильным основанием pH раствора кислоты вычисляют с учетом ее константы диссоциации:
Интервал скачка рН на кривой титрования 0,1 мольл уксусной кислоты раствором 0,1 мольл NaOH значительно уже предыдущего случая. Он простирается от рН = 7,8 до рН = 10.
При титровании слабого основания сильной кислотой интервал скачка уменьшается в щелочной области рН. Рассчитывается рН в этом случае следующим образом:
При титрование слабой кислоты слабым основанием (или наоборот) сужение интервала скачка рН происходит и в кислотной, и в щелочной областях рН. Вследствие этого интервал скачка рН на кривой вовсе исчезает. Пример — нейтрализация раствора 0,1 моль/л СН3СООН раствором 0,1 моль/л NН4ОН. Кривая титрования не имеет скачка рН. Поэтому нельзя ожидать и резкого изменения окраски индикаторов. Титрование слабой кислоты слабым основанием вообще невозможно.
Индикаторы метода кислотно-основного титрования. Теории индикаторов
Индикаторы — вещества, которые резко реагируют на изменение концентрации определяемого компонента или титранта вблизи точки эквивалентности. В методах кислотно-основного титрования для определения конечной точки титрования используют кислотноосновные индикаторы (табл. 3.1). Это органические вещества, способные видимо и обратимо изменять свою окраску в растворе при изменении рН среды.
Кислотно-основные индикаторы изменяют свою окраску в области интервала перехода независимо от того, достигнута ли точка эквивалентности. Правильно выбранный индикатор изменяет окраску в области скачка титрования. У неправильно выбранного индикатора изменение окраски может происходить задолго до наступления точки эквивалентности или после нее.
Таблица 3.1 Характеристики кислотно-основных индикаторов
Выбирают индикатор с помощью кривой титрования. Для этого на график наносят интервал перехода индикатора. У правильно выбранного индикатора интервал перехода полностью или частично перекрывается скачком титрования. Если такого перекрывания нет, то индикатор для данного титрования не подходит. Значение рН, при котором заканчивается титрование с данным индикатором, называют показателем титрования и обозначают рТ. Показатель титрования находится обычно в середине интервала перехода индикатора. Существуют различные теории индикаторов, каждая из которых по-своему объясняет поведение кислотно-основных индикаторов в кислых и щелочных средах.
Ионная теория индикаторов. В связи с тем, что кислотно-основные индикаторы представляют собой слабые кислоты или слабые основания, любой индикатор диссоциирует в растворе согласно уравнению:
HInd = Н+ + Ind — (бесцветный — малиновый).
Изменение окраски индикаторов происходит при прибавлении к любому раствору любой кислоты или щелочи влечет за собой изменение концентрации ионов Н+ в нем, а следовательно, и величины рН. Перемена окраски у индикаторов также связана с изменением рН раствора. Однако каждый индикатор изменяет окраску только в определенном, характерном для него интервале значений рН. Объясняется это тем, что окраска индикатора зависит от соотношения концентраций его диссоциированной и недиссоциированной форм, т. е.
Если к раствору фенолфталеина прибавить щелочь и довести рН раствора до 8, то соотношение [HInd] / [Ind−] = 10 –8 /10 –9 уменьшится в 10 раз и раствор станет бледно-розовым. При рН = 9 соотношение [HInd] / [Ind−] = 10 –9 /10 –9 = 1,0, т. е. в растворе присутствуют равные количества бесцветных молекул индикатора и окрашенных в красный цвет ионов, при этом раствор приобретает розовую окраску. Следовательно, цвет водного раствора индикатора определяется соотношением концентрации его молекулярной и ионной форм, отличающихся различной окраской, и зависит от [Н+].
Техника титрования
Правильное определение точки эквивалентности при титровании зависит не только от выбора индикатора, но и от порядка титрования. По методу нейтрализации титруют растворы кислот растворами оснований или наоборот. Этот порядок следует учитывать при выборе индикатора. Например, если титруют кислоту основанием и в качестве индикатора используют метиловый оранжевый (или метиловый красный), то розовая окраска индикатора от избыточной капли щелочи должна перейти в желтую.
Такое изменение окраски гораздо хуже улавливается глазом, чем переход ее из желтой в розовую. Поэтому с метиловым оранжевым (или метиловым красным) рекомендуют титровать растворы оснований растворами кислот. С фенолфталeином удобнее титровать растворы кислот растворами оснований, так как при этом бесцветный раствор становится малиновым.
Следует заметить, что при использовании индикаторов для фиксирования конечной точки титрования возможно появление индикаторной ошибки. Она образуется в случае несовпадения рН раствора в точке эквивалентности и рТ индикатора. Если такое несовпадение имеет место, то раствор обычно либо несколько перетитровывают, либо, наоборот, недотитровывают. Для уменьшения индикаторной ошибки титрование проводят с так называемым свидетелем. В запасную коническую колбу (или стакан) наливают дистиллированную воду в количестве, приблизительно равном объему жидкости, получающейся в конце титрования. Прибавляют к воде столько же капель индикатора, например метилового оранжевого, сколько и к титруемому раствору, и приливают из бюретки 1−2 капли кислоты, вызывающей слабое порозовение раствора. Приготовленный таким образом свидетель используют в качестве образца при титровании, добиваясь, чтобы окраска анализируемого раствора и свидетель была одинакова. С помощью свидетель вводят также поправку в результаты титрования на прибавленный избыток кислоты, т. е. из затраченного ее объема вычитают объем двух капель (0,04 мл), использованных на окрашивание индикатора в свидетель.
Правильное определение точки эквивалентности зависит от количества прибавленного индикатора. Иногда стараются прилить побольше индикатора, полагая, что большая интенсивность окраски раствора облегчит определение точки эквивалентности. Но чем больше прибавлено индикатора, тем труднее заметить изменение окраски, так как оно будет происходить медленнее. Для установления конечной точки титрования имеет значение не столько яркость окраски раствора, сколько четкость ее изменения. Опытным путем найдено, что на 10–15 мл анализируемого раствора следует брать одну каплю раствора индикатора, а на 25 мл — не более двух капель.
Таким образом, результат объемного определения зависит не только от выбора индикатора, но также от его взятого количества и от принятого порядка титрования.