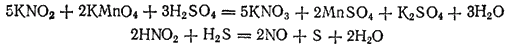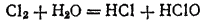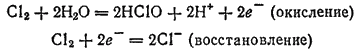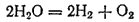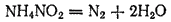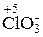Что такое окислительно восстановительная двойственность
97. Окислительно-восстановительная двойственность.
Внутримолекулярное окисление-восстановление. Соединения высшей степени окисленности, присущей данному элементу, могут в окислительно-восстановительных реакциях выступать только в качестве окислителей, степень окисленности элемента может в этом случае только понижаться. Соединения низшей степени окисленности могут быть, наоборот, только восстановителями; здесь степень окисленности элемента может только повышаться. Если же элемент находится в промежуточной степени окисленности, то его атомы могут, в зависимости от условий, как принимать, так и отдавать электроны. В первом случае степень окисленности элемента будет понижаться, во втором — повышаться. Поэтому соединения, содержащие элементы в промежуточных степенях окисленности, обладают окислительно-восстановительной двойственностью-способностью вступать в реакции как с окислителями, так и с восстановителями.
Так, азот образует соединения, в которых степень его окисленности изменяется от —3 (аммиак и соли аммония) до +5 (азотная кислота и ее соли). Азот, входящий в состав аммиака, может выступать только в качестве восстановителя, азот азотной кислоты— только в качестве окислителя. Азотистая же кислота HNO2 и ее соли, где степень окисленности азота равна +3, вступают в реакции как с сильными окислителями, так и с сильными восстановителями. В первом случае HNO2 окисляется до азотной кислоты, во втором — восстанавливается обычно до оксида азота NO2
В качестве примеров окислительно-восстановительной двойственности азотистой кислоты можно привести реакции:
Кроме азотистой кислоты окислительно-восстановительной двойственностью обладают сера, иод, пероксид водорода и ряд других веществ.
Вещества, содержащие элемент в промежуточной степени окисленности, обладают в ряде случаев еще одним характерным свойством. Оно состоит в том, что в определенных условиях такое вещество претерпевает процесс, в ходе которого часть элемента окисляется, а часть — восстанавливается. Этот процесс называется самоокислением-самовосстановлением. Так, при взаимодействии хлора с водой получается смесь соляной и хлорноватистой (HClO) кислот:
Здесь и окисление, и восстановление претерпевает хлор:
Самоокисление-самовосстановление называют также диспропорционированием.
Некоторые сложные вещества в определенных условиях (обычно при нагревании) претерпевают внутримолекулярное окисление-восстановление. При этом процессе одна составная часть вещества служит окислителем, а другая — восстановителем. Примерами внутримолекулярного окисления-восстановления могут служить многие процессы термической диссоциации. Так, в ходе термической диссоциации водяного пара
кислород окисляется (его степень окисленности возрастает от —2 до 0), а водород восстанавливается (его степень окисленности уменьшается от +1 до 0).
Другим примером может служить реакция разложения нитрита аммония, применяемая в лабораторной практике для получения чистого азота:
Окислительно-восстановительная двойственность
Окислители и восстановители
Восстановителем называется вещество, в состав которого входит элемент, повышающий степень окисления. Окислителем называется вещество, в состав которого входит элемент, понижающий степень окисления при протекании реакции.
С точки зрения электронной теории, окислением называют процесс отдачи электронов. Вещество, присоединяющее электроны и вызывающее таким образом окисление другого вещества, называется окислителем.Окислителями являются большинство неметаллов (галогены, кислород, сера и др.), многие кислородосодержащие кислоты (HNO3, H2SO4, HCIO4, HCIO3, HCIO2, HCIO, H2SeO4) и их соли (NaNO3, KCIO3, NaCIO2, NaCIO); соединения металлов в высших положительных степенях окисления (KMnO4, K2Cr2O7, K2FeO4).
Восстановлением, согласно электронной теории, называют процесс присоединения электронов. Вещество, отдающее электроны (и этим вызывающее восстановление другого вещества), называется восстановителем.Восстановителями являются металлы, соединения металлов в низших степенях окисления (FeSO4, SnCl2, CrCl3, MnSO4 и др.), некоторые неметаллы (водород, углерод), соединения неметаллов в отрицательных степенях окисления (NH3, H2S, HI, KI); соединения неметаллов в немаксимальных положительных степенях окисления (SO2, H2SO3, HNO2, NaNO2, H3PO3, H3PO2).
Многие вещества в зависимости от партнёра по реакции и условий её проведения могут быть как восстановителями, так и окислителями. Способность многих веществ быть как восстановителями, так и окислителями, называется окислительно-восстановительной двойственностью. Например, в ряду соединений, расположенных по возрастанию степени окисления азота
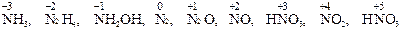
аммиак обладает только восстановительными свойствами, так как в его составе азот находится в крайней отрицательной степени окисления, которая может только повышаться. Азотная кислота, наоборот, обладает только окислительными свойствами, так как азот в ней находится в крайней положительной степени окисления, которая может только понижаться. Остальные вещества, в которых азот находится в промежуточных степенях окисления, обладают окислительно-восстановительной двойственностью.
Таким образом, окислительно-восстановительной двойственностью обладают вещества, в состав которых входят элементы в промежуточных степенях окисления.
Пример 7. Среди данных соединений укажите окислители, восстановители и вещества с окислительно-восстановительной двойственностью: 1) FeCl3, K2FeO4, Fe; 2) K2S, H2SO4, Na2SO3
Решение. В перечне 1 степень окисления железа в соединениях равна +3 (FeCl3), +6 (K2FeO4) и 0 (Fe), следовательно окислителями являются феррат калия K2FeO4, восстановителем – железо (Fe), а хлорид железа (III) FeCl3 обладает окислительно-восстановительной двойственностью.
В перечне 2 окислителем является серная кислота (степень окисления серы +6 – максимальная), восстановителем – H2S (степень окисления серы –2 – минимальная), а двойственными свойствами обладает сульфит натрия Na2SO3 (степень окисления серы +4 – промежуточная).
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Окислители и восстановители. Окислительно-восстановительная двойственность. Типы окислительно-восстановительных реакций



Многие вещества обладают особыми свойствами, которые в химии принято называть окислительными или восстановительными. В аквариумных процессах эти вещества играют достаточно важную роль, поэтому мы расскажем о них подробнее.
Что же такое окислитель и восстановитель, окисление и восстановление? Окислительно-восстановительные свойства вещества связаны с процессом отдачи и приема электронов атомами, ионами или молекулами. Окислитель — это вещество, которое в ходе реакции принимает электроны, т. е. восстанавливается; восстановитель — отдает электроны, т. е. окисляется.
В результате этой реакции металл магний переходит в частицы с зарядом+2. Для всех металлов в соединениях характерна положительная степень окисления.
Окислительно-восстановительная двойственность – это способность атома, находящегося в промежуточной степени окисления, быть как восстановителем, так и окислителем, в зависимости от того, с каким веществом он реагирует.
Типы окислительно-восстановительных реакций
Все химические реакции, в которых электроны переходят от одного вещества или его части к другому веществу или к другой части одного и того же вещества, называются окислительно-восстановительными, или редокспроцессами. Любому веществу-окислителю соответствует восстановленная форма, а восстановителю– окисленная форма, вместе они образуют сопряженную окислительно-восстановительную пару
Основные понятия химии координационных соединений: центральный атом, лиганды, внешняя и внутренняя сферы комплекса, координационное число, дентатность лиганда
Роль центрального атома в комплексе способен играть любой элемент. Чаще всего это переходные металлы, степень окисления которых может быть различной, даже отрицательной.
Лига́нд— атом, ион или молекула, связанные с неким центром. Понятие применяется в биохимии для обозначения агентов, соединяющихся с биологическими акцепторами, а также в химии комплексных соединений, обозначая там присоединенные к одному или нескольким центральным атомам металла частицы.
Число занимаемых лигандом координационных мест центрального атома, называется дентатностью.. Лиганды, занимающие одно координационное место, называются монодентатными (например, NH3), два — бидентатными. Лиганды, способные занять большее количество мест, обычно обозначают как полидентатные. Например, этилендиаминтетрауксусная кислота (EDTA), способная занять шесть координационных мест.
Кроме дентатности, существует характеристика, отражающая количество атомов лиганда, связанных с одним координационным местом центрального атома. В английской литературе обозначается словом hapticity и имеет номенклатурное обозначение η с соответствующим надстрочным индексом. Хотя устоявшегося термина в русском языке она, по-видимому, не имеет, в некоторых источниках можно встретить кальку «гаптность». Как пример, можно привести циклопентадиенильный лиганд в металлоцентровых комплексах, занимающий одно координационное место и связанный через все пять атомов углерода: η5-[C5H5]−.
Координационное число— характеристика, которая определяет число ближайших частиц в молекуле или кристалле.
Окислительно-восстановительная двойственность



Если степень окисления некоторого атома в химическом соединении промежуточная, то этот атом может как принимать электроны (т.е. быть окислителем), так и отдавать их (т.е. быть восстановителем). Такое поведение, в частности, характерно для пероксида водорода, поскольку в состав молекулы Н2O2 входят атомы кислорода в промежуточной степени окисления минус 1:
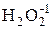
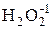
При прогнозировании поведения пероксида водорода и других веществ, характеризующихся окислительно-восстановительной двойственностью, необходимо учитывать следующее. Если, например, для пероксида водорода партнёром по реакции является вещество, способное быть только окислителем (KMnO4, K2Cr2O7), то H2O2 будет вести себя как восстановитель и окисляться до O2. Если же пероксид водорода взаимодействует с веществом, способным проявлять только восстановительные свойства (KI), то молекулы H2O2 будут выполнять функцию окислителя, восстанавливаясь до молекул H2O.
Окислительно-восстановительная двойственность характерна также для азотистой кислоты и нитритов:
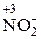
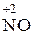
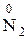
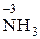
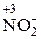
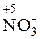
Активные неметаллы, например, галогены в щелочных растворах подвергаются реакциям самоокисления-самовосстановления (диспропорционирования); в этих реакциях одна часть атомов простого вещества является окислителем, а другая – восстановителем:
Cl2 0 ® 2Cl –1 Cl2 0 ® 2Cl –1
Cl2 0 ® 2 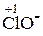
соединения двухвалентной меди проявляют окислительные свойства, восстанавливаясь до соединений одновалентной меди:
соединения железа (II) легко окисляются до соединений железа (III):
растворимые соли железа (III) проявляют окислительные свойства, восстанавливаясь до соединений железа (II):
сульфиты – сильные восстановители и легко окисляются до сульфатов:
Некоторые неметаллы (C, S, P, As) окисляются концентрированной азотной кислотой до высшей степени окисления:
Йод окисляется азотной кислотой до степени окисления +5: I2 ® HIO3.
Сама HNO3 в этих реакциях может восстанавливаться как до NO2, так и до NO.
Неметаллы могут также окисляться концентрированной серной кислотой:
При этом H2SO4 восстанавливается до SO2.
Далее рассматриваются примеры, иллюстрирующие использование приведённого выше теоретического материала при прогнозировании продуктов окислительно-восстановительных реакций.
При выполнении данного задания следует учитывать, что запись H2SO4 в условии подразумевает разбавленную серную кислоту; если в реакции участвует концентрированная серная кислота – будет применяться запись H2SO4 (конц.).
В молекуле N2H4 атом азота находится в промежуточной степени окисления минус 2. Теоретически атом в промежуточной степени окисления может быть как окислителем, так и восстановителем. Но в данной реакции функцию окислителя выполняет K2Cr2O7. Поэтому гидразин (N2H4) – восстановитель. Как уже было ранее сказано, атомы-восстановители в отрицательной степени окисления обычно окисляются до нулевой степени окисления. Поэтому, даже не зная химии гидразина, можно предположить, что продуктом его окисления в данной реакции будет азот: N2H4 ® N2.
Исходные схемы превращений: Cr2O7 2– ® 2Cr 3+
Процедура составления ионно-электронных уравнений подробно рассмотрена в методических указаниях по общей химии [2]. Напомним кратко важнейшие правила уравнивания атомов кислорода и водорода при составлении полуреакций.

 |
Щёлочи (LiOH, NaOH, KOH, Ca(OH)2, Ba(OH)2) в водных растворах не проявляют ни окислительных, ни восстановительных свойств. При проведении окислительно-восстановительных реакций эти вещества используются для создания щелочной среды. Следовательно, и окислителем, и восстановителем в данной реакции являются атомы хлора; это реакция самоокисления-самовосстановления (реакция диспропорционирования).
Исходные схемы превращений: Cl2 ® 2Cl –

 |
KOH обеспечивает щелочную среду и не проявляет окислительно-восстановительную активность (см. пример 4.2). Следовательно, восстановителем являются атомы кислорода в молекуле H2O2, степень окисления которых равна минус 1 (промежуточная). Атомы кислорода O –1 окисляются до нулевой степени окисления (типичное поведение восстановителя в отрицательной степени окисления): H2O2 ® O2.
Исходные схемы превращений: MnO4 – ® MnO4 2–

 |
Атом марганца в KMnO4 находится в высшей степени окисления +7 (окислитель). В нейтральной среде (в левой части уравнения – молекулы воды) KMnO4 (Mn +7 ) восстанавливается до MnO2 (Mn +4 ): MnO4 – ® MnO2¯.
Исходные схемы превращений: MnO4 – ® MnO2¯
Следует иметь в виду, что в ходе реакции, которая начинается в нейтральной среде, может происходить либо подкисление раствора, либо подщелачивание, либо среда раствора останется без изменений.
Таким образом, в рассматриваемом примере при составлении полуреакций нужно определиться, как уравнивать атомы кислорода: с помощью ионов H + и молекул H2O (кислая среда) или же с помощью ионов OH – и молекул H2O (щелочная среда).
 |
2MnO4 – + 3NO2 – + 8H + + 3H2O ® 2MnO2¯ + 3NO3 – + 6H + + 4H2O

 |
Варианты заданий по теме прогнозирование продуктов окислительно-восстановительных реакций представлены в таблице 4.1
Что такое окислительно восстановительная двойственность
Так, азот образует соединения, в которых степень его окислен-иости изменяется от —3 (аммиак и соли аммония) до 



В качестве примеров окислительно-восстановительной двойственности азотистой кислоты можно привести реакции:
Кроме азотистой кислоты окислительно-восстановительной двойственностью обладают сера, иод, пероксид водорода и ряд других веществ.
Вещества, содержащие элемент в промежуточной степени окисленности, обладают в ряде случаев еще одним характерным свойством. Оно состоит в том, что в определенных условиях такое вещество претерпевает процесс, в ходе которого часть элемента окисляется, а часть — восстанавливается. Этот процесс называется самоокислением-самовосстановлением. Так, при взаимодействии хлора с водой получается смесь соляной и хлорноватистой 
Здесь и окисление, и восстановление претерпевает хлор:
Самоокисление-самовосстановление называют также диспропорционированием.
Некоторые сложные вещества в определенных условиях (обычно при нагревании) претерпевают внутримолекулярное окисление-восстановление. При этом процессе одна составная часть вещества служит окислителем, а другая — восстановителем. Примерами внутримолекулярного окисления-восстановления могут служить многие процессы термической диссоциации. Так, в ходе термической диссоциации водяного пара
кислород окисляется (его степень окисленности возрастает от —2 до 0), а водород восстанавливается (его степень окисленности уменьшается от 
Другим примером может служить реакция разложения нитрита аммония, применяемая в лабораторной практике для получения чистого азота:
Здесь ион