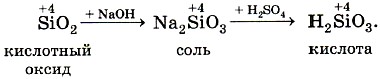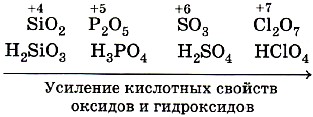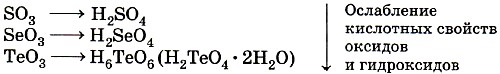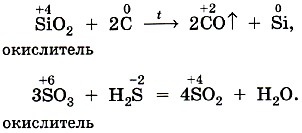Что такое оксид неметалла
Соединения неметаллов
Оксиды неметаллов и кислородсодержащие кислоты.
Водородные соединения неметаллов. Общая характеристика подгруппы галогенов.
Сегодня на уроке нам потребуется рабочая тетрадь, учебник, письменные принадлежности.
На уроке вы познакомитес ь со свойствами оксидов неметаллов и водородных соединений.
Вспомните закономерность изменения свойств соединений неметаллов в периоде и группе.
На уроке нам понадобятся тетрадь рабочая и учебник.
Шаг 1. Ознакомьтесь с теорией по оксидам неметаллов и водородным соединениям неметаллов, свойствами галогенов. В тетради запишите дату и тему урока. Сделайте краткий конспект.
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Соединения неметаллов с кислородом и водородом
Неметаллы (углерод, кислород, азот, сера, галогены) могут образовывать соединения как с кислородом (оксиды), так и с водородом. Водородные соединения являются газами или жидкостями, например, вода, аммиак, сероводород, соляная кислота. Оксиды могут быть газами (углекислый или сернистый газ), жидкостями (оксид хлора(VI) и (VIII)) или твёрдыми телами (оксид фосфора(V)).
Оксиды неметаллов
Типичными примерами оксидов неметаллов являются:
Сернистый газ (SO 2 ), серный газ (SO 3 ), угарный газ (CO), углекислый газ (CO 2 ), оксид фосфора V (P 2 O 5 ), оксид азота I (NO), оксид азота II (NO 2 ).
Оксиды неметаллов подразделяют на две группы – несолеобразующие (SiO, N 2 O, NO, CO, S 2 O, H 2 O) и солеобразующие (остальные).
Несолеобразующих оксидов немного, их обыкновенно образуют одновалентные и двухвалентные неметаллы.
Высшие оксиды – это оксиды, в которых неметалл проявляет степень окисления, равную номеру группы.
Кислотные свойства оксидов. В пределах одного периода с увеличением номера группы наблюдается увеличение кислотных свойств высших оксидов и соответствующих им кислот. Например, для неметаллов третьего периода, кремниевая кислота является слабой, а хлорная кислота является одной из самых сильных.
Такая закономерность вытекает из периодического закона Менделеева. В периоде радиус атома неметалла уменьшается с увеличением номера группы, а заряд неметалла при этом увеличивается. Поэтому при движении по периоду слева направо связь между неметаллом и кислородом упрочняется, а связь неметалл-водород ослабевает, что даёт увеличение диссоциации кислоты.
В пределах одной главной подгруппы происходит ослабление кислотных свойств оксидов и кислот с увеличением номера периода.
Разница между оксидами металлов и неметаллов
Основное различие между оксидами металлов и неметаллов заключается в том, что оксиды металлов являются основными соединениями, тогда как оксиды неметаллов являются кислотными соединениями.
«Оксиды» — это большая группа соединений, в которых химические элементы связаны по существу с атомами кислорода. Однако благородные газы не образуют эти соединения из-за их инертной природы и более высокой стабильности. Большинство металлов и неметаллов образуют оксиды с различными степенями окисления, в то время как некоторые другие химические элементы образуют оксиды с фиксированной степенью окисления; например, магний образует только оксид магния, имеющий химическую формулу MgO, в то время как ванадий образует различные оксиды, такие как V2O3 и V2O5.
Содержание
Что такое оксиды металлов?
Примеры для оксидов металлов:
Что такое неметаллические оксиды?
Неметаллические оксиды представляют собой неорганические химические соединения, содержащие неметаллы, связанные по существу с атомами кислорода. Следовательно, эти соединения в основном содержат p-блочные элементы, потому что p-блочные элементы являются неметаллами, которые мы имеем. Почти все неметаллические оксиды являются ковалентными соединениями, потому что они имеют тенденцию делить электроны с другими атомами, например с атомами кислорода.
Это кислотные соединения, следовательно, они образуют кислоту при растворении в воде. По той же причине они могут реагировать с основаниями с образованием солей посредством реакций нейтрализации. Кроме того, они могут образовывать оксикислоты, которые могут образовывать гидроксиды в водной среде.
Примеры неметаллических оксидов:
В чем разница между оксидами металлов и неметаллов?
Оксиды металлов представляют собой неорганические химические соединения, содержащие металлы, связанные по существу с атомами кислорода, тогда как неметаллические оксиды представляют собой неорганические химические соединения, содержащие неметаллы, связанные по существу с атомами кислорода. В этом принципиальная разница между оксидами металлов и неметаллов. Более того, эти соединения отличаются друг от друга по своей химической природе. Таким образом, ключевое различие между оксидами металлов и неметаллов заключается в том, что оксиды металлов являются основными соединениями, тогда как неметаллические оксиды являются кислотными соединениями.
Кроме того, существует некоторая разница между металлическими и неметаллическими оксидами также и по их химической структуре. В большинстве случаев оксиды металлов являются ионными соединениями, в то время как неметаллические оксиды являются ковалентными соединениями. Кроме того, оксиды металлов имеют тенденцию реагировать с водой с образованием щелочных растворов, но неметаллические оксиды имеют тенденцию реагировать с водой с образованием кислых растворов. Кроме того, оксиды металлов реагируют с кислотами с образованием солей, тогда как неметаллические оксиды реагируют с основаниями с образованием солей.
Заключение — Оксиды металлов против оксидов неметаллов
Оксиды представляют собой химические соединения, имеющие либо металл, либо неметалл, связанный с одним или несколькими атомами кислорода. Основное различие между оксидами металлов и неметаллов заключается в том, что оксиды металлов являются основными соединениями, тогда как неметаллические оксиды являются кислотными соединениями.
Оксиды: классификация, получение и химические свойства
В зависимости от второго элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды традиционно делят на солеобразующие и несолеобразующие. Некоторые оксиды относят к солеобразным (двойным).
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степень окисления +1 и +2.
Кислотные оксиды — это оксиды, характеризующиеся кислотными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Классификация оксидов
Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом :
1.1. Окисление металлов: большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
Не взаимодействуют с кислородом золото, платина, палладий.
Натрий при окислении кислородом воздуха образует преимущественно пероксид Na2O2,
Калий, цезий, рубидий образуют преимущественно пероксиды состава MeO2:
Примечания : металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3):
Железо также горит с образованием железной окалины — оксида железа (II, III):
1.2. Окисление простых веществ-неметаллов.
Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
Оксид серы (VI) можно получить только окислением оксида серы (IV) в жестких условиях в присутствии катализатора:
2SO2 + O2 = 2SO3
Азот окисляется кислородом только при очень высокой температуре (около 2000 о С), либо под действием электрического разряда, и только до оксида азота (II):
Не окисляется кислородом фтор F2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы (гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д.
При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
Сероводород горит с образованием оксида серы (IV) при избытке кислорода и с образованием серы при недостатке кислорода:
А вот аммиак горит с образованием простого вещества N2, т.к. азот реагирует с кислородом только в жестких условиях:
А вот в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
гидроксид → оксид + вода
Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония, гидроксиды серебра (I), меди (I):
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др.:
Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с с изменением степени окисления:
Более подробно про разложение нитратов можно прочитать в статье Окислительно-восстановительные реакции.
Химические свойства оксидов
Значительная часть химических свойств оксидов описывается схемой взаимосвязи основных классов неорганических веществ.
Химические свойства основных оксидов
Подробно про химические свойства оксидов можно прочитать в соответствующих статьях:
Урок №43. Оксиды: классификация, номенклатура, свойства, получение, применение
Сегодня мы начинаем подробное знакомство с важнейшими классами неорганических соединений. Неорганические вещества по составу делятся, как вы уже знаете, на простые (металлы и неметаллы) и сложные:
А – кислотный остаток
ОН – гидроксильная группа
Сложные неорганические вещества подразделяют на четыре класса: оксиды, кислоты, основания, соли. Мы начинаем с класса оксидов.
ОКСИДЫ
оксид углерода ( II )
оксид марганца (VII )
Классификация оксидов
Все оксиды можно разделить на две группы: солеобразующие (основные, кислотные, амфотерные) и несолеобразующие или безразличные.
4). Несолеобразующие оксиды – это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды неметаллов с валентностью I и II (Например, N 2 O, NO, CO).
Вывод: характер свойств оксидов в первую очередь зависит от валентности элемента.
Например, оксиды хрома:
Классификация по растворимости в воде
Кислотные оксиды
(не растворим в воде)
Основные оксиды
В воде растворяются только оксиды щелочных и щелочноземельных металлов
Амфотерные оксиды
С водой не взаимодействуют.
В воде не растворимы
Выполните задания:
1. Выпишите отдельно химические формулы солеобразующих кислотных и основных оксидов.
Выпишите оксиды и классифицируйте их.
Физические свойства оксидов
Химические свойства оксидов
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ
1. Основной оксид + Кислотный оксид = Соль (р. соединения)
3K 2 O + 2H 3 PO 4 = 2K 3 PO 4 + 3H 2 O
Na 2 O + H 2 O = 2NaOH
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ
2. Кислотный оксид + Основание = Соль + Н 2 О (р. обмена)
P 2 O 5 + 6KOH = 2K 3 PO 4 + 3H 2 O
3. Основной оксид + Кислотный оксид = Соль (р. соединения)
4. Менее летучие вытесняют более летучие из их солей
CaCO 3 + SiO 2 = CaSiO 3 +CO 2
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ
Взаимодействуют как с кислотами, так и со щелочами.
ZnO + 2 HCl = ZnCl 2 + H 2 O
ZnO + 2 NaOH + H 2 O = Na 2 [Zn(OH) 4 ] ( в растворе)
ZnO + 2 NaOH = Na 2 ZnO 2 + H 2 O (при сплавлении)
Применение оксидов
Некоторые оксиды не растворяются в воде, но многие вступают с водой в реакции соединения:
В результате часто получаются очень нужные и полезные соединения. Например, H 2 SO 4 – серная кислота, Са(ОН) 2 – гашеная известь и т.д.
Если оксиды нерастворимы в воде, то люди умело используют и это их свойство. Например, оксид цинка ZnO – вещество белого цвета, поэтому используется для приготовления белой масляной краски (цинковые белила). Поскольку ZnO практически не растворим в воде, то цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков. Нерастворимость и неядовитость позволяют использовать этот оксид при изготовлении косметических кремов, пудры. Фармацевты делают из него вяжущий и подсушивающий порошок для наружного применения.
Такими же ценными свойствами обладает оксид титана (IV) – TiO 2 . Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил. TiO 2 не растворяется не только в воде, но и в кислотах, поэтому покрытия из этого оксида особенно устойчивы. Этот оксид добавляют в пластмассу для придания ей белого цвета. Он входит в состав эмалей для металлической и керамической посуды.
Оксид хрома (III) – Cr 2 O 3 – очень прочные кристаллы темно-зеленого цвета, не растворимые в воде. Cr 2 O 3 используют как пигмент (краску) при изготовлении декоративного зеленого стекла и керамики. Известная многим паста ГОИ (сокращение от наименования “Государственный оптический институт”) применяется для шлифовки и полировки оптики, металлических изделий, в ювелирном деле.
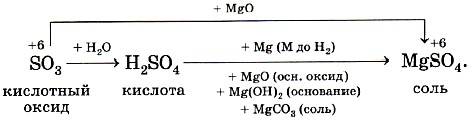
§ 19.4. Оксиды неметаллов и соответствующие им гидроксиды
В оксидах неметаллов связь между атомами ковалентная полярная. Среди оксидов молекулярного строения есть газообразные СO2, SO2, N2O, СО, NO и др., жидкие (летучие) SO3, N2O3, твердые (летучие) Р2O5, N2O5, SeO2. Твердый, очень тугоплавкий оксид SiO2 — вещество с атомной кристаллической решеткой.
Оксиды неметаллов делят на две группы: несолеобразующие и солеобразующие. К несолеобразующим оксидам относятся SiO, N2O, NO, NO2, CO. Все остальные оксиды неметаллов являются солеобразующими, кислотными. При растворении их в воде образуются гидраты оксидов — гидроксиды, по своему характеру являющиеся кислотами. Кислоты и кислотные оксиды в результате химических реакций образуют соли, в которых неметалл сохраняет степень окисления.
Кислотный оксид SiO2 нерастворим в воде, но ему также соответствует гидрат в виде кислоты H2SiO3 и соли:
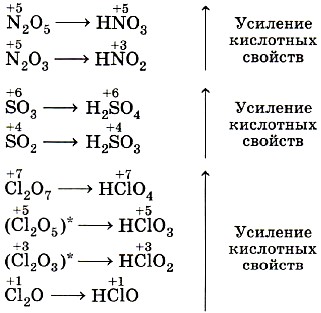
Оксиды и соответствующие им гидроксиды — кислоты, в которых неметалл проявляет степень окисления, равную номеру группы, т. е. высшее ее значение, называют высшими. Рассматривая Периодический закон, мы уже характеризовали их состав и свойства, например:
В пределах одной главной подгруппы, например VI группы, действует следующая закономерность изменения свойств высших оксидов и гидроксидов.
Если неметалл образует два или более кислотных оксидов, а значит, и соответствующих кислородсодержащих кислот, то их кислотные свойства усиливаются с увеличением степени окисления неметалла.
- . Оксиды такого состава неизвестны; НСlO2 даже в водном растворе быстро разлагается.
Оксиды и кислоты, в которых неметалл имеет высшую степень окисления, могут проявлять только окислительные свойства.
Особенности сильнейших окислителей азотной кислоты HNO3 и концентрированной серной кислоты H2SO4 проявляются в реакциях с металлами, неметаллами, органическими веществами. Эти их свойства мы рассмотрим в § 20.
Оксиды и кислоты, где неметалл имеет промежуточную степень окисления, могут проявлять и окислительные, и восстановительные свойства.