Что такое олигосахариды в детском питании
Использование пребиотиков-олигосахаридов в питании детей первого года жизни
Новый подход к адаптации детских молочных смесей (по материалам зарубежной печати) В последние годы внимание врачей и научных работников все чаще привлекают вопросы, связанные со значением кишечной микрофлоры для нормального роста и развития ребенка.
Новый подход к адаптации детских молочных смесей (по материалам зарубежной печати)
В последние годы внимание врачей и научных работников все чаще привлекают вопросы, связанные со значением кишечной микрофлоры для нормального роста и развития ребенка. Получены достоверные доказательства того, что интестинальная микрофлора выполняет важные физиологические функции.
Формирование кишечной микрофлоры у детей, находящихся на искусственном и естественном вскармливании, происходит неодинаково. Уже в 1900 г. Tissier [56] доказал, что у детей, находящихся на грудном вскармливании, основным компонентом кишечной микрофлоры являются бифидобактерии. Такая бифидодоминантная микрофлора выполняет защитные функции и способствует созреванию механизмов иммунного ответа ребенка.
Напротив, у детей, находящихся на искусственном вскармливании, количество бифидобактерий в толстом кишечнике значительно меньше, и видовой состав кишечной микрофлоры менее разнообразен [60].
Желудочно-кишечный тракт (ЖКТ) человека колонизирован огромным количеством микроорганизмов, которое значительно превосходит суммарное количество человеческих клеток. В разных отделах ЖКТ число бактерий различно. В ротовой полости в условиях кислой среды количество микроорганизмов невелико и составляет от 0 до 103 КОЕ на миллилитр содержимого, в то время как в нижних отделах ЖКТ процент микроорганизмов значительно выше. Основными факторами среды, ограничивающими размножение бактерий в верхних отделах ЖКТ, являются быстрый пассаж пищевых масс и секреция желчи и сока поджелудочной железы. Среда толстого кишечника диаметрально противоположна, поэтому в этом отделе ЖКТ количество бактерий достигает 1013 КОЕ на миллилитр [50].
Кишечник населен несколькими сотнями видов бактерий, среди которых количественно преобладают бифидобактерии и бактероиды, доля которых составляет 25 и 30% соответственно по отношению к общему количеству анаэробных бактерий [48].
Микрофлора кишечника человека выполняет несколько основных функций, включая процессы метаболической адаптации [35]. Одной из этих функций является ферментация не расщепленных ранее компонентов пищи, главным образом углеводов, таких, как крахмал, другие полисахариды и олигосахариды. Конечные продукты, образующиеся в результате процесса ферментации, оказывают положительное влияние на состояние здоровья человека. Например, в результате ферментации некоторых углеводов образуются продукты, положительно влияющие на метаболизм, в частности молочная кислота и короткоцепочечные жирные кислоты [19, 2].
Короткоцепочечные жирные кислоты выполняют трофическую функцию и используются клетками слизистой оболочки кишечника как дополнительный источник энергии. Таким образом улучшается функционирование защитного барьера слизистой оболочки кишечника [48]. Более того, определенные углеводы способны селективно стимулировать рост полезных для здоровья человека бактерий в толстом кишечнике [19].
Микрофлора кишечника защищает человека от колонизации экзогенными патогенными микроорганизмами и подавляет рост уже имеющихся в кишечнике патогенов. Механизм этого явления заключается в конкуренции патогенных микроорганизмов и функциональной микрофлоры за питательные вещества и участки связывания, а также в выработке нормальной микрофлорой определенных ингибирующих рост патогенов субстанций [42].
Более того, бактерии, населяющие толстый кишечник, участвуют в реализации иммунологических защитных механизмов. При токсической или антигенной атаке энтероциты путем определенных активирующих сигналов стимулируют экспрессию генов, отвечающих за транскрипцию и трансляцию молекул цитокинов. Кроме того, происходит выброс факторов роста, необходимых для стимуляции пролиферации и дифференцировки поврежденного участка слизистой оболочки [7, 59].
До рождения ребенка его желудочно-кишечный тракт стерилен. В момент рождения происходит быстрая колонизация кишечника бактериями, входящими в состав интестинальной и вагинальной флоры матери. В результате образуется сложное сообщество микроорганизмов, состоящее из бифидобактерий, лактобацилл, энтеробактерий, клостридий и грамположительных кокков. После этого состав микрофлоры подвергается изменениям в результате действия нескольких факторов окружающей среды, важнейшим из которых является питание ребенка.
У детей, находящихся на грудном вскармливании, в составе кишечной микрофлоры преобладают бифидобактерии. В то время как у малышей на искусственном и смешанном вскармливании состав кишечной микрофлоры более разнообразен и содержит одинаковые количества бифидобактерий и бактероидов [3, 22, 35, 53]. «Минорными» компонентами кишечной микрофлоры у детей, находящихся на естественном вскармливании, являются лактобациллы и стрептококки; у детей на искусственном вскармливании — стафилококки, кишечная палочка и клостридии.
При добавлении в рацион ребенка, находящегося на естественном вскармливании, твердой пищи, количество бифидобактерий в толстом кишечнике уменьшается. К 12 месяцам у большей части детей состав и количество анаэробных микроорганизмов в толстом кишечнике приближается к таковому у взрослых людей [42, 53, 35]. Микрофлора взрослого человека представлена в основном анаэробами и состоит из бактероидов, бифидобактерий, эубактерий, клостридий, стрептококков, кишечной палочки и лактобацилл [19].
Преобладание бифидобактерий в составе интестинальной микрофлоры детей, находящихся на грудном вскармливании, объясняется наличием в грудном молоке определенных компонентов, однако механизм этого явления до конца неизвестен [23, 59]. Считается, что бифидогенный эффект могут оказывать такие компоненты молока, как молочная сыворотка и лактоферрин. Кроме того, доказано, что бифидогенными веществами являются олигосахариды грудного молока, которые представляют собой вторую по количеству углеводную фракцию молока после лактозы [24, 33, 40, 45].
Грудное молоко содержит около 1 г на 100 мл нейтральных олигосахаридов и около 0,1 г на 100 мл кислых олигосахаридов [39]. Итак, олигосахариды присутствуют в человеческом молоке примерно в таких же количествах, как и белки. На сегодняшний день известно более 100 различных олигосахаридов, некоторые из них имеют высокую молекулярную массу и обладают сложной структурой [52, 15].
Скелет олигосахаридной молекулы представлен соединенными остатками лактозы (Гал-Глю-). При добавлении еще одного образуются три различные по изомерной структуре галактозил-лактозных молекулы (галактоолигосахариды) [12, 1, 63]. Более крупные молекулы олигосахаридов образуются при добавлении к остатку лактозы галактозил-N-ацетилглюкозамина. Следовательно, одним из основных свойств олигосахаридов является большое количество галактозы в молекуле.
Олигосахариды грудного молока не расщепляются ферментами верхних отделов ЖКТ и достигают толстого кишечника в неизменном виде. Там они выполняют функции пребиотиков, т. е. являются субстратом для роста бифидобактерий [14, 20], способствуя образованию мягкого переваренного стула, похожего на стул детей, получающих грудное молоко [57, 62, 64, 65].
Типичный бифидодоминантный состав кишечной микрофлоры детей, находящихся на естественном вскармливании, дает ряд положительных эффектов, основным из которых является повышенная резистентность организма ребенка к кишечным инфекциям [28, 32, 48]. С этим эффектом может быть связано несколько свойств бифидобактерий. Во-первых, бифидобактерии способны секретировать вещества, ингибирующие рост патогенных микроорганизмов. Во-вторых, бифидобактерии создают кислую среду в толстом кишечнике путем продукции ацетата и молочной кислоты.
Бифидобактерии также выполняют функцию модуляции механизмов иммунного ответа ребенка [19, 25, 48]. Исследования с применением пробиотиков показали, что в результате применения смесей для искусственного вскармливания с добавлением бифидобактерий повышается резистентность детей к инфекционным заболеваниям [47]. Недавно проведенное исследование выявило, что у детей с атопическими заболеваниями в возрасте 12 месяцев в составе кишечной микрофлоры преобладают клостридии, а количество бифидобактерий у таких детей значительно ниже, чем у их сверстников, не страдающих атопическими заболеваниями [6]. Все эти исследования показывают, что между составом кишечной микрофлоры и степенью зрелости механизмов иммунного ответа детей существует определенная связь [27, 28).
«Золотым стандартом» детского питания можно назвать грудное вскармливание. Дети, находящиеся на грудном вскармливании, имеют бифидодоминантную микрофлору кишечника. Поэтому при искусственном вскармливании желательно выбирать такие смеси, которые способствовали бы формированию похожей по составу микрофлоры.
В последние годы были предприняты несколько попыток повышения бифидогенности смесей для искусственного вскармливания детей [9, 10]. При добавлении в смеси лактоферрина [4] и уменьшении общей концентрации фосфатов [43] выраженного влияния на количество бифидобактерий в кишечнике замечено не было. При использовании сывороточных протеинов количество бифидобактерий увеличилось незначительно [5].
Одним из способов повышения бифидогенности смесей для искусственного вскармливания явилось добавление в них пробиотиков, т. е. живых бифидобактерий [12, 17, 34]. На современном этапе количество бифидобактерий в кишечнике ребенка можно увеличить, применяя смеси, содержащие пребиотики-олигосахариды [8, 18, 38, 30, 31, 44]. Пребиотики-олигосахариды — это компоненты грудного молока, не подвергающиеся расщеплению в верхних отделах желудочно-кишечного тракта. Они способны селективно стимулировать рост бифидобактерий в толстом кишечнике.
Поскольку олигосахариды содержатся в грудном молоке, то добавление их в смеси для искусственного вскармливания представляет собой наиболее физиологичный путь повышения количества бифидобактерий и лактобацилл
в кишечнике детей, находящихся на искусственном вскармливании.
Олигосахариды грудного молока — это очень сложные по строению молекулы. Технологически невозможно воссоздать копии олигосахаридов, полностью аналогичные входящим в состав женского молока. Тем не менее следует подобрать природные олигосахариды таким образом, чтобы по своей массе и размерам они максимально соответствовали олигосахаридам грудного молока [52].
В составе молекулы олигосахаридов грудного молока преобладают остатки галактозы, поэтому основным компонентом смесей с пребиотиками (в настоящее время их производит голландская компания Nutricia) являются галактоолигосахариды. Суммарно смесь пребиотиков-олигосахаридов в смесях Нутрилон 1, Нутрилон 2 и Нутрилон Омнео содержит 90% низкомолекулярных галактоолигосахаридов и 10% высокомолекулярных фруктоолигосахаридов. Соотношение двух названных компонентов подобрано с учетом того, что распределение молекул по размерам максимально соответствовало таковому в грудном молоке. Только в этом случае эффект от применения искусственно созданной смеси пребиотиков будет в наибольшей степени соответствовать воздействию, которое оказывает на организм ребенка грудное молоко, и не приведет к повышению осмолярности питания.
Олигосахариды способны выполнять свою основную функцию благодаря тому, что они не расщепляются ферментами верхних отделов ЖКТ и доходят в неизмененном виде до толстого кишечника. Там они подвергаются процессу ферментации бифидобактериями и служат для них факторами роста. Ферментация происходит за счет анаэробных процессов [41, 54]. Олигосахариды используются бактериальными ферментами с образованием более мелких частиц, которые затем захватываются бактериальной клеткой и подвергаются дальнейшему метаболизму с образованием определенного количества энергии и некоторых конечных продуктов, например короткоцепочечных жирных кислот.
Резистентность фрукто- и галактоолигосахаридов (ФОС/ГОС) к действию ферментов верхних отделов ЖКТ была доказана в ходе нескольких исследований in vitro и in vivo. Эти работы показали наличие мощного бифидогенного эффекта ФОС и ГОС [51, 59]. Исследования in vitro показали, что ФОС подвергаются избирательной ферментации большим числом штаммов бифидобактерий [61, 36]. Более того, при росте бифидобактерий на этих субстратах они подавляют размножение потенциально патогенной микрофлоры — бактероидов, клостридий и колиформ. Данный эффект частично объясняется образованием в результате жизнедеятельности бифидобактерий молочной кислоты и созданием кислой среды, а частично — секрецией веществ, ингибирующих рост клостридий, кишечной палочки, листерий, шигелл, сальмонелл, холерного вибриона [19, 36, 9, 29, 56, 58].
Кроме бифидогенного эффекта, ФОС и ГОС положительно влияют на характеристики стула детей. Также показано, что при добавлении в смеси для искусственного вскармливания пребиотиков повышается всасывание кальция в кишечнике ребенка [11, 21, 25,49, 58].
Эффективность смесей с пребиотиками-олигосахаридами для искусственного вскармливания, а именно их бифидогенные свойства, положительное влияние на характеристики стула детей и другие эффекты, была продемонстрирована в ходе нескольких клинических испытаний, результаты которых представлены ниже.
В ходе исследования, проведенного Boehm et al. в 2002 г. [8], в смесь для искусственного вскармливания недоношенных детей добавлялись пребиотики. Исследование проводилось с двойным слепым контролем, дети для исследования были выбраны случайным образом, контрольная группа получала плацебо. 30 недоношенных детей получали смесь для искусственного вскармливания, в которую были добавлены пребиотики. Детям из контрольной группы назначалась обычная смесь. Третья группа детей получали грудное молоко (группа сравнения).
В течение 28 дней четыре раза (на 1-й, 7-й, 14-й и 28-й день) брались пробы кала и исследовался состав кишечной микрофлоры детей. Кроме того, оценивались характеристики стула детей, их вес и рост и наличие или отсутствие побочных эффектов. Средний возраст гестации в исследуемой группе составил 31 неделю, средний возраст детей в момент начала исследования — восемь дней.
За исследуемый период количество бифидобактерий в кале детей, получавших смесь с добавлением пребиотиков, возросло, в то время как в кале детей из контрольной группы этот показатель остался без изменений. На 28-й день эксперимента количество бифидобактерий в кишечнике детей из опытной группы было значительно выше, чем у детей из контрольной группы.
Кроме того, у детей из опытной группы увеличилась частота актов дефекации. По консистенции кал стал более мягким. Оба эти показателя приближали детей из опытной группы к детям из группы сравнения, получавшим грудное молоко.
Дети из всех трех групп не различались по росту и весу, побочных эффектов обнаружено не было.
Это исследование показывает, что пребиотики способны оказывать бифидогенный эффект у недоношенных детей. Кроме явно выраженного бифидогенного эффекта исследователи отметили, что, по основным характеристикам, стул у детей стал приближаться к стулу малышей, находящихся на грудном вскармливании.
Moro и соавторы в 2002 г. исследовали влияние концентрации пребиотиков на выраженность бифидогенного эффекта и характеристики стула доношенных детей [38]. 90 доношенных детей, чьи матери по каким-то причинам не кормили их грудью, были случайным образом разделены на три группы. Первая группа детей получала смесь для искусственного вскармливания с добавлением пребиотиков в концентрации 0,4 г/100 мл, вторая — в концентрации 0,8 г/100 мл, третья, контрольная, группа — обычную смесь для искусственного вскармливания.
В качестве группы сравнения рассматривались 15 детей, находящихся на грудном вскармливании. Средний срок гестации во всех группах составил 39-40 недель, средний возраст детей в момент начала исследования — шесть-семь дней.
В первый день эксперимента количество бифидобактерий в кале детей из всех трех групп было одинаковым. Однако на 28-й день этот показатель существенно различался. Количество бифидобактерий в кишечнике детей из первой и второй групп, т. е. детей, получавших пребиотики в разной концентрации, значительно возросло и достигло уровня, отмечавшегося у детей из группы сравнения. При этом количество бифидобактерий в кишечнике детей из контрольной группы осталось без изменений. Оказалось, что бифидогенный эффект зависел от дозы полученного пребиотика. Также в кишечнике детей увеличилось количество лактобацилл, причем этот эффект не зависел от дозы полученного пребиотика.
Частота стула у детей, получавших пребиотики в концентрации 0,8 г/100 мл, была чуть выше, чем у детей, получавших пребиотики в концентрации 0,4 г/100 мл. У всех наблюдаемых детей никаких побочных эффектов отмечено не было.
Известно, что рН кала ниже у детей, находящихся на грудном вскармливании, по сравнению с получающими искусственное вскармливание [63, 38, 17]. Считается, что именно благодаря высокой кислотности кала подавляется рост потенциально патогенных микроорганизмов.
В ходе исследования было также показано, что олигосахариды оказывают влияние на рН кала. В течение 28 дней исследования рН кала детей из контрольной группы увеличился. pН кала детей, получавших пребиотики в концентрации 0,4 г/100 мл, не изменился, а рН кала детей, получавших пребиотики в концентрации 0,8 г/100 мл, уменьшился, т. е. кал этих детей стал более кислым.
Итак, олигосахариды оказывают дозозависимый бифидогенный эффект, при их добавлении в смеси для искусственного вскармливания уменьшается рН кала детей, и характеристики стула приближаются к таковым у детей, находящихся на грудном вскармливании [6].
Бифидогенный эффект пребиотиков при применении их для искусственного вскармливания доношенных детей исследовался Schmelzle и соавторами.
В ходе данного исследования 145 здоровых доношенных детей были случайным образом разделены на две группы. Первая группа детей получала молочную смесь Нутрилон Омнео, Nutricia (Голландия), новую смесь, содержащую пребиотики в концентрации 0,8 г/100 мл, частично гидролизованные сывороточные протеины и b-пальмитат (общее количество пальмитиновой кислоты 0,6 г/100 мл, 41% молекул в b-положении). Детям второй группы давали обычную смесь для искусственного вскармливания. Исследование продолжалось в течение 12 недель.
Анализ проб кала, взятых у детей из обеих групп, показал, что доля бифидобактерий в кале детей, получавших Нутрилон Омнео, увеличилась с 31 до 59%. У детей из контрольной группы таких изменений отмечено не было. Кроме того, у детей из опытной группы наблюдалась более мягкая консистенция кала.
В ходе исследования, проведенного Knol и соавторами в 2002 г. [31], изучалось влияние пребиотиков на детей 4–12 недели жизни, которые по меньшей мере первые четыре недели своей жизни находились на искусственном вскармливании. Целью исследования было определение того, могут ли пребиотики оказывать бифидогенный эффект на таких детей.
Дети были разделены на две группы. Первая группа получала смесь с пребиотиками, вторая — обычную смесь для искусственного вскармливания. В качестве группы сравнения служила третья группа детей, находившихся на естественном вскармливании.
Е. С. Киселева, кандидат медицинских наук
Х. М. Боклер
НИЦ Nutricia, Германия
Заменители грудного молока с содержанием пребиотических волокон — олигосахаридов: новый подход к искусственному вскармливанию
Защита и поддержка естественного вскармливания является основной задачей практического здравоохранения в России. При невозможности грудного вскармливания наиболее важным для здоровья ребенка является правильный подбор заменителей грудного молока. Искусст
Защита и поддержка естественного вскармливания является основной задачей практического здравоохранения в России. При невозможности грудного вскармливания наиболее важным для здоровья ребенка является правильный подбор заменителей грудного молока. Искусственное питание должно обеспечить полноценное развитие детей, не имеющих возможности получать молоко матери. В последнее десятилетие стало ясно, что состав микрофлоры кишечника является важным фактором, влияющим на здоровье ребенка. В настоящее время имеются научные доказательства того, что микрофлора кишечника имеет физиологическое значение для детей первых месяцев жизни, особенно если они не получают материнское молоко.
Одна из важнейших функций кишечных микроорганизмов — ферментация олигосахаридов, которые являются неперевариваемой частью углеводного компонента грудного молока.
В результате микробной ферментации олигосахаридов вырабатываются конечные продукты метаболизма неперевариваемых углеводов — молочная кислота и короткоцепочечные жирные кислоты (КЦЖК), которые обладают полезными для организма человека свойствами.
КЦЖК являются дополнительным источником энергии для эпителиальных клеток слизистой оболочки кишечника и обладают трофическим эффектом. Это является основой формирования защитного барьера слизистой оболочки кишечника [1].
Неперевариваемые олигосахариды грудного молока стимулируют в кишечнике ребенка рост полезных микроорганизмов, таких как бифидобактерии и лактобактерии [2].
Функциональная кишечная микрофлора подавляет рост экзогенной и эндогенной патогенной микрофлоры. Механизмы подавления роста патогенной микрофлоры сложны и включают как конкуренцию бактерий за питательные вещества, так и выработку специальных ингибиторов — факторов, препятствующих росту патогенных бактерий [3].
Бифидо- и лактобактерии, заселяющие кишечник, являются частью защитного механизма слизистой оболочки кишечника. Они стимулируют иммунный ответ организма на воздействие бактериальных, токсических и других антигенов [4]. Поэтому кишечная микрофлора может рассматриваться как постоянно обновляющаяся часть организма человека, которая регулирует обменные и адаптационные процессы.
В настоящее время установлено, что росту бифидобактерий в кишечнике ребенка способствуют олигосахариды грудного молока [5, 6]. В женском молоке концентрация олигосахаридов достигает 1 г/100 мл. После лактозы (7 г/100 мл) олигосахариды являются второй по значимости группой углеводов материнского молока [7].
Олигосахариды грудного молока не перевариваются в тонком кишечнике под воздействием пищеварительных ферментов и достигают толстого кишечника неизмененными. В нижнем отделе толстого кишечника олигосахариды подвергаются ферментации (перевариванию) собственными бифидобактериями организма. Это приводит к увеличению общей бактериальной массы, повышению моторики кишечника и формированию каловых масс [8, 9].
Таким образом, олигосахариды грудного молока относят к пребиотикам, то есть неперевариваемым ингредиентам пищи, которые благотворно влияют на пищеварение за счет избирательной стимуляции роста бифидобактерий и лактобактерий. Неперевариваемые олигосахариды также способствуют образованию однородного мягкого стула у детей, получающих грудное молоко [8, 10].
Известно, что новорожденные, находящиеся на грудном вскармливании, гораздо реже подвержены заболеванию кишечными инфекциями. Этот эффект полностью связан с защитными свойствами бифидобактерий. Бифидобактерии выделяют особые субстанции — ингибиторы роста возбудителей инфекционных заболеваний. Они также вырабатывают уксусную и молочную кислоты, которые повышают кислотность желудочного сока. За счет этого в желудке создается антибактериальная среда, губительная для патогенных микроорганизмов.
Предполагается, что бифидобактерии повышают иммунный ответ у грудных детей [1,12]. Исследования показали, что в каловых массах детей в возрасте 12 месяцев, страдающих атопическими заболеваниями, количество клостридий повышено, а количество бифидобактерий снижено. В возрасте 3 недель у этих детей также наблюдалось снижение количества бифидобактерий по отношению к клостридиям [11]. Сравнительное исследование кишечной микрофлоры у здоровых детей первого года жизни и детей с атопией продемонстрировало аналогичное снижение количества бифидобактерий у детей-атопиков [12]. Этот факт неоспоримо доказывает влияние здоровой кишечной бифидофлоры на нормальное функционирование иммунной системы ребенка.
 |
| Рисунок 1. Химическое строение галактоолигосахаридов (ГОС) |
Для того чтобы помочь правильному формированию бифидофлоры детей на искусственном вскармливании, разработана специальная смесь пребиотических волокон олигосахаридов, которые по своему составу и свойствам воспроизводят пребиотический эффект олигосахаридов грудного молока. Разработанная смесь олигосахаридов, представляющая собой специально подобранную комбинацию короткоцепочечных галактоолигосахаридов (ГОС) (рис.1) и длинноцепочечных фруктоолигосахаридов (ФОС) (рис. 2), включена в состав детского питания «Нутрилон Омнео», «Нутрилон 1» и «Нутрилон 2» с пребиотиками (Nutricia, Голландия).
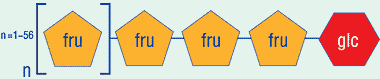 |
| Рисунок 2. Химическое строение фруктоолигосахаридов (ФОС) |
ГОС являются углеводами, которые состоят из молекул галактозы и глюкозы и включают в себя смесь молекул с длиной цепи от 2 до 7 молекул сахаров. ГОС присутствуют в грудном молоке, в ферментированном молоке и молочных продуктах.
ФОС также являются углеводами, состоящими из молекул фруктозы и глюкозы, с длиной цепи от 5 до 60 молекул сахаров. ФОС содержатся в большом количестве продуктов питания, таких как пшеница, бананы, цикорий, артишоки и лук-порей. Многочисленные исследования доказали, что сочетание двух видов пребиотических волокон — галакто- и фруктоолигосахаридов наиболее эффективно увеличивает количество бифидобактерий и лактобактерий в микробиоценозе толстой кишки [13, 14, 15, 16, 17].
Эффективность пребиотических волокон олигосахаридов в составе детских смесей была доказана рядом клинических испытаний [18, 19, 20]. При проведении двойного слепого рандомизированного исследования две группы здоровых, рожденных в срок младенцев в течение первой недели жизни получали заменители грудного молока. Первая группа детей получала заменитель грудного молока с добавлением смеси пребиотических волокон (Nutricia, Голландия). Вторая группа детей — стандартный заменитель грудного молока, не содержащий пребиотические волокна [20]. На 1-й и 28-й день исследования в стуле младенцев проводилось определение количества бифидобактерий.
Содержание бифидобактерий в 1-й день исследования было одинаковым у всех детей. На 28-й день исследования количество бифидобактерий в микрофлоре кишечника детей первой группы было значительно выше по сравнению с детьми второй группы. Более того, количество бифидобактерий у детей первой группы достигло уровня, сходного с количеством бифидобактерий у детей на грудном вскармливании (рис. 3) [20, 21]. В дополнение исследование продемонстрировало увеличение количества лактобацилл в стуле детей, получающих смесь с добавлением пребиотических волокон.
Стул детей первой группы был намного мягче стула детей второй группы и был больше похож на стул детей, получающих грудное молоко (рис. 4) [20, 21]. Эффект мягкого стула, обусловленного воздействием смеси пребиотических волокон, очень важен. Общеизвестно, что матери младенцев, получающих искусственное питание, гораздо чаще озабочены проблемой твердого стула у своих детей, чем матери, кормящие своих детей грудью [22]. Проведенное исследование также подтвердило, что значительное число матерей, чьи дети являются «искусственниками», отмечают у них частое возникновение запоров.
Таким образом, дети, получающие заменители грудного молока со смесью пребиотических волокон олигосахаридов, лучше защищены от воздействия инфекционных агентов благодаря формированию функциональной кишечной флоры. Пищеварительный процесс у них приближен к перевариванию пищи в желудочно-кишечном тракте детей, которых кормят грудью, что существенно повышает качество жизни ребенка, вынужденного находиться на искусственном вскармливании.
По вопросам литературы обращайтесь в редакцию
А. И. Хавкин, доктор медицинских наук, профессор
Е. С. Киселева, кандидат медицинских наук
НИИ педиатрии и детской хирургии