Что такое онкогенные вирусы
Что такое онкогенные вирусы
Открытие вирусов, вызывающих злокачественные опухоли у животных, произошло еще на рубеже XIX и XX веков. В 1910 г. Пейтон Рауш обнаружил, что бесклеточный фильтрат из тканей птичьей саркомы может вызывать развитие аналогичной саркомы у цыплят. Примерно в это же время была доказана вирусная природа птичьего миелобластоза. Позднее было обнаружено, что часто проходит весьма значительный латентный период между инфицированием вирусом и развитием рака.
Тем не менее вплоть до 1960-х годов не существовало четких доказательств того, что инкорпорация вирусной ДНК в геном клетки является необходимым условием развития злокачественной трансформации, как не было и случаев выделения вирусной ДНК из раковых клеток.
В настоящее время выделяют два типа вирусных онкогенов. Оба этих типа онкогенов встраиваются в клеточную ДНК. Вирусы первого типа несут онкогены, которые вызывают быструю злокачественную «трансформацию» клеток в культурах in vitro, а в организме вызывают развитие опухолей. При втором типе вирус действует медленнее и для развития опухоли требуется значительное время. Вирусы второго типа не вызывают злокачественной трансформации клеток в культурах in vitro.
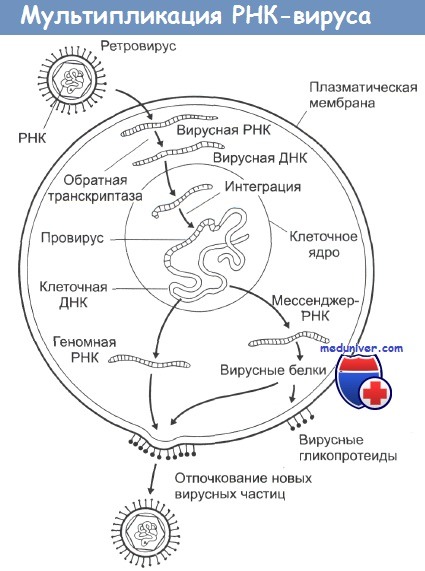
Эта ДНК затем встраивается в клеточные хромосомы, и на ее основе клетка уже сама начинает синтез новых вирусных белков, вирусных обратных транскриптаз и элементов гликопротеиновой оболочки. Из-за механизма их действия этот тип вирусов получил название ретровирусы. Все они имеют весьма схожий внешний вид на электронных микрофотографиях и являются самыми маленькими из известных вирусов.
Некоторые из ретровирусов (например, вирусы птичьего лейкоза, кошачьей и мышиной лейкемии) содержат в себе только три гена и обладают очень длительным инкубационным периодом с момента заражения до возникновения опухоли. Другие вирусы (например, вирус саркомы Рауса (ВСР)) вызывают очень быструю злокачественную трансформацию и могут быть выделены из культуры опухолевых клеток.
Показано, что вирус ВСР содержит особый ген (v-src), способный вызывать трансформацию фибробластов in vitro. Этот ген кодирует наработку протеинкиназы, которая фосфорилирует тирозин. К сожалению, действие этой протеинкиназы запускает целый каскад различных метаболических процессов, и очень сложно оценить, какой именно из них ведет к злокачественной трансформации.
В настоящее время известно, что и нормальные, и злокачественные клетки содержат в своем генотипе участки ДНК, сходные или идентичные ряду последовательностей онкогенных РНК-содержащих вирусов. Такие участки получили название клеточных прото-онкогенов (чтобы отличать их от вирусных онкогенов). Постулируется, что активация этих участков, возникающая в результате канцерогенного воздействия, запускает целую цепочку событий, ведущую в итоге к злокачественной трансформации клетки. Считается также, что ретровирусы инкорпорировали эти клеточные участки в свой геном в процессе эволюции.
В настоящее время мы лучше понимаем механизмы действия продуктов вирусной активации. Примером такого продукта является протеинкиназа, активируемая геном sre, а также целый ряд других вирус-индуцированных канцерогенов. Это и рецепторы к эпидермальному фактору роста, продуцируемые геном v-erb, и тромбоцитарный фактор роста (ТФР), кодируемый фрагментами гена v-sis, и целый ряд связывающихся с ядром клетки белков, продукцию которых вызывает вирус птичьей лейкемии.
Вирусные онкогенные молекулы в большинстве случаев структурно отличаются от своих аналогов клеточного происхождения; кроме того, в них отсутствуют интроны. Например, белок, кодируемый геном v-erb, гомологичен клеточному рецептору к эпидермальному фактору роста (ЭФР), но в нем отсутствует часть экстраклеточного домена, включая ЭФК-специфичный сайт. Так как в продуцируемой вирусом молекуле отсутствует плазматический участок, ответственный за автофосфорилирование, такой вирусный рецептор все время находится во «включенном» состоянии.
Как нормальные, так и раковые клетки содержат в себе участки последовательностей ДНК, гомологичные РНК онкогенных вирусов. Если происходит экспрессия или активация под действием канцерогенов этих клеточных онкогенов, это ведет к злокачественной трансформации клеток.
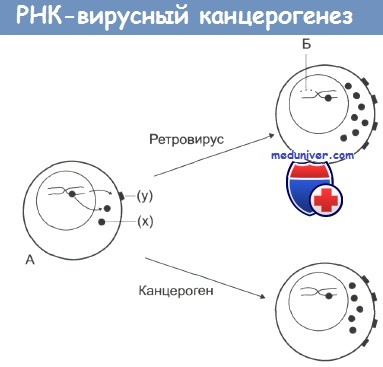
На стадии А нормальная клетка, которая характеризуется низкой протоонкогенной активностью, продуцирует фактор роста (х) или белки дифференцировки или рецепторы (у).
Канцерогены повышают активность протоонкогенов, что дает начало неопластической трансформации.
По другому механизму: при заражении ретровирусом происходит внедрение в ДНК клетки вирусных промоторов или онкогенов (Б), что также ведет к увеличению онкогенной активности и последующей злокачественной трансформации.
Вирус может активировать процессинг в клетках путем внедрения в их ДНК специальных регуляторных последовательностей — промоторов считывания белка, нарушая таким образом нормальные процессы транскрипции. Запускаемый таким образом механизм внедренного мутагенеза может вовлекать в себя целый комплекс различных процессов. Примером может служить внедрение в ДНК клетки вирусной после довательности «многочисленных терминальных повторений» (МТП). При внедрении в клеточную ДНК данная последовательность инициирует транскрипцию в обоих направлениях цепочки ДНК, позволяя транскрибировать одновременно как клеточные, так и вирусные гены. Такой механизм действия характерен для вируса клеточного лейкоза, когда вирусная ДНК интегрируется в клеточную сразу вслед за участком с-тус, вызывая его активацию.
Первым ретровирусом, для которого была однозначно доказана связь со злокачественными новообразованиями, был вирус Т-клеточной лейкемии человека (ВТКЛ-1), выделенный из клеток хронической кожной Т-лимфомы. Этот вирус довольно широко распространен, может передаваться половым путем, через кровь, особенно в среде наркоманов, и от беременной женщины к плоду. Первоначально эндемический ареал циркуляции данного вируса был в основном представлен тропическими странами, однако в настоящее время в США серопозитивная реакция на вирус обнаруживается у каждого из 4000 человек населения. Кроме Т-клеточной лейкемии вирус вызывает тропический спастический паралич.
После 20 лет наблюдения за серопозитивными пациентами оценено, что риск развития последнего заболевания составляет около 5%. Один из вирусных генов, а именно tax-ген, вызывает увеличение продукции клеточного интерлейкина-2 (ИЛ-2) и его рецепторов, что является основным фактором, стимулирующим деление Т-клеток.
Ретровирусы могут вызывать опухолевые заболевания не напрямую, а опосредованно, как это было показано для вируса иммунодефицита человека (ВИЧ-1), вызывающего развитие СПИДа. Случаи развития рака у ВИЧ-инфицированных рассмотрены в одном из обзоров. Отмечается, что у ВИЧ-инфицированных наиболее часто развиваются три типа опухолей: мгновенная или высокозлокачественная В-клеточная лимфома; саркома Капоши (СК, которую вызывает другой вирус — герпесвирус ГСК, или герпесвирус 8); карцинома шейки матки.
До разработки эффективных методов терапии ВИЧ-инфицированных более 40% из них заболевали тем или иным видом рака. Тем не менее связь этого вируса с развитием онкологических заболеваний скорее всего косвенная и опосредована развитием общей хронической иммунодепрессии организма, которая и позволяет другим канцерогенным вирусам вызывать рак. В-клеточные лимфомы также характеризуются довольно сложным патогенезом. Хотя В-клетки не поражаются вирусом ВИЧ-1, они могут быть мишенью для других типов вирусов, например для вируса Эпштейна-Барра (ВЭБ). Рак шейки матки у женщин также развивается на основе вторичной вирусной инфекции — вируса папилломы человека (ВПЧ), на фоне общей иммунодепрессии, вызванной ВИЧ-1. По причине общего снижения иммунных реакций организма все эти опухоли развиваются особенно быстро и агрессивно.
Показано, что РНК-содержащий вирус гепатита С значительно увеличивает риск заболевания гепатоклеточной карциномой. У больных, инфицированных этим вирусом, риск развития раковой опухоли возрастает в 100 раз, но механизмы его канцерогенного действия в настоящее время почти не изучены. Если больной заражен еще и вирусом гепатита В, риск развития рака печени возрастает многократно. На земном шаре одним или обоими из этих вирусов заражено около миллиарда человек.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Онкогенные вирусы
Инфекция, вызванная онкогенными вирусами, является причиной 15,4% заболеваний раком по всей земле. Первый онкогенный вирус, который был идентифицирован — это куриный вирус саркомы Рауса в 1911 году. Десятилетиями позже были обнаружены серии других онкогенных вирусов, в том числе вирус папилломы Шопа (вирус папилломы кроличьего хвоста), вирус опухоли молочной железы мыши, аденовирус, вирус SV40 (обезьяний вирус sv40). Теория опосредованного вирусом онкогенеза в итоге была экспериментально продемонстрирована в 1976 году Гарольдом Вармусом и Майклом Бишопом путем превращения инфицированных клеток в опухолевые вирусом саркомы (ген v-src вызывает образование опухоли после захвата протоонкогена человеческой клетки в результате трансдукции).
Несмотря на то, что онкогенные вирусы нашли в исследованиях онкогенной активности животных клеток, они были не в состоянии преобразовать человеческие клетки. Теория вирусного онкогенеза в человеческой клетке оставалась спорной до 1965 года, когда вирус Эпштейн-Барр (EBV) был обнаружен в клетках лимфомы Беркитта. В ходе последующих исследований, в том числе выделении Т-лимфотропного вируса человека (HTLV) из клеток Т-клеточной лимфомы и выявлении роли папилломовирусов человека с высокой онкогенной активностью в развитии рака шейки матки, был определен путь для понятия человеческих онкогенных вирусов. Обнаружение связи между герпес-вирусом и саркомой Капоши (KSHV) и лимфомой и между полиомавирусом клеток Меркеля (MCV) и карциномой клеток Меркеля (MCC) подчеркнуло возможность открытия еще большего количества онкогенных вирусов с помощью современных технологий. Далее каждый вирус будет рассмотрен отдельно.
Вирус Эпштейн-Барр
Вирус Эпштейн-Барр (ВЭБ, EBV) — ДНК-содержащий вирус, который преимущественно поражает B-лимфоциты, также является митогеном для них; вызывает лимфопролиферативные болезни (лимфома Беркитта, носоглоточная карцинома, NK-клеточная лейкемия, лимфома Ходжкина и т.д.), а также инфекционный мононуклеоз. Вирионы вируса были обнаружены при электронной микроскопии биоптата лимфомы Беркитта в начале 1964 года Энтони Эпштейном и Ивонной Барр.
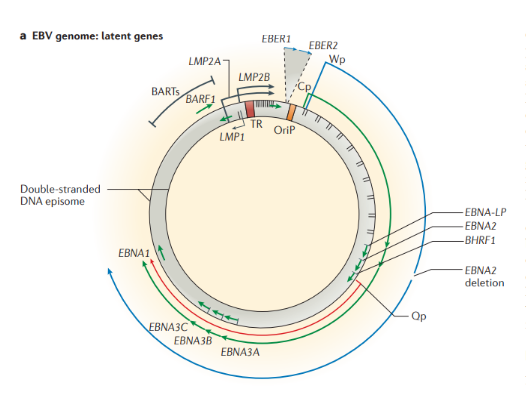
Строение. ВЭБ имеет вирусный капсидный антиген (VCA), ядерные антигены-EBNAs 1, 2, 3, 3a, 3b, 3c; латентные мембранные протеины (LMPs) 1, 2 и две маленькие Эпштейна-Барр-кодируемые РНК (EBER) молекулы — EBER1 и EBER2. EBNAs и LMPs являются ДНК-связывающими белками, считающимися необходимыми для развития инфекции и фиксации.
В зависимости от набора экспрессируемых вирусных генов в пораженных клетках выделяют три типа латентности (I, II и III тип), характерные для различных видов лимфом: I тип подразумевает избирательную экспрессию EBNA-1 при ВЭБ-положительной лимфоме Беркитта; II тип заключается в экспрессии EBNA-1, LMP-1 и LMP-2 и является отличительным признаком ВЭБ-положительной ходжкинской лимфомы, периферических T/NK-клеточных лимфом; латентность III типа, характеризуемая экспрессией всего набора из девяти латентных белков ВЭБ, наблюдается при лимфопролиферативных поражениях, возникающих у пациентов с тяжелым иммунодефицитом (после трансплантации паренхиматозных органов или стволовых клеток, ВИЧ-инфекции). Тип латентности определяет восприимчивость инфицированных клеток к различным иммунотерапевтическим тактикам. Индуцированные ВЭБ злокачественные новообразования связаны с экспрессией латентных генов. У большинства иммунокомпетентных носителей ВЭБ вирус не индуцирует опухолевый процесс. Новообразования развиваются при комплексном взаимодействии ВЭБ, иммуногенетических факторов, факторов внешней среды (паразитарных инфекций — чаще, малярии, недоедании, потреблении пищи, содержащей канцерогены) и иммунодефицита (ВИЧ-инфекция, трансплантация).
Папилломавирусы человека
Описано около 200 папилломавирусов. Вирусы передаются при контактах через микротравмы кожи и слизистых оболочек, а также половым путем. Папилломавирусы человека вызывают доброкачественные кожные, генитальные, оральные и конъюнктивальные папилломы; индуцируют пролиферацию эпителия, обладают онкогенным потенциалом. С папилломавирусом, особенно ПВЧ-5 и ПВЧ-8, тесно связано развитие немеланомных разновидностей рака кожи. Различают низкоонкогенные папилломавирусы, вызывающие бородавки, которые не малигнизируются, и высокоонкогенные, способные вызвать рак шейки матки, — ПВЧ-16, 18, 31, 33, 35, 45, 51, 52, 58.
Строение. Капсид икосаэдрический, состоит из двух капсидных белков (L1-L2), формирующих 72 пентамера. Геном — двунитевая циркулярная ДНК; имеет в зависимости от вируса восемь ранних генов (E1-E8) и два поздних гена (L1-L2). Гены E6-E7 обладают онкогенной активностью.
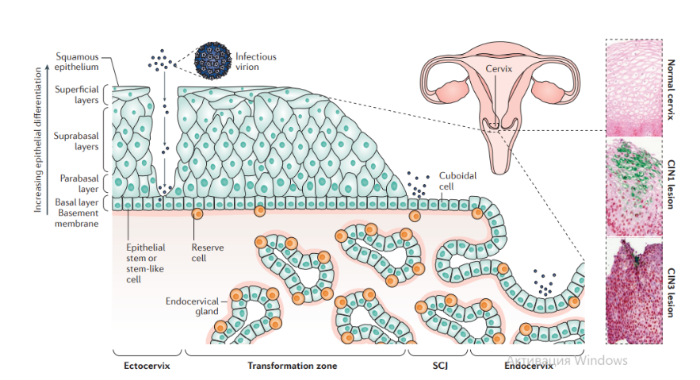
Патогенез. В целом, для развития продуктивного поражения ВПЧ (высокого или низкого риска) требуется, чтобы вирус имел доступ к эпителию базального слоя как только эпителиальный барьер был подвержен риску. Папилломавирусы должны инфицировать делящуюся клетку, чтобы стать признанными как малое количество копий ядерной эписомы, и для развития стойкого поражения первичная инфицированная клетка, вероятно, должна быть похожа на долгоживующую эпителиальную стволовую клетку или похожую на нее. Кроме того, связанные с заживлением ран изменения в местном микроокружении, включая увеличение количества факторов роста, могут играть ключевую роль в создании резервуара инфекции в базальном слое. Способность ВПЧ инфицировать, и реплицироваться, и управлять прогрессированием рака зависит от функции вирусного белка, положении в эпителии, где эти белки экспрессируются. Как только инфицированные базальные клетки поделились и в конечном итоге вошли в парабазальный слой, они начинают проходить программу экспрессии генов, которая связана с дифференциацией. Амплификация вирусного генома обычно происходит в срединно-эпителиальных слоях, тогда как сбор и выход вируса происходит вблизи наружной поверхности эпителия.
Несмотря на то, что эффективная амплификация генома требует комбинированного действия множественных продуктов вирусного гена, включая E6, E7, E2 и кодированную вирусом геликазы E1, поддержание репликации в базальном слое эпителия может зависеть от факторов репликации клетки хозяина. Программа, зависящая от дифференциации, которая происходит в надбазальных слоях эпителиальной клетки, включает как временные изменения в активности промотора, так и изменения в шаблонах сплайсинга мРНК, которые облегчают производство различных продуктов вирусных генов на разных стадиях во время программы дифференциации. Функция вирусного белка далее регулируется посттрансляционной модификацией, включая фосфорилирование и протеолитическое деление клетки.
Герпесвирус, ассоциированный с саркомой Капоши
KSHV, или человеческий герпесвирус 8, был обнаружен в 1994 году как член семейства гамма-герпеса человека, присоединившись к ВЭБ. Инфекция иммунокомпрометированных индивидуумов с KSHV была связана с развитием саркомы Капоши, полученной из эндотелиальных клеток, и по меньшей мере двумя B-лимфоцит лимфопролиферативными заболеваниями: первичная выпотная лимфома и многоцентричная болезнь Кастлмана. Однако изучение патогенеза и онкогенеза KSHV затруднено отсутствием значимой модели животных и восприимчивой клеточной культуры.
Онкогенное действие. Две иммортализованные клеточные линии, KS Y-1 и SLK, когда-то использовались для исследований KS и KSHV, но в KS Y-1 были также обнаружены клетки линии рака мочевого пузыря T 24, что затруднило дальнейшую работу. Первичные эмбриональные метанефрические мезенхимальные клетки-предшественники почек крысы восприимчивы к инфекции и трансформации KSHV, но из них распространяются ограниченное количество инфекционных вирионов. Линии B-клеток, полученные из первичной выпотной лимфомы, обычно заражаются KSHV на латентной стадии и могут быть индуцированы для получения малого количества вирионов KSHV, но первичные B-лимфоциты из периферической крови или тонзиллярной ткани являются устойчивыми к инфекции KSHV, и для их инфицирования может потребоваться совместный рост с KSHV-позитивными клетками.
Т-лимфотропный вирус человека (HTLV)
T-лимфотропный вирус человека (HTLV) относится к семейству ретровирусов, является возбудителем T-клеточного лимфолейкоза взрослых. Вирус впервые был изолирован в 1980 году от больного Т-лимфомой.
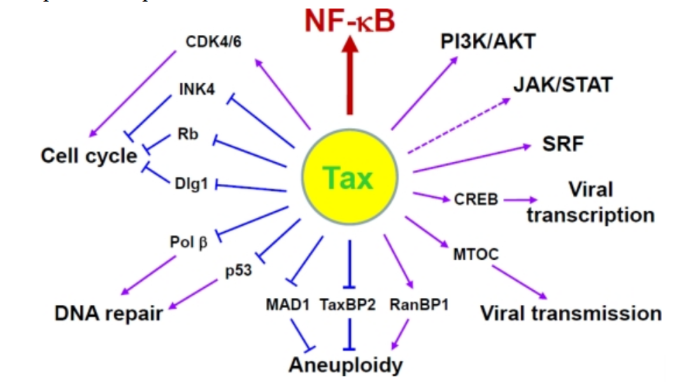
Геном. Gag, Pol и Env являются вирусными структурными белками, другие — вирусными регуляторными/вспомогательными белками. За исключением гена hbz, который кодируется минус-цепью провирусного генома HTLV из 3′-LTR, все остальные гены кодируются плюсовой нитью по направлению 5′-LTR. Следует отметить, что 5′-LTR часто удаляется или метилируется по мере прогрессирования заболевания. Кроме того, на поздних стадиях лейкемиогенеза в гене tax часто возникают нонсенс- или миссенс-мутации. Хотя белок tax и ген HBZ индуцируют опухоли у трансгенных мышей, а p12 проявляет слабую онкогенную активность, ни один из вирусных белков/генов, кроме tax, не требуется для опосредованного HTLV-1 опухолеобразования. Продукт tax гена действует на терминальные повторы LTR, стимулируя синтез вирусной иРНК, а также образование рецепторов IL-2 на поверхности зараженной клетки.
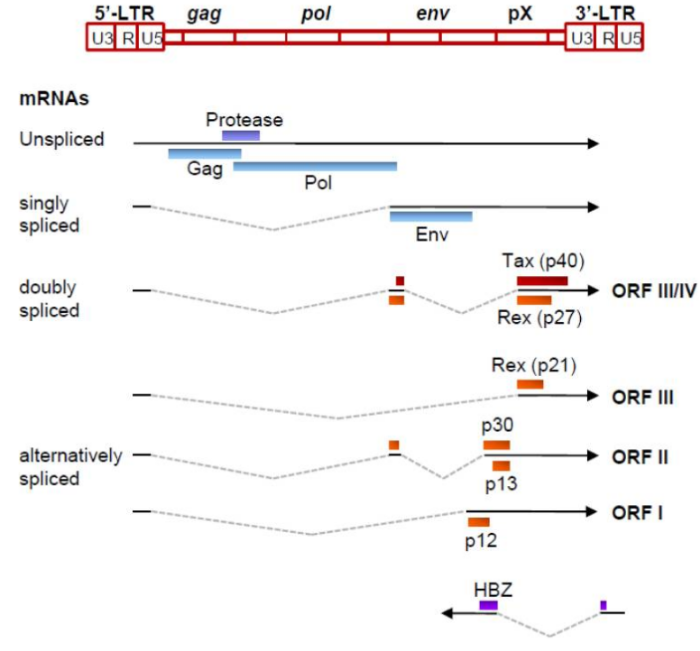
Рисунок 4. К леточные пути вирусного онкобелка tax
Патогенез. Проникновение HTLV-1 в клетку человека охарактеризовывает начало выживания и репликации вируса. HTLV-1 связывается с рецептором клеток, имеющих необходимый антиген, что инициирует процесс инвазии. Рецепторный комплекс состоит из транспортера глюкозы (GLUT1), гепаринсульфат протеогликана (HSPG) и рецептора VEGF-165 нейропилина-1 (NRP-1). HTLV-1 взаимодействует с HSPG. Процесс слияния происходит через комбинацию GLUT1 с HSPG/NRP-1, после чего ядро, содержащее вирусную РНК, доставляется в цитоплазму клеток-мишеней. После обратной транскрипции HTLV-1 встраивает свой геном в генома хозяина, чтобы сформировать провирус, окруженный двумя LTR на 5′ и 3′ концах. Затем провирус транскрибируется и кодирует структурные, регуляторные и вспомогательные белки. Впоследствии вирусные геномные РНК и Gag, Env и Gag-Pol белки переносятся в плазматическую мембрану, чтобы начать собираться в зрелую вирусную частицу.
Вирусы гепатита
Вирус гепатита В (HBV) и вирус гепатита С (HCV) представляют собой несвязанные вирусы, имеющие тропность к гепатоцитам и реплицирующиеся в них. Около 2 миллиардов человек инфицированы HBV, и более 350 миллионов человек становятся хроническими носителями. Только 5-10% взрослых, которые приобретают инфекцию, становятся хроническими носителями, у 30% развиваются прогрессирующие хронические заболевания печени: гепатит, фиброз, цирроз и, наконец, гепатоцеллюлярная карцинома (HCC).
Геном. Геном вируса гепатита B представляет собой одну двухцепочечную кольцевую ДНК длиной около 3200 нуклеотидов (длина генома различна у разных изолятов). Одна из цепей («плюс-цепь») ДНК короче другой (ее длина составляет 1700-2800 нуклеотидов). Вторая цепь тоже не является замкнутой и к ее 5’-концу ковалентно присоединена молекула полимеразы (P). В геноме вируса найдено 4 гена: S, С, Р, X, кодирующих соответственно HBsAg, HBcAg, полимеразу и белок-регулятор экспрессии генов. Кроме того, там есть регуляторные последовательности ДНК, ответственные за синтез белков и репликацию вируса. Гены частично перекрываются, что обусловливает малый размер генома.
Патогенез. HCC, индуцированная посредством HBV и HCV, развивается в области воспаления и регенерации, что является результатом хронического повреждения печени, а это в свою очередь указывает на то, что патогенез HCC иммунно-опосредован. Эти вирусы постоянно реплицируются в культуре клеток без явных повреждений и смерти клеток, подразумевая, что они являются не цитопатическими. Постоянная репликация вируса является фактором риска для образования HCC, потому что воспаление часто приводит к длительным хроническим заболеваниям печени CLD без выведения вируса. В этом контексте HBV и HCV генерируют белки, подавляющие иммунитет, который должен контролировать хронические инфекции. HBV- и HCV-кодированные белки изменяют экспрессию гена хозяина и клеточный фенотип, что является признаком рака. Эти изменения способствуют независимой от фактора роста пролиферации, сопротивлению к ингибированию роста, инвазии тканей и метастазированию, ангиогенезу, перепрограммированию энергетического метаболизма и устойчивости к апоптозу. Хроническое воспаление также способствует генетической нестабильности в клетках опухоли. Вклад HBV в развитие HCC включает в себя экспрессию гена гепатита Bx (HBx) и, возможно, усеченные пре-S или S-полипептиды карбоксимицина; основной белок и неструктурные (NS) белки NS3 и NS5A HCV способствуют онкогенной трансформации. Изменения в экспрессии гена хозяина, которые способствуют возникновению опухолевого генеза, также, похоже, поддерживают репликацию вируса и/или защиты вирусных гепатоцитов от иммунного опосредованного повреждения и разрушения.
Что нужно знать об онкогенных вирусах
Когда речь идет об онкологических заболеваниях, редко кому приходит в голову, что раком можно заразиться. Однако уже достоверно известно, что ряд вирусов вызывает определенные злокачественные образования, причем некоторые из этих вирусов передаются от человека к человеку
Онкогенная активность вирусов
С развитием злокачественных опухолей ассоциированы представители четырех семейств вирусов. Процесс трансформации нормальных клеток в злокачественные изучен для шести вирусов, которые вызывают 15% всех опухолей человека. К канцерогенным относят вирусы простого герпеса 2-го (HHV-2) и 8-го типа (HHV-8); вирус Эпштейна — Барр; вирус папилломы человека;
Вирус простого герпеса; просвечивающая электронная микроскопия
вирусы Т-лимфоцитов-1 (НТLV-1) и Т-лимфоцитов-2 (НТLV-2). Доказана канцерогенная роль вируса папилломы человека в развитии рака шейки матки, вируса гепатита B — в развитии рака печени, ВИЧ — в развитии саркомы Капоши.
Попадая в организм человека, генетический материал вируса может активно взаимодействовать с ДНК хозяина, активируя протоонкогены человека и трансформируя их в действующие онкогены. Геном некоторых ретровирусов содержит самостоятельные высокоактивные онкогены, активирующиеся после включения ДНК вируса в ДНК клеток человека. Большинство онкогенных вирусов обладают специфическим клеточным тропизмом. Отличительным признаком опухолей, ассоциированных с вирусами, является то, что опухолевые клетки содержат вирусный геном.
География вирусного канцерогенеза
Частота опухолей, связанных с онкогенными вирусами, отличается в зависимости от континента. Вирус НТLV-1 (АТLV) распространен в тропических странах, но спорадически вызываемая им лимфома и лейкемия встречаются во всем мире. Заболевание возникает обычно у лиц старше 50 лет, протекает тяжело и быстро приводит к летальному исходу.
Кроме полового пути инфицирования, вирусом можно заразиться при переливании зараженной крови и через загрязненные медицинские инструменты. Этот вирус может проникнуть трансплацентарным путем от матери к плоду. Заболевает один из 2000 инфицированных. В эндемических очагах 20% населения, в основном родственники больных, являются носителями данного вируса.
Инфекция HTLV-1 эндемична в районах Японии. Вирус, очевидно, передается от матери к ребенку, но после инфицирования Т-клеточная лейкемия проявляется не сразу, а лишь спустя 20 лет.
Вирус Эпштейна — Барр вызывает aфpиканскую лимфому Беркитта и недифференцированную назофарингеальную карциному, распространенную в Юго-Восточной Азии. Получены весомые аргументы в пользу возможной этиологической роли вируса Эпштейна — Барр для лимфомы Ходжкина.
Последствия беспорядочных половых связей
По результатам исследования установлено, что беспорядочные половые связи приводят к развитию рака шейки матки и рака полового члена, а также могут быть причиной рака предстательной железы. С этим процессом связывают вирус простого герпеса (симплексвирус 2-го типа). Одним из доказательств служит тот факт, что у монахинь рак шейки матки возникает крайне редко. А у женщин, которые рано начали половую жизнь и часто меняют партнеров, повышен риск развития рака шейки матки.
Вирусы герпеса способны размножаться в клетках эпителия головки члена и внутренней поверхности крайней плоти. Своеобразным резервуаром для вирусов служит смегма, превращающаяся в канцероген для эпителия влагалищного отдела шейки матки. Также половым путем, причем от мужчины к женщине, но не наоборот, передается вирус НТLV-1 (АТLV), который вызывает Т-клеточную лимфому и Т-клеточную лейкемию.
Вирус Эпштейна — Барр вызывает aфpиканскую лимфому Беркитта и недифференцированную назофарингеальную карциному, распространенную в Юго-Восточной Азии. Получены весомые аргументы в пользу возможной этиологической роли вируса Эпштейна — Барр для лимфомы Ходжкина
Папилломы и иммуноскомпрометированные мишени
Папилломавирусы широко распространены среди населения во всем мире, но зачастую никак себя не проявляют. Вирус папилломы человека не только является возбудителем доброкачественных вирусных бородавок на коже и слизистой оболочке ротовой полости, но также ассоциирован с онкологическими заболеваниями гениталий, полости рта и гортани. Значительная часть случаев рака шейки матки, вульвы и яичника связана с воздействием этого вируса. Латентный период до развития рака может длиться до 30 лет. Кроме того, вирус папилломы человека 5-го типа вызывает такое редкое заболевание кожи, как дисплазию Левандовского.
Особую опасность онкогенные вирусы представляют для людей, у которых в силу различных причин снижен иммунитет. Например, на фоне тяжелого иммунодефицита вирус герпеса человека 8-го типа вызывает злокачественные опухоли. Наиболее часто он обусловливает развитие злокачественной опухоли легкого — саркомы Капоши.
Гепатит, вызывающий рак
Вирус гепатита В; просвечивающая электронная микроскопия
В большинстве случаев наличие онкогенных вирусов является недостаточным для 100% развития рака. У многих людей клетки могут быть инфицированными в течение десятилетий, однако лишь у 1% из них развивается опухоль. Вирус гепатита В (гепаднавирус HBV) повышает частоту рака печени лишь в сочетании с другими агентами. Для перехода в активную стадию необходимо наличие не менее двух онкогенов.
Следует отметить, что HBV легко передается от родителей к ребенку. В 90% случаев дети, инфицированные в родах, остаются на всю жизнь постоянно инфицированными. Хроническая инфекция предрасполагает к развитию гепатита, цирроза и гепатоцеллюлярной карциномы. HBV — самый частый из известных факторов риска развития карциномы. Ежегодно в мире с НBV ассоциируется 1 млн новых случаев гепатоцеллюлярного рака. Это заболевание особенно распространено на западе Центральной Африки, на Тайване и в Китае.
Онковирусы не всесильны
Следует подчеркнуть, что обычные контакты с онкологическим больным не приводят к развитию злокачественных опухолей у родственников и медицинского персонала. Все известные опасные онкогенные вирусы передаются только через кровь или половым путем. Кроме того, у многих людей клетки могут быть инфицированы некоторыми онкогенными вирусами десятилетиями, однако лишь у небольшой части зараженных развивается злокачественная опухоль.
Достижения молекулярной биологии и новые знания о вирусном канцерогенезе открывают реальные перспективы для эффективной профилактики опухолевых заболеваний. В частности, применение вакцин может обеспечить защиту от развития рака шейки матки.
Татьяна Кривомаз, канд. биол. наук
На фото под заголовком: вирус папилломы человека, электронная микроскопия; © Institut Pasteur