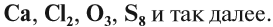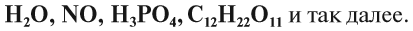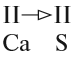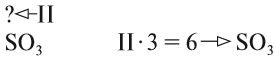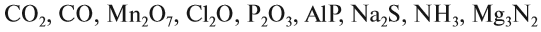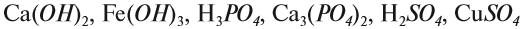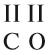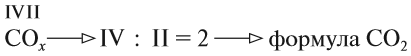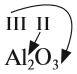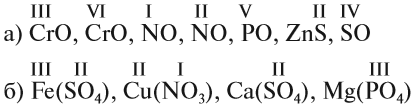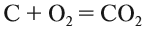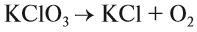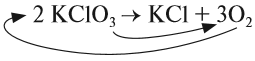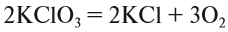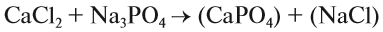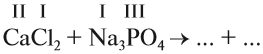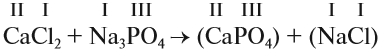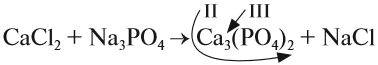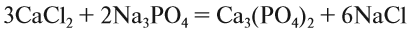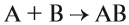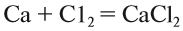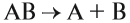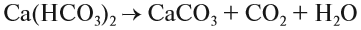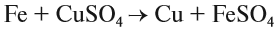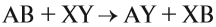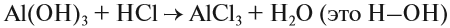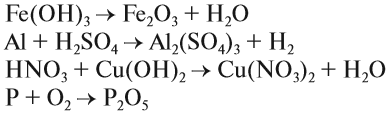Что такое описание в химии кратко
Урок 1. Основные понятия и законы предмета «Химия»
Простейшие понятия: вещество, молекула, атом, химический элемент
Что такое химия? Где мы встречаемся с химическими явлениями? Везде. Сама жизнь — это бесчисленное множество разнообразных химических реакций, благодаря которым мы дышим, видим голубое небо, ощущаем изумительный запах цветов…
Что изучает химия? Химия изучает вещества, а также химические процессы, в которых участвуют эти вещества.
Что такое вещество — понятно: это то, из чего состоит окружающий нас мир и мы сами. Но что такое химический процесс (явление)?
К химическим явлениям относятся процессы, в результате которых изменяется состав или строение молекул, образующих данное вещество. Изменились молекулы — изменилось вещество (оно стало другим!), — изменились его свойства:
Все эти изменения — следствие сложных и многообразных химических процессов. Итак,
химия — это наука о веществах и их превращениях.
При этом исследуются не всякие превращения, а только такие, при которых
В этом определении встречаются такие понятия, как «вещество», «молекула», «атом». Разберём их подробнее.
Вещество — это то, из чего состоят окружающие нас предметы. Каждому абсолютно чистому веществу (таких в природе, кстати, не существует) приписывают определённую химическую формулу, которая отражает его состав, например:
Выше приведены молекулярные формулы двух веществ. Следует отметить, что далеко не все вещества состоят из молекул, так как существуют вещества, которые состоят из атомов или ионов. Например, алмаз состоит из атомов углерода, а обычная поваренная соль — из ионов Na + и ионов Cl – (условная «молекула» — NaСl).
Наименьшая частица вещества, которая отражает его качественный и количественный состав, называется молекулой.
Молекулы состоят из атомов. Атомы в молекуле соединены при помощи химических связей. Каждый атом обозначается при помощи символа (химического знака):
Число атомов в молекуле обозначают при помощи индекса:
Но! Если атомы не связаны химической связью, то их число обозначают при помощи коэффициента:
Аналогично изображают число молекул:
Почему атомы водорода и кислорода имеют разное название, разный символ? Потому что это атомы разных химических элементов.
Химический элемент — это частицы с одинаковым зарядом ядер их атомов.
Что такое ядро атома? Почему заряд ядра является признаком принадлежности атома к данному химическому элементу? Чтобы ответить на эти вопросы, следует уточнить: изменяются ли атомы в химических реакциях? Из чего состоит атом*?
* Подробнее о строении атома будет рассказано в уроке 3.
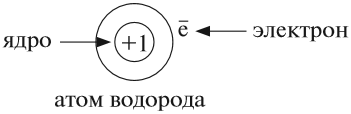
Атом не имеет заряда, хотя и состоит из положительно заряженного ядра и отрицательно заряженных электронов:
В ходе химических реакций число электронов любого атома может изменяться, но заряд ядра атома в химических реакциях НЕ МЕНЯЕТСЯ!
Поэтому заряд ядра атома — своеобразный «паспорт» химического элемента. Все атомы с зарядом ядра +1 принадлежат химическому элементу под названием «водород». Атомы с зарядом ядра +8 составляют химический элемент «кислород».
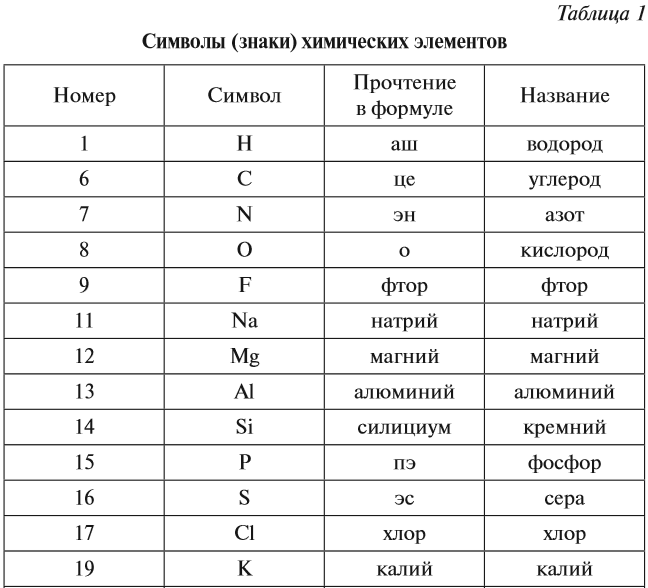
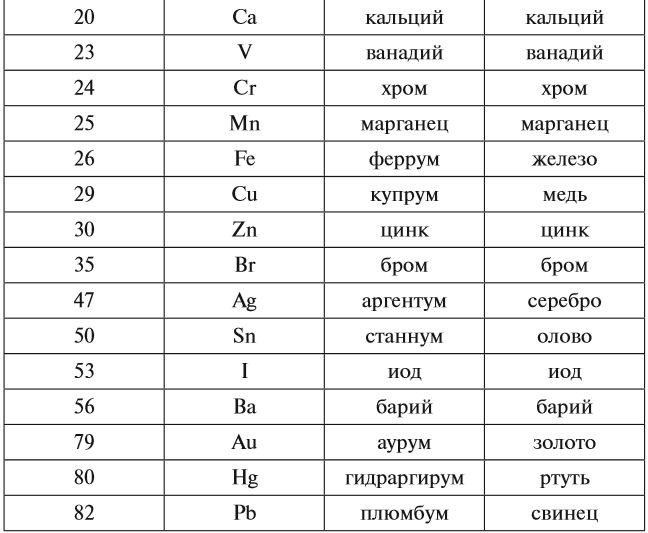
Каждому химическому элементу присвоен химический символ (знак), порядковый номер в таблице Менделеева (порядковый номер равен заряду ядра атома); определённое название и, для некоторых химических элементов, особое прочтение символа в химической формуле (табл. 1).
Подведём итог. Вещества состоят из молекул, молекулы состоят из атомов, атомы с одинаковым зарядом ядра относятся к одному и тому же химическому элементу.
Но, если вещество состоит из молекул, то любое изменение состава или строения молекулы приводит к изменению самого вещества, его свойств.
Вопрос. Чем отличаются химические формулы веществ: Н2О и Н2О2?
Хотя по составу молекулы этих веществ отличаются на один атом кислорода, сами вещества по свойствам сильно отличаются друг от друга. Воду Н2О мы пьём и жить без неё не можем, а Н2О2 — перекись водорода, пить нельзя, а в быту её используют для обесцвечивания волос.
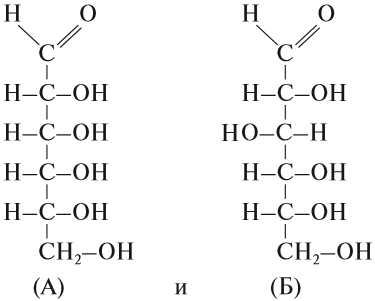
Вопрос. А чем отличаются химические формулы веществ:
Состав этих веществ — аллозы (А) и глюкозы (Б) — одинаков — С6Н12О6. Отличаются они строением молекул, в данном случае — расположением групп ОН в пространстве. Глюкоза — универсальный источник энергии для большинства живых организмов, а аллоза практически не встречается в природе и не может быть источником энергии.
Простые и сложные вещества. Валентность
Вещества бывают простые и сложные. Если молекула состоит из атомов одного химического элемента, — это простое вещество:
Если в состав вещества входят атомы только одного химического элемента — это простое вещество. Причём некоторые химические элементы образуют несколько простых веществ. Так, химический элемент кислород образует простое вещество «кислород» О2 и простое вещество «озон» О3*.
* В 2002 г. появилось сообщение о существовании ещё одного простого вещества кислорода — O4.
А химический элемент углерод образует четыре простых вещества, причём ни одно из них не называется «углерод». Эти вещества отличаются пространственным расположением атомов:
В четвертой модификации «углерода» — фуллерене — атомы углерода образуют сферу, т. е. молекулы фуллерена напоминают мячик.
Существование элемента в виде нескольких простых веществ называется аллотропией. Алмаз, графит, карбин, фуллерен — аллотропные модификации элемента «углерод», а кислород и озон — аллотропные модификации элемента «кислород».
Таким образом, не следует путать эти понятия: «химический элемент» и «простое вещество», а также «молекула» и «атом».
Очень часто в письменных записях слова «молекула» или «атом» заменяют соответствующими символами, но не всегда правильно. Так, нельзя писать: «В состав воды входит Н2», так как речь здесь идёт о химическом элементе водороде — Н. Нужно писать: «В состав воды входит (Н)». Аналогично, правильной будет запись: «При действии металла на раствор кислоты выделится Н2», т. е. вещество водород, молекула которого двухатомна.
Молекулы сложных веществ состоят из атомов разных химических элементов:
Как известно, в состав сложных веществ входят атомы разных химических элементов. Эти атомы соединяются между собой химическими связями: ковалентными, ионными, металлическими.
Способность атома образовывать определённое число ковалентных химических связей называется валентностью. (Подробнее см. урок 4 «Химическая связь».) Правильнее всего определять валентность по графическим или структурным формулам:
В таких формулах одна чёрточка обозначает одну ковалентную связь, т. е. «одну валентность». На практике чаще всего валентность определяют по молекулярной формуле, хотя здесь правильнее говорить о степени окисления элемента (см. урок 7). Иногда результат определения степени окисления соответствует реальному значению валентности, но бывают и неодинаковые результаты.
Задание 1.1. Определите «валентность» (степени окисления) атомов кальция и углерода по формуле СаС2. Совпадает ли полученный результат с реальным значением валентности?
В устойчивой молекуле не может быть «свободных», «лишних» валентностей! Поэтому для двухэлементной молекулы число химических связей (валентностей) атомов одного элемента равно общему числу химических связей атомов другого элемента.
Валентность атомов некоторых химических элементов постоянна (табл. 2).
Для других атомов валентность можно определить (вычислить) из химической формулы вещества.
Строго говоря, по нижеизложенным правилам определяют не валентность, а степень окисления (см. урок 7). Но поскольку в некоторых соединениях числовые значения этих понятий совпадают, то иногда по формуле можно определять и валентность.
При этом следует учитывать изложенное выше правило о химической связи.
Сделаем практические выводы.
1. Если один из атомов в молекуле одновалентен, то валентность второго атома равна числу атомов первого элемента (см. на индекс!):
2. Если число атомов в молекуле одинаково, то валентность первого атома равна валентности второго атома:
3. Если у одного из атомов индекс отсутствует, то его валентность равна произведению валентности второго атома на его индекс:
4. В остальных случаях ставьте валентности «крест-накрест», т. е. валентность первого атома равна числу атомов второго элемента и наоборот:
Задание 1.2. Определите валентности элементов в соединениях:
Вначале укажите валентности атомов, у которых она постоянна! Аналогично определяется валентность атомных групп (ОН), (РО4), (SО4) и так далее.
Задание 1.3. Определите валентности атомных групп (в формулах выделены курсивом):
Обратите внимание! Одинаковые группы атомов (OH), (РО4), (SO4) имеют одинаковые валентности во всех соединениях.
Зная валентности атома или группы атомов можно составить формулу соединения. Для этого пользуются правилами:
Задание 1.4. Составьте химические формулы соединений:
Уравнения химических реакций
Вещества, состав которых отражают химические формулы, могут участвовать в химических процессах (реакциях). Графическая запись, соответствующая данной химической реакции, называется уравнением химической реакции. Например, при сгорании (взаимодействии с кислородом) угля происходит химическая реакция:
Запись показывает, что один атом углерода С, соединяясь с одной молекулой кислорода O2, образует одну молекулу углекислого газа СО2. Число атомов каждого химического элемента до и после реакции должно быть одинаково! Это правило — следствие Закона сохранения массы вещества: масса исходных веществ равна массе продуктов реакции. Закон был открыт в 18-м веке М. В. Ломоносовым и, независимо от него, А. Л. Лавуазье.
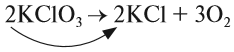
Выполняя этот закон, необходимо в уравнениях химических реакций расставлять коэффициенты так, чтобы число атомов каждого химического элемента не изменялось в результате реакции. Например, при разложении бертолетовой соли КClO3, получается соль КСl и кислород О2:
Число атомов калия и хлора одинаково, а кислорода — разное. Уравняем их:
Теперь изменилось число атомов калия и хлора до реакции. Уравняем их:
Теперь между правой и левой частями уравнения можно поставить знак равенства:
Полученная запись показывает, что при разложении двух молекул КClO3 получается две молекулы КСl и три молекулы кислорода O2. Число молекул показывают при помощи коэффициентов.
При подборе коэффициентов необязательно считать отдельные атомы. Если в ходе реакции не изменился состав некоторых атомных групп, то можно учитывать число этих групп, считая их единым целым:
Последовательность действий такова:
1. Определим валентность исходных атомов и группы PO4:
2. Перенесём эти числа в правую часть уравнения:
3. Составим химические формулы полученных веществ по валентностям составных частей:
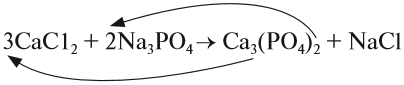
4. Обратим внимание на состав «самого сложного» соединения: Ca3(PO4)2 и уравняем число атомов кальция (их три) и число групп РО4 (их две):
5. Число атомов натрия и хлора до реакции теперь стало равным шести; доставим соответствующий коэффициент:
Эти правила образуют Алгоритм составления уравнений химических реакций обмена, так как, пользуясь этой последовательностью, можно уравнять схемы многих химических реакций, за исключением более сложных окислительно-восстановительных реакций (см. урок 7).
Химические реакции бывают разных типов. Основными являются:
1. Реакции соединения:
Здесь из двух и более веществ образуется одно вещество:
2. Реакции разложения:
Здесь из одного вещества получаются два вещества и более веществ:
3. Реакции замещения:
Здесь реагируют простое и сложное вещества, образуются также простое и сложное вещества, причём простое вещество замещает часть атомов сложного вещества:
4. Реакции обмена:
Здесь реагируют два сложных вещества и получаются два сложных вещества. В ходе реакции сложные вещества обмениваются своими составными частями:
Существуют и другие типы химических реакций.
Задание 1.5. Расставьте коэффициенты в предложенных выше примерах.
Задание 1.6. Расставьте коэффициенты и определите тип химической реакции:
Выводы
Вещества бывают простые и сложные. Состав веществ показывают при помощи химических формул. Формулы веществ составляют, учитывая валентности составных частей этих веществ. Запись химического процесса при помощи формул называется уравнением химической реакции. Химические реакции бывают разных типов: обмена, замещения, разложения, соединения и другие.
Методы исследования в химии
Цель курсовой или дипломной по химии — это конечная точка, к которой должен прийти студент в своём исследовании. Задачи — пункты, составляющие маршрут. А методы — способы, которые помогают успешно справиться со всеми вызовами в пути и достичь поставленной цели.
А какие именно теоретические и экспериментальные методы исследования чаще всего используют в химии? В чём их особенности и отличия от других? Обо всё этом расскажем в статье, а также приведём примеры, как применяют методы исследования в химии.
Не забудьте подписаться на наш информационный канал в Telegram — в нём мы публикуем актуальные и полезные новости. И следите за акциями и скидками от компании.
Доверь свою работу кандидату наук!
Узнать стоимость бесплатно
Методы исследования в химии: определение и классификация
Методы исследования: определение понятия
Прежде чем мы рассмотрим, какие современные методы исследования используют в химии, давайте дадим научное определение этому понятию:
Методы исследования — это способы познания в научно-исследовательских работах, которые включают в себя специфические методики, приёмы и подходы. Все методы, используемые в процессе, составляют методологическую базу исследования.
Классификация современных методов исследования в химии
Химия — практическая наука. Именно поэтому большинство работ по этой научной дисциплине имеют экспериментально-аналитический характер. Соответственно большинство методов исследования веществ, соединений, реакций и явлений в химии относятся к эмпирическим.
Для удобства мы разделили самые популярные методы исследования на три большие группы:
Проводя химические опыты, соблюдайте правила безопасности
Первые две группы методов встречаются в методологиях других наук, а специальные, или узкоспециализированные — только в химических исследованиях.
В химии применяют разные методы, в том числе и междисциплинарные. Это методологические приёмы, которые решают задачи смежных наук. Например, физико-химический анализ подходит для физических, химических, биологических и даже исторических исследований.
Методы научного исследования в химии: описание
Чтобы выбрать методы, которые лучше всего помогут раскрыть тему вашего исследования, стоит разобраться, что они из себя представляют и для каких задач применяются.
Общенаучные теоретические методы исследования в химии
Самыми востребованными теоретическими методами в химии являются:
Кстати! Для наших читателей сейчас действует скидка 10% на любой вид работы.
Метод наблюдения
Наблюдение — это внешнее изучение определённых химических явлений или веществ. Как правило, чтобы этот метод был эффективным, исследователь должен соблюдать следующие условия:
Только соблюдая условия, можно получить чёткие результаты и не запутаться в большом количестве данных.
Пример: провести наблюдение за химической реакцией сульфита меди и хлорида натрия.
Метод описания
Метод описания в химии чаще всего дополняет другие методы. С его помощью перечисляют основные признаки веществ и изображают химически проведённые опыты.
Пример: описать состав комплексных химических соединений тетрафторобериллат (II) калия и тетрагидридоалюминат (III) лития.
Метод моделирования
В химии далеко не все химические реакции можно провести в лаборатории. Для сложных явлений используют метод моделирования. С его помощью создают модели, по которым проверяют выдвинутые гипотезы.
Применяют две группы моделей:
Пример: провести молекулярное моделирование структурного состава атома водорода.
Метод абстрагирования
Метод абстрагирования применяют, когда необходимо отбросить несущественные показатели и более подробно исследовать общие закономерности химических веществ и явлений.
Пример: изучить общие свойства неорганических веществ.
Общенаучные эмпирические методы исследования в химии
К методам экспериментальных исследований в химии относят:
Метод эксперимента
Чем отличается эксперимент от наблюдения? Тем, что экспериментальные опыты — это всегда активное воздействие на изучаемый материал. Эксперимент проводят в контролируемых условиях и используют для практической части исследования.
Пример: провести химические опыты, позволяющие очистить загрязненную поваренную соль.
Метод измерений
Без метода измерений в химической науке никуда. Ведь мало просто провести научный эксперимент и описать реакцию. Надо понимать, какие показатели измерять и как их сравнивать, чтобы делать правильные выводы.
Пример: измерить физико-химические показатели горючего.
Важный этап любого опыта — записать выполненные измерения
Метод анализа
Аналитические методы в современных исследованиях химии очень важны. Они помогают изучать химические вещества с разных сторон, специально проводить нужные реакции и получать обоснованные выводы.
Пример: провести сравнительный анализ методов получения бутандиола-1,4.
В химии существует большое количество различных видов анализа. Их можно смело отнести к следующей группе методов — специальных.
Существует даже целая отдельная отрасль — аналитическая химия, в которой существуют собственные методы исследования: методы разделения и концентрирования, метод испарения, гравиметрический анализ, титриметрический анализ, хроматографические методы и так далее.
Метод синтеза
Метод синтеза в химии помогает получать новые вещества в процессе химических реакций. Он также важен, как и анализ. Его часто применяют в качестве метода исследования в органической химии.
Пример: описать историю химического синтеза и его важное значение для науки.
Специальные методы исследования в химии
К специальным в химии относятся методы исследования, которые обладают практическим характером. Их применение связано с изучением количественного состава и химических свойств различных соединений.
Таких методов довольно много, но условно их можно разделить на три большие группы:
Физические методы исследования в химии
Физические методы в химии — это методы исследования, которые изучают физические параметры химических веществ. Среди наиболее часто встречающихся физических методов можно назвать:
Пример: определить, как изменилось излучение после воздействия на разные химические вещества.
Классические методы исследования в химии
Классические методы исследования помогают изучать химические растворы, газы, тела и другие элементы через различные виды реакций. Существует несколько разновидностей данных методических приёмов:
Пример: решить ряд химических уравнений, в ходе которых необходимо вычислить количество вещества, исходя из его объёма в газообразном состоянии.
Физико-химические методы исследования в химии
Физико-химические методы позволяют исследователю наблюдать и фиксировать, какие физические изменения происходят в веществах после того, как произошла химическая реакция. Среди них:
Резонансные методы исследования в химии
Самые известные методологические приёмы в этой группе — это резонансные методы исследования в химии:
Резонансные методы помогают изучить структурные и динамические изменения в молекулах, ионах и других элементах в различных химических фазах, например, в конденсированной или газообразной.
Пример: изучить, как распределяются электроны в молекулах с помощью резонансного метода исследования.
Магниторезонансный метод лежит в основе МРТ
Метод гигиенического исследования в химии
К физико-химическим методам также относится метод гигиенического исследования. Его применение связано с очень практическими целями:
Пример: провести санитарно-химический анализ воды, позволяющий оценить уровень хлора, сульфата и хлорида в составе.
Как выбирать методы исследования в химии
Практически любое грамотное химическое исследование строится на пяти основных этапах:
Поэтому и методологию стоит составлять из методов, которые помогут на каждом этапе всесторонне изучить объект и получить конкретные результаты.
Например, выбирая физико-химические методы исследования в органической химии, не забывайте об основе — теоретическом наблюдении и анализе химических материалов, полученных экспериментально.
Мы разобрали некоторые методы исследований, которые применяют в органической и неорганической химии. Теперь у вас есть хороший инструментарий, чтобы провести свою исследовательскую работу. А если нет времени писать лабораторную, курсовую или диплом по химии самостоятельно, обращайтесь в студенческий сервис. Наши специалисты помогут определиться с методами исследования и сдать работу даже по самой сложной теме точно в срок.
«Я видала такую чепуху, по сравнению с которой эта чепуха — толковый словарь» (Льюис Кэрролл «Алиса в стране чудес»). Любительница йоги, спиральной динамики и душевных разговоров 😊