Что такое орбиталь атома
Атомная орбиталь
Из Википедии — свободной энциклопедии
Атом каждого элемента имеет полный набор всех орбиталей на всех электронных уровнях. Орбитали существуют независимо от того, находится на них электрон или нет, их заполнение электронами происходит по мере увеличения порядкового номера то есть заряда ядра и, соответственно, числа электронов.
Волновая функция рассчитывается по волновому уравнению Шрёдингера в рамках одноэлектронного приближения (метод Хартри — Фока) как волновая функция электрона, находящегося в самосогласованном поле, создаваемом ядром атома со всеми остальными электронами атома.
Сам Э. Шрёдингер рассматривал электрон в атоме как отрицательно заряженное облако, плотность которого пропорциональна квадрату значения волновой функции в соответствующей точке атома. В таком виде понятие электронного облака было воспринято и в теоретической химии.
Однако большинство физиков не разделяло убеждений Шрёдингера: доказательства существования электрона как «отрицательно заряженного облака» не было. Макс Борн обосновал вероятностную трактовку квадрата волновой функции. В 1950 г. Э.Шрёдингер в статье «Что такое элементарная частица?» вынужден был согласиться с доводами М.Борна, которому в 1954 году была присуждена Нобелевская премия по физике с формулировкой «За фундаментальное исследование в области квантовой механики, особенно за статистическую интерпретацию волновой функции».
Название «орбиталь» (а не орбита) отражает геометрическое представление о стационарных состояниях электрона в атоме; такое особое название отражает тот факт, что состояние электрона в атоме описывается законами квантовой механики и отличается от классического движения по траектории. Совокупность атомных орбиталей с одинаковым значением главного квантового числа n составляют одну электронную оболочку.
Основы строения атомов
Большинство из нас думает, что знает об атомах достаточно много. Мы знаем какие они маленькие и даже можем дать определение атому. Но как же человечество пришло к пониманию, что такое атом и каковы основы строения атомов?
Модель атома Томпсона (пудинг с изюмом)
В 1897 году Дж. Дж. Томпсон проводил опыт — в вакуумную трубку между двумя палочками (электродами) подавал напряжение и заметил, что в результате этого, проходит пучок сверкающих лучей от «-» к «+» электроду.
Эти лучи он назвал катодными лучами, позднее их стали называть электронными лучами. С помощью магнита, Томпсон определил, что эти лучи содержат частицы с отрицательным зарядом. После большой серии опытов ему удалось установить, что отрицательные частицы (электроны) очень малы, по сравнению с тем, что дает положительный заряд атому.
В итоге многочисленных опытов была разработана модель атома, получившая название «пудинг с изюмом». В этой модели атом – это большое облако, имеющее «+» заряд (пудинг), имеющее очень маленькие вкрапления «-» заряженных частиц (электроны — изюм).
Модель атома Резерфорда (ядерная модель)
В 1907 году Эрнест Резерфорд «дурачился» в своей лаборатории, запуская в тонкую золотую фольгу альфа-частицы, чтобы увидеть, как они отклоняются облаком положительного заряда.
Но вот произошло то, что он никак не ожидал увидеть: хотя большинство частиц летели прямо, некоторые отклонялись на большой угол, а некоторые летели назад в сторону источника. Этот эксперимент позволил предположить, что весь положительный заряд находится в ядре атома, а отрицательно заряженные электроны плавают вокруг него. Согласно ядерной модели строения атома по Резерфорду, большую часть атома занимает пустое пространство.
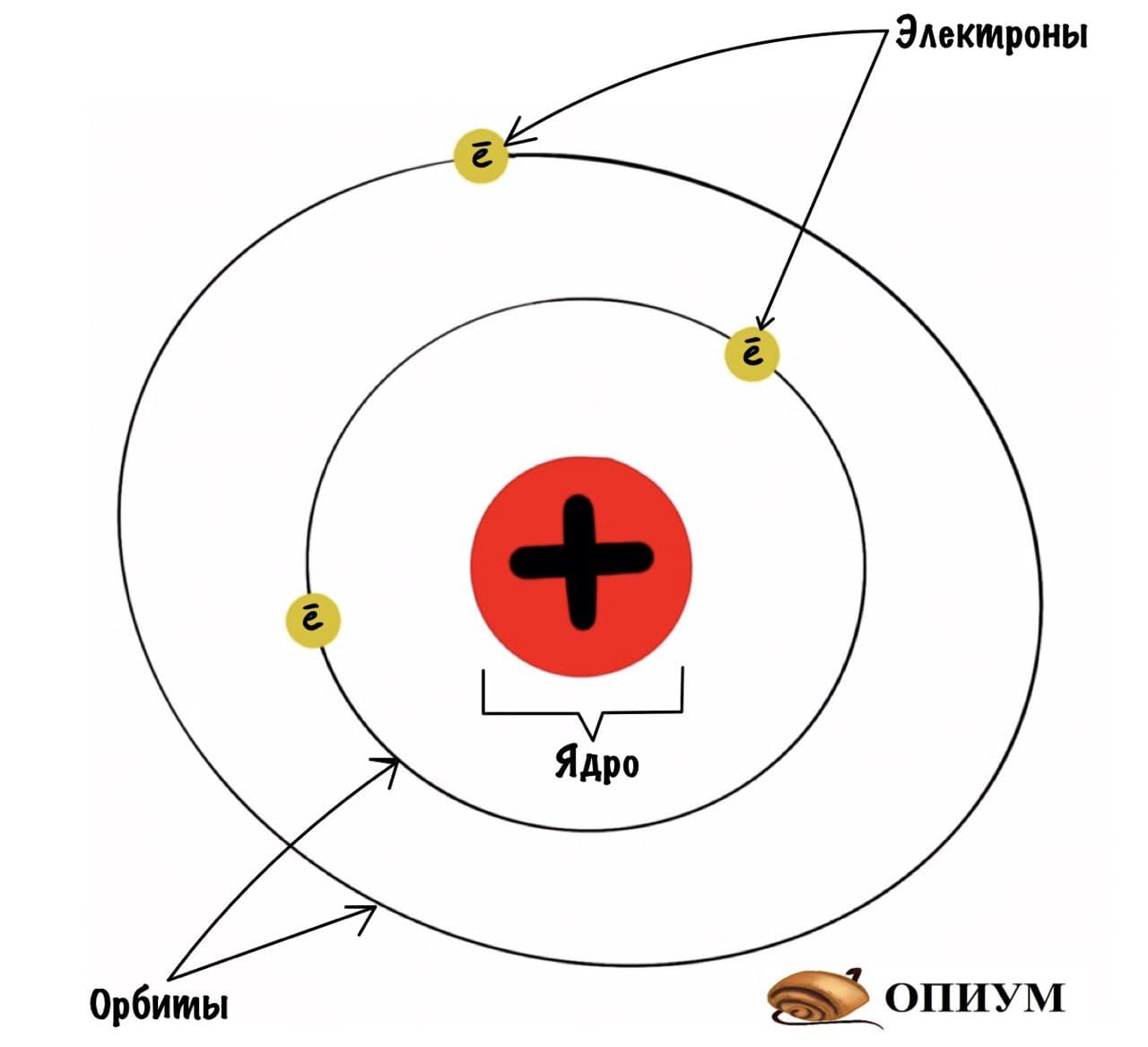
Модель атома Бора (планетарная модель)
Пока другие ученые ставили эксперименты с катодными лучами, Нильс Бор был озадачен теми линиями, которые давал водород при добавлении ему энергии. И вот возникла планетарная модель атома, в которой Бор предположил, что электроны движутся вокруг ядра по круговым орбитам, подобно планетам, вращающихся вокруг Солнца.
Также он полагал, что чем дальше электрон находится от ядра, тем большей энергией он обладает. При получении атомом дополнительной энергии, электроны с ближних орбит могут перескакивать на более отдаленные. Начальная орбиталь называется основной, а конечная – возбужденной. Энергия, полученная атомом должна куда-то уйти, и она высвобождается в виде квантов электромагнитного излучения. Т.к. существует несколько возбужденных состояний, то испускаются кванты различных энергий. Этим он объяснил полученный спектр водорода.
Современная модель атома (квантовая модель)
Во что мы верим сейчас? Из предыдущего раздела Основные понятия и законы химии, мы знаем, что Атом состоит из ядра и электронов. Атомное ядро имеет положительный заряд и состоит из протонов (Z) и нейтронов (N), а сумма масс протонов (Z) и нейтронов (N) атомного ядра называется массовым числом A = Z + N. Электроны атома расположены вокруг ядра на своих орбиталях.
В таблице приведены характеристики частиц, входящих в атом
Частица
Атомы электронейтральны и число протонов совпадает с числом электронов, а вот число нейтронов может отличаться, тогда и появляются изотопы. Поскольку все элементы имеют несколько изотопов, то у каждого из них мы будем иметь среднюю атомную массу от масс всех изотопов, отсюда и возникает дробное значение атомной массы элемента в Периодической таблице Менделеева.
Атомная орбиталь
А что же такое атомная орбиталь, какова ее природа и как она выглядит? В результате титанического труда многих ученых, родилась новая теория строения атома – квантовая.
Согласно этой теории электрон обладает корпускулярно-волновым дуализмом — является одновременно волной и частицей. Масса и заряд электрона – это свойства частицы, а способность к дифракции и интерференции — волновые.
Уравнение де Бройля связывает эти два свойства электрона.
Вскоре было выведено уравнение Шредингера, которое описывает электрон как волну:
где E— полная энергия электрона, V-потенциальная энергия электрона, Ψ-квадратный корень от вероятности нахождения электрона в пространстве с координатами x, y и z (при этом начало координат — ядро).
Уравнение предполагало, что точно предсказать местонахождение и траекторию движения электрона невозможно. Однако, можно найти вероятность нахождения электрона с помощью волновой функции. Теперь орбитали стали не двухмерными, как считалось ранее, а трехмерными телами.
Что такое орбиталь?
Орбиталь — это околоядерное пространство, в котором вероятность обнаружения электрона равна 95%.
Т.о. можно описать 4 разных видов орбиталей, имеющих разную энергию и различную форму:
Электроны в зависимости от занимаемой орбитали (подуровня), называют s-, p-, d- и f-электронами.
Элементы, внешние электроны которых занимают только s-подуровень, называются s-элементами. Таким же образом называют p-элементы, d-элементы и f-элементы.
Квантовые числа (n, l, ml, ms)
Чтобы описанные раннее уравнения работали, нужны 4 переменные (4 квантовых числа). Опишем их:
Принцип Паули гласит,
Никакие два электрона в атоме не могут иметь одинаковый набор всех 4х квантовых чисел.
Из принципа Паули вытекает, что на энергетическом уровне n может находиться не более чем 2n 2 электронов, на n 2 подуровнях.
Существует правило, которое гласит, что электроны размещаются на уровнях и орбиталях не беспорядочно, а по принципу наименьшей энергии, т.е. чтобы сумма главного и орбитального квантовых чисел n+l была наименьшей.
Это правило известно, как правило Клечковского. В случае, когда сумма равна, сначала идет заполнение энергетического уровня с наименьшим главным квантовым числом.
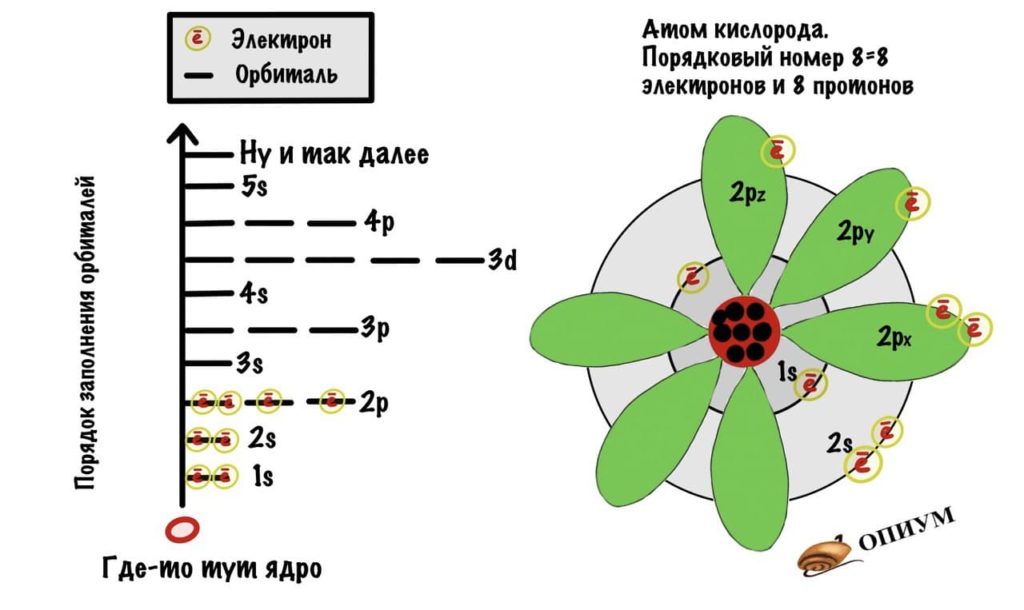
Правила заполнения орбиталей
Заполнение орбиталей происходит в следующем порядке:
1s В пределах одного периода, находясь в основном состоянии, атом стремится к максимально возможному числу неспаренных электронов
Зная, где находится электрон, мы можем написать его электронную конфигурацию (запись ряда орбиталей атома, на которых находятся электроны), которая составляется по образцу:
n(тип орбитали) число электронов на этой орбитали
Итак, заполнение орбиталей электронами происходит следующим образом:
Возбужденное состояние атома
При сообщении атому дополнительной энергии (действие температуры, рентгеновского или электромагнитного излучения), его электроны переходят в возбужденное состояние. При этом один или несколько электронов основного состояния переходят с занятых орбиталей на свободные. Предпочтительно возбуждаются электроны внешних оболочек, т.к. образующиеся состояния обладают наименьшей энергией.
Это состояние очень неустойчиво и длится всего миллионные доли секунды.
Валентные электроны (электроны, расположенные на внешнем уровне) способны выравнивать свою энергию и изменять форму орбиталей. Этот процесс называется гибридизацией атомных орбиталей и подробнее описан в разделе Метод валентных связей
Примеры с решениями на составление электронных формул, распределение электронов по орбиталям в различных атомах Вы можете посмотреть в разделе Задачи по теме Основы строения атомов
Строение атома. Гибридизация орбиталей
Обычно в начале статьи пишут краткий план того, о чем пойдет речь в статье. Еще добавляют зачем и почему на нее нужно тратить время. Но здесь такого не будет, потому что я не уверен — нужна ли она вообще.
Но я расскажу историю. Вообще статья должна была быть про белок, как формируется первичная, вторичная структура, ну и так далее. И вот идет подготовка материала, а там довольно большую роль играет электроотрицательность. На самом деле не очень и большую, но все-таки роль у нее есть. И вот мне стало интересно, а как она формируется? Ты конечно знаешь, что она растет в периодической таблице слева направо и зависит от радиуса атома. Но почему? В общем-то эти вопросы привели меня к строению атома и закону Кулона. Поэтому сейчас мы устроим маленькое путешествие в химию и физику. Начнем со строения атома. А уже в следующей статье будем разбираться с электроотрицательностью.
Планетарная модель строения атома от Резерфорда
Это модель ключевая, потому что на ее основе строились все остальные. Вообще Резерфорд крутой мужик, который очень любил всякие опыты. Вот один из них:
Какие выводы делает Резерфорд из этого опыта? Он предполагает, что основная масса атома сосредоточена в его ядре — когда альфа-частицы попадают в него, то отскакивают в обратную сторону. Ядро очень маленькое и заряжено положительно, а вокруг него по орбитам летают отрицательно заряженные электроны. Он называет это планетарной моделью. Очень красиво, согласитесь? Мы живем в мире, который находится в солнечной системе. А атомы, из которых состоит все вокруг, имеют строение такой же системы.
Это все очень поэтично и красиво, но есть парочка проблем:
Были и еще проблемы, но это основные. Как же их решить?
Полуклассическая модель атома по Бору
Появляется второй крутой мужик. Может быть, он даже круче первого, потому что говорит такое — от чего волосы у физиков встают дыбом. Бор взял модель атома по Резерфорду и сказал что-то вроде: «Давайте предположим, что электроны движутся по орбитам, но никакую энергию они не излучают. Но если электрон перепрыгивает с одной орбиты на другую, то он выделяет энергию — фотоны. Это и есть спектр!»
Бор назвал состояние атома, когда его электроны движутся по свои орбитам, стационарным состоянием. При перепрыгивании одного электрона на другую орбиту атом становится возбужденным и может выделять энергию. Атом становится возбужденным не просто так — он поглощает какую-то энергию извне, она представляет собой фотон или фотоны.
Переведем Бора на язык физиков: “Вся ваша физика полная туфта. Атому на нее плевать, он живет по другим законам”. И все как бы в шоке, но больше всех Эйнштейн — он становится главным хейтером Бора. Но экспериментально модель Бора подтверждается.
Модель Бора чем-то похожа на дом. Представьте себе панельку. Если электрон упадет с 7 этажа на первый, то он выделит энергию — это и есть фотон. А вот если зарядить как следует атом, то электрон может прыгнуть с первого этажа на пятый. Чем больше зарядишь, тем выше прыгнет. Чем с большей высоты упадет, тем больше выделит энергии. Примерно так. Оказалось, что Бор был прав и дальше мы это увидим.
Резерфорд, кстати, сделал предположение, что ядро состоит из положительно заряженных протонов. Но Резерфорд и Бор еще не знали, от чего зависит количество электронов и протонов, но с этим разберутся попозже.
Современная модель атома
Ну а дальше началось самое интересное — физики взяли модель атома по Бору и добавили к ней своего добра. Так получилась современная модель атома. Конец! Ну или не совсем. Атом состоит из ядра и электронной оболочки. Начинаем с ядра.
Ядро атома
У атома есть ядро, которое состоит из протонов и нейтронов. Протоны заряжены положительно, а у нейтронов заряда нет. Количество протонов и электронов равно — зависит от порядкового номера в таблице Менделеева. Если это атом азота, то у него 7 протонов и 7 электронов. Нейтрон такому правилу не подчиняется — их может быть больше, а может и меньше. Протон и нейтрон весят в примерно 1800 раз больше, чем электрон. Поэтому основная масса атома находится в ядре.
На самом деле протон и нейтрон состоят из других частиц, но не будем слишком глубоко копать. Можешь почитать, если интересно.
Электронная оболочка
Электронная оболочка — это все электроны атома. Она состоит из слоев, на которых располагается какая-то часть электронов.
Каждый слой состоит из орбиталей. Заметили? Не орбит, а орбиталей. Орбита — это траектория движения тела, на которой в какой-то момент времени можно его встретить. Помните круговые поливалки в деревне? Вода из них движется по определенной траектории. Можно встать и подождать пока тебя польют в жаркий день. Орбиталь — это другое дело, на ней электрон проводит 90 процентов времени, но как он там движется — одному ему известно. Поэтому можно стоять очень долго, но так и не дождаться пока тебя польют. Пример не очень, согласен. Лучше бы привел Луну или какую-нибудь планету, но вы поняли…
Есть 4 вида орбиталей: s, p, d и f. S- это сфера, p — бесконечность или гантелька, d и f сложнее. Я их рисовать не буду, потому что они нас не интересуют. P-орбиталей всегда 3 — px, py, pz.
Слои электронной оболочки
Теперь подробнее про слои. Первый слой состоит только из одной орбитали — s. Второй слой: одна s и три p орбиталей. Третий слой — одна s, три p и пять d орбиталей. Ну а на четвертом за 5d орбиталями добавятся еще 7f. Количество слоев зависит от количества электронов, а значит от порядкового номера атома.
Тут есть определенные правила:
Добавим к атому лития, который я показывал до этого, орбитали и получим что-то такое.
Можно еще попробовать свести орбитали в один рисунок, смотрите.
Химические связи чаще всего образуются за счет неспаренных электронов, но подробнее об этом поговорим в следующей статье. А сейчас нас интересует углерод и гибридизация его орбиталей.
Гибридизация орбиталей
Сначала посмотрим на электронную формулу углерода и вспомним о Боре. В стационарном состоянии у углерода всего два электрона на 2p-орбиталях. Однако, если атом углерода поглотит энергию фотона, то электрон с 2s-орбитали может перейти на 2p-орбиталь — атом углерода становится возбужденным. В таком состоянии он может образовать 4 связи, т.к. у него 4 неспаренных электрона.
И тут встал вопрос. Атом углерода в возбужденном состоянии может образовать четыре связи, так как у него четыре неспаренных электрона. Но энергия связей будет разной, потому что эти электроны располагаются на разных орбиталях (у p орбитали энергия побольше). Это не очень хорошо сказывается на стабильности системы. Как выйти из этого положения? Атом придумал интересную штуку — он изменил форму и размеры орбиталей. Это и есть гибридизация.
У азота есть одна неподеленная электронная пара на втором энергетическом слое, а именно на 2s-орбитали — там находится два электрона и третий туда уже не засунуть. Но азот может отдать протону водорода один электрон по донорно-акцептерному механизму и образовать связь. Так возникает ион аммония. Такая же тема с водой, но кислород не может отдать по электрону от каждой электронной пары — только с одной! Так образуется ион гидроксония.
sp 2 и sp-гибридизация
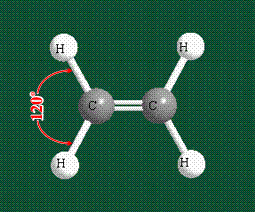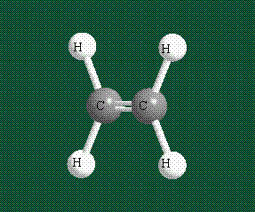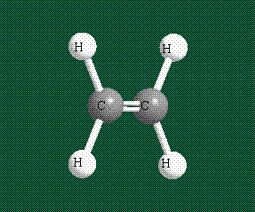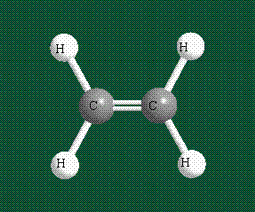
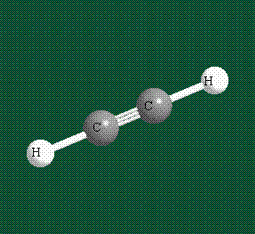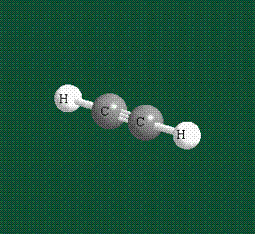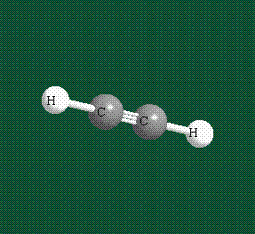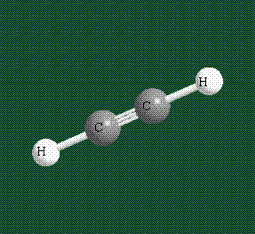
Куда пропала p-связь? Ну ладно, держите формулу этилена со всеми связями.
На рисунке видно, что p-орбитали без гибридизации находятся над и под плоскостью, они образуют сигма-связь — эта связь более жесткая, чем пи-связь. Поэтому вращение вокруг нее ограничено.
sp-гибридизацию нарисовать не смогу, сорян. Но смысл вы поняли: без изменений останутся две p-орбитали, а две sp-орбитали будут похожи на палочку — угол между ними будет 180 градусов. Одна p-орбиталь будет идти над плоскостью, а другая смотреть в лицо. Надеюсь, что у тебя получилось представить. Едем дальше.
Атомный остов
Электронный слой бывает завершенным или незавершенным:
Заряд ядра атома (количество протонов) + заряд завершенных слоев (количество электронов) = атомный остов. Картинка….
У кислорода заряд атомного остова больше, чем у натрия. Это нам понадобится, когда будем считать электроотрицательность.
Фух, со строением атома закончили. Поздравляю всех, кто дочитал до этого момента. Дальше можно переходить к электроотрицательности, но это уже в следующей статье.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.
ОРБИТАЛЬ
ОРБИТАЛЬ – область наиболее вероятного местонахождения электрона в атоме (атомная орбиталь) или в молекуле (молекулярная орбиталь).
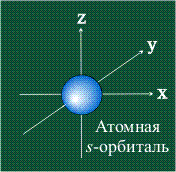
Электрон движется в атоме вокруг ядра не по фиксированной линии-орбите, а занимает некоторую область пространства. Например, электрон в атоме водорода может с определенной вероятностью оказаться либо весьма близко к ядру, либо на значительном удалении, однако существует определенная область, где его появление наиболее вероятно. Графически орбиталь изображают в виде поверхности, очерчивающей область, где вероятность появления электрона наибольшая, иначе говоря, электронная плотность максимальна. У атома водорода орбиталь электрона имеет сферическую (шаровую) форму:
К настоящему моменту описано пять типов орбиталей: s, p, d, f и g. Названия первых трех сложились исторически, далее был выбран алфавитный принцип. Формы орбиталей вычислены методами квантовой химии.
Орбитали существуют независимо от того, находится на них электрон (занятые орбитали), или отсутствует (вакантные орбитали). Атом каждого элемента, начиная с водорода и заканчивая последним полученным на сегодня элементом, имеет полный набор всех орбиталей на всех электронных уровнях. Их заполнение электронами происходит по мере увеличения порядкового номера, то есть, заряда ядра.
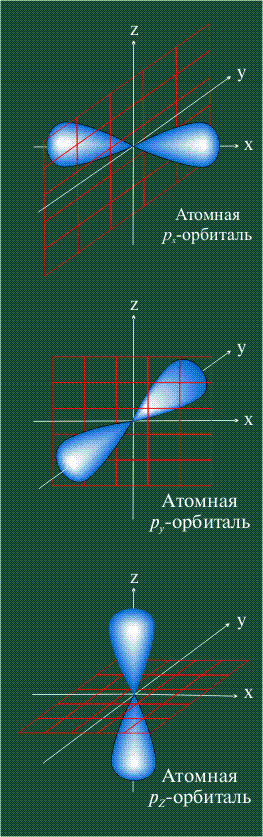
s-Орбитали, как было показано выше, имеют сферическую форму и, следовательно, одинаковую электронную плотность в направлении каждой оси трехмерных координат:
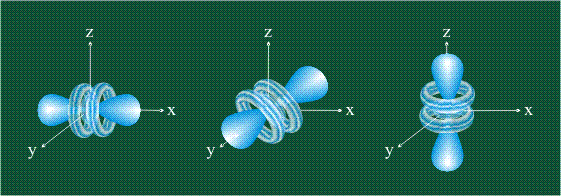
На первом электронном уровне каждого атома находится только одна s-орбиталь. Начиная со второго электронного уровня помимо s-орбитали появляются также три р-орбитали. Они имеют форму объемных восьмерок, именно так выглядит область наиболее вероятного местонахождения р-электрона в районе атомного ядра. Каждая р-орбиталь расположена вдоль одной из трех взаимоперпендикулярных осей, в соответствии с этим в названии р-орбитали указывают с помощью соответствующего индекса ту ось, вдоль которой располагается ее максимальная электронная плотность:
В современной химии орбиталь – определяющее понятие, позволяющее рассматривать процессы образования химических связей и анализировать их свойства, при этом внимание сосредотачивают на орбиталях тех электронов, которые участвуют в образовании химических связей, то есть, валентных электронов, обычно это электроны последнего уровня.
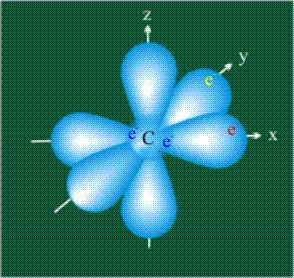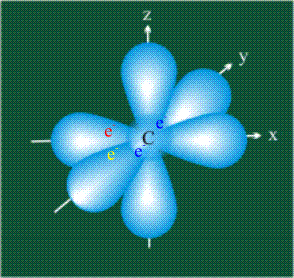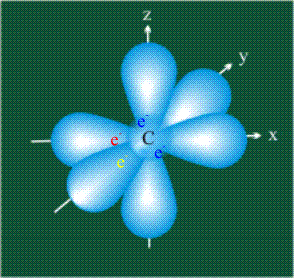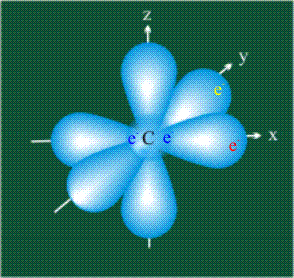
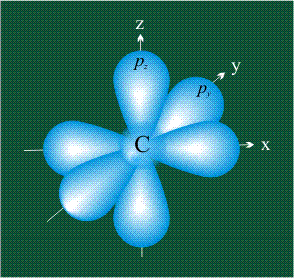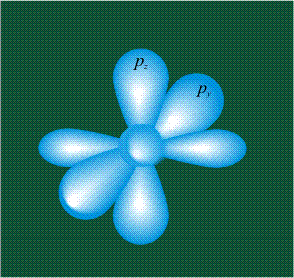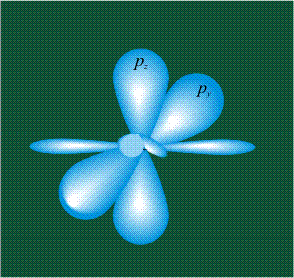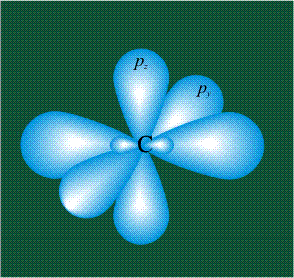
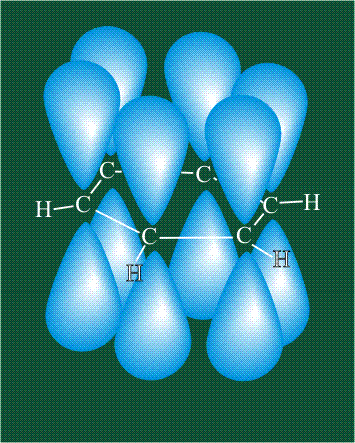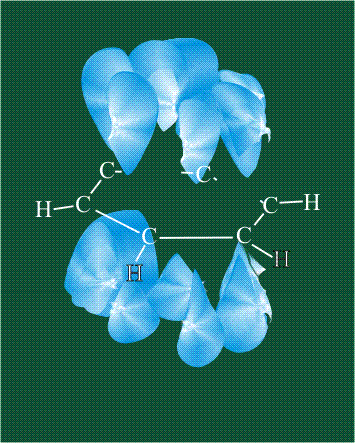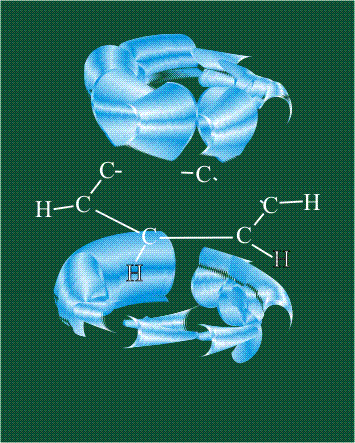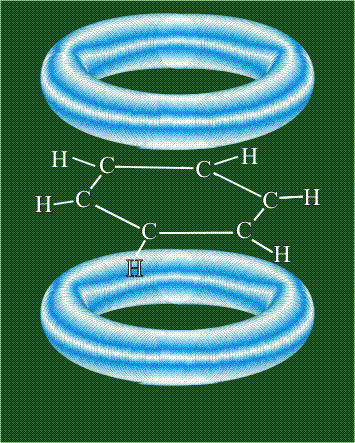
У атома углерода в исходном состоянии на втором (последнем) электронном уровне находится два электрона на s-орбитали (отмечены синим цветом) и по одному электрону на двух р-орбиталях (отмечены красным и желтым цветом), третья орбиталь – рz-вакантная:
Гибридизация.
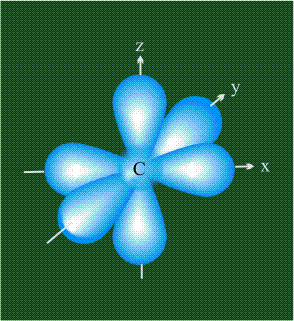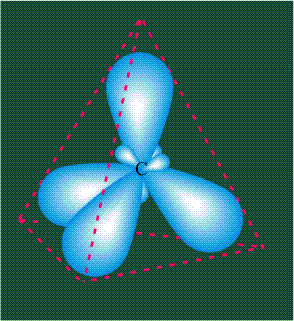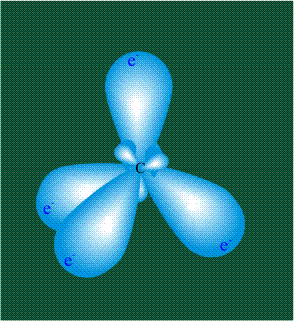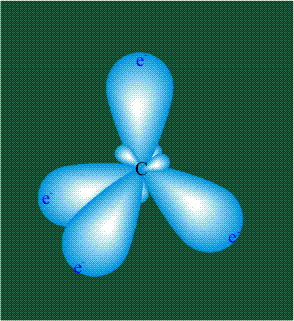
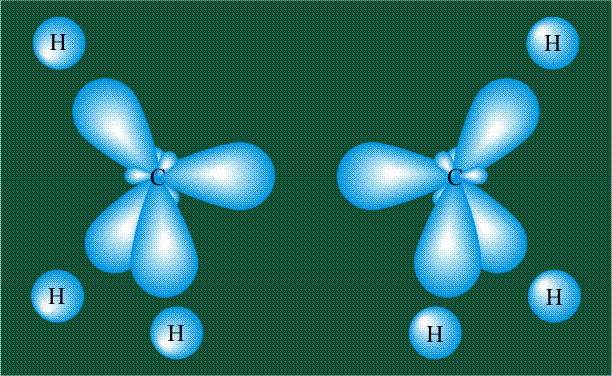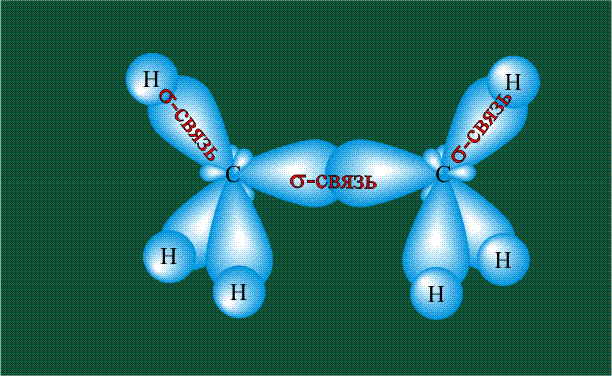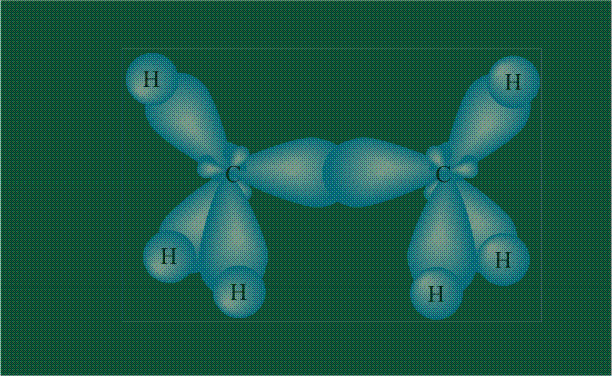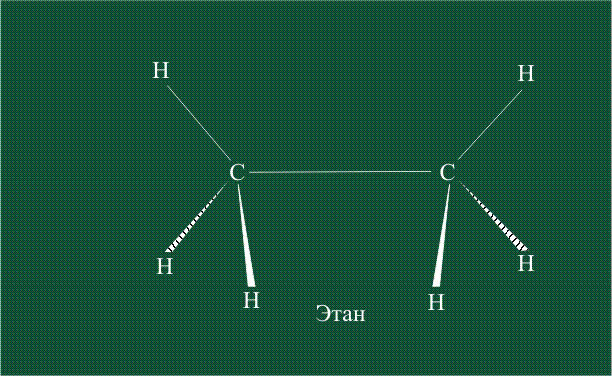
В том случае, когда атом углерода участвует в образовании насыщенных соединений (не содержащих кратных связей), одна s-орбиталь и три р-орбитали объединяются, образуя новые орбитали, представляющие собой гибриды исходных орбиталей (процесс называют гибридизацией). Количество гибридных орбиталей всегда равно количеству исходных, в данном случае, четыре. Получившиеся орбитали-гибриды одинаковы по форме и внешне напоминают асимметричные объемные восьмерки:
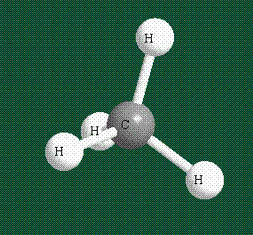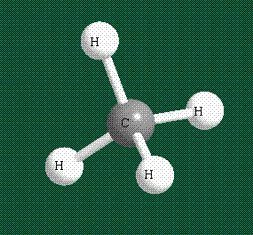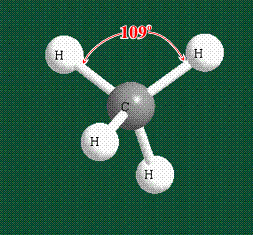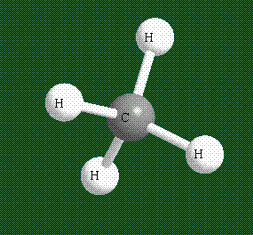
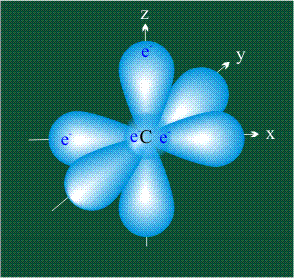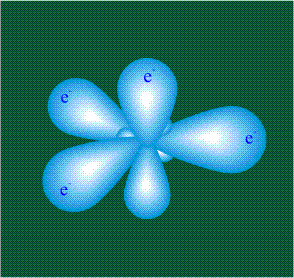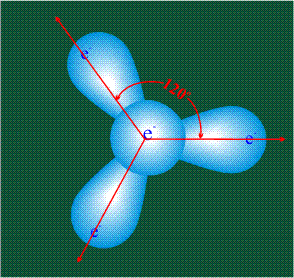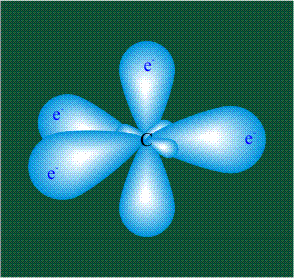
Вся конструкция оказывается как бы вписанной в правильный тетраэдр – призма, собранная из правильных треугольников. При этом орбитали-гибриды располагаются вдоль осей такого тетраэдра, угол между любыми двумя осями – 109°. Четыре валентных электрона углерода располагаются на этих гибридных орбиталях:
Участие орбиталей в образовании простых химических связей.
Свойства электронов, разместившихся на четырех одинаковых орбиталях, эквивалентны, соответственно, будут эквивалентны химические связи, образованные с участием этих электронов при взаимодействии с атомами одного типа.
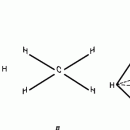
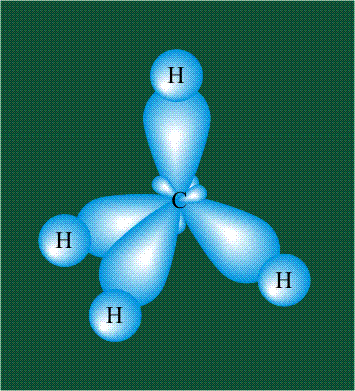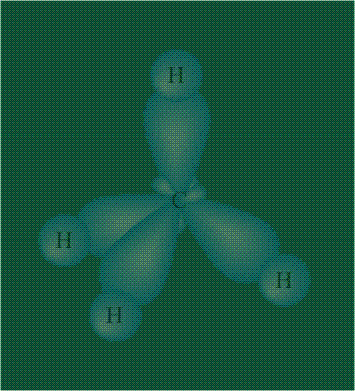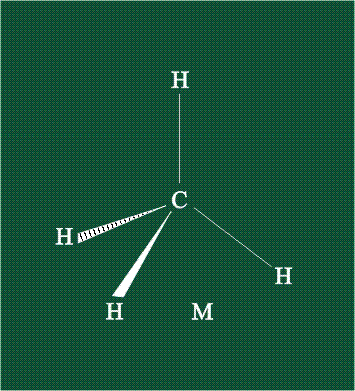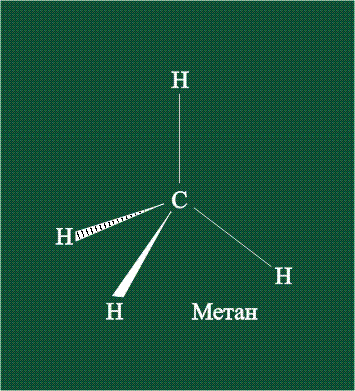
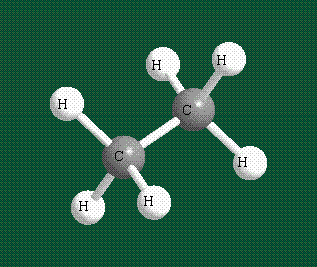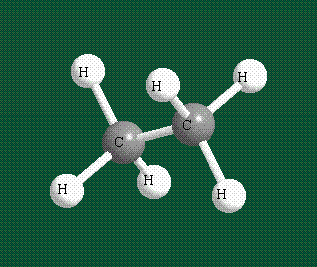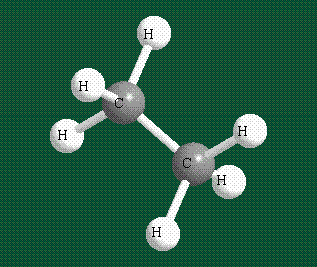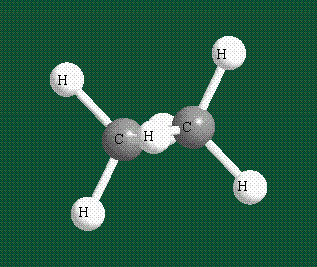
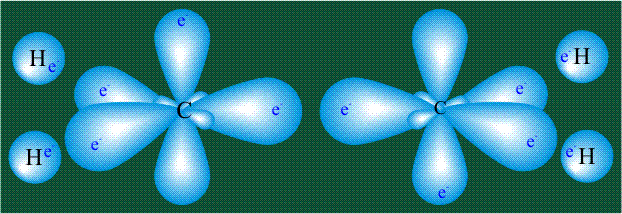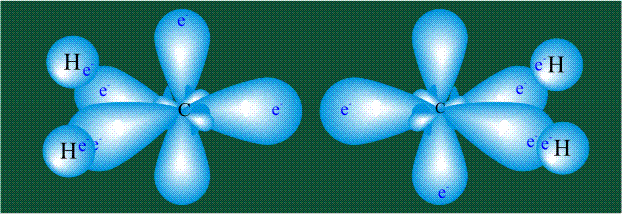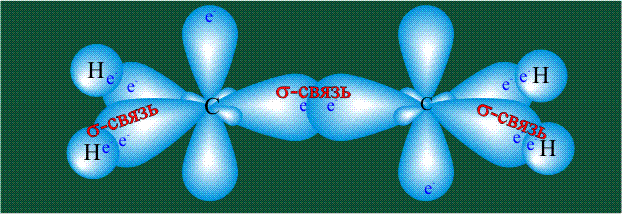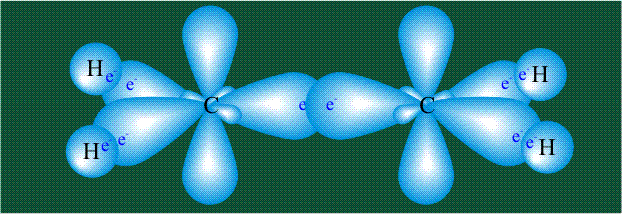
Взаимодействие атома углерода с четырьмя атомами водорода сопровождается взаимоперекрыванием вытянутых гибридных орбиталей углерода со сферическими орбиталями водородов. На каждой орбитали находится по одному электрону, в результате перекрывания каждая пара электронов начинает перемещаться по объединенной – молекулярной орбитали.
В традиционном написании структуры образовавшегося метана вместо перекрывающихся орбиталей используют символ валентной черты. Для объемного изображения структуры валентность, направленную от плоскости чертежа к зрителю показывают в виде сплошной клиновидной линии, а валентность, уходящую за плоскость рисунка – в виде штриховой клиновидной линии:
Таким образом, структура молекулы метана определяется геометрией гибридных орбиталей углерода:
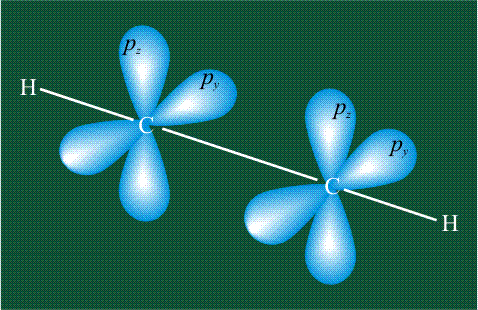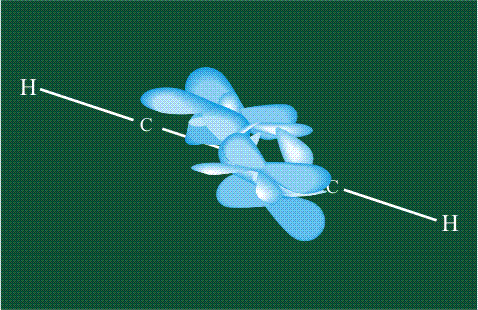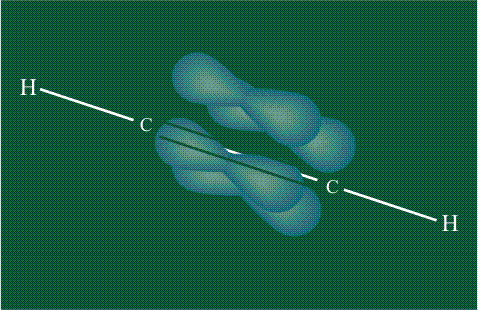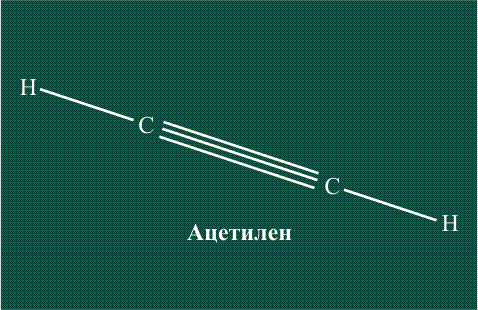
Образование молекулы этана аналогично показанному выше процессу, отличие состоит в том, что при взаимоперекрывании гибридных орбиталей двух атомов углерода происходит образование С-С – связи:
Участие орбиталей в образовании кратных химических связей.
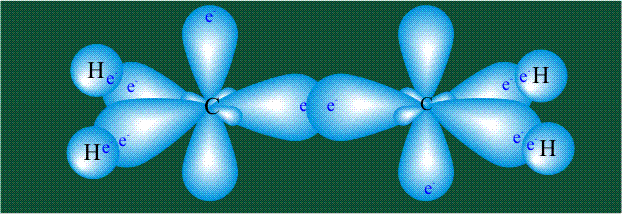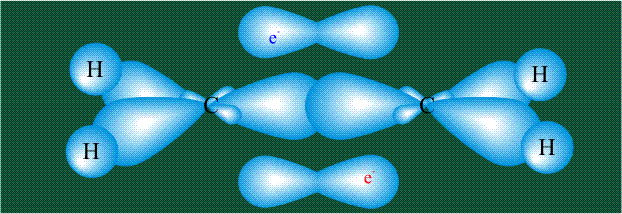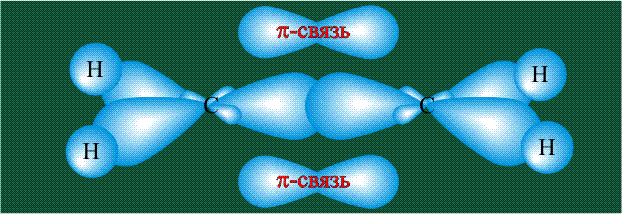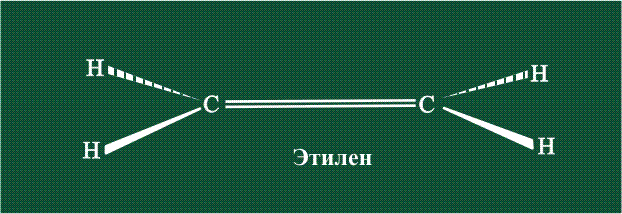
Молекула этилена образована также с участием орбиталей-гибридов, однако в гибридизации участвуют одна s-орбиталь и только две р-орбитали (рх и ру), третья орбиталь – pz, направленная вдоль оси z, в образовании гибридов не участвует. Из исходных трех орбиталей возникают три гибридных орбитали, которые располагаются в одной плоскости, образуя трехлучевую звезду, углы между осями – 120°:
Вторая валентная черта в обозначении двойной связи, широко используемая для изображения ненасыщенных соединений уже не одно столетие, в современном понимании подразумевает наличие двух областей с повышенной электронной плотностью, расположенных по разные стороны линии связи С-С.
Структура молекулы этилена задана геометрией гибридных орбиталей, валентный угол Н-С-Н – 120°:
При образовании ацетилена в гибридизации участвует одна одна s-орбиталь и одна рx-орбиталь (орбитали pyи pz, в образовании гибридов не участвуют). Две образовавшиеся гибридные орбитали располагаются на одной линии, вдоль оси х:
В итоге молекула ацетилена имеет палочкообразную форму:
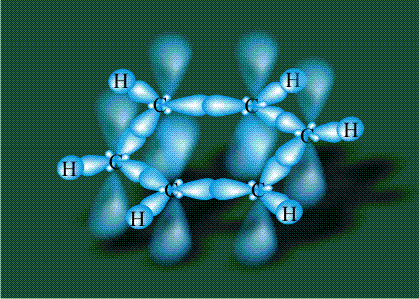
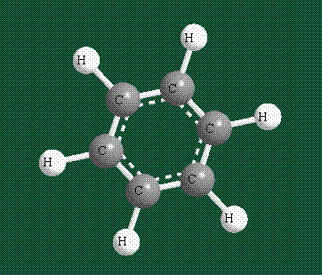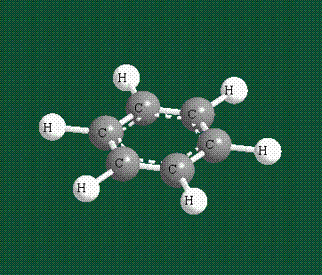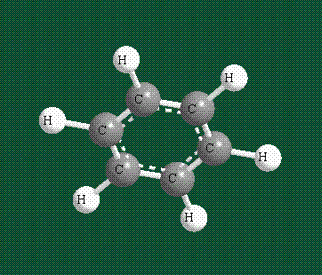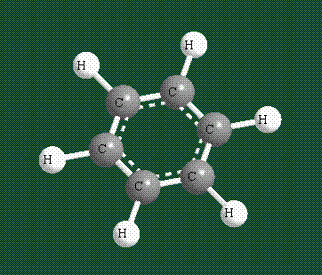
У бензола остов молекулы собран из атомов углерода, имеющих гибридные орбитали, составленные из одной s— и двух р-орбиталей, расположенные в форме трехлучевой звезды (как у этилена), р-орбитали, не участвующие в гибридизации, показаны полупрозрачными:
Шесть оставшихся р-орбиталей взаимоперекрываются, образуя молекулярную орбиталь в виде двух кольцевых областей, над и под плоскостью бензольного цикла:
Возникает единая замкнутая электронная система (см. также АРОМАТИЧНОСТЬ).
Молекула бензола плоская, что задано плоской конфигурацией «трехлучевых звезд», из которых она собрана. Молекулярную орбиталь, образованную перекрыванием шести атомных р-орбиталей обозначают в виде кольцевого символа внутри бензольного цикла:
В образовании химических связей могут также участвовать вакантные, то есть, не содержащие электронов орбитали (см. также ТРЕХЦЕНТРОВЫЕ СВЯЗИ).
Орбитали высоких уровней.
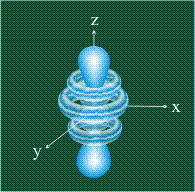
Начиная с четвертого электронного уровня, у атомов появляются пять d-орбиталей, их заполнение электронами происходит у переходных элементов, начиная со скандия. Четыре d-орбитали имеют форму объемных четырехлистников, называемых иногда «клеверным листом», они отличаются лишь ориентацией в пространстве, пятая d-орбиталь представляет собой объемную восьмерку, продетую в кольцо:
d-Орбитали могут образовывать гибриды с s- и p-орбиталями. Параметры d-орбиталей обычно используют при анализе строения и спектральных свойств в комплексах переходных металлов.
Начиная с шестого электронного уровня, у атомов появляются семь f-орбиталей, их заполнение электронами происходит в атомах лантаноидов и актиноидов. f-Орбитали имеют довольно сложную конфигурацию, ниже на рисунке показана форма трех из семи таких орбиталей, имеющих одинаковую форму и ориентированных в пространстве различным образом:
f-Орбитали весьма редко используют при обсуждении свойств различных соединений, поскольку расположенные на них электроны практически не принимают участия в химических превращениях..
Перспективы.
На восьмом электронном уровне находится девять g-орбиталей. Элементы, содержащие электроны на этих орбиталях, должны появится в восьмом периоде, пока они недоступны (в ближайшее время ожидается получение элемента № 118, последнего элемента седьмого периода Периодической системы, его синтез проводят в Объединенном институте ядерных исследований в Дубне).
Форма g-орбиталей, вычисленная методами квантовой химии, еще более сложная, чем у f-орбиталей, область наиболее вероятного местонахождения электрона в данном случае выглядит весьма причудливо. Ниже показан внешний вид одной из девяти таких орбиталей:
В современной химии представления об атомных и молекулярных орбиталях широко используют при описании строения и реакционных свойств соединений, также при анализе спектров различных молекул, в некоторых случаях – для прогнозирования возможности протекания реакций.