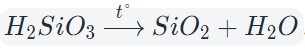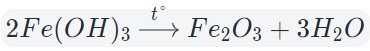Что такое основной остаток химия
Номенклатура оснований. Основные остатки
Названия оснований состоят из слова «гидроксид» и названия металла в родительном падеже: KOH – гидроксид калия, Ba(OH)2 – гидроксид бария, Al(OH)3 – гидроксид алюминия. Если металл образует несколько оснований, то в их названиях римской цифрой в скобках указывается степень окисления атомов этого металла, например: Fe(OH)2 – гидроксид железа(II), Fe(OH)3 – гидроксид железа(III), Sn(OH)2 – гидроксид олова(II), Sn(OH)4 – гидроксид олова(IV).
Основание NH3∙H2O, образующееся при растворении аммиака в воде, называется гидрат аммиака. Ранее его состав выражался формулой NH4OH, однако соединение такого состава в действительности не существует.

Формулы, значения валентности и названия остатков важнейших оснований приведены в Приложении 2.
Дата добавления: 2015-09-18 ; просмотров: 1480 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Кислотный остаток
Кислотный остаток — это анион, который является второй частью формулы сложного химического соединения. Они способны замещать определенное количество атомов или групп атомов. Ни у одного кислотного остатка нет свободных реакциоспособных электронов. Как правило, кислотный остаток состоит из атомов неметаллов.
Таблица самых распространенных кислотных остатков
| Кислотный остаток | Валентность | Название | Тривиальное название кислоты |
|---|---|---|---|
| -Cl | I | хлорид | соляная кислота |
| -NO3 | I | нитрат | азотная кислота |
| -SO4 | II | сульфат | серная кислота |
| -SO3 | II | сульфит | сернистая кислота |
| -S | II | сульфид | сероводородная кислота |
| -SiO3 | II | силикат | кремниевая кислота |
| -CO3 | II | карбонат | угольная кислота |
| -PO4 | III | ортофосфат | ортофосфатная кислота |
| -NO2 | I | нитрит | нитритная кислота |
| -F | I | фторид | плавиковая кислота |
| -I | I | иодид | иодидная кислота |
| -Br | I | бромид | бромидная кислота |
Полезное
Смотреть что такое «Кислотный остаток» в других словарях:
кислотный остаток — — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN acid residue … Справочник технического переводчика
кислотный остаток — rūgšties liekana statusas T sritis chemija apibrėžtis Rūgšties anijonas. atitikmenys: angl. acid residue rus. кислотный остаток … Chemijos terminų aiškinamasis žodynas
кислотный остаток — кислотный радикал … Cловарь химических синонимов I
кислотный радикал — кислотный остаток … Cловарь химических синонимов I
Эфиры сложные — (хим.) представляют собой сочетания спиртов с кислотами, происходящие путем выделения воды за счет водных остатков этих соединений. Названия [В немецкой химической литературе сложные Э. весьма целесообразно названы, по предложению Гмелина, особым … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Число координатное — химических соединений — Термин введен в науку А. Вернером, который предполагает, что ему удалось открыть закономерность, определяющую состав гидратов, аммиакатов (ср. Кобальтиаковые соединения), двойных (и простых, кислородсодержащих) солей и вообще неорганических и… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Анион — Анион отрицательно заряженный ион. Характеризуется величиной отрицательного электрического заряда; например, Cl− однозарядный анион, а SO42− двузарядный анион. В электрическом поле анионы перемещаются к положительному… … Википедия
диазосоединения — органические соединения общей формулы RN2 (алифатические диазосоединения; R алкил) или ArN2X (ароматические диазосоединения; Ar арил, Х гидроксильная группа или кислотный остаток), из которых наиболее важны последние соли диазония.… … Энциклопедический словарь
ртутьорганические соединения — содержат в молекуле атом ртути, непосредственно связанный с углеродом. Известны ртутьорганические соединения типа R2Hg и RHgX, где R органический радикал, Х галоген, ОН, кислотный остаток. Применяются в органическом синтезе, как фунгициды.… … Энциклопедический словарь
соли — продукты замещения атомов водорода кислоты на металл или групп ОН основания на кислотный остаток. При полном замещении образуются средние, или нормальные, соли (NaCl, K2SO4 и др.), при неполном замещении атомов Н кислые (напр., NaHCO3), неполном … Энциклопедический словарь
Классификация неорганических веществ
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
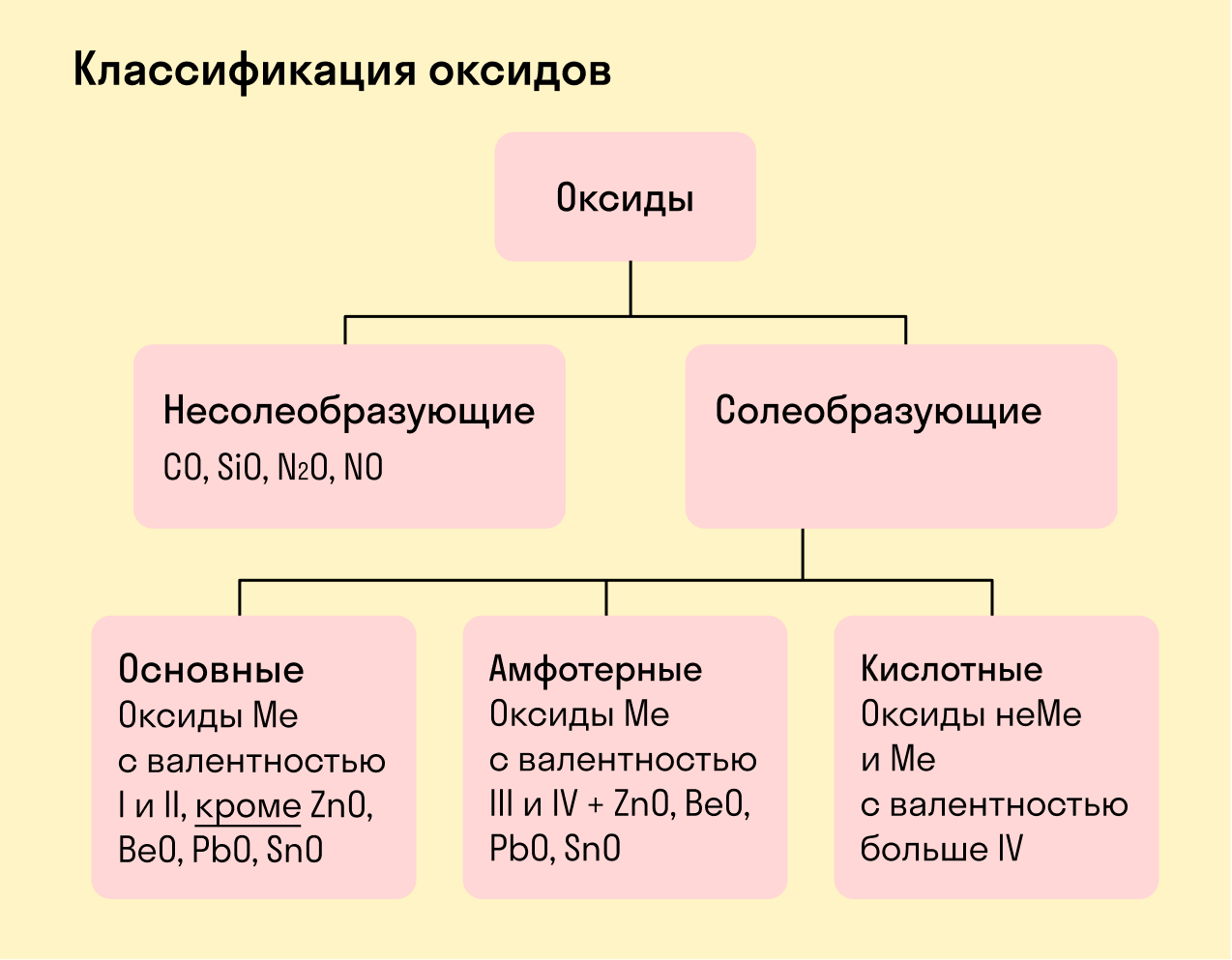
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)
Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)
Основания
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.
Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Кислоты
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
Блиц-опрос по теме Классификация неорганических веществ
Оксиды
Определение оксидов
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
Виды оксидов
Все оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
Солеобразующие оксиды делятся на три группы:
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na +1 2O, Ca +2 O, Ba +2 O.
Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
Примеры амфотерных оксидов: Al +3 2O3, Fe2 +3 O3.
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Примеры кислотных оксидов: S +6 O3, N2 +5 O5, Mn2 +7 O7.
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
CrO (оксид хрома (II)) — проявляет основные свойства;
Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:
Номенклатура оксидов
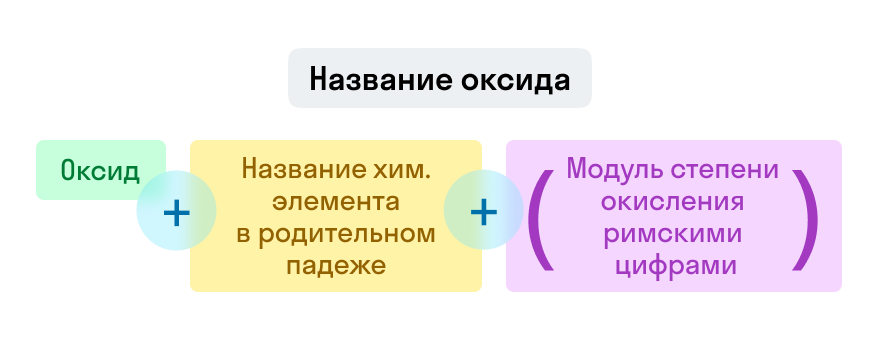
Названия оксидов строятся по систематической номенклатуре следующим образом:
Указываем название второго химического элемента в родительном падеже.
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три.
Na2O — оксид натрия. Читается: натрия два о.
SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
Химическая формула оксида
Бытовое (тривиальное название)
Возможное научное название
Химические свойства основных оксидов
1. Взаимодействие с водой
С водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
Основный оксид + вода = основание
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
Основный оксид + кислотный оксид = соль
Основный оксид + кислота = соль + вода
3. Взаимодействие с амфотерными оксидами
В эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
Основный оксид + амфотерный оксид = соль
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Химические свойства кислотных оксидов
1. Взаимодействие с водой
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
Кислотный оксид + вода = кислота
2. Взаимодействие с основными оксидами и щелочами
Кислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
Кислотный оксид + основный оксид = соль
Кислотный оксид + основание = соль + вода
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
Кислотный оксид + амфотерный оксид = соль
Кислотный оксид + амфотерный оксид = соль + вода
Химические свойства амфотерных оксидов
1. Взаимодействие с водой
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
Амфотерный оксид + вода ≠
2. Взаимодействие с кислотными оксидами и кислотой
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
Амфотерный оксид + кислотный оксид = соль
Амфотерный оксид + кислота = соль + вода
3. Взаимодействие с основными оксидами
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
Амфотерный оксид + основный оксид (расплав) = соль
4. Взаимодействие со щелочами
Продукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
Амфотерный оксид + щелочь (раствор) + вода = комплексная соль
Амфотерный оксид + щелочь (расплав) = средняя соль + вода
Получение оксидов
1. Окисление металлов
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
3. Разложение гидроксидов
Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
Гидроксид (кислота) = оксид + вода
Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
4. Окисление сложных веществ
Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т. д.
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!
Классы неорганических веществ. Гидроксиды, кислоты, соли
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Классы неорганических веществ
Все вещества делятся на простые (элементарные) и сложные. Простые вещества состоят из одного элемента, в состав сложных входит два или более элементов. Простые вещества, в свою очередь разделяются на металлы и неметаллы.
Металлы отличаются характерным «металлическим» блеском, ковкостью, тягучестью, могут прокатываться в листы или вытягиваться в проволоку, обладают хорошей теплопроводностью и электрической проводимостью. При комнатной температуре все металлы (кроме ртути) находятся в твердом состоянии.
Неметаллы не обладают характерным для металлов блеском, хрупки, очень плохо проводят теплоту и электричество. Некоторые из них при обычных условиях газообразны.
Сложные вещества делят на органические, неорганические и элементоорганические. Неорганическая химия охватывает химию всех элементов периодической системы. Свойства органических соединений существенно отличаются от свойств неорганических, а элементоорганические соединения, с учетом их специфики, занимают промежуточное положение. С классификацией органических и элементоорганических соединений удобнее познакомиться при изучении соответствующих разделов химии, посвященных этим соединениям.
Неорганические вещества разделяются на классы либо по составу (двухэлементные, или бинарные, соединения и многоэлементные соединения; кислородсодержащие, азотосодержащие и т.п.), либо по химическим свойствам, т.е. по функциям (кислотно-основным, окислительно-восстановительным и т.д.), которые эти вещества осуществляют в химических реакциях, – по их функциональным признакам.
К важнейшим бинарным соединениям относятся любые соединения только двух различных элементов. Например, бинарными соединениями азота и кислорода являются: N2O, NO, N2O3, NO2, N2O5; бинарные соединения меди и серы: Cu2S, CuS, CuS2. В формулах бинарных соединений металлы всегда предшествуют неметаллам: SnCl2, Al3N. Если бинарное соединение образовано двумя неметаллами, то на первом месте ставится символ того элемента, который располагается левее в следующей последовательности:
B, Si, C, As, P, H, Te, Se, S, I, Br, Cl, N, O, F.
Если бинарное соединение состоит из двух металлов, то первым указывается металл, располагающийся в большом периоде раньше (от начала периода). Если оба металла находятся в одной группе, то первым указывается элемент с большим порядковым номером.
Бинарные соединения подразделяются на классы в зависимости от типа неметалла (табл. 1.2.), а остальные бинарные соединения относят к соединениям между металлами – интерметаллидам.
Таблица 3. Классы бинарных соединений от типа неметалла
| Класс | Неметалл | Пример формулы соединения | Название |
| Галогениды | F, Cl, Br, I | NaCl | Хлорид натрия |
| Оксиды | O | FeO | Оксид железа (II) |
| Халькогениды | S, Se, Te | ZnS | Сульфид цинка |
| Пниктогениды | N, P, As | Li3N | Нитрид лития |
| Гидриды | H | CaH2 | Гидрид кальция |
| Карбиды | C | SiC | Карбид кремния |
| Силициды | Si | FeSi | Силицид железа |
| Бориды | B | Mg3B2 | Борид магния |
Их названия образуются из латинского корня названия неметалла с окончанием «ид» и русского названия менее электроотрицательного элемента в родительном падеже (табл. 3). Если менее электроотрицательный элемент может находиться в разных окислительных состояниях, то после его названия в скобках указывают римскими цифрами его степень окисления. Так, Cu2O – оксид меди (I), CuO- оксид меди (II), CO – оксид углерода (II), CO2 – оксид углерода (IV), SF6 – фторид серы (VI). Можно также вместо степени окисления указывать с помощью греческих числительных приставок (моно-, ди-, три-, тетра-, пента-, гекса- и т.д.) стехиометрический состав соединения: СО – монооксид углерода (приставку «моно» часто опускают), СО2 – диоксид углерода, SF6 – гексафторид серы, Fe3O4 – тетраоксид трижелеза. Для отдельных бинарных соединений сохраняют традиционные названия: Н2О – вода, NН3 – аммиак, РН3 – фосфин.
Оксиды.
Оксиды – сложные вещества, бинарные соединения, состоящие из двух элементов, один из которых является кислород. Атомы кислорода в оксидах связаны ионно или ковалентно с атомами электроположительного элемента и не связаны друг с другом. Например:
Оксиды образуют почти все химические элементы. При образовании названия к слову оксид добавляется название элемента в родительном падеже. Если элемент проявляет переменную степень окисления, то ему соответствует несколько оксидов. В таких случаях при названии оксидов указывается степень окисления римской цифрой в скобках: Fe +2 O –оксид железа (II), Fe +3 2 O3 – оксид железа (III), S +4 O2 – оксид серы (IV), S +6 О3– оксид серы (VI) и др.
По химическим свойствам оксиды можно разделить на солеобразующие (их большинство) и несолеобразующие (безразличные). Примером несолеобразующих оксидов могут служить такие, как NO, N2O. Они не образуют солей. Солеобразующие оксиды подразделяются на кислотные, основные и амфотерные.
К кислотным относят оксиды типичных неметаллов (SО3, N2O5, CO2, P2O5, Сl2O7), а также оксиды некоторых металлов в их высшей степени окисления (СrO3, V2O5, Mn2O7 и др.). Этим оксидам соответствуют кислоты.
Основные оксиды – это оксиды типичных металлов: Na2O, MgO, BaO, CuO, Fe2O3 и др. Им соответствуют гидроксиды (основания).
К амфотерным относятся оксиды некоторых металлов: ZnO, Al2O3, SnO, Сr2O3, РbО и др. Они обладают одновременно свойствами кислотных и основных оксидов. В данной работе амфотерные оксиды и гидроксиды не рассматриваются.
1.Большинство кислотных оксидов взаимодействуют с водой, образуя кислоты:
Оксид кремния (IV) SiO2, а так же кислотные оксиды некоторых металлов (WO3, MoO3) не взаимодействуют с водой. Из основных оксидов в воде растворимы только оксиды щелочных (Li2O, Na2O, K2O) и щелочноземельных металлов (СаО, SrO, BaO), при этом образуются соответствующие гидроксиды:
Оксиды остальных металлов с водой не реагируют и соответствующие им гидроксиды получают косвенным путем.
2. Кислотные оксиды взаимодействуют с гидроксидами и их растворами, образуя соль и воду:
Основные оксиды взаимодействуют с кислотами, также образуя соль и воду:
3.Взаимодействие кислотных оксидов с основными приводит к образованию солей:
Кислоты.
Кислоты – это электролиты, диссоциирующие в водных растворах с образованием только катионов водорода.
Кислоты по своему химическому составу могут быть кислородными (HNO3, HNO2, H2SO4, Н2СО3 и др.) бескислородными (Н2S, НСl, HF, HBr, HCN) и др. Названия кислородных кислот происходят от названия кислотообразователя (центрального атома). Например, Н2СО3 – угольная кислота.
В тех случаях, когда элемент в одной и той же степени окисления образует несколько кислородных кислот, отличающихся между собой количеством атомов водорода и кислорода, к названию кислот добавляются приставки: мета – (наименьшее количество атомов водорода и киcлорода): орто – (наибольшее количество атомов водорода и кислорода). Например, НРО3 – метафосфорная кислота, Н3РO4 – ортофосфорная кислота.
Некоторые кислотообразующие элементы при одной и той же степени окисления образуют несколько кислот, молекулы которых отличаются числом атомов кислотообразователя. Эти кислоты называются изополикислотами. В названии кислоты содержится приставка из русского числительного, показывающая число атомов кислотообразователя в ее молекуле. Например: Н2S2О7 – двусерная кислота; Н2B4O7 – четырехборная кислота; H4P2O7 – двуфосфорная кислота; Н2Сr2О7 – двухромовая кислота.
Таблица 4. Названия наиболее часто употребляемых кислот и кислотных остатков
| Формулы кислоты | Название кислоты | Формула остатка | Название кислотного остатка | ||
| Кислородные кислоты | |||||
| HNO2 | Азотистая | NO‾2 | Нитрит-ион | ||
| HNO3 | Азотная | NO‾3 | Нитрат-ион | ||
| НВО2 | Метаборная | BO‾2 | Метаборат-ион | ||
| Н3ВО3 | Ортоборная | ВО 3 ‾3 | Ортоборат-ион | ||
| H2SiO3 | Метакремневая | SiO 2‾ 3 | Метасиликат-ион | ||
| H2SiO4 | Ортокремневая | SiO 4‾ 4 | Ортосиликат-ион | ||
| H2MnO4 | Марганцовистая | MnO 2‾ 4 | Манганат-ион | ||
| HMnO4 | Марганцевая | MnO‾4 | Перманганат-ион | ||
| HAsO2 | Метамышьяковистая | AsO‾2 | Метаарсенит-ион | ||
| H3AsO4 | Ортомышьяковая | AsO 3 ‾4 | Ортоарсенит-ион | ||
| H2SO3 | Сернистая | SO 2‾ 3 | Сульфит-ион | ||
| HSO‾3 | Гидросульфит-ион | ||||
| H2SO4 | Серная | SO 2 ‾4 | Сульфат-ион | ||
| HSO‾4 | Гидросульфат-ион | ||||
| H2CO3 | Угольная | CO3 2‾ | Карбонат-ион | ||
| HCO‾3 | Гидрокарбонат-ион | ||||
| НРO3 | Метафосфорная | РО‾3 | Метафосфат-ион | ||
| Н3РO4 | Ортофосфорная | РО 3 ‾4 | Ортофосфат-ион | ||
| НРО 2‾ 4 | Гидроортофосфат-ион | ||||
| Н2РО‾4 | Дигидроортофосфат-ион | ||||
| HClO | Хлорноватистая | ClO‾ | Гипохлорит-ион | ||
| НсlО4 | Хлорная | СlO‾4 | Перхлорит-ион | ||
| Бескислородные кислоты | |||||
| НСl | Хлороводородная (соляная) | Хлорид-ион | |||
| HF | Фтороводородная (плавиковая) | F ‾ | Фторид-ион | ||
| НВг | Бромоводородная | Вг‾ | Бромид-ион | ||
| HI | Иодоводородная | I ‾ | Иодид-ион | ||
| H2S | сероводородная | S 2 ‾ | Сульфид-ион | ||
| HS‾ | Гидросульфид-ион | ||||
Названия бескислородных кислот образуются от названия неметалла – кислотообразователя с добавлением слова – водородная. Например: НСl – хлороводородная (соляная) кислота; H2S – сероводородная кислота.
Кроме того, кислоты подразделяются по числу водород-ионов, способных “отщепляться” при диссоциации, на одноосновные (НСl, НNО3, СН3СООН), двухосновные (Н2SО4, Н2СО3, H2S) и многоосновные (Н3РО4, Н3ВО3, Н4P2O7). Анион, который остается после отщепления от молекулы кислоты одного или более водород-иона называется кислотным остатком. Заряд кислотного остатка определяется числом отнятых водород-ионов.
Основность килоты зависит от количества кислотных остатков, соответствующих данной кислоте. Так, одноосновным кислотам соответствует один кислотный остаток:
Двух- и многоосновные кислоты диссоциируют ступенчато, т. е. их молекулы последовательно отщепляются по одному водород – иону, и этим кислотам соответствуют два или более кислотных остатка. Так, молекулы серной кислоты в первую очередь, диссоциируют по уравнению:
Отщепление второго водород – иона идет по уравнению:
Ортофосфорная кислота Н3 РО4 диссоциирует в три ступени и имеет три кислотных остатка:
Следует отметить, что для многоосновных кислот вторая и третья ступени
диссоциации протекают в гораздо меньшей степени, чем первая.
Ступенчатая диссоциация кислот подтверждается наличием кислых солей. Каждый кислотный остаток способен образовать соль с катионом металла, т. е. основность кислоты показывает, сколько солей соответствует данной кислоте.
HSO4 – – гидросульфат – ион
HPO4 2 – – гидроортофосфат – ион
H2PO4 – – дигидроортофосфат – ион
Получение кислот
2. Взаимодействие солей с кислотами (наиболее распространенный способ).
При помощи этих реакций можно получить более слабую или более летучую кислоту, чем исходная.
3. Взаимодействие некоторых неметаллов с водородом:
Водные растворы таких соединений являются кислотами.
Для всех кислот характерны следующие реакции.
1. Все кислоты взаимодействуют с гидроксидами (основаниями): H2SO4 + 2NaOH = Na2SO4 + 2Н2О;
Или в ионной форме:
2Н + + MgO = Mg 2+ + Н2О
3. Разбавление кислоты (кроме азотной и азотистой) реагируют с активными металлами, выделяя водород:
4.Кислоты вступают в реакцию обмена с солями, в результате чего образуется либо нерастворимая соль, либо слабая кислота, либо газ:
Гидроксиды.
Гидроксиды – это электролиты, которые при диссоциации в водных растворах образуют только анионы гидроксила. Например:
Количество гидроксид-ионов в молекуле гидроксида определяется степенью окисления металла. Международные названия оснований происходят от слова гидроксид с добавлением названия металла в родительном падеже. Если металл проявляет переменную степень окисления и может образовать два или три гидроксида, то при названии гидроксида указывается его степень окисления римской цифрой в скобках. Например:
NaOH – гидроксид натрия; Bа (ОН)2 – гидроксид бария ; Fe (ОН)2 – гидроксид железа (II); Fe (ОН)з – гидроксид железа (Ш); Sn (ОН)2 – гидроксид олов (II); Sn (ОН)4 – гидроксид олов (IV).
Гидроксиды, имеющие в составе молекул по два или более гидроксид-ионов называются многокислотными. Они диссоциируют ступенчато:
Ва (ОН) 2 ↔ ВаОН + + ОН‾
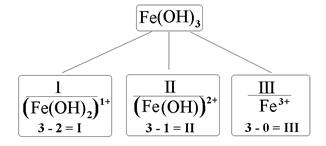
Ступенчатые диссоциации гидроксидов подтверждается наличием основных солей, в состав которых входят основные остатки, содержащие гидроксид-ионы. Каждый основной остаток способен образовать соль с кислотным остатком, т. е. кислотность гидроксида показывает, сколько типов солей может образовать данный гидроксид.
Основные остатки называются по названию металла с добавлением слова – ион. Например: Na + – натрий-ион, Ва 2+ – барий-ион. Если металл проявляет переменную степень окисления, то величина заряда его иона указывается римской цифрой в скобках. Например: Fe 2+ – железо (П)-ион; Fe 3+ – железо (Ш)-ион и т. д.
В случае сложных катионов к названию металла добавляются приставки гидроксо-, ди-гидроксо-, тригидроксо-, характеризующие в основном остатке наличие одного, двух или трех гидроксид-ионов. Например:
ВаОН + – гидроксобарий-ион;
FeOH 2+ – гидроксожелезо (Ш)-ион;
Fe(OH) + 2 – гидроксожелезо (Ш)-ион.
В основу классификации гидроксидов положена их растворимость в воде. Гидроксиды, растворимые в воде, называются щелочами. Это гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH, КОН, Са(ОН)2, Sr(ОН)2, Ва(ОН)2. В промышленности гидроксиды щелочных металлов получают электролизом расплавом солей этих металлов, а в лабораторных условиях – взаимодействием этих металлов или их оксидов с водой. Например:
Или в ионной форме:
Щелочи в растворах почти полностью диссоциируют на ионы. Они относятся к сильным электролитам и в ионных уравнениях записываются в виде ионов.
Большинство гидроксидов в воде практически не растворимы. Их получают действием щелочей на водные растворы соответствующих солей. Например:
FeCl3 + 3NaOH = ↓ Fe (ОН)3 + 3NaCl
Или в ионной форме:
Общие свойства класса гидроксидов (действие на индикаторы, взаимодействие с кислотами, солями, оксидами) обусловлены наличием в их растворах гидроксид-ионов. Наиболее характерными для гидроксидов являются следующие реакции:
1. Гидроксиды (растворимые и нерастворимые основания) реагируют с кислотами.
Или в ионной форме:
2. Щелочи реагируют с кислотными оксидами:
Или в ионной форме:
3. Щелочи реагируют с растворами солей металлов, образуя нерастворимые гидроксиды:
Или в ионной форме:
Соли.
Соли – это электролиты, образующие при диссоциации в водных растворах катионы основных остатков и анионы кислотных остатков.
Названия солей образуется из названия кислотных остатков (в именительном падеже) и названия основного остатка (в родительном). Например: NaCl – хлорид натрия, MgSO4 –сульфат магния, Fe (NO3)3 – нитрат железа (III), KHSO4 – гидросульфат калия, FeOHCl –хлорид гидроксожелеза (П), NaH2PO4 – дигидроортофосфат натрия.
Получение солей
Важнейшие способы получения солей рассмотрены при изложении основных химических свойств оксидов, кислот и гидроксидов. Отметим ряд других методов.
1. Взаимодействие между двумя солями. Реакции этого типа протекают до конца, если один из продуктов выпадает в осадок:
2. Взаимодействие металла с неметаллом. Таким путем получают соли бескислород-ных кислот:
3. Термическое разложение солей:
В зависимости от состава различают средние (нормальные) (КСl, MgSO4), кислые (КНСО3, NaHS), основные (FeOHCl2, MgOHNO3) соли.
Любую соль можно представить как продукт взаимодействия гидроксида и кислоты (реакция нейтрализации). Например:
В данной реакции участвует одинаковое количество гидроксид-ионов и водород-ионов (2ОН‾ и 2Н + ). Получается средняя соль Na2SO4 – сульфат натрия. Если гидроксида взять меньше, чем требуется для полной нейтрализации кислоты (т. е. водород–ионов), то получается кислая соль NaHSO4 – гидросульфат натрия:
Таким образом, кислые соли – продукты неполного замещения водорода кислоты на катионы металла. Они образуются только двух- и многоосновными кислотам (у этих кислот по два и более кислотных остатка). Так, например, ортофосфорная кислота может дать одну среднюю соль и две кислые соли (в зависимости от количества взятого гидроксида):
Или в ионной форме:
Одноосновные кислоты, которым соответствует только один кислотный остаток, не образуют кислых солей.
Кислые соли можно перевести в средние, добавляя в их растворы соответствующие гидроксиды:
Или в ионной форме:
Основные соли содержат в своем составе гидроксид–ионы исходного основания, не замещенные на кислотные остатки. Они образуются при взаимодействии кислоты с избытком гидроксида (основания). Например:
Или в ионной форме:
Основные соли образуются только многокислотными гидроксидами. Так, например, гидроксид железа (III) Fe(OH)3 при взаимодействии с кислотой может образовывать одну среднюю и две основные соли:
Однокислотные гидроксиды (NaOH, КОН) не образуют основных солей, так как этим гидроксидам соответствует только один основный остаток.
Перевод основных солей в средние осуществляют добавлением соответствующих кислот. Например:
Или в ионной форме:
MgOH + + H + ↔ Mg 2+ + H2O;
CuOH + + H + ↔ Cu 2+ + H2O
Все соли, за небольшим исключением HgCl2, CdCl2, относятся к сильным электролитам и в водных растворах полностью диссоциируются на катионы основных остатков и анионы кислотных остатков.
Диссоциация средних солей протекает полностью в одну стадию:
Кислые соли, подобно многоосновным кислотам, диссоциируют ступенчато:
Однако степень диссоциации на второй и третьей ступенях очень мала. Поэтому раствор кислой соли содержит лишь незначительное количество водород–ионов.
Основные соли – диссоциируют также ступенчато. Например:
Однако диссоциация на второй и третьей ступенях настолько мала, что гидроксид-ионов в растворах основных солей практически нет.