Что такое основные свойства в химии
От чего зависят кислотно-основные свойства
Содержание статьи
Что такое кислотно-основные свойства
Основные свойства проявляют металлы, их оксиды и гидроксиды. Кислотные свойства проявляются неметаллы, их соли, кислоты и ангидриды. Существуют также амфотерные элементы, способные проявлять как кислотные, так и основные свойства. Цинк, алюминий и хром являются одними из представителей амфотерных элементов. Щелочные и щелочно-земельные металлы проявляют типичные основные свойства, а сера, хлор и азот кислотные.
Так, при реакции оксидов с водой, в зависимости от свойств основного элемента, получается либо основание или гидроксид, либо кислота.
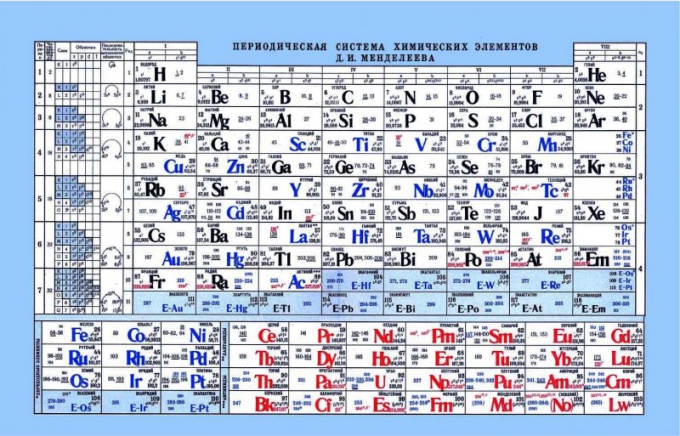
Периодическая таблица Менделеева, как показатель кислотно-основных свойств
Таблица Менделеева может помочь в определении кислотно-основных свойств элементов. Если посмотреть на таблицу Менделеева, то можно увидеть такую закономерность, что по горизонтали слева-направо усиливаются неметаллические или кислотные свойства. Соответственно ближе к левому краю находятся металлы, по центру амфотерные элементы, а справа неметаллы. Если посмотреть на электроны и их притяжение к ядру, то заметно, что в левой части элементы имеют слабый заряд ядра, а электроны находятся на s-уровне. В результате таким элементам проще отдать электрон, нежели элементам, находящимся в правой части. Неметаллы имеют достаточно высокий заряд ядра. Тем самым усложняется отдача свободных электронов. Таким элементам проще присоединить к себе электроны, проявляя кислотные свойства.
Три теории для определения свойств
Существуют три подхода, определяющих какие свойства имеет соединение: протонная теория Бренстеда-Лоури, апротонная электронная теория Льюиса, теория Аррениуса.
Согласно протонной теории кислотными свойствами обладают соединения, способные отдавать свои протоны. Такие соединения были названы донорами. А основные свойства проявляются способностью акцептировать или присоединять протон.
Апротонный подход подразумевает то, что акцептирование и донорство протонов для определения кислотно-основных свойств необязательно. Кислотные свойства по данной теории проявляются возможностью принять электронную пару, а основные, наоборот, отдать эту пару.
Периодический закон
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.
Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.
Период, группа и электронная конфигурация
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Длина связи
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Основные и кислотные свойства
Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Восстановительные и окислительные свойства
Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.
Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Кислотно-основные свойства химических соединений
Любое вещество в определенных условиях может проявлять свойства кислоты и основания по отношению к какому-либо другому веществу, включая и растворитель.
Со времен Аррениуса, по определению которого кислоты в водных растворах диссоциирует на ионы водорода и анионы, а основания диссоциируют на гидроксид-ионы и катионы, круг веществ, участвующих в реакциях кислотно-основного равновесия, значительно расширился. Общепринятными считаются протонная теория Бренстеда–Лоури и электронная теория Льюиса.
Протонная теория Бренстеда–Лоури применима лишь к протонсодержащим или протонприсоединяющим веществам. Согласно этой теории кислотой называется вещество, способное быть донором протонов, а основанием – вещество, которое может присоединить (акцептировать) протон:
По определению, HAn – кислота, An– – основание, сопряженное с этой кислотой. Любой кислоте соответствует сопряженное с ней основание.
Любое кислотно-основное равновесие включает взаимодействие двух пар сопряженных кислот и оснований.
В определенных условиях многие вещества могут вести себя как кислота или как основание. Эти два понятия неразделимы, а потому правильнее говорить о кислотно-основных свойствах данного вещества.
В соответствии с законом действующих масс константы равновесия реакций протолиза сопряженных кислот и оснований в воде связаны между собой простым соотношением
Перемножив константы сопряженных кислот и оснований, получим
Заменив активности 

Произведения констант диссоциации сопряженных кислот и оснований в водных растворах равно ионному произведению воды. По известным Kk(Kосн) можно легко найти значения сопряженных KВ.
Электронная теория Льюиса допускает, что участие в кислотно-основном равновесии протона необязательно, поэтому ее называют апротонной. Согласно апротонной (электронной) теории, кислотой называется вещество, способное присоединять электронную пару, а основанием – вещество, способное отдавать электронную пару.
При взаимодействии донора электронной пары :NF3 (кислота) и акцептора электронной пары BF3 (основание) образуется более устойчивое электронное окружение (октет) за счет донорно-акцепторной (двухэлектронной двухцентровой) связи.
Ни кислота, ни основание протонов не содержат.
Эта концепция расширяет границы веществ, проявляющих кислотно-основные свойства, включая в себя протонотдающие и протонприсоединяющие системы.
В периоде сила кислородсодержащей кислоты растет с увеличением заряда и с уменьшением радиуса иона кислотообразующего элемента:
Для одного и того же элемента константа диссоциации различных кислот возрастает по мере увеличения степени окисления кислотообразующего элемента примерно на пять порядков каждый раз.
В пределах одной группы элементов сила кислоты уменьшается по мере увеличения радиуса кислотообразующего элемента:
Для многоосновных кислот способность к депротонизации уменьшается по мере увеличения отрицательного заряда аниона:
При этом константа диссоциации каждой последующей ступени уменьшается примерно на пять порядков:
На состояние динамического равновесия, в котором находится раствор слабого электролита, сильно влияет присутствие одноименного иона. Так, диссоциация уксусной кислоты протекает по схеме
и для этой реакции
Прибавление к раствору уксусной кислоты ее соли (CH3COONa → CH3COO– + Na+) резко увеличивает концентрацию ионов CH3COO– и смещает равновесие в сторону образования недиссоциированных молекул кислоты. Ее диссоциация теперь пренебрежимо мала, и концентрация недиссоциированных молекул почти равна концентрации кислоты, тогда при [CH3COOH] = [кислота], и [CH3COO–] = [соль] концентрация H+ равна
Следовательно, концентрация ионов H+ этого раствора будет определяться соотношением концентраций кислоты и соли, взятых для его приготовления.
Рассуждая аналогичным образом, можно вывести уравнения для раствора слабого основания и его соли (NH4OH и NH4Cl):
Из предыдущих уравнений видно, что концентрация ионов водорода при разбавлении сохраняется, ибо отношения [кислота]:[соль], [соль]:[основание] остаются постоянными. Добавление к такой смеси кислоты или щелочи приводит к связыванию избыточных ионов H+ анионами, а OH– – катионами. Это смещает равновесие диссоциации слабого электролита, в результате чего концентрация H+ практически не меняется. Растворы, содержащие смесь слабого электролита и его соли, сохраняющие характерные для него значения pH при разбавлении, добавлении сильных кислот или щелочей, называются буферными
Если к одному литру ацетатного буфера, содержащего по 0,1 моля уксусной кислоты (K = 1,86 · 10–5) и ее соли, имеющего [H+] = 1,86 ∙ 10–5, pH 4,73, добавить 10 мл HCl (0,01 моля), то в результате реакции
концентрация кислоты увеличится, а соли уменьшится на 0,01 моля; тогда
Добавление такого же количества щелочи приведет к увеличению [CH3COO–]:
Свойства основных классов неорганических соединений
Основные классы неорганических соединений
Неорганическими называют соединения, которые не содержат углерод. Также в порядке исключения к ним относят некоторые вещества на основе углерода: карбонаты, карбиды, карбонилы металлов, цианиды и цианаты, оксиды углерода.
Неорганические соединения разделяют на простые (содержат атомы одного элемента) и сложные (образуются из атомов двух и более элементов).
Простые и сложные вещества также подразделяют на классы.
Классы простых веществ — это металлы, неметаллы, амфотерные вещества и благородные газы.
Классы сложных неорганических веществ — основания, оксиды, кислоты и соли.
Основные свойства простых неорганических веществ
Металлы:
Неметаллы — химические элементы, не обладающие металлическими свойствами:
Амфотерные вещества проявляют и металлические (оснóвные), и неметаллические (кислотные) свойства: бериллий Be, алюминий Al, свинец Pb, цинк Zn, железо Fe, марганец Mn и другие.
Благородные (инертные) газы — гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радиоактивный радон Rn:
Основные свойства сложных неорганических веществ
Оксиды — соединения двух химических элементов, один из которых — кислород.
По химическим характеристикам оксиды подразделяют на:
Изменяют окраску индикаторов:
В зависимости от отношения к воде основания подразделяют на:
Кислоты — соединения анионов кислотных остатков с катионами водорода, которые могут замещаться на катионы металлов.
Меняют цвет индикаторов:
Соли — соединения одного или нескольких катионов (или подобных ионов, например, NH4+ и анионов кислотного остатка (одного или нескольких).
Генетическая связь классов неорганических соединений
Химические свойства веществ основных классов неорганических соединений дают им возможность вступать в реакции между собой: см. таблицу 1.