Что такое остаток фосфорной кислоты
Остаток фосфорной кислоты



Тема: Нуклеиновые кислоты
Нуклеиновые кислоты, как и белки, необходимы для жизни. Они представляют собой генетический материал всех живых организмов вплоть до самых простых вирусов. Название «нуклеиновые кислоты» отражает тот факт, что локализуются они главным образом в ядре (nucleus — ядро). При специфическом окрашивании на нуклеиновые кислоты ядра бывают очень хорошо видны в световом микроскопе.
Нуклеиновые кислоты – это сложные природные высокомолекулярные соединения, обеспечивающие хранение и передачу наследственной информации в живых организмах.
Нуклеиновые кислоты – высокомолекулярные соединения, биополимеры, мономерами которых являются нуклеотиды.
Выяснение структуры ДНК (дезоксирибонуклеиновой кислоты) — одного из двух существующих типов нуклеиновых кислот — открыло новую эпоху в биологии, так как позволило, наконец, понять, каким образом живые организмы хранят информацию, необходимую для регулирования их жизнедеятельности и каким образом передают эту информацию своему потомству. Выше мы уже отметили, что нуклеиновые кислоты состоят из мономерных единиц, называемых нуклеотидами. Из нуклеотидов строятся чрезвычайно длинные молекулы — полинуклеотиды. Чтобы понять структуру полинуклеотидов, необходимо, следовательно, сначала ознакомиться с тем, как построены нуклеотиды.
Строение нуклеотидов
Молекула нуклеотида состоит из трех частей — пятиуглеродного сахара, азотистого основания и фосфорной кислоты.
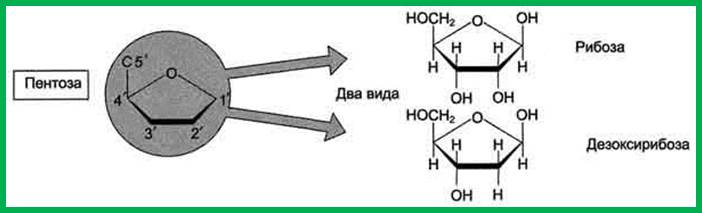
1. Сахар.
Сахар, входящий в состав нуклеотида, содержит пять углеродных атомов, т. е. представляет собой пентозу. В зависимости от вида пентозы, присутствующей в нуклеотиде, различают два типа нуклеиновых кислот — рибонуклеиновые кислоты (РНК), которые содержат рибозу, и дезоксирибонуклеиновые кислоты (ДНК), содержащие дезоксирибозу. В дезоксирибозе — ОН-группа при 2-м атоме углерода заменена на атом Н, т. е. в ней на один атом кислорода меньше, чем в рибозе.
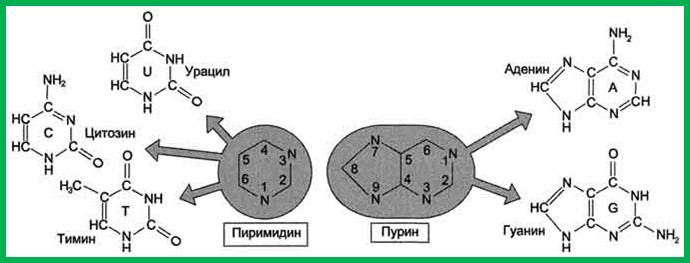
2. Азотистые основания
В обоих типах нуклеиновых кислот содержатся основания четырех разных видов: два из них относятся к классу пуринов и два — к классу пиримидинов. Основной характер этим соединениям придает включенный в кольцо азот. К числу пуринов относятся аденин (А) и гуанин (Г), а к числу пиримидинов — цитозин (Ц) и тимин (Т) или урацил (У) (соответственно в ДНК или РНК). Тимин химически очень близок к урацилу (он представляет собой 5-метилурацил, т. е. урацил, в котором у 5-го углеродного атома стоит метильная группа). В молекуле пуринов имеется два кольца, а в молекуле пиримидинов — одно. Основания принято обозначать первой буквой их названия: А, Г, Т, У и Ц.
Остаток фосфорной кислоты
Нуклеиновые кислоты являются кислотами потому, что в их молекуле содержится фосфорная кислота.
Сахар, азотистое основание и фосфорная кислота, объединяясь, образуют молекулу нуклеотида. Соединение сахара с основанием происходит с выделением молекулы воды, т. е. представляет собой реакцию конденсации. Для образования нуклеотида требуется еще одна реакция конденсации — между сахаром и фосфорной кислотой.
Разные нуклеотиды отличаются друг от друга природой сахаров и оснований, которые входят в их состав.
Роль нуклеотидов в организме не ограничичается тем, что они служат строительными блоками нуклеиновых кислот; некоторые важные коферменты также представляют собой нуклеотиды. Таковы, например, аденозинтрифосфат (АТФ), циклический аденозинмонофосфат (цАМФ), кофермент А, никотинамидаденинди-нуклеотид (НАД), никотинамидадениндинуклеотидфосфат (НАДФ) и флавинадениндинуклеотид (ФАД).
Дезоксирибонуклеииновая кислота (ДНК) — макромолекула, обеспечивающая хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов. ДНК содержит информацию о структуре различных видов РНК и белков.
ДНК представляет собой длинную полимерную цепочку, состоящую из многих тысяч мономеров – дезоксирибомононуклеотидов, в состав которых входят: дезоксирибоза, фосфорная кислота, азотистые основания А, Т, Г, Ц. Структура ДНК имеет три уровня.
Остаток фосфорной кислоты
Химический состав живых организмов
Элементный состав
Химический состав живых организмов можно выразить в двух видах — атомном и молекулярном. Атомный (элементный) состав характеризует соотношение атомов элементов, входящих в живые организмы. Молекулярный (вещественный) состав отражает соотношение молекул веществ.
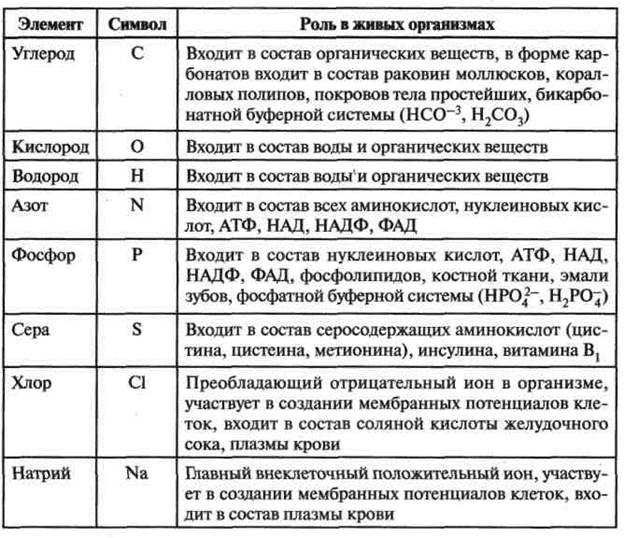
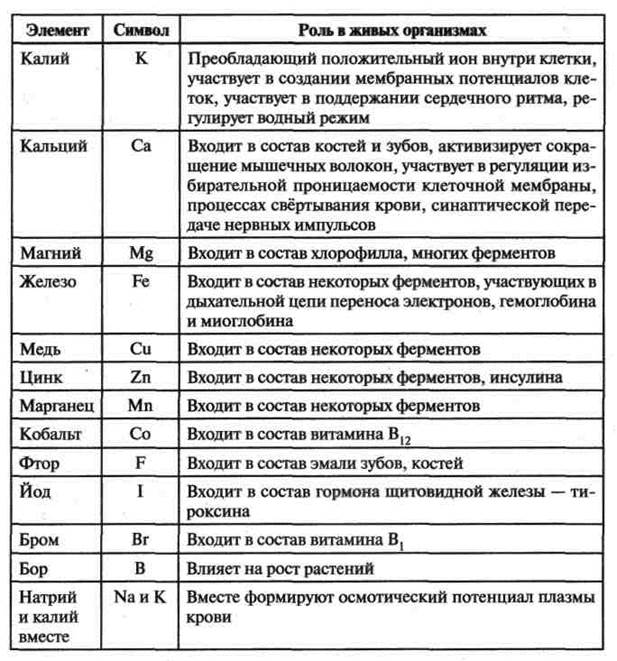
По относительному содержанию элементы, входящие в состав живых организмов, принято делить на три группы:
/. Макроэлементы — О, С, Н, N (в сумме около 98—99 %, их еще называют основные); Са, К, Si, Mg, P, S, Na, CI, Fe (в сумме
около 1—2%). Макроэлементы составляют основную массу процентного состава живых организмов.
2. Микроэлементы — Mn, Co, Zn, Си, В, I, F и др. Их суммарное содержание в клетке составляет порядка 0,1%.
3. Ультрамикроэлементы — Se, U, Hg, Ra, Au, Ag и др. Их содержание в клетке очень незначительно (менее 0,01 %), а физиологическая роль большинства из них не раскрыта.
Химические элементы, которые входят в состав живых организмов и при этом выполняют биологические функции, называются биогенными. Даже те из них, которые содержатся в клетках в ничтожно малых количествах, ничем не могут быть заменены и совершенно необходимы для жизни
Молекулярный состав
Химические элементы входят в состав клеток в виде ионов и молекул неорганических и органических веществ. Важнейшие неорганические вещества в клетке — вода и минеральные соли, важнейшие органические вещества — углеводы, липиды, белки и нуклеиновые кислоты.
Вода
Вода— преобладающий компонент всех живых организмов. Она обладает уникальными свойствами благодаря особенностям строения: молекулы воды имеют форму диполя и между ними образуются водородные связи. Среднее содержание воды в клетках большинства живых организмов составляет около 70 %. Вода в клетке присутствует в двух формах: свободной (95 % всей воды клетки) и связанной (4—5 % связаны с белками).
1. Вода — растворитель.
3. Транспортная функция.
4. Вода — термостабилизатор и терморегулятор.
5. Структурная функция.
УглеводыУглеводы — органические соединения, состоящие из одной или многих молекул простых Сахаров. Содержание углеводов в животных клетках составляет 1—5 %, а в некоторых клетках растений достигает 70%. Выделяют три группы углеводов: моносахариды (или простые сахара), олигосахариды (состоят из 2—10 молекул простых Сахаров), полисахариды (состоят более чем из 10 молекул сахаров).
Моносахариды: рибоза, дезоксирибоза, глюкоза, фруктоза. Олигосахариды: мальтоза, лактоза, сахароза. Полисахариды: целлюлоза, крахмал, гликоген, хитин.
1. Энергетическая (глюкоза).
2. Запасающая (крахмал и гликоген).
3. Строительная, или структурная (целлюлоза, хитин).
4. Рецепторная (гликопротеины).
Липиды
Липиды — жиры и жироподобные органические соединения, практически нерастворимые в воде. Их содержание в разных клетках сильно варьирует: от 2—3 до 50—90 % в клетках семян растений и жировой ткани животных. В химическом отношении липиды, как правило, сложные эфиры жирных кислот и ряда спиртов. Они делятся на несколько классов. Наиболее распространены в живой природе нейтральные жиры, воски, фосфолипиды, стероиды. В состав большинства липидов входят жирные кислоты, молекулы которых содержат гидрофобный длинноцепочечный углеводородный «хвост» и гидрофильную карбоксильную группу.
1. Строительная, или структурная (фосфолипиды, холестерин).
2. Гормональная, или регуляторная (тестостерон, прогестерон, кортизон).
6. Участие в метаболизме (витамин D).
Белки
Белки — это биологические гетерополимеры, мономерами которых являются аминокислоты. В образовании белков участвуют только 20 аминокислот. Они называются фундаментальными, или основными. Некоторые из аминокислот не синтезируются в организмах животных и человека и должны поступать с растительной пищей (они называются незаменимыми). Аминокислоты, соединяясь друг с другом ковалентными пептидными связями, образуют различной длины пептиды.
Выделяют 4 уровня организации белков:
Первичная структура— последовательность аминокислот в полипептидной цепи. Она образуется за счет ковалентных пептидных связей между аминокислотными остатками.
Вторичная структураобразуется укладкой полипептидных цепей в α-спираль или
β-структуру. Она поддерживается за счет водородных связей между атомами водорода групп NH- и атомами кислорода групп СО—, α-спиральформируется в результате скручивания полипептидной цепи в спираль с одинаковыми расстояниями между витками. Она характерна для глобулярных белков, имеющих сферическую форму глобулы, β-структура представляет собой продольную укладку трех полипептидных цепей. Она характерна для фибриллярных белков, имеющих вытянутую форму фибриллы. Третичная и четвертичная структуры имеют только глобулярные белки.
Третичная структураобразуется при сворачивании спирали в клубок (глобулу, домен). Домены — глобулоподобные образования с гидрофобной сердцевиной и гидрофильным наружным слоем. Третичная структура формируется за счет связей, образующихся между радикалами R-аминокислот, за счет ионных, гидрофобных и дисперсионных взаимодействий, а также за счет образования дисульфидных (S—S) связей между радикалами цистеина.
Четвертичная структурахарактерна для сложных белков, состоящих из двух и более полипептидных цепей, не связанных ковалент-ными связями, а также для белков, содержащих небелковые компоненты (ионы металлов, коферменты). Четвертичная структура поддерживается такими же химическими связями, как итретичная.
Утрата белковой молекулой своей структурной организации называется денатурацией.
По химическому составу различают простые и сложные белки. Простые белки состоят только из аминокислот. Сложные белки содержат белковую часть и небелковую — простетические группы.
1. Каталитическая, или ферментативная (все ферменты).
2. Строительная, или структурная (кератины, коллаген, эластин).
3. Транспортная (гемоглобин).
4. Гормональная, или регуляторная (инсулин).
5. Защитная (иммуноглобулины).
6. Сократительная, или двигательная (актин и миозин).
7. Рецепторная (сигнальная).
Нуклеиновые кислоты
Существуют два типа нуклеиновых кислот: ДНК и РНК. Нуклеиновые кислоты — полимеры, мономерами которых служат нуклеотиды. Нуклеотиды ДНК и РНК состоят из следующих компонентов:
1. Азотистое основание(в ДНК: аденин, гуанин, цитозин и тимин; в РНК: аденин, гуанин, цитозин и урацил).
2. Сахар-пентоза (в ДНК — дезоксирибоза, в РНК — рибоза).
Остаток фосфорной кислоты.
ДНК (дезоксирибонуклеиновые кислоты)— длинноцепочечный не-разветвленный полимер, состоящий из четырех типов мономеров — нуклеотидов А, Т, Г и Ц — связанных друг с другом ковалентной связью через остатки фосфорной кислоты.
Молекула ДНК состоит из двух спирально закрученных цепей (двойная спираль). При этом аденин образует 2 водородные связи с тимином, а гуанин — 3 связи с цитозином. Эти пары азотистых оснований называют комплементарными.
Связываясь с белками, молекула ДНК образует хромосому. Хромосома — комплекс одной молекулы ДНК с белками. Молекулы ДНК эукариотических организмов (грибов, растений и животных) линейны, незамкнуты, связаны с белками, образуя хромосомы. У прокариот (бактерий) ДНК замкнута в кольцо, не связана с белками, не образует линейную хромосому.
Функция ДНК:хранение, передача и воспроизведение в ряду поколений генетической информации. ДНК определяет, какие белки и в каких количествах необходимо синтезировать.
РНК (рибонуклеиновые кислоты)вместо дезоксирибозы содержат рибозу, а вместо тимина — урацил. РНК, как правило, имеют лишь одну цепь, более короткую, чем цепи ДНК. Двуцепочечные РНК встречаются у некоторых вирусов.
Информационная (матричная) РНК — иРНК (или мРНК).
Транспортная РНК — тРНК.
Рибосомная РНК — рРНК.
Функции РНК:участие в биосинтезе белков.
Молекулы ДНК обладают способностью, неприсущей ни одной другой молекуле, — способностью к удвоению. Процесс удвоения молекул ДНК называется репликацией. Воснове репликации лежит принцип комплементарности — образование водородных связей между нуклеотидами А и Т, Г и Ц.
Фосфорная кислота [H3PO4]: Структура | Свойства | Применение
В чистом виде фосфорная кислота представляет собой бесцветное твердое вещество. В менее концентрированном виде это вязкая жидкость без запаха с плотностью 1,885 г/мл. Обычно она нелетучая и нетоксична, но 85-процентный раствор по-прежнему может повредить глаза и вызвать сильное раздражение кожи.
Давайте копнем глубже и выясним, как образуется фосфорная кислота, как она выглядит на молекулярном уровне, каковы ее физические и химические свойства и где она используется.
Профиль фосфорной кислоты
Молярная масса: 97,994 г/моль
Внешний вид: густая бесцветная жидкость.
Точка кипения: 212 °C
Точка плавления: 42,35 °C (кристаллического твердого вещества)
Динамическая вязкость: от 2,4 до 9,4 сантипуаз (85% водный раствор).
Плотность: 1,83 г / см 3 (твердое вещество); 1,68 г / см 3 (85% водный раствор при 25 °C)
Структура
Соединение H3PO4 имеет в общей сложности 32 валентных электрона. Поскольку фосфор является наименее электроотрицательным, он помещается в центре. Атомы водорода присоединяются к внешней стороне атомов кислорода, образуя он-Группы.
В этой структуре каждый атом имеет полную внешнюю оболочку: атомы фосфора и кислорода имеют восемь валентных электронов, а атомы водорода имеют вокруг себя два валентных электрона.
В структуре все еще есть 32 валентных электрона, и каждый атом имеет формальный заряд, равный нулю. Таким образом, это наиболее вероятная или вероятная структура Льюиса для H3PO4.
Соединение содержит 3 одинарные связи ОН, 3 одинарные связи PO и 1 двойную связь P = O. Каждая одинарная связь является сигма-связью, а двойная связь состоит из сигма-связи и пи-связи.
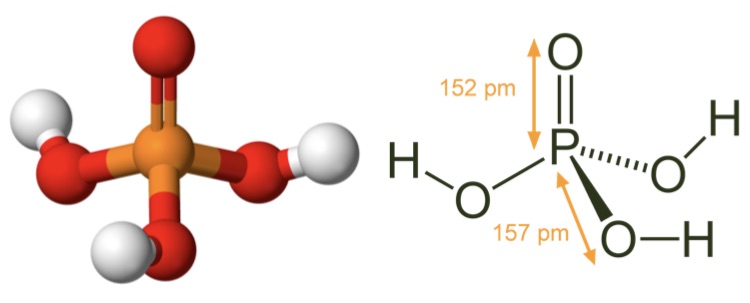
Фосфорная кислота: шарообразная модель и размеры структурной формулы
Молекулярная геометрия PO (OH)3 является тетраэдрической, а кристаллическая структура-моноклинной. А поскольку распределение зарядов на центральных атомах асимметрично, то молекула считается полярной.
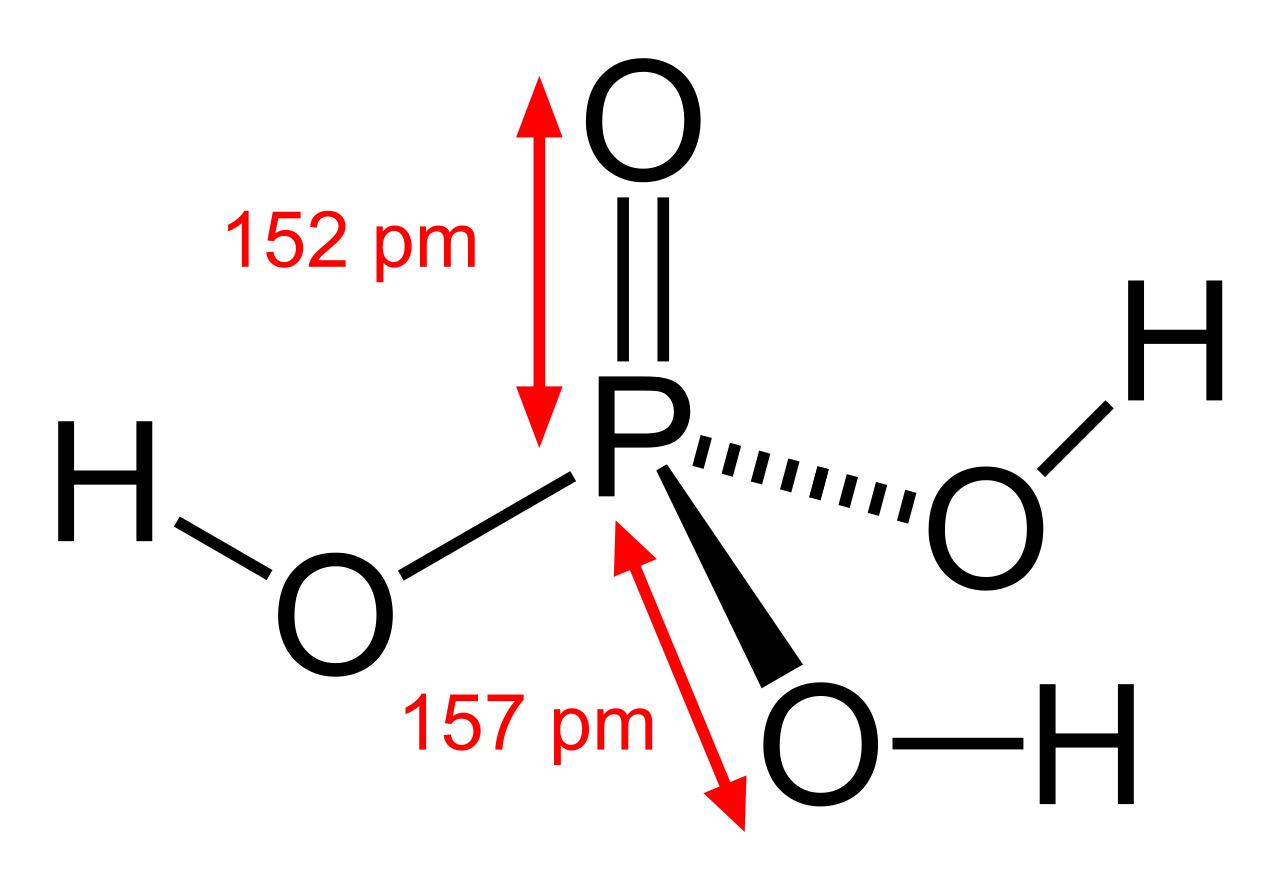
Последние достижения в области нанотехнологий, включая методы поглощения рентгеновских лучей вблизи краев и методы рассеяния рентгеновских лучей под большим углом, позволили ученым точно определить структуру фосфорной кислоты. Расстояние связи P=O в структуре близко к 152 пикометрам, и расстояния P=O-O были уточнены до 309 пикометров, с углом связи близким к тетраэдрическому.
Как она производится?
Фосфорная кислота может быть синтезирована либо мокрым способом, либо термическим способом.
В последнем в качестве сырья используются воздух, вода и элементарный фосфор. Он включает в себя три важных этапа: сгорание, увлажнение и запотевание. Вот как это происходит:
Во-первых, жидкий элементарный фосфор сжигается в камере сгорания при высоких температурах в диапазоне от 1650 до 2760 °C. Эта реакция окисления происходит в окружающем воздухе и производит пятиокись фосфора.
Затем продукт гидратируют водой с образованием сильной фосфорной кислоты (в жидком состоянии).
На последнем этапе для удаления фосфорно-кислотного тумана из потока дымовых газов используются высоконапорные каплеуловители.
Концентрация фосфорной кислоты, синтезированной в этом процессе, обычно составляет от 75 до 85 процентов. Такие уровни концентрации необходимы для производства высококачественной химической продукции. Несколько эффективных установок извлекают чрезвычайно концентрированную фосфорную кислоту (до 99,9%), используя тот же тепловой процесс.
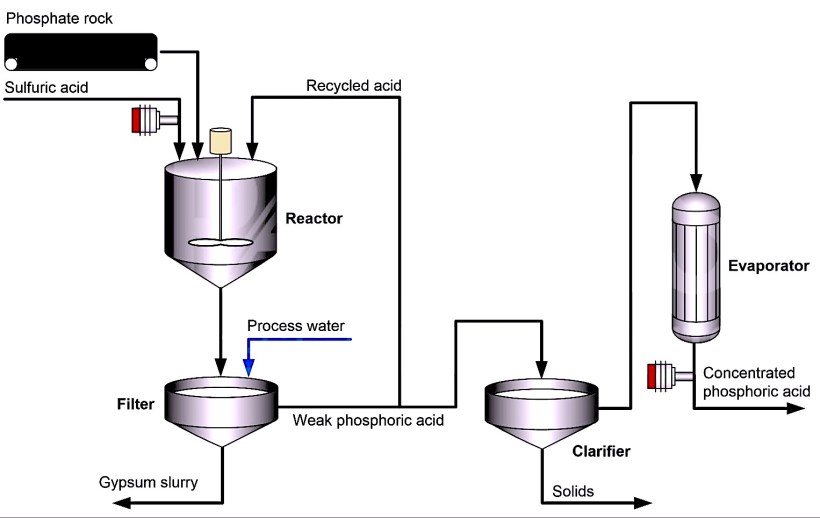
Однако почти 80% фосфорной кислоты производится мокрым способом. В этом методе серная кислота обрабатывается природным фосфатсодержащим минералом, таким как гидроксиапатит.
Минерал высушивают, крошат, а затем подают в реактор вместе с серной кислотой. В результате реакции сульфат сливается с кальцием (из минерала), образуя сульфат кальция (гипс).
Затем добавляется обработанная вода, и гипс вместе с другими нерастворимыми примесями удаляется через фильтр. Фосфорная кислота, полученная этим мокрым способом, содержит 25-30% пятиокиси фосфора.
Обычно эта кислота дополнительно концентрируется, чтобы соответствовать требованиям, предъявляемым к производству удобрений. В большинстве случаев фосфорная кислота концентрируется до 40-55% пятиокиси фосфора с помощью двух / трех вакуумных испарителей.
Свойства
Чистая фосфорная кислота в лаборатории выглядит как плотное, бесцветное, бесформенное кристаллическое твердое вещество, которое плавится при температуре 42,35 °C. Ее физические свойства зависят от чистоты, концентрации кислоты, а также от температуры, при которой вы ее видите.
Фосфорная кислота менее агрессивна и менее опасна по сравнению с азотной и серной кислотами. Это негорючее вещество как в жидкой, так и в твердой форме.
Когда кислота подвергается воздействию тепла, а затем охлаждается до комнатной температуры, она образует прозрачное, хрупкое стекло. После такого воздействия тепла состав кислоты остается прежним.
Обычно фосфорная кислота выпускается в виде бесцветного сиропа с концентрацией в воде 85 процентов и плотностью 1,885 граммов на миллилитр.
В водном растворе фосфорная кислота действует как трипротовая кислота, имеющая три ионизируемых атома водорода. Соединение может потерять эти атомы в виде протонов (ионов H + ).
Кислота растворима как в воде, так и в этаноле. Однако большинство ее солей не растворимы в воде, если нет сильной минеральной кислоты.
Области применения
Фосфорная кислота имеет несколько важных применений. Ее соли, такие как фосфаты аммония и кальция, широко используются в качестве удобрений. Кислота используется для производства электролитов, средств для удаления ржавчины, модификаторов рН, травителей, бытовых чистящих средств и дезинфицирующих средств.
Поскольку это вещество нетоксично и имеет умеренно кислую природу, оно также используется в напитках, пищевых ароматизаторах, косметике, средствах для ухода за зубами и кожей. Давайте подробнее рассмотрим, чем полезна фосфорная кислота.
В менее концентрированной форме она используется для производства различных видов безопасных фосфорных удобрений, которые помогают растениям расти. Фактически, почти 90% синтезированной фосфорной кислоты используется в качестве удобрений.
Многие безалкогольные напитки, в том числе Coca-Cola, содержат фосфорную кислоту. Это придает напитку слегка кисловатый вкус. Несмотря на то, что его концентрация достаточно низкая, экстремальный прием таких напитков может вызвать эрозию зубов и даже привести к образованию почечных камней.
Фосфорная кислота в качестве электролита имеет полезные характеристики, такие как хорошая ионная проводимость, низкая летучесть, стабильность при относительно высоких температурах и устойчивость к диоксиду углерода и монооксиду углерода.
Поскольку чистая фосфорная кислота обладает высокой протонной проводимостью и превосходной термостабильностью, полибензимидазол (PBI), допированный фосфорной кислотой, является наиболее многообещающим среди мембран на основе PBI, которые могут обеспечить хорошую производительность топливных элементов даже при низком уровне увлажнения и температуре 200 °С.
Специфическое применение фосфорной кислоты:
Глобальный рынок
Многие развивающиеся страны начали сосредотачиваться на увеличении добычи фосфатов и производства фосфатов. Правительства некоторых стран уже сотрудничали с различными поставщиками по всему миру для создания заводов по добыче минералов для производства фосфорной кислоты.
В 2019 году объем мирового рынка фосфорной кислоты оценивался в 45,85 миллиарда долларов. Ожидается, что к 2027 году он достигнет более 61 миллиарда долларов, а совокупный годовой темп роста составит 3,7%.
Рынок подразделяется на Азиатско-Тихоокеанский регион, Европу, Северную Америку, Латинскую Америку, Ближний Восток и Африку. Ожидается, что в ближайшем будущем Азиатско-Тихоокеанский регион будет доминировать на мировом рынке. Рост рынка фосфорной кислоты в этих регионах будет дополнительно подпитываться развитым сельскохозяйственным сектором Индии и Китая.
Синтез АТФ

Всего получено оценок: 21.
Всего получено оценок: 21.
АТФ — сокращённое название аденозинтрифосфорной кислоты. В химических связях этого вещества запасается энергия. Молекулы АТФ транспортируются в те части клетки и органы целостного организма, где усиленно расходуются энергетические запасы. Постоянный синтез АТФ обеспечивает потребности в энергии, необходимой для роста, развития и других процессов жизнедеятельности.
Состав и значение
Что такое АТФ? Вещество содержит аденозин — азотистое основание аденин (А), связанное с моносахаридом рибозой. Аденозин в АТФ удерживает 3 остатка фосфорной кислоты (Ф) — Н3РО4. Аденозинмонофосфорная кислота (АМФ) содержит 1 остаток фосфорной кислоты, аденозиндифосфорная кислота (АДФ) 2 остатка Н3РО4.
В результате происходящих в клетке реакций запасается много энергии (Е) между остатками фосфорной кислоты.
Связи между кислородом и фосфором в АТФ называют макроэргическими. В одной молекуле АТФ две такие связи. АТФ в реакциях отдает только одну молекулу Н3РО4 и превращается в АДФ. При отщеплении остатка фосфорной кислоты высвобождается около 30 кДж/моль энергии.
Синтез в хлоропластах
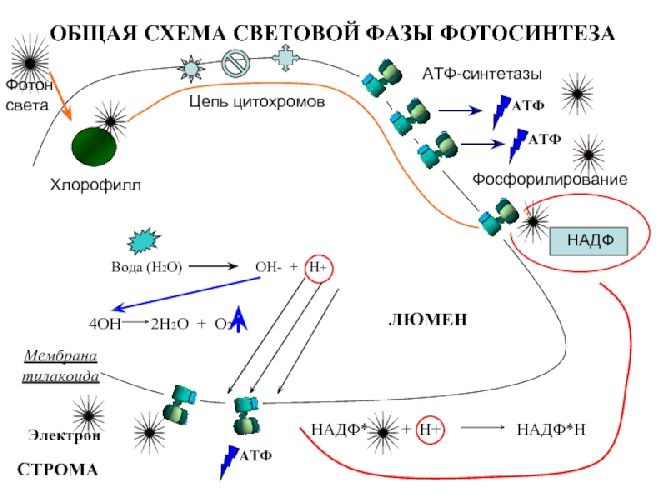
Окисленную форму НАДФ обозначают знаком «+», в восстановленной добавляют Н (водород). НАДФ является аккумулятором энергии для синтеза АТФ. Энергия возбуждённого электрона нужна для фосфорилирования АДФ и образования АТФ при участи АТФ-синтетазы. Присоединяется остаток фосфорной кислоты и образуется макроэргическая связь. Часть электронов используется для восстановления окисленной формы НАДФ.
Гликолиз
Всего в процессе бескислородного расщепления глюкозы (гликолиза) возникает 8 молекул АТФ.
АТФ образуется в бактериальных клетках, не содержащих хлорофилл. Первоначальным источником энергии служат химические реакции окисления неорганических веществ: сероводорода, аммиака, диоксида железа.
Синтез в митохондриях
Местом, где синтезируется АТФ, являются также митохондрии. Основная функция «энергетических станций» клетки — осуществление ферментативных реакций цикла Кребса и окислительное фосфорилирование. Кратко цикл Кребса можно описать так: исходный материал — пировиноградная кислота и молекулы ацетилкофермента А, возникающие при окислении глюкозы, жирных кислот и аминокислот. Энергию запасают молекулы НАД Н и ФАД Н2 (флавинадениндинуклеотид).
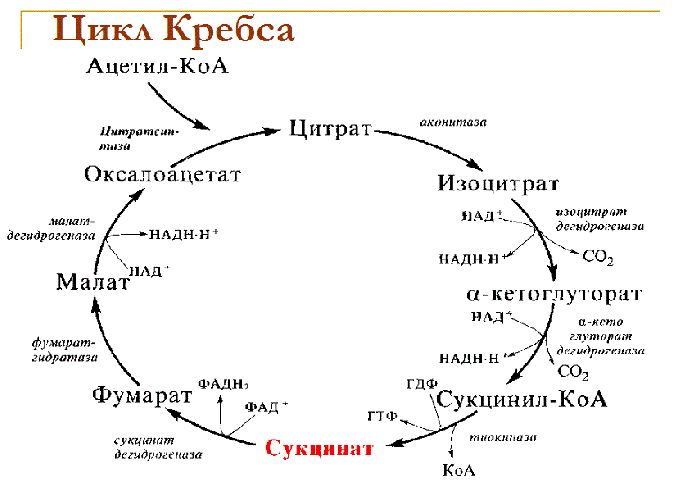
Следующий этап — окислительное фосфорилирование (реакции с участием кислорода). Энергия, запасённая в молекулах НАД Н и ФАД Н2 в процессе гликолиза и цикла Кребса, используется для синтеза АТФ из АДФ. Всего при окислении одной молекулы глюкозы в присутствии кислорода выделяется энергия, которую запасают 38 молекул АТФ.