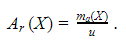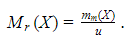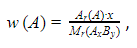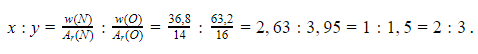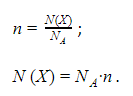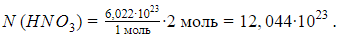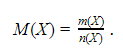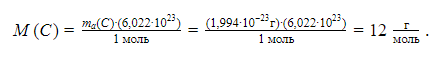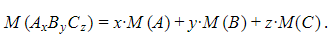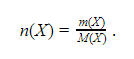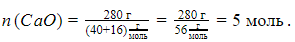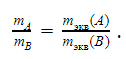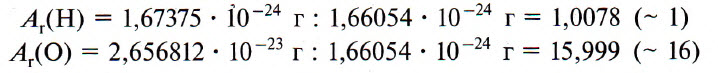Что такое относительная формульная масса
Масса молекул. Количество вещества и моль
При расчетах химических процессов необходимо оперировать массами веществ в абсолютных и относительных единицах. Эти величины требуется поставить в соответствие с числом частиц, участвующих во взаимодействиях. Выразив через количество вещества это множество объектов микромира, химики получили возможность быстро, без громоздких вычислений решать задачи, связанные с соотношением веществ.
Размеры и масса структурных единиц вещества
Вещество строится из микроскопических частиц – атомов и молекул. Атом – это носитель индивидуальных свойств химического элемента, наименьшая частица, способная вступать в химическое взаимодействие. Молекула – устойчивое сочетание атомов – является минимальной порцией вещества, которой присущи его химические свойства.
У атома нет четкой границы. Его радиус определяется по правилам квантовой механики и зависит от заряда ядра. Величины атомных радиусов лежат в диапазоне от 3,1∙10-11 м у гелия до 2,9∙10-10 м у франция. Характерный размер большинства атомов – 10-10 м. Размеры молекул сопоставимы с атомными.
Массы атомов сильно различаются. Легчайший атом с массой 1,67∙10-27 кг принадлежит водороду. Атом урана-238 имеет массу 3,95∙10-25 кг. Массу молекулы определяют сложением масс составляющих ее атомов.
Относительные массовые величины
Вести расчеты в абсолютных значениях масс атомов и молекул неудобно из-за их малости. Химики используют безразмерные величины, выражающие отношение массы частицы вещества к эталону – атомной единице массы (а. е. м.), в качестве которой выбрана 1/12 массы атома углерода.
где u – атомная единица массы; ma(C) – масса атома углерода.
Для кислорода она составляет 

Эта величина есть сумма относительных масс атомов, образующих молекулу. Так, для сероводорода она равна Mr (H2S)=2∙Ar (H)+Ar (S)=2∙1+32=34.
Массовая доля
Из формулы соединения можно получить массовые доли входящих в его состав элементов:
где w(A) – массовая доля элемента A; x, y – индексы элементов A и B.
Пример: расчет массовых долей натрия и кислорода в оксиде натрия Na2O.
Формулу химического соединения можно установить по массовым долям. Пусть в соединении азота и кислорода NxOy на долю азота приходится 36,8% массы. Тогда массовая доля кислорода будет:100-36,8=63,2%. Далее вычисляется соотношение индексов x и y:
Следовательно, формула вещества – N2O3.
Химическое количество вещества
В качестве единицы измерения химического количества вещества в международной системе СИ принят моль – порция вещества, содержащая приблизительно 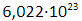
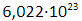
Постоянная Авогадро
Величину 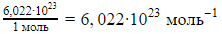
Например, число молекул в 2 молях азотной кислоты составит
Молярная масса
Существует величина, выражающая массу одного моля вещества, – молярная масса. Она равна отношению массы к количеству вещества и имеет размерность кг/моль или, чаще, г/моль:
Молярная масса элемента равна массе 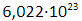
Молярные массы соединений вычисляют путем сложения:
Молярная масса воды составляет 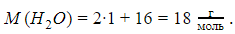
По молярной массе можно найти, сколько молей составляет количество вещества некоторой массы:
Например, 280 г оксида кальция соответствует количество
Эквивалентная масса
Количество вещества, реагирующее с 1 молем ионов водорода, называется эквивалентом, а его масса mэкв – эквивалентной. Она рассчитывается из молярной массы и зависит от того, к какому классу соединений принадлежит вещество.
С помощью этой величины описывают химические взаимодействия, опираясь на закон эквивалентов: отношение масс реагентов (и продуктов реакции) пропорционально отношению их эквивалентных масс:
Это упрощает расчеты, позволяя обойтись без составления уравнения реакции.
Задачи
Задача 1. Определите относительные молекулярные массы:
Задача 2. Определите массовые доли химических элементов:
Задача 3. Определите формулу:
Задача 4. Определите химическое количество вещества:
Задача 5. Определите число молекул:
Задача 6. Определите массу:
Решения задач
урок 11. Относительная молекулярная и формульная массы
Каждый химический элемент характеризуется определенным значением относительной атомной массы. Состав любого вещества выражается формулой его структурной единицы (молекулярной формулой или формульной единицей). Такая формула состоит из определенного числа атомов химических элементов. Поэтому масса структурной единицы также может быть выражена в атомных единицах массы.
Вещества молекулярного строения характеризуются величиной относительной молекулярной массы, которая обозначается Мr.
Относительная молекулярная масса — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
Эта величина равна сумме относительных атомных масс химических элементов, образующих данную молекулу. При этом, конечно, необходимо учитывать индексы у символов атомов в молекулярной формуле. Например, рассчитаем относительную молекулярную массу воды Н20:
$\mathrm
Относительная молекулярная масса серной кислоты H2S04:
$\mathrm
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Мr. Например, относительная формульная масса мела СаСО3, равна:
$\mathrm
Относительная формульная масса Al2(S04)3 равна:
$\mathrm
Исходя из химической формулы вещества, можно рассчитать массовую долю атомов каждого химического элемента, входящего в его состав.
Массовая доля (W) атомов химического элемента в веществе показывает, какая часть относительной молекулярной (формульной) массы вещества приходится на атомы данного элемента.
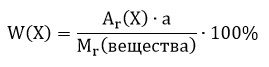
где w («дубль-вэ») — массовая доля элемента Х;
Аr(Х) — относительная атомная масса элемента Х;
Массовую долю выражают в долях единицы, например 0,07; 0,26; 0,99. Значение массовой доли можно выразить и в процентах. Для этого значение в долях нужно умножить на 100, например W(О) = 0,22, или 22 %.
Масса любого вещества равна сумме входящих в его состав атомов. Т.е. массовая доля всего вещества равна 100%, что составляет сумму массовых долей атомов, входящих в состав вещества.
Итак, сегодня мы узнали:
— Относительная молекулярная масса (Mr) — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
— Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой Мr и высчитывается также как и относительная молекулярная масса.
— Массовая доля химического элемента в веществе равна отношению массы атомов этого элемента к массе всего вещества.
Что такое относительная формульная масса
Ключевые слова конспекта: атомная единица массы, относительная атомная масса химических элементов, относительная молекулярная масса.
Атомная единица массы — это 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Обратите внимание! На Земле встречаются три разновидности атомов углерода, различающиеся только массой. Такие разновидности атомов одного и того же элемента называют изотопами. В данном случае речь идёт о разновидности, масса атомов которой в атомных единицах массы равна 12.
Разделив массу атома какого-либо химического элемента на 1/12 массы атома углерода, получают величину, которую называют относительной атомной массой и обозначают Аr (А — от слова «атом», r — от латинского слова relativus — относительный).
Например, относительную атомную массу водорода и кислорода вычисляют следующим образом:
Относительная атомная масса элемента (Аr) показывает, во сколько раз масса его атома больше 1/12 массы атома углерода, масса которого равна 12 а. е. м.
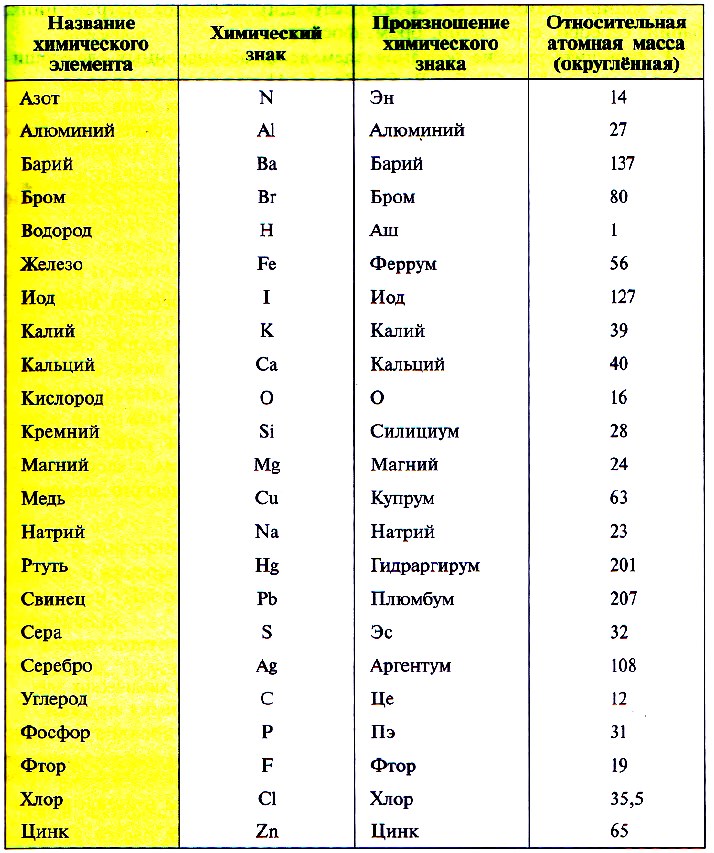
Так как первую таблицу относительных атомных масс ряда элементов составил английский учёный Джон Дальтон в 1803 г, то в память о его трудах химики иногда называют атомную единицу массы дальтоном (сокращённо Da). Значение относительной атомной массы каждого химического элемента приведено в периодической таблице Д. И. Менделеева. На практике эти значения обычно округляют до целых чисел.
Относительная молекулярная масса
Массу молекул, так же как массу атомов, принято выражать в атомных единицах массы. Разделив массу молекулы какого-либо вещества на 1/12 массы атома углерода, получают величину, которую называют относительной молекулярной массой вещества.
Относительная молекулярная масса вещества показывает, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Относительная молекулярная масса Мr — безразмерная величина. Она складывается из относительных атомных масс элементов, составляющих молекулу, например:
Конец конспекта «Относительная атомная масса. Относительная молекулярная масса».
Относительная молекулярная масса – формула, примеры, таблица (химия, 8 класс)
Для химиков важно знать массы молекул исследуемых ими веществ. Измерять их в килограммах неудобно, поэтому ученые используют а. е. м. – атомные единицы массы.
Понятие атомной единицы массы
На сегодняшний день принята договоренность, что масса атома углерода (а точнее его изотопа углерод-12) в точности равна 12 а. е. м. По этой причине используемую химиками величину иногда называют углеродной единицей. Ранее ученые использовали другие единицы – водородную и кислородную, но они по ряду причин оказались неудобными. Опыты показывают, что 1 а. е. м. равна примерно 1,66•10 –27 кг.
Атомная масса показывает, какую массу имеет тот или иной атом. Найти ее можно в таблице Менделеева. Обычно в этой таблице масса записана как дробное число, очень близкое к какому-либо целому значению. Например, атомная масса водорода составляет 1,000797 а. е. м., у гелия она равна 4,0026 а. е. м., а у кислорода 15,9994 а. е. м. При решении практических задач принято округлять эти значения до целых чисел. То есть надо считать, что у водорода атомная масса равна 1 а. е. м, у гелия – 4 а. е. м., у кислорода – 16 а. е. м. Исключением является хлор, чью массу округляют до значения 35,5 а. е. м.
Важно понимать, что на самом деле у одного и того же элемента атомы могут иметь различную массу. Такие отличающиеся по массе атомы называются изотопами. У изотопов одного элемента одинаковое количество протонов, но различное количество нейтронов. При этом все изотопы одного элемента имеют одинаковые химические свойства.
В таблице Менделеева указан средний вес всех изотопов, при этом учитывается их распространенность в природе. Например, у кислорода есть три стабильных изотопа:
С учетом этого атомная масса кислорода, указанная в таблице Менделеева, рассчитывается так:
(15,9949•99,759 + 16,9991•0,037 + 17,9991•0,204)/100 = 15,9994 а. е. м.
Молекулярная масса
Зная атомные массы отдельных элементов, можно находить и молекулярные массы молекул. Для этого надо всего лишь сложить атомные массы тех атомов, которые входят в состав молекулы.
Например, рассмотрим молекулу метана, она имеет формулу СН4, то есть состоит из 1 атома углерода (который весит 12 а. е. м.) и 4 атомов водорода (каждый массой по 1 а. е. м.). Складываем атомные массы:
12 + 1 + 1 + 1 + 1 = 12 + 4•1 = 16 а. е. м.
Итак, молекула метана имеет молекулярную массу 16 а. е. м.
Заметим, что очень часто возникает путаница из-за молекул простых газов – водорода, кислорода, азота и т. д. Дело в том, что их молекулы состоят из двух атомов, поэтому и масса у них вдвое больше, чем масса атомов. Например, атомная масса элемента кислород – 16 а. е. м., а вот молекула кислорода, имеющая формулу О2, весит уже 16•2 = 32 а. е. м.
Молярная масса
Молекулярные массы веществ тесно связаны с понятием молярной массы. Молярная масса – это масса 1 моля вещества. Численно она совпадает с молекулярной массой, но измеряется в других величинах – в граммах на моль, или в г/моль.
Молярная масса позволяет определять, легче или тяжелее воздуха тот или иной газ. Для этого надо лишь сравнить молярную массу газа с молярной массой воздуха, составляющей 28,98 г/моль. Так, кислород оказывается тяжелее воздуха, так как его молярная масса – 32 г/моль. Азот же легче воздуха, ведь его масса равна 28 г/моль. Здесь следует уточнить, что воздух не является отдельным веществом в химическом смысле слова, то есть никаких «молекул воздуха» не существует (поэтому не существует и понятия «молекулярная масса воздуха»). В реальности воздух – это смесь нескольких газов, преимущественно азота и кислорода. При этом более тяжелые молекулы чаще встречаются в нижних слоях атмосферы, а легкие молекулы – на высоте. По этой причине (но отнюдь не только из-за нее) в горах тяжело дышать – на большой высоте воздух содержит меньше кислорода и больше азота.
Подведение итогов
Молекулярная масса показывает, какую массу имеет та или иная молекула. Для ее вычисления достаточно сложить массы входящих в молекулу атомов. Молекулярная масса численно равна молярной массе, и по ней можно оценить, какой газ легче воздуха, а какой – тяжелее.
Относительная молекулярная масса вещества. Вычисление по ее химической формуле. Примеры
Молекулярная масса — одна из важнейших характеристик вещества. Это понятие тесно связано с определением молекулы.
Для условных структурных частиц (формульных единиц) немолекулярных веществ применяют понятие «формульная масса».
Массы структурных единиц вещества очень малы. Поэтому для них используют относительные массы.
Относительную молекулярную массу обозначают Mr.
Относительную формульную массу немолекулярных веществ также обозначают Mr.
Величины относительных молекулярных масс широко используют в разных химических, физических и химико-технических расчетах. Поэтому важно уметь их вычислять.
Вычисление относительной молекулярной массы вещества по ее химической формуле. По химической формуле вещества можно не только охарактеризовать его состав, а и вычислить относительную молекулярную массу или (для немолекулярных соединений) относительную формульную массу.
Относительная молекулярная масса состоит из относительных масс атомов, которые входят в молекулу, с учетом их количества.
Пример. Вычислим относительную молекулярную массу серной кислоты H2SO4 (рис. 9.1). Относительная масса молекулы серной кислоты состоит из суммы относительных масс двух атомов водорода, одного атома серы и четырех атомов кислорода:
Таким же образом вычисляют и относительные формульные массы немолекулярных веществ.
Пример. Вычислим относительную формульную массу фторида кальция CaF2 (рис. 9.2). Относительная масса формульной единицы фторида кальция состоит из суммы относительных масс катиона кальция Са 2+ и двух анионов фтора F — :
 |
| Рис. 9.2. Вычисление относительной формульной массы фторида кальция CaF2 |
 |
| Рис. 9.3. Состав и строение уваровита |
Часто химические формулы веществ содержат скобки. Например, состав минерала уваровита описывает химическая формула Ca3Cr2(SiO4)3. Уваровит — ионный кристалл (рис. 9.3). Относительную массу его формульной единицы можно вычислить так: Материал с сайта http://worldofschool.ru
Обрати внимание : индексы, стоящие в химической формуле за скобками, произносят так — дважды, трижды и т. д.