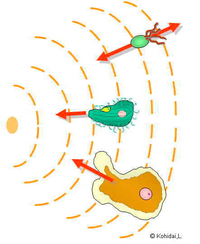
Что такое отрицательный хемотаксис
Хемотаксис
Хемота́ксис — двигательная реакция микроорганизмов на химический раздражитель.
Содержание
Хемотаксис бактерий
Бактерии способны двигаться по направлению к аттрактантам (зачастую питательным веществам) и от репеллентов (например, токсинов). В качестве аттрактантов выступают практически все сахара и аминокислоты, в качестве репеллентов — жирные кислоты, спирты и другие потенциально вредоносные вещества. Чувствительность бактерии впечатляет — они легко детектируют изменение концентрации на 0,1 % при микромолярных концентрациях веществ, а диапазон детектируемых концентраций перекрывает пять порядков.
Аттрактанты и репелленты детектируются за счет непосредственного взаимодействия со специфическими хеморецепторами, а не за счет каких-либо внутриклеточных эффектов детектируемого вещества.
Мембранные рецепторы группируются в кластеры, как правило расположенные на полюсах клетки, однако это не может помочь бактерии уловить разницу концентраций между полюсами, поскольку она будет слишком маленькой из-за малого размера самой клетки.
Вместо этого бактерии ориентируются в химических градиентах путем измерения временных изменений концентраций при движении. Обычно скорость движения Escherichia coli составляет 10—20 своих длин в секунду.
Сравнивая текущую загруженность хеморецепторов специфическими лигандами с таковой несколько секунд назад, клетка фактически может «измерить» разницу концентраций определенного вещества на расстоянии, во много раз превышающем длину самой клетки.
Такое измерение концентрации лиганда во времени возможно за счет адаптивного метилирования хеморецепторов, которое зависит от загруженности их лигандами.
Задержка во времени, между связыванием лиганда и метилированием рецептора, представляет собой своеобразную молекулярную «память», которая и позволяет измерять изменение концентраций лиганда.
Если выбранное направление движения соответствует увеличению концентрации аттрактанта (снижению концентрации репеллента), то время до следующего кувыркания увеличивается. К сожалению, из-за своего малого размера, клетка постоянно сбивается с «верного» пути броуновским движением и, поэтому, просто не может продолжительно двигаться прямо. Такой механизм только в общем обеспечивает движение бактерии по градиенту концентрации в нужном направлении, но для бактерии является достаточно эффективным.
Механизм, основанный на переключении направления вращения жгутиков, приводящий к прямолинейному движению, которое через варьирующиеся промежутки времени сменяется кувырканием на месте, не является единственным.
У Rhodobacter sphaeroides вращение единственного жгутика сменяется его полной остановкой, а у Rhizohium meliloli вращение жгутика никогда не прекращается — изменяется только его скорость. Но, во всех этих случаях, результат работы сенсорной системы хемотаксиса один и тот же: если бактерия движется в «нужном» направлении — продолжительность такого движения увеличивается.
Сенсорный механизм хемотаксиса более сложен, чем рассмотренные ранее. Это объясняется, прежде всего, двумя причинами.
Во-первых, поскольку броуновское движение может очень быстро изменить ориентацию бактериальной клетки, бактерии должны обрабатывать хемотаксические сигналы очень быстро и, действительно, от стимула до переключения «моторов», у бактериальной клетки, проходит не более 0,2 секунды.
Во-вторых, для правильного сравнения пространственных градиентов, клеткам необходимо такое устройство сенсорного механизма, которое «гасило» бы сенсорную стимуляцию в статических условиях, то есть в отсутствие градиента концентрации, как бы много какого-то аттрактанта или репеллента ни присутствовало бы в среде.
Белковый аппарат хемотаксиса бактерий
Три класса белков участвуют в хемотаксисе: трансмембранные рецепторы, цитоплазматические сигнальные белки и ферменты адаптивного метилирования.
Рецепторы хемотаксиса
Эти белки являются мембранными сенсорами, в принципе аналогичными по своей структуре HnvZ, с тем только отличием, что цитоплазматический сигнальный домен не является автокиназой.
Функцию автокиназы выполняет другой белок — CheA, а сигнальные домены МСР обеспечивают взаимодействие с CheA.
Еще одно отличие от типичного сенсора — по обе стороны сигнального домена располагаются сайты метилирования, необходимые для адаптации рецепторов.
МСР-белки состоят приблизительно из 550 аминокислотных остатков и являются димерами.
Хорошо изучены 4 МСР-белка из Е. coli, реагирующие на серин (Tsr), аспартат и мальтозу (Таr), рибозу, глюкозу и галактозу (Trg) и дипептиды (Тар).
У сальмонелл нет Тар, но есть сенсор цитрата Тер.
Серин, аспартат и цитрат связываются непосредственно с рецепторами, тогда как сахара и дипептиды сначала связываются с соответствующими периплазматическими белками, а уже эти комплексы взаимодействуют с рецепторами.
Кроме того, МСР реагируют на изменения температуры и рН, а также являются рецепторами для различных репеллентов.
Классический рецептор хемотаксиса состоит из
Цитоплазматические домены сенсоров содержат 4 или 5 остатков глутамата, доступных для метилирования.
Трансляция внеклеточного стимула во внутриклеточный сигнал
Для объяснения механизма трансмембранной передачи сигнала молекулой хеморецептора было предложено две модели. Имеющиеся экспериментальные данные не позволяют полностью исключить ни одну из них, однако большинство исследователей склоняется в пользу второй модели (модели пистона).
В соответствии с первой моделью (моделью ножниц) контакт лиганда с дистальными концами связанных с мембраной спиралей хеморецептора может индуцировать значительное перемещение трансмембранных сегментов. В несвязанном с лигандом состоянии субъединицы рецептора предположительно взаимодействуют между собой только в области первого трансмембранного сегмента.
Связывание с лигандом вызывает сближение сенсорных и периплазматических субъединиц, что передается сигнальным субъединицам и обеспечивает их взаимодействие между собой, а в таком виде они уже не могут взаимодействовать с CheA и стимулировать его автокиназную активность. Метилирование создает стерические препятствия для взаимодействия сигнальных доменов между собой, что снова позволяет им стимулировать автокиназную активность CheA.
Сейчас все больше и больше данных накапливается в пользу другого механизма (модель пистона), основанного на скольжении трансмембранных сегментов (ТМС) друг относительно друга. В соответствии с этой моделью аминоконцевой ТМС закреплен в мембране жестко, тогда как второй более подвижен и, при связывании лиганда, скользит «вниз», то есть в сторону цитоплазмы, что и вызывает конформационное изменение цитоплазматического сигнального домена, инактивирующее его. Вариация на эту тему — участие двух амфипатических спиралей линкерного домена в изменении конформации.
Цитоплазматические сигнальные белки и регуляторный механизм хемотаксиса
Взаимодействие между рецепторами и переключателем жгутика осуществляется четырьмя белками:
Пара белков CheA-CheY представляет собой двухкомпонентную регуляторную систему. Наиболее существенным отличием от классических систем является то, что CheY не является транскрипционным фактором и, соответственно, у него отсутствует ДНК-связывающий домен. Гистидинкиназа CheA функционирует в виде димера, с которым связываются два мономера CheW, и уже этот комплекс вступает в ассоциацию с димерным рецептором. В составе такого комплекса автокиназная активность CheA резко возрастает, что усиливает перенос фосфата от CheA
P связывается с FliM моторно-переключательного комплекса базального тела, что приводит к вращению жгутика по часовой стрелке. CheZ предотвращает накопление CheY
P, стимулируя автофосфатазную активность CheY.
При отсутствии аттрактанта концентрация CheY-P поддерживается на уровне, способствующем вращению жгутика преимущественно по часовой стрелке и, следовательно, отсутствию упорядоченного движения бактерии. Связывание аттрактанта с рецептором индуцирует конформационное изменение, которое передается через мембрану и подавляет автокиназную активность CheA. Концентрация CheY
P падает, и жгутики бактерии более продолжительное время вращаются против часовой стрелки. Поэтому клетки будут дольше двигаться прямолинейно, если они попадают в среду с более высокой концентрацией аттрактанта. Однако этот механизм не объясняет, как клетка может реагировать на постоянно возрастающую концентрацию аттрактанта. Этой цели служит сенсорная адаптация.
Метилазы хемотаксиса и сенсорная адаптация
Адаптация сенсорного аппарата достигается путем обратимого метилирования рецепторов, в котором участвуют два белка — метилтрансфераза CheR и метилэстераза CheB. Метилирование рецепторов оказывает действие, противоположное связыванию аттрактанта. Интересно, что метилирование стимулируется связыванием аттрактанта с рецептором и в конечном итоге нейтрализует эффект связывания аттрактанта. Однако между связыванием аттрактанта и метилированием рецептора проходит некоторое время, в течение которого бактерии движутся прямолинейно, что и составляет основу молекулярной памяти аппарата хемотаксиса.
Метилтрансфераза CheR метилирует остатки глутамата в цитоплазматических доменах МСР с постоянной скоростью, перенося метильную группу с S-аденозилметионина. Регуляции со стороны сенсорного аппарата хемотаксиса подвергается не метилирование рецепторов, а обратный процесс, зависящий от белка CheB. CheB является мишенью для переноса фосфата с CheA
P, и в фосфорилированном состоянии CheB является метилэстеразой, деметилирующей МСР.
В отсутствие стимула метилирование МСР, осуществляемое CheR, компенсируется удалением метильных групп фосфорилированным CheB, что поддерживает метилирование МСР на уровне 0,5-1 метильная группа на субъединицу рецептора.
Когда аттрактант связывается с рецептором и ингибирует активность CheA, концентрация CheB
P падает, хотя и более медленно, чем концентрация CheY
P не является субстратом для CheZ. Повышение степени метилирования восстанавливает способность рецептора стимулировать CheA. Однако, даже после того как базальные уровни CheY
P восстанавливаются, связанный с аттрактантом рецептор остается метилированным, поскольку метилированный рецептор — более плохой субстрат для метилэстеразы CheB
Таким образом, с учетом метилирования принцип работы молекулярной машины хемотаксиса выглядит следующим образом.
P происходит дефосфорилирование CheB
P, хотя и с меньшей скоростью (поскольку CheB-P не является субстратом для CheZ), что приводит к повышению степени метилирования рецептора и восстановлению его сигнальной активности.
Поскольку и CheY, и CheB являются свободными цитоплазматическими белками, степень их фосфорилирования будет зависеть от степени метилирования рецепторов и их загруженности лигандами. Это делает возможным вместо ответа «все или ничего» плавно регулировать подвижность бактерий в широком диапазоне концентраций аттрактантов и репеллентов. Метилирование рецепторов обеспечивает простейшую молекулярную память, позволяющую бактерии контролировать «правильность» направления движения. Уровень метилирования будет высоким, если концентрация аттрактанта была высокой некоторое время назад. Когда клетка движется, она «сравнивает» сиюмоментную концентрацию аттрактанта (определяемую по степени занятости рецепторов) с концентрацией в недавнем прошлом (как зафиксировано степенью метилирования рецепторов). Если окружающие условия значительно улучшились или ухудшились, активность гистидинкиназы СheА будет соответственно снижена или повышена, изменяя продолжительность прямолинейного движения бактерии соответствующим образом.
Хемотаксизм в чем он состоит, примеры
хемотаксис Это биологический процесс, в котором движение или смещение некоторых клеток происходит, когда они привлекаются хемотаксическими агентами (химическими веществами). Клетки могут быть прокариотическими или эукариотическими; например, бактерии и лейкоциты.
Это явление встречается у одноклеточных и многоклеточных организмов, у которых есть органы передвижения, которые позволяют им двигаться. Это чрезвычайно важно для всех живых существ. Это требуется с того момента, когда генерируется новое существо, и его важно выполнять на разных стадиях эмбрионального и внутриутробного развития..
Хемотаксизм жизненно важен для выполнения нормальных функций многоклеточных организмов; например, питание и защита организма.
Бактериальный хемотаксис был открыт Энгельманом и Пфеффером более века назад. Было установлено, что эти микроорганизмы могут представлять различные типы хемотаксиса в зависимости от того, является ли стимул притяжением или отталкиванием к хемотаксическому агенту..
Способ, которым происходит хемотаксический ответ или характеристики смещения, варьируется в зависимости от органов передвижения, которыми обладают организмы.
Что такое хемотаксис??
Хемотаксические факторы представляют собой неорганические или органические вещества. В клеточной мембране организмов есть белки хемотаксиса, которые функционируют как рецепторы, обнаруживая различные типы химических градиентов этих веществ..
Движение бактерий
Бактерия плавает по прямой линии, вращая жгутики в направлении, противоположном стрелкам часов. Через определенные промежутки времени происходит изменение направления жгутиков; что проявляется в движениях бактерий, таких как прыжки или прыжки.
В целом, хемотаксические сигналы среды влияют на движение бактерий. Когда бактерии приближаются к привлекательному фактору, плавайте по прямой в течение длительного времени, время от времени прыгая; тогда как когда он отходит от химического фактора, он делает это с большим количеством прыжков.
Хемотаксизм отличается от хемокинеза или хемокинеза тем, что градиент изменяет вероятность движения только в одном направлении; то есть при хемокинезе химическое вещество производит неориентированное или случайное движение организма.
тип
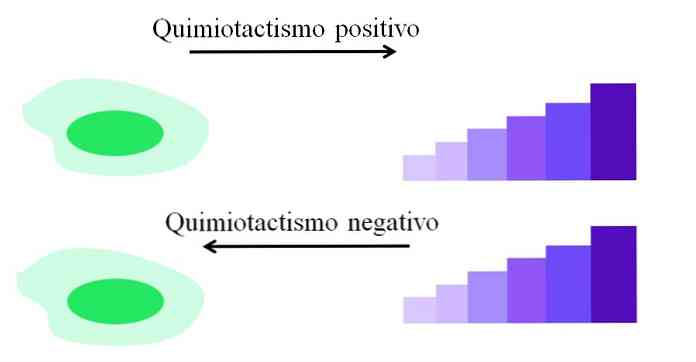
Учитывая смысл или направление движения клеток по отношению к фактору притяжения, описывается существование двух типов хемотаксиса: положительный и отрицательный..
Положительный хемотаксис
Движение организма происходит в направлении большей концентрации химического вещества, найденного в его среде.
Например: когда бактерии движутся или плавают, притягиваются к самой высокой концентрации углерода в форме глюкозы.
Этот тип хемотаксиса представлен на изображении. Организм перемещается в области, где есть большая концентрация вещества, полезного для него; тогда как при отрицательном хемотаксисе происходит обратное: ничто в направлении области, где концентрация вредного вещества ниже.
Отрицательный хемотаксис
Происходит, когда движение организма происходит в противоположном направлении от места, где имеется более высокая концентрация диффундирующего химического вещества..
Пример такого типа отрицательного хемотаксиса возникает, когда бактерии могут отойти от определенных химических веществ, которые им вредны. Они выходят на пенсию, они бегут из того места, где есть вещества, такие как, например, фенол, который для них является ядом.
Помимо описанного хемотаксиса, существует другая классификация движения, которая генерируется в ответ на тип модификации, которая происходит в среде:
-Аэротаксия, то есть движение клеток к месту, где есть оптимальная концентрация кислорода.
-Фототаксия, или движение бактерий в местах, где больше света.
примеров
-Хемотаксизм в бактериальном питании
Присутствие хемотаксического фактора или химического аттрактанта, такого как сахар или аминокислота, фиксируется специфическими рецепторами для этого вещества, расположенного в бактериальной мембране..
Было описано, что метилирование и деметилирование мембранно-специфических белков, опосредованных циклическим гуанозинмонофосфатом (цГМФ), является одним из механизмов, побуждающих бактерии выполнять различные типы хемотаксиса..
Аттрактантные хемотаксические факторы вызывают временное ингибирование деметилирования, тогда как репеллентные факторы стимулируют деметилирование.
-В оплодотворении и эмбриональном развитии
Хемотаксизм ответственен за оплодотворение. В этом случае градиент концентрации обусловлен выбросом прогестерона клубочковыми клетками (которые окружают zona pellucida ооцита). Это заставляет сперму перемещаться к яйцеклетке, расположенной в маточной трубе..
На разных стадиях эмбрионального развития и во время органогенеза клетки мигрируют и организуются в ответ на большое количество специфических хемотаксических факторов; как факторы роста.
-Хемотаксизм при воспалении
Факторы, продуцируемые микроорганизмами
В реакциях воспаления, возникающих в ответ на инфекцию, те же самые микроорганизмы, такие как бактерии, продуцируют хемотаксические вещества. Они вызывают хемотаксис, быструю миграцию или прибытие полиморфных ядерных лейкоцитов в место, где происходит инфекция..
Бактериальные пептиды инициируют с помощью N-формилметионина, который является хемоаттрактантом многочисленных фагоцитарных клеток-хозяев.
Хемотаксический фактор, генерируемый комплементом
Комплемент представляет собой набор сывороточных белков, которые выполняют функцию защиты организма и активируются серией протеолитических реакций в последовательном или каскадном режиме..
Основной функцией фрагмента комплемента C5a является хемотаксис, посредством которого привлекаются нейтрофильные лейкоциты и моноциты. Эти клетки при диапедезе проходят через эндотелий сосудов и достигают инфицированной ткани или слизистой оболочки, вызывая фагоцитоз или проглатывание патогенов или инородных частиц..
Хемотаксические факторы, генерируемые клетками
Некоторые клетки, такие как моноциты и макрофаги, продуцируют хемотаксические вещества, включая лейкотриены и несколько интерлейкинов. В и Т-лимфоциты также выделяют хемотаксические цитокины, действие которых усиливает реакции иммунитета.
-Изменение хемотаксиса при инфекционных заболеваниях
В целом, хемотаксис модифицируется у пациентов с инфекционными заболеваниями, такими как СПИД и бруцеллез.
Хемотаксизм может уменьшаться при нескольких синдромах, при которых ингибируется фагоцитоз. Это может происходить при воспалительных заболеваниях, таких как артрит, метастазирование опухоли, интоксикации асбестом, среди других состояний.
Что такое отрицательный хемотаксис
Местный иммунитет слизистой оболочки рта
Говоря о неспецифических механизмах резистентности, необходимо отметить роль слизи, которая препятствует прикреплению бактерий к эпителиальным клеткам, способствует удалению возбудителей из ротовой полости с помощью движения ресничек эпителия в процессе кашля, чихания [1, 2, 3, 5, 7, 8, 10].
Количество микроорганизмов ротовой полости зависит и от интенсивности слущивания эпителия слизистой С адсорбированными на нем микробными клетками, смывания и проглатывания микробов со слюной, поэтому ограничение слюноотделения, нарушения жевания и глотания способствуют увеличению микрофлоры ротовой полости.
Важная роль в регуляции микрофлоры рта отводится микробному антагонизму: зеленящие и негемолитические стрептококки, превалирующие в полости рта, являются основными антагонистами случайной микрофлоры [1, 2, 3, 8, 10].
Мощными факторами селекции микроорганизмов являются pH среды, температура ротовой полости, наличие питательных веществ.
Однако важнейшими факторами защиты ротовой полости от бактериальной микрофлоры являются такие бактерицидные компоненты слюны, как лизоцим, лактоферрин, миелопероксидаза, опсонины, лейкины, иммуноглобулины. К клеточным факторам защиты полости рта относятся нейтрофилы и лимфоциты, а также моноциты. Установлено, что в полость рта эмигрирует ежеминутно до 250 000 лейкоцитов в основном через зубодесневую борозду. При этом до 97 %: клеток приходится на нейтрофилы, 1–2 % – на лимфоциты, 2–3 % – на моноциты. Такое же соотношение лейкоцитов имеет место в десневой жидкости пародонтальных карманов. Основной, но далеко не единственной функцией нейтрофилов и макрофагов является фагоцитоз. В первичных азурофильных гранулах нейтрофилов содержатся лизосомальные гидролитические ферменты, миелопероксидаза, лизоцим, катионные белки. Вторичные гранулы зрелых нейтрофилов включают лактоферрин, лизоцим, фосфатазу, третичные гранулы содержат кислые гидролазы. Помимо указанных соединений на фоне антигенной стимуляции нейтрофилы могут освобождать в окружающую среду вновь синтезированные биологически активные соединения – эндопирогены, индуцирующие развитие лихорадки, а также свободные радикалы с выраженной бактерицидной активностью. Нейтрофилы обеспечивают в основном защиту от пиогенных бактерий [1, 2, 3, 5, 7, 8, 10].
Макрофаги ротовой полости также обеспечивают антибактериальную ‘защиту в основном за счет фагоцитоза, а также, подобно макрофагам других органов и тканей, обладают способностью продуцировать группу биологически активных соединений, известных под названием монокины. Группа монокинов включает в себя провоспалительные цитокины интерлейкин-1, интерлейкин-6, интерлейкин-8, колониестимулирующие факторы, С1 С2, С3, С4, С5 – компоненты комплемента, интерферон, а также лизоцим, активатор плазминогена, а2-макроглобулин, фактор лизиса опухолевых клеток, пропердин, фактор активации фибробластов, простагландины Е2, тромбоксан – А2, лейкотриены. На поверхности макрофагов и нейтрофилов имеются рецепторы к Fc-фрагменту иммуноглобулинов и к С3, с помощью которых осуществляется прикрепление опсонизированных микробов к поверхности фагоцита. В развитии реакций фагоцитоза в полости рта, так же как и в других органах и тканях, различают следующие стадии: направленный хемотаксис фагоцита к фагоцитируемому объекту, затем – прикрепление и окружение объекта фагоцитом, опсонизация и распознавание, внутриклеточное поглощение, киллинг микробов, заканчивающийся деструкцией или полным перевариванием объекта. В соответствии с этим фагоцитоз может носить завершенный или незавершенный характер [1, 2, 3, 4, 6, 9, 10].
Характеризуя факторы неспецифической резистентности ротовой полости, следует отметить важную роль лизоцима, обладающего бактериолитическим и бактериостатическим действием, особенно на грамположительные бактерии. Лизоцим катализирует гидролиз гликозаминогликанов, растворяет клеточную оболочку и вызывает распад всей бактериальной клетки. Лизоцим оказывает менее выраженное действие на грамотрицательные микроорганизмы, поскольку пептидогликаны их клеточной оболочки находятся под слоем липопротеинов и липополисахаридов и недоступны гидролизующему воздействию лизоцима. Лизоцим оказывает также стимулирующее воздействие на В- и Т-системы лимфоцитов, активирует систему комплемента, обладает способностью связывать и инактивировать гистамин, серотонин, стимулирует различные стадии фагоцитоза, регенераторные процессы в тканях. При снижении способности лейкоцитов человека синтезировать лизоцим резко подавляются многие неспецифические механизмы резистентности слизистой ротовой полости к патогенному воздействию различных возбудителей. Препараты лизоцима широко применяют в клинике в ингаляциях, внутримышечно для лечения инфекционных заболеваний дыхательной системы, тканей пародонта с затяжным течением [1, 2, 3, 4, 6, 9, 10].
Пропердин – высокомолекулярный белок, обнаруживаемый во всех трех фракциях сыворотки крови, обеспечивает бактерицидное, гемолитическое, вируснейтрализующее действие в сочетании с ионами магния, третьим компонентом комплемента за счет образования комплекса с полисахаридными структурами инфекционного возбудителя [1, 2, 3, 8, 10].
Лейкины – термостабильные бактерицидные факторы, образуемые при распаде лейкоцитов, способные инактивировать стафилококки и другие грамположительные микробы. Аналогичным свойством обладают плакины, освобождаемые при распаде тромбоцитов [4, 6, 8, 9, 10].
Бета-лизины – термостабильные гуморальные факторы резистентности против анаэробов и некоторых аэробов.
Интерфероны – термостабильные низкомолекулярные белки, продуцируемые лимфоцитами и моноцитами с выраженной противовирусной активностью. Интерферон участвует в распознавании антигена, усиливает функции нейтрофильных лейкоцитов, повышает фагоцитарную активность макрофагов, активность лизоцима, модулирует функции В- и Т-лимфоцитов. Таким образом, интерфероны являются факторами неспецифической противовирусной защиты слизистой оболочки рта, интенсивно образуясь под влиянием одной разновидности вирусов макрофагами и лимфоцитами, они подавляют репродукцию различных вирусов [ 2, 3].
Комплемент – система термолабильных ферментных белков сыворотки крови, включающая 9 компонентов, 20 белков, обеспечивает развитие неспецифической резистентности и специфических иммунологических механизмов защиты. Различают классический и альтернативный пути активации комплемента под влиянием соответственно специфических иммуноглобулинов, иммунных комплексов или антигенных воздействий. В ряде случаев активация комплемента возникает вторично вслед за первичной активацией калликреин-кининовой системы, системы фибринолиза, свертывающей системы, а также под влиянием лизосомальных ферментов нейтрофилов, С-реактивного белка [1, 2, 3, 8, 10].
Активация системы комплемента сопровождается возникновением ряда биологических эффектов: обеспечивает активацию и хемотаксис фагоцитов, опсонизацию фагоцитируемого объекта, развитие лизиса клеток, на которых фиксируются иммунные комплексы вместе с комплементом, в связи с формированием ионопроницаемых трансмембранных каналов. Дефицит компонентов системы комплемента делает слизистую оболочку ротовой области чувствительной к патоген-ному воздействию микрофлоры, в то же время формируется аутоиммунно- и онкогенноопасная ситуация.
Компоненты комплемента, так же как иммуноглобулины, могут попадать в слюну из кровотока предположительно через зубодесневую борозду. Значительная часть этих факторов специфической иммунной защиты ротовой полости скапливается в зубодесневой жидкости – в борозде и пародонтальных карманах.
Иммуноглобулины – гуморальные факторы специфической противобактериальной и противовирусной защиты полости рта. Важнейшими факторами иммунной защиты ротовой полости являются иммуноглобулины A, G, М, которые в слюну, проникают путем пассивной диффузии либо через зубодесневую борозду, либо между эпителиальными клетками десны, в значительном количестве находятся в соединительной ткани десны, богатой микрососудами, возможна внутриклеточная локализация иммуноглобулинов. В сыворотке крови и жидкости десневых карманов соотношение концентрации иммуноглобулинов G и А одинаково и составляет 8:1. Секреторному иммуноглобулину А придается основное значение в иммунологической защите слизистой рта. Секреторный IgA фиксируется на эпителиальной клетке слизистой рта, становясь ее рецептором и придавая ей иммунологическую специфичность. Секреторный IgA устойчив к воздействию ферментов, поэтому присутствует в слюне в наибольших количествах [1, 2, 3, 8, 10].
В образовании молекулы секреторного IgA принимают участие два типа клеток: плазматические и эпителиальные. Мономеры секреторного IgA и J-цепь синтезируются плазматическими клетками подслизистого слоя, при этом образуется (IgA)2J, секретируемый в межклеточное пространство.
Секреторные иммуноглобулины обладают способностью агглютинировать микроорганизмы, препятствовать их размножению, фиксации к эпителию слизистой. Важная роль в антибактериальной защите слизистой рта отводится антителам, принадлежащим к иммуноглобулинам классов G и М. Отсутствие указанных иммуноглобулинов при иммунодефицитных состояниях приводит к развитию рецидивирующей инфекции слизистой рта [1, 2, 3, 5, 7, 8, 10].
Иммунитет слизистой ротовой полости нельзя рассматривать лишь как секреторный иммунитет, он обеспечивается взаимосвязанной функцией Т-, В-лимфоцитов и макрофагов. В нормальной ткани десны число макрофагов составляет около 2 % клеток, но в десневой жидкости их число достигает 18 %, это долгоживущие в тканях клетки. Т- и В-лимфоциты содержатся и в десневой жидкости, причем В-клеток в 2– 3 раза больше, чем Т-лимфоцитов. Источником лимфоцитов ротовой жидкости является десневая жидкость, куда они мигрируют из крови, а также лимфоидное глоточное кольцо и соединительная ткань слизистой оболочки рта, в том числе десны и глотки. Под влиянием антигенных стимулов лимфоидные клетки, располагающиеся в подслизистом слое десны, собираются в дискретную лимфоидную ткань [1, 2, 3, 4, 6, 9, 10].
Таким образом, наличие последовательного взаимодействия гуморальных факторов неспецифической резистентности, моноцитарно-макрофагальной системы, В системы лимфоцитов, обеспечивающей выработку антигенспецифических антител и нормального микробиоцитоза обеспечивают противоинфекционную защиту полости рта.