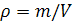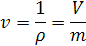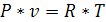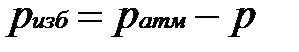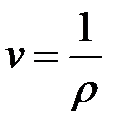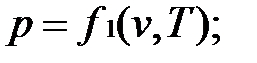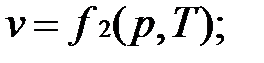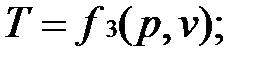Что такое параметры состояния термодинамической системы
Термодинамические параметры состояния системы
Вы будете перенаправлены на Автор24
Термодинамической системой называют совокупность макрообъектов (тел, полей), которые обмениваются энергией друг с другом и внешними (по отношению к системе) объектами. Такую систему называют замкнутой (изолированной), если у нее нет ни какого обмена энергией с внешними телами. Если нет обмена только теплотой, то система адиабатический изолирована. Систему называют закрытой, если нет массообмена у нее с внешней средой.
Величины, которые характеризуют состояние термодинамической системы, называют термодинамическими параметрами. Два состояния системы считают разными, если у этих состояний отличается хотя бы один из параметров. Состояние системы называют стационарным, если параметры системы не изменяются во времени. Стационарное состояние системы равновесно, если система находится в стационарном состоянии не благодаря какому-либо внешнему процессу.
Термодинамические параметры имеют связи между собой. Поэтому для однозначного определения состояния термодинамической системы достаточно ограниченного числа термодинамических параметров. Основными параметрами состояния термодинамической системы являются: давление, температура, удельный объем ($V_u$) (или молярный$<(\ V>_<\mu >)$).
Готовые работы на аналогичную тему
Для однородного тела удельный объем:
Температурой (t, или T) называют физическую величину, характеризующую степень нагретости тела. Различают несколько видов температуры (в зависимости от используемой шкалы измерения). В состоянии термодинамического равновесия все тела системы (все части системы) имеют равные температуры.
В соответствии с правилом Гиббса состояние однородной (в физическом смысле) термодинамической системы полностью определяется двумя параметрами. Уравнение, которое связывает параметры термодинамической системы, называют уравнением состояния. Так, например, можно записать уравнение для внутренней энергии (в общем виде):
Макроскопические термодинамические параметры, описывающие систему целиком, имеют смысл средних значений (за большой промежуток времени) каких-то функций, характеризующих динамическое состояние системы.
Кроме параметров термодинамические системы описывают с помощью функций состояния (иногда об этих физических величинах говорят как о параметрах состояния термодинамической системы).
Важнейшими функциями состояния в термодинамике являются: внутренняя энергия (U), энтальпия (H), энтропия (S).
Внутренняя энергия идеального газа часто выражается следующим образом:
Энтальпия идеального газа зависит только от T и пропорциональна m:
Бесконечно малое приращение внутренней энергии идеального газа задано формулой:
Из уравнения Менделеева-Клайперона выразим температуру (T), помним, что давление постоянно:
Подставим (1.2) в (1.1), получим:
Найдем изменение внутренней энергии газа:
где i =5 по условию задачи, так как газ двухатомный.
Задание: Азот массы 1 кг нагрели на 100 К при постоянном объеме. Найти количество теплоты, полученное газом в заданном процессе. Работу газа, изменение внутренней энергии.
Сразу дадим ответ относительно работы газа. Так как процесс изохорный (изменения объема нет), то работа газа равна нулю.
Изменение внутренней энергии газа можно записать как:
\[\triangle U=\frac<2>\nu R\triangle T\left(2.1\right),\]
молярная масса азота находится с помощью таблицы Менделеева, она равна:
Все данные в задаче в системе СИ, молекула азота состоит из двух атомов, число степеней свободы равно 5, поэтому проведем расчет:
\[\triangle U=\frac<2>\frac
По первому началу термодинамики для изохорного процесса получаем:
\[\triangle Q=\triangle U\left(2.3\right).\]
Можем записать ответ.
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 26 11 2021
Термодинамические параметры
Что такое термодинамические параметры
Термодинамические параметры — явления, описывающие макроскопические движения системы. С греческого слово «parametron» переводится как «отмеривающий» или «соразмеряющий». Таким образом, термодинамические параметры это то, что измеряет систему.
Для описания обычно достаточно трех величин. К примеру, чтобы определить состояние газа, необходимо знать его давление, температуру и удельный объём. Параметры состояния термодинамической системы не зависят от того, каким образом она пришла в данное положение.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Если оно равновесное, то это описывается строго определенным набором величин. Зависимость между ними определяется уравнением состояния, которое и позволяет классифицировать системы.
Классификация величин
Явления, которые характеризируют всю систему целиком, называют макроскопическими. В разных источниках классификация величин отличается, но основные группы все же можно выделить.
В некоторых случаях в литературе используются также такие определения, как внешние и внутренние величины. К первым относят экстенсивные свойства, а ко вторым — внутреннюю энергию, температуру или химсостав.
Термодинамическими параметрами называют и величины, которые поддаются и не поддаются измерению приборами. Давление, температура и объем легко измеряется, а внутреннюю энергию уже нужно вычислять по формулам.
Наряду с термическими параметрами свойств в термодинамике также широко используются и калорические. К ним относятся, в частности энтальпия и энтропия.
Основные величины
К основным термодинамическим параметрам относятся: удельный объем, давление и температура. Если меняется хотя бы одна из этих величин, происходит процесс. Совокупность генеральных свойств системы соответственно определяет ее состояние.
Основные термодинамические параметры состояния:
Основным термодинамическим параметром являются также удельная теплоемкость вещества (объем теплоты, поглощаемой в процессе нагревания на 1 кельвин).
Интенсивные и экстенсивные параметры
Термодинамические параметры состояния делятся на две группы: экстенсивные (суммирующиеся) и интенсивные (выравнивающиеся). В первом случае свойство прямо пропорционально массе системы и обладает аддитивностью. Во втором: параметры таким свойством не обладают и не зависят от массы.
Экстенсивные или аддитививные параметры при фиксированных значениях интенсивных параметров пропорциональны числу частиц в системе (или ее массе). Интенсивные параметры принимают одинаковые значения для любой части равновесной системы, даже когда она не является пространственно однородной.
Экстенсивные величины — величины, значения которых для всей системы равны аналогичному показателю для отдельных ее частей.
Интенсивные величины — величины, которые не изменяются при разделении системы на части.
В отличие от них экстенсивные величины зависят от размеров системы и ее массы.
Интенсивные термодинамические параметры:
Разновидности по свойствам веществ, вступающих в реакцию
Любая химическая реакция сопровождается изменениями функций состояния системы, определяющихся переменными состояниями системы (объемом, давлением и температурой, количеством молей химических компонентов). Реакция возможна, если вещества имеют более низкую свободную энергию, чем реагенты.
К характеристикам параметров состояния термодинамической системы относятся разные величины (в том числе температура, состав или плотность и многое другое). Именно они описывают ее в определенный момент времени в зависимости от набора состояний.
Состояние термодинамической системы. Параметры состояния



Для количественного описания поведения термодинамической системы вводят так называемые параметры состояния, под которыми понимаются величины, численные значения которых однозначно определяют состояние системы в заданный момент времени. Параметры состояния, их смысл и число могут быть найдены только на основании опыта. Термодинамический, т.е. феноменологический, подход требует только, чтобы параметры состояния могли быть измеримы опытным путём с помощью макроскопических приборов. Перечислим некоторые из возможных параметров состояния термодинамической системы, измерение которых доступно современными приборами: 1) координаты центра инерции системы; 2) скорость центра инерции; 3) угловая скорость вращения системы; 4) масса системы; 5) объём; 6) температура; 7) давление; 8) диэлектрическая проницаемость; 9) магнитная проницаемость; 10) магнитный момент; 11) концентрации химических элементов в смеси и т.д.
Как видим, число макроскопических параметров достаточно велико и, строго говоря, не определено, однако далеко не все из них имеют существенное значение для термодинамики. Некоторые из них, такие как положение центра инерции, его скорость и угловая скорость вращения, могут быть вообще исключены из рассмотрения, так как согласно известным положениям классической механики всегда имеется возможность перейти в систему отсчёта с началом в центре инерции системы и жёстко связанную с ней. Численные значения некоторых параметров во множестве прикладных задач термодинамики либо могут считаться равными нулю, либо постоянными с достаточной степенью точности, либо вообще выпадают из рассмотрения. Таковы, например, электрические и магнитные свойства большинства веществ в отсутствие или при наличии слабых электрического и магнитного полей, а также концентрации компонентов в смеси.
В простейшем случае любая термодинамическая система должна обладать четырьмя макроскопическими параметрами: массой M, объёмом V, давлением p и температурой T. Рассмотрим каждый из них более подробно
В системе единиц СИ масса M измеряется в килограммах (кг). Примерно один килограмм составляет массу 1 литра (1 дм 3 ) дистиллированной воды при температуре 15 о С.
Объём. Измерение объёма представляется наиболее простой операцией, даже если форма оболочки термодинамической системы весьма сложна. В этом случае объём системы можно измерить по объёму вытесненной жидкости, однако в любом случае измерение объёма связано с необходимостью измерения длин. В современной физике за единицу длины принимается расстояние, пройденное светом в вакууме за 1/299792458 секунды, при этом за 1 секунду принимается время, в течение которого электромагнитные волны, излучаемые атомом цезия Сs 133 при квантовом переходе между линиями сверхтонкой структуры основного состояния, совершают 9192631770 колебаний. В системе единиц SI это расстояние принимается за 1 метр.
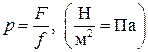
1 бар = 100000 Па = 10 5 Па.

Очевидно, что эта формула справедлива и для любой другой жидкости, лишь бы её можно было считать несжимаемой.
Определение (1.14) позволяет найти связь между единицами давления мм рт.ст. и Па:
В физических исследованиях, в технике, аэродинамике, гидрометеорологии весьма часто в качестве единицы давления используется так называемая физическая атмосфера, определяемая равенствами
1 физ.атм. = 760 мм рт.ст. = 10329 мм вод.ст. = 101325 Па = 1.013 бар.
В технике также широко используется единица давления, называемая технической атмосферой и определяемая как сила в один килограмм, приходящаяся на 1 см 2 поверхности. В частности, большинство технических манометров градуированы в технических атмосферах. Из определения технической атмосферы легко находим
1 тех.атм. = 98100 Па = 0.98 бар = 736 мм рт.ст., 1 бар = 750 мм рт.ст.
Приборы, предназначенные для измерения давления, называются манометрами. При этом прибор, предназначенный для измерения атмосферного давления, носит название барометра.Первый известный в истории барометр был сконструирован итальянским учёным Э.Торричелли в 1644 году и с тех пор не претерпел никаких принципиальных изменений. Этот барометр представлял собой запаянную с одного конца стеклянную трубку длиной около одного метра, заполненную ртутью и опущенную открытым концом вертикально в сосуд с ртутью. Оставшийся в трубке столб ртути высотой около 750 мм уравновешивается атмосферным давлением, величину которого после опытов Торричелли стали измерять непосредственно в миллиметрах этого ртутного столба. Позднее был изобретён барометр, называемый анероидом, конструкция которого оказалась более удобной. Барометр-анероид представляет собой вакуумированный герметически запаянный диск из сравнительно тонкой латуни или бронзы. Изменение атмосферного давления приводит к деформации оснований диска, а величина этой деформации, пропорциональная атмосферному давлению, передаётся на указательную стрелку. Очевидно, что ртутный барометр Торричелли и барометр-анероид ввиду наличия вакуума показывают абсолютное давление атмосферного воздуха, называемое обычно барометрическимpбар.
Температура
История становления понятия температуры в физике, технике и в повседневной жизни связана со многими событиями, на описании которых мы не имеем возможности останавливаться. Остановимся лишь на вопросах, имеющих существенное значение для понимания категории температуры и на методах и способах её измерения.
Можно дать по меньшей мере четыре определения температуры [15]:
· температура есть мера нагретости тела; при этом под нагретостью понимают субъективное ощущение теплоты или холода;
· температура есть показания специального прибора, именуемого термометром;
· температура есть величина, пропорциональная средней кинетической энергии молекул;
· различные комбинации трёх первых определений.
Все эти определения тем не менее не обладают необходимой в любой науке, тем более «строгой», точностью, однозначностью в отличие, например, от определений массы или объёма.
Несмотря на это, введение понятия, аналогичного температуре, было продиктовано всей практикой человеческой и, в частности, научной деятельности. Отвлекаясь от чисто субъективных ощущений тепла и холода, было замечено, что состояния двух тел, приведенных в контакт друг с другом без видимого силового взаимодействия, изменяются и далее с течением времени остаются неизменными. Такой контакт был назван тепловым, а тепловое взаимодействие понималось как «перетекание» от одного тела к другому некоторой невесомой жидкости без цвета и запаха, названной теплородом. Гипотеза теплорода просуществовала вплоть до второй половины XIX века и была отвергнута только под давлением экспериментальных фактов, которые никак не могли быть ею объяснены. При этом под температурой понимался некий «потенциал», т.е. некоторая «высота», с которой, по аналогии с потоком воды в поле тяжести Земли, теплород «стекает» в области с меньшим потенциалом, с меньшей температурой. Несмотря на кажущуюся наивность этих представлений с современной точки зрения, гипотеза теплорода на первых порах оказалась довольно плодотворной и позволила, например, Сади Карно в 1824 году прийти к выводам, лежащим в основе так называемого второго начала термодинамики и понятия энтропии. Случай с температурой является уникальным в научной практике, так как это была первая из физических величин, которую научились измерять, не зная, что это такое. Уточним, что ни один из термометров не измеряет непосредственно температуру. Любой термометр измеряет только тот или иной эффект, связанный с изменением температуры. Например, ртутный, спиртовый или газовый термометры позволяют измерять изменение объёма с изменением температуры при постоянном давлении, термометр сопротивления фиксирует изменение электрического сопротивления с изменением температуры, пирометр связывает с температурой яркость тел, нагретых до больших температур и т.д. Строгое определение температуры и температурной шкалы в рамках термодинамики даёт только второе начало термодинамики в связи с рассмотрением цикла Карно. Такое же строгое обоснование имеет понятие температуры в статистической физике, где температура (называемая абсолютной) оказывается величиной, пропорциональной параметру, характеризующему распределение вероятности кинетической энергии огромного числа хаотически движущихся молекул, составляющих газ.
И, наконец, в 1848 году английский физик Вильям Томсон (лорд Кельвин) ввёл так называемую абсолютную температурную шкалу, называемую также шкалой Кельвина, в которой за начало отсчёта температуры принимается абсолютный нуль, т.е. температура, при которой теоретически прекращаются все возможные виды движения частиц в теле. В остальном введённая Кельвином абсолютная температурная шкала совпадала со шкалой Цельсия. В современной физике в качестве реперной точки выбирается тройная точка воды, т.е. состояние воды, в котором лёд, жидкость и пар сосуществуют в равновесии одновременно. В шкале Кельвина тройной точке воды приписывается температура 273.16 К. Тогда точка замерзания воды (таяния льда) имеет температуру 273.15 К.
Приведём для справок связь между различными температурными шкалами, употребляемыми в настоящее время в разных странах или в различных областях человеческой деятельности:

Что такое параметры состояния термодинамической системы
Термодинамическая система характеризуется определенными значениями ее свойств. Эти свойства термодинамического тела (системы) называются параметрами состояния.
Параметры состояния – любая величина, присущая телу, изменение которой определяется только начальным и конечным состоянием тела и не зависит от характера процесса изменения его состояния, при переходе его из первого состояния во второе. Параметры можно разделить на две группы:
Интенсивные – которые не зависят от количества вещества и при взаимодейтсвии тел выравниваются (температура, давление и т.п.);
Экстенсивные – зависящие от количества вещества, следующие закону сложения или, как говорят математики, закону аддитивности (масса, обьем, внутренняя энергия и т.п.).
Измерение экстенсивной величины производится сравнением ее с такой же по природе величиной, выбранной за единицу – эталон (метр, килограмм и т.п.). Измерение интенсивной величины основано на использовании объективной связи между изменениями этой интенсивной величины и какой-либо экстенсивной величины. Например, связь температуры и объема жидкости в термометре приводит к измерению температуры с помощью длины столбика жидкости в термометре.
Некоторые экстенсивные величины приобретают свойства интенсивных, если их рассматривают применительно к единице массы данного вещества (удельные объем, энтальпия и т.п.).
Все термодинамические параметры введены человеком для удобства изучения окружающего мира. Однако не все параметры поддаются измерению приборами. Ряд параметров, не поддающихся измерению, человек ввел для удобства расчета термодинамических процессов. Эти параметры получаются расчетным путем и имеют в размерности величину работы (энергии) Дж или кал. Например, к ним относятся энтальпия и энтропия. Такие параметры получили название – энергетических или калорических параметров, или функций состояния. Параметры, которые возможно измерить приборами, называются термическими. Например, к этим параметрам относятся температура и давление.
Общая схема разделения термодинамических параметров состояния на основые виды дана на рис. 2.4.
Термодинамическая система



Курс лекций по теплотехнике
Введение. Предмет теплотехники. Основные понятия и определения. Термодинамическая система. Параметры состояния. Температура. Давление. Удельный объем. Уравнение состояния. Уравнение Ван-дер-Ваальса.
Введение. Теплотехника – наука, которая изучает методы получения, преобразования, передачи и использования теплоты, а также принципы действия и конструктивные особенности тепловых машин, аппаратов и устройств. Теплота используется во всех областях деятельности человека. Для установления наиболее рациональных способов ее использования, анализа экономичности рабочих процессов тепловых установок и создания новых, наиболее совершенных типов тепловых агрегатов необходима разработка теоретических основ теплотехники.
Различают два принципиально различных направления использования теплоты – энергетическое и технологическое. При энергетическом использовании, теплота преобразуется в механическую работу, с помощью которой в генераторах создается электрическая энергия, удобная для передачи на расстояние. Теплоту при этом получают сжиганием топлива в котельных установках или непосредственно в двигателях внутреннего сгорания.
Предмет и метод термодинамики. Термодинамика изучает законы превращения энергии в различных процессах, происходящих в макроскопических системах и сопровождающихся тепловыми эффектами. Макроскопической системой называется любой материальный объект, состоящий из большого числа частиц. Размеры макроскопических систем несоизмеримо больше размеров молекул и атомов.
В зависимости от задач исследования рассматривают техническую или химическую термодинамику, термодинамику биологических систем и т. д. Техническая термодинамика изучает закономерности взаимного превращения тепловой и механической энергии и свойства тел, участвующих в этих превращениях. Вместе с теорией теплообмена она является теоретическим фундаментом теплотехники. На ее основе осуществляют расчет и проектирование всех тепловых двигателей, а также всевозможного технологического оборудования.
Рассматривая только макроскопические системы, термодинамика изучает закономерности тепловой формы движения материи, обусловленные наличием огромного числа непрерывно движущихся и взаимодействующих между собой микроструктурных частиц (молекул, атомов, ионов).
Физические свойства макроскопических систем изучаются статистическими термодинамическими методами. Статистический метод основан на использовании теории вероятностей и определенных моделей строения этих систем и представляет собой содержание статистической физики. Термодинамический метод не требует привлечения модельных представлений о структуре вещества и является феноменологическим (т. е. рассматривает «феномены» — явления в целом).
При этом все основные выводы термодинамики можно получить методом дедукции, используя только два основных эмпирических закона термодинамики.
В дальнейшем, исходя из термодинамического метода мы будем для наглядности использовать молекулярно-кинетические представления о структуре вещества.
Она охватывает область физических химических и других явлений, сопровождающихся тепловым эффектом в процессе превращения форм движения материй. Термодинамика основывается на двух экспериментально установленных законах, получивших название первого и второго начал термодинамики.
В зависимости от круга рассматриваемых вопросов различают физическую, химическую и техническую термодинамику.
Технической термодинамикой называется наука, изучающая вопросы взаимного превращения теплоты и работы. Ее основная задача заключается в обосновании теории тепловых двигателей.
В термодинамике широко используется понятие термодинамической системы.
Определение: термодинамической системой называется совокупность материальных тел, взаимодействующих, как между собой, так и с окружающей средой. Все тела находящиеся за пределами границ рассматриваемой системы называются окружающей средой.
Поскольку одно и то же тело, одно и то же вещество при разных условиях может находиться в разных состояниях, (пример: лед-вода-пар, одно вещество при разной температуре) вводятся, для удобства, характеристики состояния вещества – так называемые параметры состояния.
Перечислим основные параметры состояния вещества:
Температура, выраженная по абсолютной шкале, называется абсолютной температурой.
Соотношение для перехода от градусов Цельсия к градусам Кельвина:
Для измерения давления применяются различные единицы измерения. В стандартной системе измерения СИ единицей служит Паскаль (Па).
Соотношение между единицами:
1 кг/см 2 (атмосфера) = 9.8067 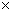
1мм рт. ст (миллиметр ртутного столба) = 133 Па
1 мм вод. ст. (миллиметр водного столба) = 9.8067 Па
Определение: Если в термодинамической системе меняется хотя бы один из параметров любого входящего в систему тела, то в системе происходит термодинамический процесс.
Основные термодинамические параметры состояния Р, V, Т однородного тела зависят один от другого и взаимно связаны уравнением состояния:
Для идеального газа уравнение состояния записывается в виде:
Если известно уравнение состояния, то для определения состояния простейших систем достаточно знать две независимые переменные из 3-х
Р = f1 (v, т); v = f2 (Р, Т); Т = f3 (v, Р).
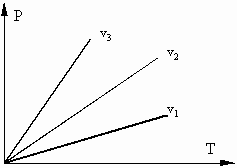
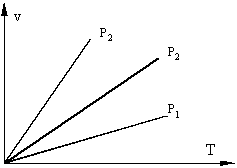
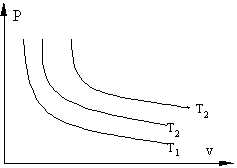
Термодинамические процессы часто изображаются на графиках состояния, где по осям отложены параметры состояния. Точки, на плоскости такого графика, соответствуют определенному состоянию системы, линии на графике соответствуют термодинамическим процессам, переводящим систему из одного состояния в другое.
Рассмотрим термодинамическую систему, состоящую из одного тела какого-либо газа в сосуде с поршнем, причем сосуд и поршень в данном случае является внешней средой.
Пусть, для примера, происходит нагрев газа в сосуде, возможны два случая:
1) Если поршень зафиксирован, и объем не меняется, то произойдет повышение давления в сосуде. Такой процесс называется изохорным (v = const), идущий при постоянном объеме;
2) Если поршень свободен, то нагреваемый газ будет расширяться, при постоянном давлении такой процесс называется изобарическим (P = const), идущим при постоянном давлении.
Если, перемещая поршень, изменять объем газа в сосуде то, температура газа тоже будет изменяться, однако можно охлаждая сосуд при сжатии газа и нагревая при расширении можно достичь того, что температура будет постоянной при изменениях объема и давления, такой процесс называется изотермическим (Т = const).
Процесс, при котором отсутствует теплообмен между системой и окружающей средой, называется адиабатным, при этом количество теплоты в системе остается постоянными (Q = const). В реальной жизни адиабатных процессов не существует поскольку полностью изолировать систему от окружающей среды не возможно. Однако, часто происходят процессы, при которых теплообменном с окружающей средой очень мал, например, быстрое сжатие газа в сосуде поршнем, когда тепло не успевает отводиться за счет нагрева поршня и сосуда.
Понятие кругового процесса является для нас ключевым в термодинамике, поскольку работа АЭС основана на пароводяном цикле, другими словами мы можем рассматривать испарение воды а активной зоне (АЗ), вращение паром ротора турбины, конденсацию пара и поступление воды в АЗ как некий замкнутый термодинамический процесс или цикл.
Определение: Передача энергии в термодинамическом процессе от одного тела к другому, связанная с изменением объема рабочего тела, с перемещением его во внешнем пространстве или с изменением его положения называется работой процесса.
Термодинамическая система
Техническая термодинамика (т/д) рассматривает закономерности взаимного превращения теплоты в работу. Она устанавливает взаимосвязь между тепловыми, механическими и химическими процессами, которые совершаются в тепловых и холодильных машинах, изучает процессы, происходящие в газах и парах, а также свойства этих тел при различных физических условиях.
Термодинамика базируется на двух основных законах (началах) термодинамики:
II закон термодинамики – устанавливает условия протекания и направленность макроскопических процессов в системах, состоящих из большого количества частиц.
Техническая т/д, применяя основные законы к процессам превращения теплоты в механическую работу и обратно, дает возможность разрабатывать теории тепловых двигателей, исследовать процессы, протекающие в них и т.п.
Объектом исследования является термодинамическая система, которой могут быть группа тел, тело или часть тела. То что находится вне системы называется окружающей средой. Т/д система это совокупность макроскопических тел, обменивающиеся энергией друг с другом и окружающей средой. Например: т/д система – газ, находящейся в цилиндре с поршнем, а окружающая среда – цилиндр, поршень, воздух, стены помещения.
Адиабатная (теплоизолированная) система – система имеет адиабатную оболочку, которая исключает обмен теплотой (теплообмен) с окружающей средой.
Однородная система – система, имеющая во всех своих частях одинаковый состав и физические свойства.
Гомогенная система – однородная система по составу и физическому строению, внутри которой нет поверхностей раздела (лед, вода, газы).
Гетерогенная система – система, состоящая из нескольких гомогенных частей (фаз) с различными физическими свойствами, отделенных одна от другой видимыми поверхностями раздела (лед и вода, вода и пар).
В тепловых машинах (двигателях) механическая работа совершается с помощью рабочих тел – газ, пар.
Свойства каждой системы характеризуются рядом величин, которые принято называть термодинамическими параметрами. Рассмотрим некоторые из них, используя при этом известные из курса физики молекулярно-кинетические представления об идеальном газе как о совокупности молекул, которые имеют исчезающе малые размеры, находятся в беспорядочном тепловом движении и взаимодействуют друг с другом лишь при соударениях.
Давление обусловлено взаимодействием молекул рабочего тела с поверхностью и численно равно силе, действующей на единицу площади поверхности тела по нормали к последней. В соответствии с молекулярно-кинетической теорией давление газа определяется соотношением
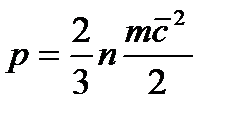
Где n — число молекул в единице объема;
т — масса молекулы; с 2 — средняя квадратическая скорость поступательного движения молекул.
В Международной системе единиц (СИ) давление выражается в паскалях (1 Па = 1 Н/м 2 ). Поскольку эта единица мала, удобнее использовать 1 кПа = 1000 Па и 1 МПа = 10 6 Па.
Давление измеряется при помощи манометров, барометров и вакуумметров.
Жидкостные и пружинные манометры измеряют избыточное давление, представляющее собой разность между полным или абсолютным давлением р измеряемой среды и атмосферным давлением
pатм, т.е.
Приборы для измерения давлений ниже атмосферного называются вакуумметрами; их показания дают значение разрежения (или вакуума):

т. е. избыток атмосферного давления над абсолютным.
Следует отметить, что параметром состояния является абсолютное давление. Именно оно входит в термодинамические уравнения.
Температурой называется физическая величина, характеризующая степень нагретости тела. Понятие о температуре вытекает из следующего утверждения: если две системы находятся в тепловом контакте, то в случае неравенства их температур они будут обмениваться теплотой друг с другом, если же их температуры равны, то теплообмена не будет.
С точки зрения молекулярно-кинетических представлений температура есть мера интенсивности теплового движения молекул. Ее численное значение связано с величиной средней кинетической энергии молекул вещества:
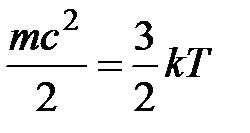
В системе СИ единицей температуры является кельвин (К); на практике широко применяется градус Цельсия (°С). Соотношение между абсолютной Т и стоградусной I температурами имеет вид
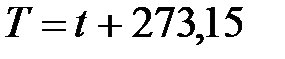
В промышленных и лабораторных условиях температуру измеряют с помощью жидкостных термометров, пирометров, термопар и других приборов.
Удельный объем v — это объем единицы массы вещества. Если однородное тело массой М занимает объем v, то по определению
В системе СИ единица удельного объема 1 м 3 /кг. Между удельным объемом вещества и его плотность существует очевидное соотношение:
Для сравнения величин, характеризующих системы в одинаковых состояниях вводится понятие «нормальные физические условия»:
p = 760 мм рт.ст. = 101,325 кПа; T = 273,15 K.
В разных отраслях техники и разных странах вводят свои, несколько отличные от приведенных «нормальные условия», например, «технические» (p = 735,6 мм рт.ст. = 98 кПа, t = 15?C) или нормальные условия для оценки производительности компрессоров (p = 101,325 кПа, t = 20?С ) и т. д.
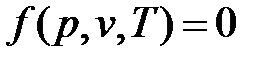
Уравнению состояния можно придать другую форму:
Эти уравнения показывают, что из трех основных параметров, определяющих состояние системы, независимыми являются два любых.
Для решения задач методами термодинамики совершенно необходимо знать уравнение состояния. Однако оно не может быть получено в рамках термодинамики и должно быть найдено либо экспериментально, либо методами статистической физики. Конкретный вид уравнения состояния зависит от индивидуальных свойств вещества.