Что такое перекись водорода простыми словами
Перекись водорода
Перекись водорода
| Пероксид водорода | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Пероксид водорода |
| Химическая формула | H2O2 |
| Отн. молек. масса | 34,01 а. е. м. |
| Молярная масса | 34,01 г/моль |
| Физические свойства | |
| Плотность вещества | 1.4 г/см³ |
| Состояние (ст. усл.) | жидкость |
| Термические свойства | |
| Температура плавления | −0,432 °C |
| Температура кипения | 150,2 °C |
| Энтальпия (ст. усл.) | -136.11 кДж/моль |
| Химические свойства | |
| pKa | 11.65 |
| Растворимость в воде | неограниченная г/100 мл |
| Классификация | |
| номер CAS | [7722-84-1] |
Перокси́д водоро́да (перекись водорода), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2•2H2O.
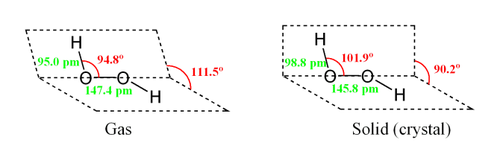
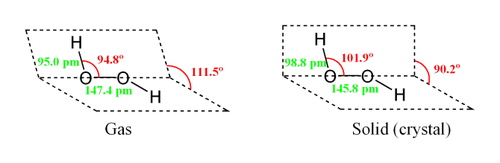
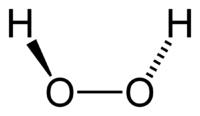
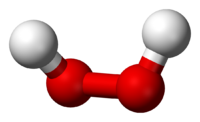
Молекула пероксида водорода имеет следующее строение:
Содержание
Физические свойства
Чистый пероксид водорода очень сильно отличается от знакомого всем 3%-ного раствора Н2О2, который стоит в домашней аптечке. Прежде всего, он почти в полтора раза тяжелее воды (плотность при 20° С равна 1,45 г/см3). Замерзает Н2О2 при температуре, немного меньшей, чем температура замерзания воды – при минус 0,41° С, но если быстро охладить чистую жидкость, она обычно не замерзает, а переохлаждается, превращаясь в прозрачную стеклообразную массу. Растворы Н2О2 замерзают при значительно более низкой температуре: 30%-ный раствор – при минус 30° С, а 60%-ный – при минус 53° С. Кипит Н2О2 при температуре более высокой, чем обычная вода, – при 150,2° С. Смачивает стекло Н2О2 хуже, чем вода, и это приводит к интересному явлению при медленной перегонке водных растворов: пока из раствора отгоняется вода, она, как обычно, поступает из холодильника в приемник в виде капель; когда же начинает перегоняться Н2О2, жидкость выходит из холодильника в виде непрерывной тоненькой струйки. На коже чистый пероксид водорода и его концентрированные растворы оставляют белые пятна и вызывают ощущение жгучей боли из-за сильного химического ожога.
Чистый Н2О2, как и сахарный сироп, сильно преломляет свет. Действительно, коэффициент преломления безводного Н2О2 (1,41) намного больше, чем у воды (1,33). Однако то ли в результате неверного толкования, то ли из-за плохого перевода с французского, практически во всех учебниках до сих пор пишут, что чистый пероксид водорода – «густая сиропообразная жидкость», и даже объясняют это теоретически – образованием водородных связей. Но ведь вода тоже образует водородные связи. На самом деле вязкость у Н2О2 такая же, как и у чуть охлажденной (примерно до 13° С) воды, но нельзя сказать, что прохладная вода густая, как сироп.
Химические свойства
Разлагается на кислород и воду при нагревании, под действием ультрафиолетового излучения, а также в присутствии ионов переходных металлов и серебра:
Однако очень чистый пероксид водорода устойчив.
Пероксид водорода проявляет очень слабые кислотные свойства (К = 1,4·10 –12 ). При действии концентрированного раствора Н2O2 на гидроксиды в ряде случаев можно выделить пероксиды металлов (Li2O2, MgO2 и др.):
Окислительно-восстановительные свойства
Пероксид водорода обладает сильными окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также кислород при реакции с водным раствором перманганата калия в кислой среде.
При действии сильных окислителей H2O2 проявляет восстановительные свойства, выделяя свободный кислород:
Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2:
Окисление органических соединений пероксидом водорода (например, сульфидов и тиолов) целесообразно проводить в среде уксусной кислоты.
Биологические свойства
Перекись водорода относится к реактивным формам кислорода и при повышенном образовании в клетке вызывает оксидативный стресс. Некоторые ферменты, например глюкозоксидаза, образуют в ходе окислительно-восстановительной реакции пероксид водорода, который может играть защитную роль в качестве бактерицидного агента. В клетках млекопитающих нет ферментов, которые бы восстанавливали кислород до перекиси водорода. Однако несколько ферментных систем (ксантиноксидаза, НАД(Ф)H-оксидаза, циклоксигеназа и др.) продуцируют супероксид, который спонтанно или под действием супероксиддисмутазы превращается в перекись водорода.
Получение
Пероксид водорода получаются в промышленности по реакции с участием органических веществ, в частности, каталитическим окислением изопропилового спирта:
Ценным побочным продуктом этой реакции является ацетон.
В лабораторных условиях для получения пероксида водорода используют реакцию
Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
Применение
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химии, в медицине, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит свое применение в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов. В медицине растворы пероксида водорода применяются как антисептическое средство. При контакте с поврежденной кожей и слизистыми пероксид водорода под влиянием фермента каталазы распадается с выделением кислорода, что способствует сворачиванию крови и создает неблагоприятные условия для развития микроорганизмов. Однако такое действие непродолжительно и обладает слабым эффектом. Тем не менее, пероксид водорода (аптечное название — перекись водорода, 3 %) применяется при первичной обработке ран (в том числе открытых). Перекись водорода очень эффективна для лечения небольших царапин, особенно у детей — она не «щиплет», не имеет запаха, бесцветна. Однако она может вызывать небольшое жжение в районе открытой раны. Стоимость пузырька такого раствора (на 2009 год) — около 6 руб. В пищевой промышленности растворы пероксида водорода применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией. Кроме того, на предприятиях по производству молочной продукции, соков, растворы перекиси водорода используются для дезинфекции упаковки (технология «Тетра Пак»). Для технических целей пероксид водорода применяют в производстве электронной техники.
Формы выпуска
Выпускается в виде водных растворов, стандартная концентрация 3, 30, 38, 50, 60, 85, 90 и 98%. 30% водный раствор пероксида водорода, стабилизированный добавлением фосфатов натрия, называется пергидролем.
Опасность применения
Несмотря на то, что пероксид водорода не токсичен, его концентрированные растворы при попадании на кожу, слизистые оболочки и в дыхательные пути вызывают ожоги. В больших концентрациях недостаточно чистый пероксид водорода может быть взрывоопасен.
Пероксид водорода
| Пероксид водорода | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Пероксид водорода |
| Химическая формула | H2O2 |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Отн. молек. масса | 34,01 а. е. м. |
| Молярная масса | 34,01 г/моль |
| Плотность | 1.4 г/см³ |
| Термические свойства | |
| Температура плавления | −0,432 °C |
| Температура кипения | 150,2 °C |
| Энтальпия образования (ст. усл.) | -136.11 кДж/моль |
| Химические свойства | |
| pKa | 11.65 |
| Растворимость в воде | неограниченная |
| Классификация | |
| Рег. номер CAS | 7722-84-1 |
| SMILES | OO |
| Регистрационный номер EC | 231-765-0 |
Перокси́д водоро́да (перекись водорода), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2•2H2O.
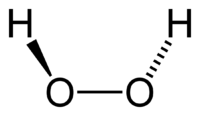
Молекула пероксида водорода имеет следующее строение:
Вследствие несимметричности молекула H2O2 сильно полярна (μ = 0,7·10 −29 Кл·м). Относительно высокая вязкость жидкого пероксида водорода обусловлена развитой системой водородных связей. Поскольку атомы кислорода имеют неподелённые электронные пары, молекула H2O2 также способна образовывать донорно-акцепторные связи.
Содержание
Химические свойства
Оба атома кислорода находятся в промежуточной степени окисления −1, что и обуславливает способность пероксидов выступать как в роли окислителей, так и восстановителей. Наиболее характерны для них окислительные свойства:

При взаимодействии с сильными окислителями пероксид водорода выступает в роли восстановителя, окисляясь до кислорода:
Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2O2 — неустойчивое соединение, легко разлагается. Так же этому может поспособствовать присутствие ионов переходных металлов. В разбавленных растворах пероксид водорода тоже не устойчив и самопроизвольно диспропорционирует на H2O и O2.Реакция диспропорционирования катализируется ионами переходных металлов, некоторыми белками:
Однако очень чистый пероксид водорода устойчив.
Пероксид водорода проявляет слабые кислотные свойства (К = 1,4·10 −12 ), и поэтому диссоциирует по двум ступеням:
При действии концентрированного раствора Н2O2 на некоторые гидроксиды в ряде случаев можно выделить пероксиды металлов, которые можно рассматривать как соли пероксида водорода (Li2O2, MgO2 и др.):

Пероксид водорода может проявлять как окислительные, так и восстановительные свойства. Например, при взаимодействии с оксидом серебра он является восстановителем:
В реакции с нитритом калия соединение служит окислителем:
Пероксидная группа [—O—O—] входит в состав многих веществ. Такие вещества называют пероксидами, или пероксидными соединениями. К ним относятся пероксиды металлов (Na2O2, BaO2 и др.). Кислоты, содержащие пероксидную группу, называют пероксокислотами, например, пероксомонофосфорная H3PO5 и пероксидисерная H2S2O8 кислоты.
Окислительно-восстановительные свойства
Пероксид водорода обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также кислород при реакции с водным раствором перманганата калия в кислой среде.
При восстановлении Н2O2 образуется Н2O или ОН-, например:
При действии сильных окислителей H2O2 проявляет восстановительные свойства, выделяя свободный кислород:
Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2:
Окисление органических соединений пероксидом водорода (например, сульфидов и тиолов) целесообразно проводить в среде уксусной кислоты.
Биологические свойства
Перекись водорода относится к реактивным формам кислорода и при повышенном образовании в клетке вызывает оксидативный стресс. Некоторые ферменты, например глюкозоксидаза, образуют в ходе окислительно-восстановительной реакции пероксид водорода, который может играть защитную роль в качестве бактерицидного агента. В клетках млекопитающих нет ферментов, которые бы восстанавливали кислород до перекиси водорода. Однако, несколько ферментных систем (ксантиноксидаза, НАД(Ф)H-оксидаза, циклоксигеназа и др.) продуцируют супероксид, который спонтанно или под действием супероксиддисмутазы превращается в перекись водорода.
Получение
Пероксид водорода получают в промышленности при реакции с участием органических веществ, в частности, каталитическим окислением изопропилового спирта:
Ценным побочным продуктом этой реакции является ацетон.
В промышленных масштабах пероксид водорода получают электролизом серной кислоты, в ходе которого образуется надсерная кислота, и последующим разложением последней до пероксида и серной кислоты.
В лабораторных условиях для получения пероксида водорода используют реакцию:
Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
Применение
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химии, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит свое применение в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов.
Хотя разбавленные растворы перекиси водорода применяется для небольших поверхностных ран, исследования показали что этот метод обеспечивая антисептический эффект и очищение и удлиняет время заживления. [1] [2] Обладая хорошими очищающими свойствами, перекись водорода на самом деле не ускоряет заживление ран. Достаточно высокие концентрации, обеспечивающие антисептический эффект, могут также удлинять время заживления из-за повреждения прилегающих к ране клеток. [3] Более того, перекись водорода может мешать заживлению и способствовать образованию рубцов из-за разрушения новообразующихся клеток кожи. [4] Однако, в качестве средства для очистки глубоких ран сложного профиля, гнойных затеков, флегмон, и других гнойных ран санация которых затруднена, перикись водорода остается препаратом выбора. Так как она обладает не только антисептическим эффектом, но и продуцирует большое количество пены, при взаимодействии с ферментом пероксидазой. Что в свою очередь позволяет размягчить и отделить от тканей некротизированные участки, сгустки крови, гноя, которые буду легко смыты последующим введением в полость раны антисептического раствора. Без предварительной обработки перекисью водорода, антисептический раствор не сможет удалить данные патологические образования, что приведет значительному увеличению времени заживления раны, и ухудшит состояние больного.
В пищевой промышленности растворы пероксида водорода применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией. Кроме того, на предприятиях по производству молочной продукции, соков, растворы перекиси водорода используются для дезинфекции упаковки (технология «Тетра Пак»). Для технических целей пероксид водорода применяют в производстве электронной техники.
В быту применяется также для выведения пятен MnO2, получившихся при взаимодействии перманганата калия «марганцовки» с предметами (ввиду его окислительных свойств).
Пероксид водорода в аквариумистике
3%-ный раствор пероксида водорода используется в аквариумистике для оживления задохнувшейся рыбы, а также для очистки аквариумов и борьбы с нежелательной флорой и фауной в аквариуме (гидры, планарии, паразиты, водоросли, бактерии и др.)
Формы выпуска
Выпускается в виде водных растворов, стандартная концентрация 1-6 %, 30, 38, 50, 60, 85, 90 и 98 %. 30 % водный раствор пероксида водорода, стабилизированный добавлением фосфатов натрия, называется пергидролем.
Опасность применения
Несмотря на то, что пероксид водорода не токсичен, его концентрированные растворы при попадании на кожу, слизистые оболочки и в дыхательные пути вызывают ожоги. В больших концентрациях недостаточно чистый пероксид водорода может быть взрывоопасен. Опасен при приёме внутрь концентрированных растворов. Вызывает выраженные деструктивные изменения, сходные с действиями щелочей. Летальная доза 30%-го раствора пероксида водорода (пергидроля) — 50—100 мл. [7]
Перекись водорода-это должен знать каждый
13-10-2020 Повышенный интерес к перекиси водорода возник в России после выхода в свет брошюры врача У.Дугласа «Целительные свойства перекиси водорода» (Спб, 1998г.). Однако, ещё до него за 30 лет наш российский профессор Иван Павлович Неумывакин публиковал в печати статьи о несомненной пользе этого препарата для лечения многих заболеваний. Дело в том, что перекись водорода — это самый страшный враг всех болезненных микробов, вирусов и прочей нечисти. Действует всегда эффективнее многих антисептиков и антибиотиков, вдобавок безвреден и не является лекарством. Его даже вырабатывает человеческий организм в малых количествах.
Естественно возникает вопрос, а почему при такой полезности, его мало используют врачи на практике? Ответ банальный — во-первых, слишком дешёвое средство для фарм индустрии. Во-вторых, к сожалению, наши люди мало знают о его свойствах. Многие ленивы и рассчитывают на чудодейственную таблетку, которая без труда избавит их от всех болезней. Но в жизни так не бывает. Приведу примеры.
Первый.
Профессор Неумывакин звонит своему другу, одному из ведущих патофизиологов дыхания, профессору Коваленко Е.А. и спрашивает его: «Женя, что ты знаешь о перекиси водорода?»
«Как что, это хороший антисептик, применяемый наружно». «Да нет, говорит, Неумывакин, я спрашиваю о её внутреннем применении». «Ты что, Иван, с ума сошёл? Всегда что-то выдумываешь». Вот такие сведения у человека с профессорским званием, а уж что говорить о простых людях.
«Огромное спасибо за то, что Вы есть. Сегодня утром (29.04.04) смотрела передачу «Доброе утро», где критиковали работу вашего центра и что Вы рекомендуете перекись водорода от многих болезней. В передаче была названа моя фамилия, которой якобы от Вашего лечения стало плохо. Корреспондентам я ничего подобного не говорила, как же можно так всё извратить и поливать грязью то, что вы делаете. А эта Е.Малышева хоть поинтересовалась бы, что действительно делают здесь, в центре, как же можно говорить то, что не посмотрела, не попробовала, да ещё в Ваше отсутствие, а защищала честь уже ничего не умеющей медицины. »
Бывают в продаже такие вольные экземпляры о перекиси водорода, как у автора Жулпановой Л.Ж. Не дай бог воспользоваться её «вольными» советами по применению препарата. Такие выпуски тоже порождают в умах людей сплошную сумятицу и подрывают авторитет лечения. Не знаешь кому верить. Верить надо однозначно — профессору Неумывакину Ивану Павловичу.
Перекись водорода — (Н2О2) это бесцветная жидкость, без запаха, хорошо растворимая в воде. Разлагается при комнатной температуре на свету. Поэтому хранить её надо в темноте с закрытой пробкой.
Другое название — ПЕРГИДРОЛЬ (пероксид), ГИДРОПЕРИТ, гиперол, лаперол. Японский эквивалент — ФЛЮЗОЛ.
ПЕРГИДРОЛЬ — концентрированный раствор Н2О2 в количестве — 27,5-3 7 %.
В аптеке, как правило, продаётся 3%-ная перекись, часто даже без обозначения концентрации достаточно чистая в отличие от технической (имеются примеси свинца и цинка). Свинец, в тех дозах, которые рекомендуются для приёма внутрь, абсолютно безопасен. Цинк только полезен организму.
ГИДРОПЕРИТ выпускается в таблетках и содержит около 35% перекиси. Знаком почти всем женщинам, которые когда-либо сами красили волосы. С его помощью растворяют и разводят красители волос.
Использование
Перекись водорода применяется прежде всего как средство, обладающее антисептическими и кровоостанавливающими свойствами, потому что она обладает сильной окислительной детоксикацией. Это в свою очередь повышает работу ИММУННОЙ системы, помогает устранять и предотвращать многие серьёзные болезни.
Окислительные процессы очень сильны, настолько, что в растворе Н2О2 (1 чайная ложка на 1 литр воды) погибают все микробы и паразиты, бактерии и грибки, вирусы, и даже возбудители ХОЛЕРЫ, БРЮШНОГО ТИФА и СИБИРСКОЙ ЯЗВЫ.
Показания к применению перекиси водорода
1. Является необходимым РЕГУЛЯТОРОМ при нарушениях ОБМЕННЫХ процессов в организме человека.
2. Уничтожает любые ВИРУСНЫЕ инфекции, ГРИБКОВЫЕ заболевания, ГНОЙНЫЕ инфекции, лечит ДИСБАКТЕРИОЗ кишечника и в целом устраняет его дисфункцию.
3. Активно борется при любых расстройствах СЕРДЕЧНО-СОСУДИСТОЙ системы: заболевания сосудов ГОЛОВНОГО МОЗГА, периферических сосудов (ЦЕРЕБРОСТЕНИЯ, рассеянный СКЛЕРОЗ, болезни ПАРКИНСОНА, АЛЬЦГЕЙМЕРА), СТТЕНОКАРДИЯ, ИШЕМИЯ, ИНФАРКТ, ВАРИКОЗНОЕ расширение ВЕН, ТРОМБОФЛЕБИТ, ИНСУЛЬТ (ишемический и геморрагический), ЭНДАРТЕРИТ (облитерирующий).
4. ДИАБЕТ (как инсулинзависимый так и независимый)
5. Перекись водорода активно препятствует росту ОПУХОЛЕЙ, в т.ч. и раковых.
6. Иммунодефмцитные — Красная ВОЛЧАНКА, Ревматоидный ПОЛИАРТРИТ, любые аллергические проявления.
В сочетании с ультрафиолетовым облучением Н2О2 способна бороться с иммунодефицитными болезнями — вирусный ГЕПАТИТ, хронические болезни, БЕСПЛОДИЕ, СПИД, БРОНХИАЛЬНАЯ АСТМА, и другие.
7. Заболевания ЗУБОВ, НОСА и Носоглотки, устраняет плохой запах изо рта.
8. Помогает быстро сращивать ПЕРЕЛОМЫ, улучшая регенерацию тканей
Способы лечения
Перекись водорода можно применять различными способами. Самый распространённый и известный — НАРУЖНЫЙ метод. Другой — внутреннее применение. Третий — менее известный — ВНУТРИВЕННОЕ ВВЕДЕНИЕ Н2О2, четвёртый — РЕКТАЛЬНЫЙ способ введения (КЛИЗМЫ). Отдельно можно отметить введение перекиси через НОС и УШИ.
Наружное применение
1. В виде компрессов, втираний в любые болезненные места (область СЕРДЦА, СУСТАВЫ и т. д.), смазывания кожной поверхности (болезнь ПАРКИНСОНА, РАССЕЯННЫЙ СКЛЕРОЗ. Для этого берут 1-2 чайные ложки 3% раствора Н2О2 на 50 мл воды с последующим увеличением концентрации р-ра вплоть до 3%.
2.При кожных заболеваниях (ЭКЗЕМА, ПСОРИАЗ и др.) можно использовать не только 3% Н2О2 (неразбавленную), но и 15-25-33%-ную, приготовленную из таблеток ГИДРОПЕРИТА. Смазывать высыпания поверхности кожи 1-2 раза в день до полного исчезновения.
3.ГРИБКИ на ногах или в других местах, БОРОДАВКИ или другие высыпания смазывать 3% р-ром Н2О2 несколько дней, и они исчезнут.
4.При ранении для предотвращения инфекции, ГНОЙНЫХ процессах, ССАДИНАХ и т. п. — является хорошим дезинфицирующим средством при неглубоких РАНАХ, ПОРЕЗАХ и ТРЕЩИНАХ в сочетании с квасцами — 10% р-р квасцов (на 10 мл воды 10 г квасцов) добавить 1 чайную ложку 3% Н2О2. Этой смесью лечить ТРОФИЧЕСКУЮ ЯЗВУ, раневые поверхности при ЛИМФОДЕНИТАХ, кожные проявления разного рода.
5.Ванны с перекисью водорода (в тёплую ванну 5-6 пузырьков (по 40 мл ) — 30-40 минут. Курс 5-7 ванн.
Предупреждение: шампуни, мыла, особенно импортные, смоют защитный слой кожи на некоторое время и она останется беззащитной.
Может повыситься температура, появиться розовые пятна на коже, лёгкое расстройство стула. Ничего страшного. Это нормальное явление, вызванное сильным внутренним загрязнением организма. Всё пройдёт.
Лечит ЭКЗЕМУ, ПСОРИАЗ, ДЕРМАТИТ, ТРОФИЧЕСКУЮ язву, изгоняет ГЛИСТОВ, снимает боль в ПОЗВОНОЧНИКЕ, СУСТАВАХ и МЫШЦАХ. Нормализует СТУЛ.
6 .Угри, морщины и другое устраняется перекисью. Вымыть лицо тёплой водой и хорошо протереть. Смочить ватку1-1,5%-ной Н2О2 а впоследствии — 2%, помассировать лицо, шею. Через 20-30 минут надо снова ополоснуть лицо тёплой водой.
Такую же процедуру проделать при ЦЕЛЛЮЛИТЕ, но промассировать с помощью массажёра или Иппликатора Кузнецова(лучше Ляпко). Прокатать живот, бёдра, руки, ноги, а затем смочить поверхность кожи 3%-ной Н2О2.
Внутреннее использование
Прежде всего отметим, что противопоказаний для приёма перекиси водорода внутрь НЕТ!
Принимать надо начинать с 1-й капли и постепенно, прибавляя каждый день по одной, довести до 10 капель на 10-й день, после чего сделать перерыв на 2-3 дня и, затем уже принимать по 10 капель, делая перерывы через каждые 2-3 дня.
Капли разбавлять 2-3- мястоловыми ложками (2 ст.л.-30 мл — от 1 до 5 капель; 3ст. л.-50 мл — от 6 до 10 капель) кипячёной воды комнатной температуры.
Пить 3 раза в день за 30 минут до еды или через 1,5-2 часа после.
Примечание. Некоторые больные, у кого здоровье позволяет, вообще не делают перерывов до выздоровления.
Применение через нос и уши
1. При любых заболеваниях или в состоянии дискомфорта ( ГРИПП, ПРОСТУДА, ГОЛОВНАЯ БОЛЬ ), особенно болезнь ПАРКИНСОНА, РАССЕЯННЫЙ СКЛЕРОЗ, заболевания НОСОГЛОТКИ (ГАЙМОРИТ, воспаление лобных ПАЗУХ), ШУМ В ГОЛОВЕ и др. надо ЗАКАПЫВАТЬ перекись водорода в НОС из расчёта 10-15 капель на 1 столовую ложку воды и по целой пипетке закапывать сначала в одну, затем в другую ноздрю.
Через 1-2 дня разрешается увеличить дозу по 2-3 пипетки в каждую ноздрю, а потом вводить до одного кубика с помощью шприца.
Когда через 20-30 сек. Из носа пойдут выделения (слизь), надо пойти в ванну, наклонить голову к плечу, пальцем зажать ноздрю, которая сверху, а через нижнюю выдуть всё, что там накопилось и выходит. Затем склонить голову в другую сторону и проделать такую же процедуру.
После этого 10-15 минут ничего не есть и не пить.
3. Различные заболевания ушей, ТУГОУХОСТЬ. В начале использовать 0,3-0,5%-ный раствор Н2О2 (1 мл на 1 ст. ложку воды). Через несколько дней можно повысить концентрацию до 1-2%. Закапывать или вводить в ухо ватный тампон.
РЕКТАЛЬНЫЙ СПОСОБ в ряде случаев является более эффективным при лечении таких болезней, как лечение любых форм дисбактериоза, кандидозов, вирусных инфекций, уреаплазмозов,, заболеваний женской и мужской половых органов, атеросклероза, простатита, аденомы. Заболеваний лёгких, кист, миом, полипов, почек, печени, поджелудочной железы, заболеваний нервной системы.
Порядок приготовления раствора, обязательные условия, правила введения и меры предосторожности смотри на стр. 108-109 указанного в конце статьи источника.
На все заявления отдельных врачей о вреде перекиси водорода, профессор Неумывакин Иван Павлович отвечает, что по собственному опыту и данным У.Дугласа —
« … считаю, что если СУТОЧНАЯ ДОЗА не превышает 30 капель, а разовая — 10 капель , то такая доза безопасна . В случае же появления каких-либо реакций надо на время прекратить приём или уменьшить дозу. И что очень важно: приём перекиси водорода всегда осуществлять на ПУСТОЙ ЖЕЛУДОК, что бывает за 30-40 мин. д о еды или через 1,5-2 часа после.»
Изучайте внимательно, пробуйте и
В работе использовалась книга И.П.Неумывакин «ПЕРЕКИСЬ ВОДОРОДА. На страже здоровья» М — Спб «ДИЛЯ» 2008, 3-е переработанное издание