Что такое периартрит узелковый
Что такое плечелопаточный периартрит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Бабинцевой Марины Юрьевны, эндокринолога со стажем в 27 лет.
Определение болезни. Причины заболевания
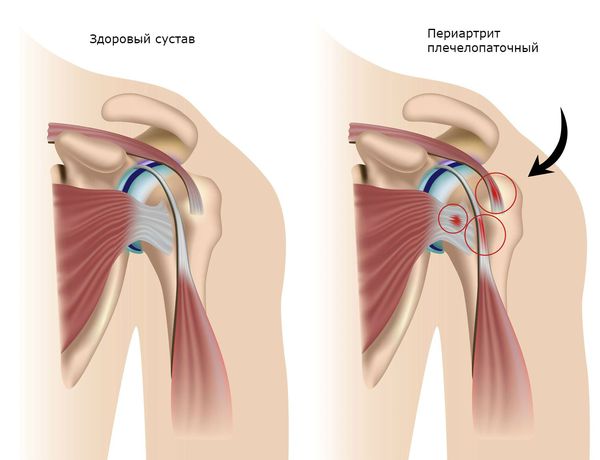
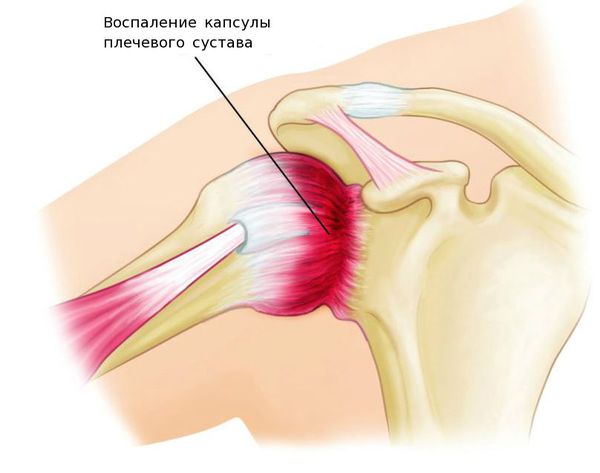
Плечелопаточный периартрит — поражение околосуставных мягких тканей: сухожилий, связок, мышц суставной капсулы, подакромиальной и поддельтовидной сумок (полостей, расположенных под лопаткой и верхней частью дельтовидной мышцы).
Другие названия заболевания: плечелопаточный периартроз, плечевая артропатия, синдром «замороженного плеча», «болезненное плечо», «шейно-плечевой синдром», «плечо пятидесятилетних», говорящие о боли в шейно-плечелопаточной области.
Основные проявления плечелопаточного периартрита — боль и нарушение движений в плечевом суставе.
Причины плечелопаточного периартрита
В развитии плечелопаточного периартрита важную роль играют как воспаление, так и дегенеративные процессы, поэтому иногда это заболевание называют плечелопаточный периартроз.
Жалобы на симптомы плечелопаточного периартрита чаще всего встречаются при заболеваниях опорно-двигательного аппарата.
Выделяют внешние и внутренние причины развития плечелопаточного периартрита.
К внешним причинам относят:
К внутренним причинам относят заболевания, в основе которых лежат нервнотрофические и нервнорефлекторные влияния.
Нервнорефлекторные причины — рефлекторный спазм мышечных волокон и мелких сосудов, в результате которых возникают локальные зоны ишемии. К провоцирующим болезням относятся инфаркт миокарда, стенокардия и спондилоартроз шейного отдела позвоночника.
Нервнотрофические механизмы включаются при нарушении трофики, т. е. питания мягких тканей плеча. В таких тканях возникают очаги ишемии и некроза, которые впоследствии замещаются соединительной тканью, рубцуются и кальцинируются. Вокруг очагов развивается зона воспаления. Кроме того, источником биологически активных веществ, приводящих к воспалению и провоцирующим фактором для дегенеративных изменений как суставного хряща, так и внесуставных мягких тканей, является жировая ткань.
К такому нарушению могут приводить мастэктомия (операция по удалению молочной железы), сахарный диабет, ожирение, туберкулёз лёгких и болезнь Паркинсона.
Другие внутренние факторы, способствующие развитию плечелопаточного периартрита: врождённые патологии суставов (артропатии) и дисплазия, или направильное развитие, соединительной ткани.
Симптомы плечелопаточного периартрита
На начальной стадии при простой форме плечелопаточного периартрита возникает незначительная боль в плече при движении, чаще всего — в правом (у правшей). Пациент обычно не может назвать причину возникновения боли, но иногда провоцирующим фактором служит переохлаждение, травма или непривычное резкое движение рукой. Также причиной может быть избыточная физическая нагрузка, которая возникает при работах, связанных с выполнением часто повторяемых движений в плечевом суставе (подъём, опускание, приведение, отведение руки). Характерным признаком считается односторонность и преобладание поражения правой верхней конечности.
Болезненными становятся бытовые движения: причёсывание, одевание, умывание, т. е. действия, связанные с поднятием руки вверх, отведением и вращением назад. Иногда боль возникает ночью, особенно если пациент спит на поражённом плече.
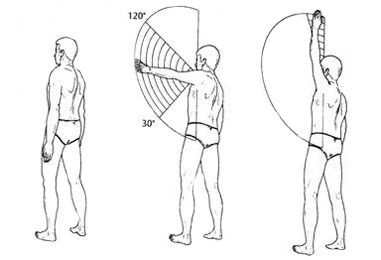
При хроническом плечелопаточном периартрите основным клиническим проявлением становится тугоподвижность плечевого сустава, которая со временем прогрессирует. Боль умеренной интенсивности может возникать в начале заболевания или уже после формирования ограничения движений.
Патогенез плечелопаточного периартрита
К развитию плечелопаточного периартрита приводят как воспалительные, так и дегенеративные процессы. Однако в основе лежит дегенеративное поражение. Воспалительный компонент может присоединяться вторично, например, при воспалительных заболеваниях суставов или воспалении, возникающем после травмы.
Первично дегенеративный процесс поражает сухожилия мышц, плохо кровоснабжаемых из-за анатомических особенностей и несущих наибольшую нагрузку. В этих сухожилиях возникают микротравмы, разрывы фибрилл (сухожильных волокон), которые впоследствии некротизируются. В некротизированных (омертвевших) участках откладываются соли кальция и полупрозрачные твёрдые массы гиалина (белок — признак патологических процессов) и разрастается соединительная ткань. В результате функция сухожилий значительно нарушается. В сухожилиях, прилегающих к ним серозных сумках и мышечных влагалищах, возникает реактивный воспалительный процесс.
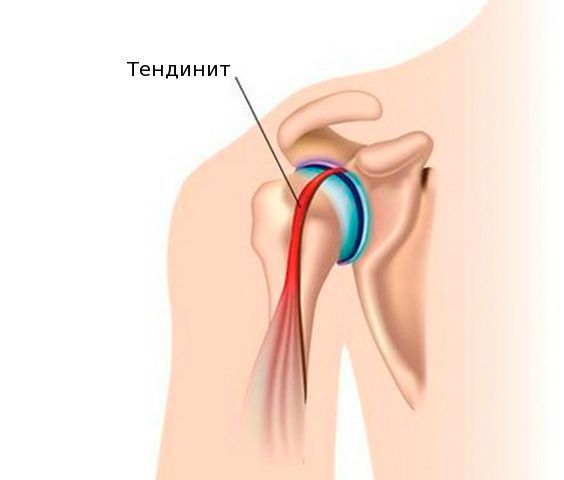
В большинстве случаев вначале поражается сухожилие в месте его прикрепления к кости, и возникает тендинит.
Тендинит — это воспаление сухожилия, которое может быть острым, подострым и хроническим. Тендинит сопровождается болью в плече при сгибании, разгибании, отведении или приведении руки.
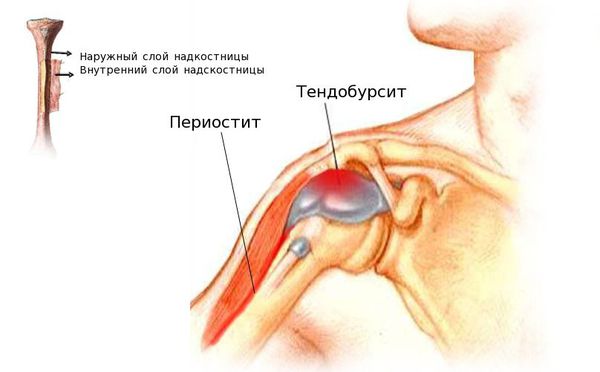
При возникновении бурситов серозная сумка становится отёчной и гиперемированной, в её полости накапливается серозный экссудат — жидкость, состоящая из белков и лейкоцитов. При присоединении бактериальной инфекции экссудат приобретает гнойный характер. В дальнейшем может возникать фиброзное сращение сухожильного влагалища и стенок сумок. Из-за сращения ухудшается скольжение сухожилия, и сустав начинает работать хуже.
Ещё одной структурой, вовлекаемой в процесс дегенерации при плечелопаточном периартрите, является апоневроз. Апоневроз — широкая сухожильная пластинка, сформированная из плотных коллагеновых и эластических волокон. Апоневроз покрывает все мышцы, от апоневроза плеча вглубь уходят фасции, которые образуют влагалища мышц плеча. Изменения апоневроза могут быть двух видов: распространёнными с поражением всей структуры или очаговыми с образованием фиброзных узелков.
Классификация и стадии развития плечелопаточного периартрита
Плечелопаточный периартрит — диагноз собирательный, поэтому классификация основывается на выделении поражённых околосуставных областей.
Наиболее часто используется классификация поражений области плечевого сустава по T. Thornhill (1989 год), которая практически полностью совпадает с МКБ-10 [6] [8] [11] :
Эта классификация дополняется импиджмент-синдромом (impingement-syndrome), при котором возникает ущемление сухожилий мышц вращательной манжеты и двуглавой мышцы плеча между акромионом (концом лопаточной кости) и головкой плечевой кости.
По клиническим формам различают:
В некоторых случаях эти клинические формы могут быть стадиями заболевания у одного пациента.
Осложнения плечелопаточного периартрита
Осложнения плечелопаточного периартрита можно условно разделить на две группы:
Развитие плечелопаточного периартрита приводит к адгезивному капсулиту (от лат. adhaerere — прилипать, быть соединённым) и формированию синдрома «замороженного плеча».
При адгезивном капсулите соединительная ткань в капсуле сустава разрастается, в ней появляются фиброзные тяжи и грубые рубцы, синовиальная оболочка приобретает характерные утолщения, её листки слипаются. Фиброзному процессу подвергаются мышцы и связки плечевого сустава, в тканях отсутствуют признаки воспаления. В результате нарушаются активные и пассивные движения в суставе, через 3-4 месяца сустав полностью утрачивает свою подвижность. В большинстве случаев полный объём движений в плечевом суставе при адгезивном капсулите не восстанавливается.
При плечелопаточном периартрите в патологический процесс часто вовлекаются нервы плечевого сплетения, чем объясняется длительное и упорное течение болевого синдрома и нарушение подвижности сустава.
Диагностика плечелопаточного периартрита
Основа диагностики плечелопаточного периартрита — это клинический метод:
На начальной стадии заболевания при тендинитах надостной, подостной и двуглавой мышц плеча при визуальном осмотре нарушения не выявляются. Может быть болезненность при пальпации в местах прикреплений сухожилий мышц. Болезненность при совершении ряда движений приводит к тому, что пациент, например, не может полностью завести руку назад и дотронуться до позвоночника.
Симптом Дауборна связан со сдавливанием поражённого сухожилия надостной мышцы акромионом (отростком лопатки, участвующим в образовании акромиально-ключичного сустава) и головкой плечевой кости.
Боль при наружной ротации плеча свидетельствует о патологии подостной и малой круглой мышцы, внутренняя ротация плеча помогает оценить состояние подлопаточной мышцы и т. д.
Лабораторная, ультразвуковая и рентгенологическая диагностика в этой стадии заболевания малоинформативны.
Пациент с острым плечелопаточным периартритом обычно держит поражённую конечность согнутой в локте, иногда придерживает её другой рукой, чтобы избежать лишних движений в плечевом суставе. При пальпации сухожилия резко болезненны (болезненность может определяться в месте прикрепления ротаторов плеча, бицепса или под акромиальным отростком). При резко выраженном воспалении в этих местах наблюдается покраснение и некоторая припухлость, область под акромионом может слегка флюктуировать (колебаться). Флюктуация ткани при пальпации говорит о выраженном воспалении, сопровождающемся скоплением жидкости в суставных сумках или мышечных влагалищах.
Движения в плечевом суставе значительно затруднены или полностью невозможны из-за выраженного болевого синдрома. У пациента может подниматься температура до субфебрилитета и быть повышенным СОЭ (скорость оседания эритроцитов).
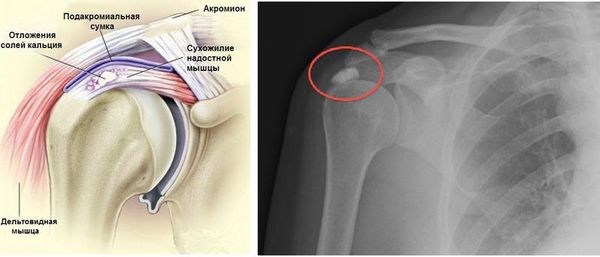
Рентгенография может выявить кальцификаты в сухожилиях или субакромиальной сумке. На ультразвуковом исследовании определяется утолщение сухожилий, наличие выпота в сухожильных влагалищах и субакромиальной и поддельтовидной сумках, кальцинаты с воспалительными участками вокруг них.
При дальнейшем развитии заболевания возникает хронический анкилозирующий плечелопаточный периартрит (от греч. ankylos — согнутый) — неподвижность сустава, обусловленная сращением суставных поверхностей. При этом подвижность в плечевом суставе значительно ограничена. Боковое отведение осуществляется только за счёт лопаточно-ключичного сочленения, при фиксации лопатки это движение становится невозможным. Затруднены также внутренняя и наружная ротация плеча. Это особенно ярко проявляется в комбинированном с отведением руки движении (например, при закладывании руки за голову или за спину).
При пальпации болезненны места прикрепления сухожилий мышц, а также зона под акромионом. Температура и лабораторные показатели остаются в пределах нормы.
На рентгенограмме и ультразвуковом исследовании могут выявляться признаки остеопороза, остеосклероза, остеофиты (краевые разрастания костной ткани) в местах прикрепления сухожилий мышц, кальцинаты, утолщение и сморщивание капсулы плечевого сустава.
Лечение плечелопаточного периартрита
Лечение включает ограничение подвижности сустава, медикаментозные средства, физиотерапию, лечебную физкультуру и хирургические методы.
Консервативное лечение плечелопаточного периартрита начинается с ограничения подвижности сустава и прекращения воздействия провоцирующих факторов. При этом необходимо, чтобы пациент активно участвовал в процессе реабилитации. Ограничиваются только те движения, которые вызывают боль. Полное обездвиживание сустава в течение длительного времени не рекомендуется, так как может вызвать или усугубить его функциональную недостаточность в дальнейшем.
Медикаментозное лечение
В остром периоде используются медикаментозные средства, направленные на уменьшение боли, отёка и воспаления в поражённых тканях, а также мышечного спазма. Для этой цели широко используются блокады триггерных точек растворами новокаина или лидокаина в сочетании с кортикостероидами («Дипроспан», «Гидрокортизон» и т. д.).
При длительном болевом синдроме используют системную медикаментозную терапию. Хорошим обезболивающим действием при плечелопаточном периартрите обладают простые анальгетики («Парацетамол»). Применяют как селективные («Мелоксикам», «Целекоксиб», «Нимесил», «Найз»), так и неселективные («Диклофенак», «Отрофен» и др.) нестероидные противовоспалительные средства.
Для снятия мышечного спазма применяют миорелаксанты, особенно при мышечно-тоническом синдроме. Иногда при отсутствии эффекта от применения вышеперечисленных лекарственных средств используют анальгетики центрального действия («Трамадол»).
Местное использование нестероидных противовоспалительных средств оказывает положительное воздействие, что особенно важно из-за отсутствия у этих препаратов системных побочных воздействий.
Терапия, направленная на улучшение процессов регенерации, используется и локально. Она состоит, например, в периартикулярном введении препаратов гиалуроновой кислоты, собственной обогащённой тромбоцитами плазмы (PRP-терапия), введении в триггерные зоны витаминов группы В.
Оперативное лечение
При адгезивном капсулите пременяется оперативное лечение с иссечением спаек и сращений, что увеличивает подвижность плечевого сустава и улучшает прогноз заболевания. Оперативное лечение рекомендовано также при полном разрыве сухожилий вращательной манжеты. Операция проводится артроскопически (внутрисуставно с помощью специального оборудования — артроскопа) или открытым доступом.
Физиотерапия
При лечении плечелопаточного периартрита эффективна физиотерапия: ультразвук и синусоидальные моделированные токи, а также электрофорез с лекарственными веществами.
Ультразвук, как и электрические импульсы определённой частоты, способен разрыхлять соединительную ткань и повышать проницаемость для лекарственных веществ. Эти физические свойства легли в основу терапевтических методов электро- и фонофореза. Чаще всего используется электрофорез (фонофорез) с гидрокортизоном, но могут применяться и другие лекарственные вещества. Также рекомендовано грязелечение и сульфидные ванны.
Лечебная физкультура
Кинезиотерапия ( греч. kinesis — движение, therapia — лечение) — форма лечебной физкультуры, естественный метод восстановления нарушений опорно-двигательного аппарата, который воздействует на систему связок, мышц и суставов.
При выполнении упражнений важно соблюдать правила:
Лечебная физкультура — обязательный компонент лечения и реабилитации пациентов с плечелопаточным периартритом после окончания острого периода и купирования болевого синдрома.
Прогноз. Профилактика
Прогноз при плечелопаточном периартрите:
Меры профилактики плечелопаточного периартрита:
При уже возникшем периартрите плечевого сустава профилактические мероприятия направлены на улучшение микроциркуляции и трофики тканей. Это массаж, самомассаж, плавание и лечебная физкультура.
Также важно лечить (или компенсировать) сопутствующие болезни, вызывающие нарушения питания тканей и ограничивающие движения в суставе:
Узелковый полиартериит (M30.0)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Эпидемиология
| Заболевание | Распространенность (на 1 000 000 населения) | Средний возраст начала заболевания, годы | Доля мужчин среди заболевших, % | Преобладающая географическая распространенность |
| Узелковый полиартериит | 4,6 (2-18) | 48±1,7 | 60 | Нет |
Клиническая картина
Клинические критерии диагностики
Cимптомы, течение
Диагностика
Лабораторная диагностика
Лабораторная диагностика УП.
При УП ассоциированном с HBV наблюдается повышение активности ЩФ, АСТ, АЛТ, определяется HbsAg, обнаруживают HBV ДНК.
При иммунологическом исследовании сыворотки крови выявляют повышение СРБ, иногда выявляют РФ, криоглобулинемию. АНЦА определяются крайне редко.
Гистологическое исследование при УП.
У пациентов с предполагаемым диагнозом УП желательно проведение гистологического исследования, выявляющего характерную картину фокального некротизирующего артериита с клеточным инфильтратом смешанного характера в сосудистой стенке. Наиболее информативна биопсия скелетной мышцы. При проведении биопсии внутренних органов у больных УП высок риск развития внутреннего кровотечения.
Инструментальные методы исследования при УП.
При ультразвуковой допплерографии у 60% больных выявляют изменения в артериях почек (прежде всего стеноз).
Ангиография позволяет обнаружить множественные микроаневризмы и стенозы отдельных участков артерий среднего калибра преимущественно в артериях почек, брыжейки, печени. Эти изменения могут исчезать на фоне эффективного лечения.
Осложнения
Лечение
Лечение узелкового полиартериита.
(Уровень доказательности А): Для индукции ремиссии УП без HBV инфекции рекомендуется ЦФ в сочетании с ГК.
(Уровень доказательности С): При HBV- ассоциированном УП рекомендуется использовать комбинированную терапию, включающую противовирусные препараты, плазмаферез и ГК.
Лечение УП без инфекции вируса гепатита В:
При ограниченном поражении сосудов, отсутствии признаков прогрессирования и невысокой воспалительной активности назначают средние дозы ГК. При тяжелом, быстропрогрессирующем течении целесообразно раннее назначение комбинированной терапии ГК и ЦФ. Развитие почечной недостаточности, периферической гангрены, полинейропатии, поражения ЖКТ является показанием для проведения в/в пульс- терапии МП в сочетании с ЦФ. Цитостатики назначают так же в случае невозможности снижения дозы ГК вследствие частых обострений заболевания.
Быстропрогрессирующее тяжелое течение УП:
ЦФ в/в пульсовые введения 15 мг/кг (не более 1 г) через 2 недели N 1- 3, далее каждые 3 недели.
+
МП в/в 0,5- 1 г/сутки 3 дня подряд с последующим назначением ПЗ внутрь 1 мг/кг/сутки (не более 80 мг) однократно утром до достижения эффекта, как правило, не менее месяца. После достижения эффекта постепенно снижают дозу ПЗ (по 1,25 мг) на 25% в месяц до 20 мг/сутки, затем на 10% каждые 2 недели до 10 мг/сутки. Далее возможно снижение дозы ПЗ на 1,25 мг каждые 4 недели.
или:
ЦФ внутрь 4 мг/кг/сутки в 2- 3 приема, 3 суток, затем ЦФ внутрь 2 мг/кг/сутки (не более 200 мг/сутки) в 2- 3 приема 7 суток, с последующим постепенным снижением дозы на 25- 50 мг/месяц в течение 2- 3 месяцев. При повышении сывороточного креатинина (> 300 ммоль/л) или в пожилом возрасте пациента дозу ЦФ снижают на 25- 50%.
+
ПЗ внутрь 1- 2 мг/кг/сутки (не более 80 мг) однократно утром до достижения эффекта, как правило, не менее месяца, с последующим постепенным снижением дозы.
Плазмаферез 7- 10 процедур в течение 14 суток с удалением 60 мл/кг плазмы и замещением равным объёмом 4,5- 5% альбумина человека.
Нормальный иммуноглобулин человека в/в 0,4- 2 г/кг 1 раз/сутки, 3- 5 суток. Возможно проведение повторных курсов 1 раз в месяц на протяжении 6 месяцев.
Ограниченное поражение сосудов, отсутствие признаков прогрессирования УП:
ПЗ внутрь 1- 2 мг/кг/сутки в 2- 3 приема (после еды) в течение 7- 10 суток,
затем, при положительной динамике клинических и лабораторных показателей:
ПЗ внутрь 1- 2 мг/кг/сутки (не более 80 мг) однократно утром до достижения эффекта, как правило, не менее месяца, с последующим постепенным снижением дозы ПЗ. В процессе снижения дозы ПЗ внимательно наблюдают за динамикой клинических симптомов и контролируют СОЭ каждый мес. в течение первых 2- 3 месяцев, затем каждые 2- 3 мес. течение 12- 18 месяцев.
Обострение УП на фоне снижения дозы ГК:
ЦФ внутрь 1- 2 мг/кг/сутки (не более 200 мг/сутки) в течение 10- 14 суток, скорость последующего снижения дозы определяется клинической картиной и данными лабораторных анализов.
Поддерживающяя терапия :
ПЗ внутрь 5- 10 мг однократно утром + АЗА 2 мг/кг/сутки с возможным снижением дозы до 1,5 мг/кг/сутки через год с длительностью поддерживающей терапии не менее 24 месяцев.
Лечение УП, ассоциированного с вирусом гепатита В.
При обнаружении маркёров активной репликации HBV лечение включает противовирусную терапию в комбинациии со средними дозами ПЗ и повторными сеансами плазмафереза. Применение высоких доз цитостатиков, способствующих усилению репликации вируса гепатита В и потенциально обладающих гепатотоксическим действием, противопоказано при серологических признаках активной репликации HBV или нарушении функций печени.
Показаниями к лечению УП противовирусными препаратами являются:
· наличие очевидных признаков активной вирусной инфекции (у HBeAg- позитивных больных: HBV DNA > 10 5 копий /мл; при отсутствии HBeAg: HBV DNA > 10 4 копий /мл);
· креатинин сыворотки крови 1 этап комбинированной терапии (первые 2 недели) :
ПЗ 1 мг/кг/сутки (не более 80 мг) однократно утром, через неделю быстрое снижение дозы (если возможно до отмены).
или:
МП в/в 15 мг/кг/сутки (не более 1 г) в течение 3 дней с последующим назначением ПЗ внутрь 1 мг/кг/сутки (не более 80 мг) однократно утром с быстрым снижением дозы через неделю (если возможно до отмены).
2 этап комбинированной терапии:
Противовирусные препараты назначают исходя из вирусологических, иммунологических и других объективных параметров в каждом конкретном случае. Арсенал средств лечения хронической инфекции гепатита В постоянно расширяется, перспективно использование комбинированной терапии (2 или 3 противовирусных препарата, включая интерфероны). Использование монотерапии ламивудином (особенно у пациентов с избыточной массой тела и у мужчин) может способствовать появлению новых, устойчивых к ламивудину, штаммов вируса гепатита В, провоцирующих обострение УП. С применением ламивудина может быть связано развитие интерстициального нефрита. Интерферон- a назначают в средних дозах (3 млн ЕД в/м 3 раза в неделю на протяжении 6- 12 месяцев). Следует помнить, что лечение интерфероном α в ряде случаев вызывает обострение васкулита, способствует развитию ряда системных проявлений (лихорадка, диспепсия, алопеция, миалгии/миопатия, тиреоидит, депрессия, цитопения).
+
Плазмаферез повторно в течение первых 3 недель- 3 раза в неделю, затем в течение 2 недель- 2 раза в неделю, далее 1 раз в неделю.
+
Нормальный иммуноглобулин человека в/в 0,4- 2 г/кг 1 раз/сутки, 3- 5 суток. Возможно проведение повторных курсов 1 раз в месяц на протяжении 6 месяцев.
+
ПЗ (низкие дозы) при невозможности его отмены.
Лечение артериальной гипертензии при УП :
При тяжёлом течении требуется одновременное назначение нескольких препаратов: ингибиторов АПФ или блокаторов рецепторов ангиотензина ІІ, блокаторов ß- адренорецепторов, которые более эффективны в комбинации с диуретиками и/или блокаторами медленных кальциевых каналов. Стабилизация артериального давления с помощью антигипертензивных лекарств разных групп, назначаемых в различных комбинациях, позволяет затормозить прогрессирование почечной недостаточности, уменьшить риск развития сосудистых катастроф (инфаркт миокарда, инсульт), недостаточности кровообращения.
Поскольку ингибиторы АПФ или блокаторы рецепторов ангиотензина II могут ухудшать функцию стенозированной почки и способствовать развитию почечной недостаточности, лечение этими препаратами требует мониторирования функции почек и их размеров и проведение при возможности повторной ультразвуковой допплерографии для оценки скорости кровотока в кортикальном слое.
Программный гемодиализ:
Необходимости проведения программного гемодиализа не мешает активной патогенетической терапии. При успешном лечении, впоследствии может исчезнуть потребность в гемодиализе.
Хирургическое лечение:
Неотложная хирургическая помощь необходима при разрыве аневризмы сосудов внутренних органов. Показаниями для ангиопластики или хирургического лечения при стенозе почечной артерии являются:
· рефрактерность гипертензии, несмотря на адекватно выбранный режим лечения;
· невозможность лекарственного лечения из- за опасности побочных эффектов;
· стремление сохранить функцию почки.