Что такое периферия у человека
Что такое периферия у человека
Поздняя кожная порфирия — наиболее распространенный тип порфирии. Клиническая картина ограничивается кожными проявлениями (буллезный фотодерматоз). Неврологические расстройства и другие нарушения отсутствуют.
Заболевание обычно манифестирует в среднем и пожилом возрасте (с этим связан термин — «поздняя»). Обычно удается выявить предшествующий или отягощающий фактор: избыток железа в организме, злоупотребление алкоголем, лечение эстрогенами, вирусный гепатит С, ВИЧ-инфекция. Выделяют три формы заболевания: семейную, спорадическую и приобретенную.
Молекулярные основы и патогенез поздней кожной порфирии
Наиболее изучены молекулярные основы семейной поздней кожной порфирии, которая встречается в 25-50% случаев. Заболевание наследуется по аутосомно-доминантному типу. Активность уропорфириногендекарбоксилазы у гетерозигот составляет 50% от нормы, у гомозигот — 3-27%. Фермент кодируется одноименным геном, расположенным на 1-й хромосоме. Характерно снижение активности уропорфириногендекарбоксилазы в печени и других органах и тканях.
Молекулярные основы спорадической поздней кожной порфирии, при которой снижение активности уропорфириногендекарбоксилазы определяется только в печени, в настоящее время недостаточно ясны. Данная форма является приобретенной и не передается по наследству. При молекулярно-генетических исследованиях мутаций гена уропорфириногендекарбоксилазы и его промотора не выявляется.
Кожные проявления обусловлены повышенной концентрацией порфиринов в плазме и коже больных и обусловлены свойством порфиринов создавать эффект флюоресценции при поглощении световых волн диапазона от 400 до 410 нм, одновременно запуская цепь патологических событий, ведущих к гибели клеток кожи.
Клинический дебют заболевания у гетерозигот с дефектом гена уропорфириногендекарбоксилазы или при спорадической форме почти всегда связан с каким-либо фактором, оказывающим повреждающее действие на печеночную ткань.
Избыток железа в организме. Появление симптомов поздней кожной порфирии во многих случаях связано с гемосидерозом печени. В гепатоцитах определяется избыточное количество депозитов железа. Абсорбция железа из кишечника повышена. Появление симптомов порфирии объясняется действием железа на активность уропорфириногендекарбоксилазы. Снижение концентрации железа после повторных флебэктомий или на фоне лечения дефероксамином приводит к ремиссии заболевания.
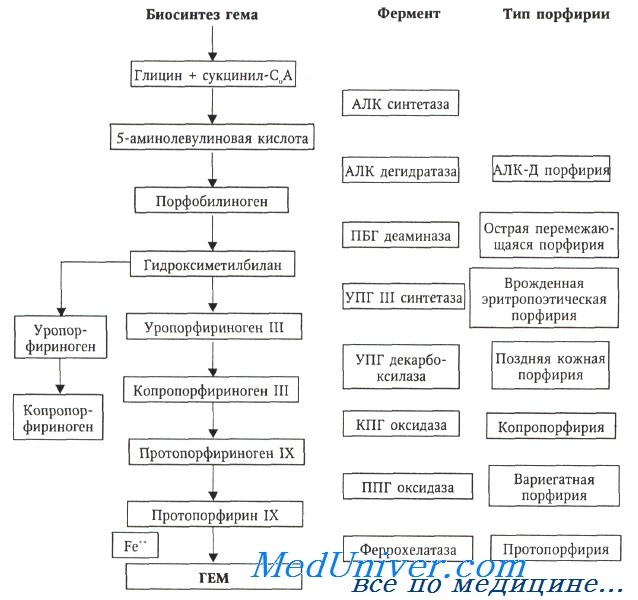
АЛК — 5-аминолевулиновая кислота, ПБГ — порфобилиноген, УПГ — уропорфириноген, КПГ — копропорфириноген, ППГ — протопорфириноген
Алкоголь может провоцировать возникновение заболевания и усугублять его течение. Избыточное потребление алкоголя отмечается у 25-100% больных поздней кожной порфирией. В то же время индуцированные алкоголем заболевания печени редко осложняются порфирией (примерно в 2% случаев). Ассоциация клинических проявлений порфирии и алкоголизма — результат гепатотоксического действия этанола.
Эстрогены. Симптомы порфирии могут появляться у женщин: а) принимающих эстрогены в составе контрацептивов; б) получающих гормональную терапию в постменопаузальном периоде. Редко заболевание проявляется в период беременности.
Каким образом гормоны оказывают влияние на печеночную ткань и способствуют возникновению заболевания, в настоящее время неясно.
Гепатит С. Установлена связь поздней кожной порфирии (семейной и спорадической) с вирусным гепатитом С. У большинства больных симптомы порфирии отсутствуют, однако в некоторых регионах земного шара эта ассоциация достигает 80%. Механизмы, ведущие к возникновению порфирии у этих пациентов, неизвестны.
Хроническая почечная недостатогность. Поздняя кожная порфирия может возникать у больных с хронической почечной недостаточностью, находящихся на программном гемодиализе. Возникновение заболевания в этом случае объясняется двумя основными причинами: 1) избытком железа в организме; 2) плохим выведением циркулирующих в плазме уропорфиринов, которые связаны с белками плазмы.
Клиническая картина поздней кожной порфирии
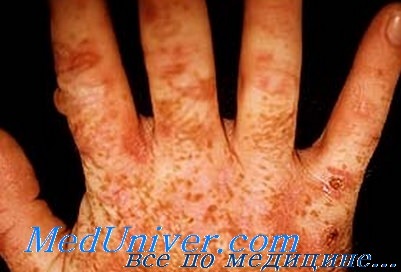
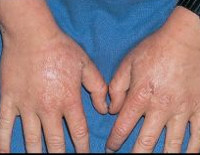
Изменения кожи — основной клинический признак поздней кожной порфирии. Кожа поражается в основном на открытых участках тела (лицо, кисти, голени, стопы). Обычно попадание солнечного света на пораженные участки тела не сопровождается неприятными ощущениями. Жалобы связаны с травматизацией кожи в функционально активных областях кистей и других участков рук, что обусловлено множественными везикулами и буллами с последующей атрофией с зонами гипер- и гипопигментации.
Обычно имеется гипертрихоз лица, особенно заметный у женщин. Возможна гиперпигментация кожи лица, алопеция. Иногда имеются признаки заболевания печени, ассоциирующегося с порфирией, но корреляция между ними отсутствует.
При гомозиготных формах поражение кожи выявляется в возрасте до 5 лет. В таких случаях возможны гепато- и спленомегалия, характерное окрашивание зубов.
Данные лабораторных исследований при поздней кожной порфирии
Выявляется повышенная экскреция порфиринов с мочой. Суточная экскреция уропорфирина составляет около 3000 мкг (в норме — менее 50 мкг). Клинические признаки обычно появляются при экскреции более 1000 мкг уропорфирина в сутки.
Концентрация сывороточного железа и насыщение трансферринов часто повышены. В биоптате печени в большинстве случаев определяются гемосидероз, перипортальное воспаление, фокальные некрозы, жировая дистрофия и фиброз.
Профилактика и лечение поздней кожной порфирии
Следует исключить прием эстрогенов и алкоголя. Полное воздержание от алкоголя может вызывать ремиссию порфирии, ассоциированной с алкогольными заболеваниями печени. Описаны ремиссии заболевания, развившегося на фоне вирусного гепатита С, после лечения интерфероном-а.
Отчетливый терапевтический эффект достигается после уменьшения запасов железа в организме. Для этой цели используется флеботомия (кровопускание). Клинические и биохимические ремиссии удается получить практически у всех пациентов. При отсутствии противопоказаний кровопускание в объеме 500 мл проводится каждые две недели. Клиническая ремиссия обычно достигается при общем объеме кровопусканий около трех литров.
Оптимальным является достижение легкого дефицита железа, когда MCV незначительно снижен, показатель сатурации транс-ферринов плазмы нормальный, а уровень ферритина в пределах 20 мкг/л. Ремиссии длятся годами, а при исключении провоцирующих факторов рецидив вообще не возникает.
Для лечения поздней кожной порфирии может использоваться также делагил (хлорохин). Действие препарата основано на способности образовывать с уропорфирином водорастворимые комплексы, которые выделяются с мочой. Доза делагила составляет 0,5-1,0 г/сут. В связи с гепатотоксичностью и меньшей эффективностью делагил показан пациентам, у которых невозможно проведение кровопусканий.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Порфирия ( Порфириновая болезнь )
Порфирии ‒ большая группа наследственных заболеваний, характеризующихся нарушением биосинтеза гема и накоплением его токсичных метаболитов. Клинические проявления крайне разнообразны – от светочувствительности и кожных высыпаний до болей в животе, полного паралича и острых психозов. Диагностика осуществляется с помощью молекулярно-генетических тестов, специальных лабораторных методов определения порфиринов и их предшественников в моче и кале, оценки активности ферментов в крови. Лечение заключается в мероприятиях, направленных на снижение образования токсических метаболитов, их выведение из крови, проведении симптоматической терапии и хирургических вмешательств.
МКБ-10
Общие сведения
Причины порфирий
В подавляющем большинстве случаев причиной порфирий выступают генетические мутации, обусловливающие неполноценность активности того или иного фермента, участвующего в биосинтезе гема. Исключением является поздняя кожная порфирия (спорадическая форма), которая развивается вследствие заболеваний печени (алкогольный гепатит, вирусный гепатит С) или длительной интоксикации тяжелыми металлами. Наследование порфирий происходит по аутосомно-доминантному или аутосомно-рецессивному типу. Синтезирование гема протекает в 8 последовательных этапов, за каждый отвечает свой фермент, кодируемый определенным геном. Для каждой формы порфирии существует специфичный ферментативный дефект.
Гем представляет собой комплексное соединение порфиринов с двухвалентным железом. Наибольшее количество гема образуется в печени и костном мозге. В печени гем входит в состав белков, участвующих в клеточном дыхании, расщеплении токсичных свободных радикалов и обезвреживании различных ксенобиотиков. В костном мозге гем используется для образования гемоглобина. Результатом сниженной активности ферментов является торможение синтеза гема на определенном уровне, что ведет к накоплению его токсичных промежуточных метаболитов.
Помимо генетической мутации, для развития острых порфирий необходимо воздействие провоцирующих факторов, стимулирующих выработку порфиринов. Такими факторами являются голодание, длительная инсоляция, стрессы, алкоголь, инфекции, интоксикация тяжелыми металлами (ртуть, свинец), лекарственные средства, подвергающиеся метаболизму системой цитохрома P-450 (нестероидные противовоспалительные препараты, антибиотики, антиконвульсанты, оральные контрацептивы, седативные средства). Особую роль играют колебания женских половых гормонов во время менструаций или беременности. У женщин месячные являются наиболее частым провоцирующим фактором, а беременность ассоциируется с тяжелым течением заболевания.
Патогенез
В результате неполноценности ферментов, участвующих в образовании гема, и действия провоцирующих факторов происходит увеличение концентрации его токсичных продуктов обмена. Для хронических порфирий характерно накопление протопорфирина, копропорфирина и упопорфирина. При острых формах возрастает количество порфобилиногена и дельта-аминолевулиновой кислоты (ДАЛК).
Порфирины накапливаются в коже и под действием ультрафиолетового излучения (солнечного света) запускают процесс перекисного окисления липидов, вызывая деструкцию и гибель клеток кожи. Копропорфирин и протопорфирин усиливают пигментацию кожи и ускоряют рост волос (гипертрихоз). Плохо растворимый в воде протопорфирин откладывается в клетках печени, закупоривает портальные тракты и желчные протоки. Отложение уропорфирина в эритроцитах приводит к их ускоренному разрушению в селезенке (гемолиз). Предшественники порфиринов (ДАЛК и порфобилиноген), накапливаясь в нервной ткани, вызывают демиелинизацию и аксональную дегенерацию нервных волокон.
Классификация
В основу разных классификаций порфирий положены различные критерии: клиническая симптоматика, локализация нарушения метаболизма порфиринов или тканевая тропность. Наиболее целесообразно выделять следующие виды порфирий:
Симптомы порфирий
При острых порфириях развиваются сильные боли в животе, задержка стула, учащение сердцебиения, повышение артериального давления, изменение цвета мочи (от розового до красно-бурого). Тяжесть состояния пациента в основном обусловлена неврологическими симптомами – болью по всему телу, снижением чувствительности, прогрессирующей мышечной слабостью, иногда достигающей полного паралича, судорожными припадками, различными психическими расстройствами (тревожность, психомоторное возбуждение, бред, галлюцинации).
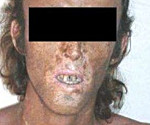
При поздней кожной форме возникает гиперпигментация участков кожи, подвергающихся постоянному воздействию солнечного света (лицо, шея, ушные раковины, верхняя часть груди, кисти рук). Кожа приобретает землистый или бронзовый оттенок. Также характерны гипертрихоз лобно-височной области лица, фотосенсибилизация, проявляющаяся повышенной ранимостью кожи и образованием пузырей с жидкостным содержимым. После вскрытия пузырей формируются эрозии. На местах разрешения эрозий образуются атрофические рубцы.
При эритропоэтических порфириях наблюдаются более выраженные признаки светочувствительности, чем при ПКП (ранимость, пузыри, эрозии). При длительном нахождении на свету появляется покраснение и сильное жжение кожи. Обширные эрозии оставляют после себя грубые рубцы на лице, что приводит к обезображиванию внешнего вида больного. В результате множественных рубцов на коже кистей рук развиваются контрактуры суставов, что значительно затрудняет их движения. Моча становится красной или розовой, а зубы окрашиваются в красно-коричневый цвет (эритродонтия). Из-за увеличенной селезенки могут появиться тяжесть или ноющие боли в левом подреберье. Специфический признак ЭПП – утолщение, огрубение и уплотнение кожи вокруг рта и глаз, на крыльях и спинке носа, на тыльных поверхностях кистей.
Осложнения
Нарушения порфиринового обмена ухудшают течение сердечно-сосудистых заболеваний, неблагоприятно влияют на углеводный метаболизм и повышают риск развития сахарного диабета 2 типа. Острые формы порфирий вследствие выраженной полинейропатии осложняются параличом дыхательной мускулатуры, аспирационной пневмонией, отеком головного мозга, тромбоэмболиями, рабдомиолизом. Постоянные эрозии кожных покровов могут привести к бактериальным инфекциям. При ЭПП из-за отложения нерастворимого в воде протопорфирина может развиться цирроз печени и печеночная недостаточность.
Диагностика
При подозрении на порфирию пациента направляют к врачу-гематологу. При постановке диагноза учитывается наличие заболевания у близких родственников, возраст больного, обстоятельства возникновения симптомов (инсоляция, прием лекарств или алкоголя, голодание, инфекции, менструации, беременность). Лабораторная диагностика порфирий следующая:
Эритропоэтические порфирии дифференцируют с дерматологическими заболеваниями (буллезным пемфигоидом, вульгарной пузырчаткой), с гематологическими патологиями, протекающими со спленомегалией (лейкозами, лимфомами, аутоиммунными гемолитическими анемиями) с болезнями почек. ПКП дифференцируют с заболеваниями печени, гемохроматозом, надпочечниковой недостаточностью. Острые порфирии следует дифференцировать с хирургическими заболеваниями, сопровождающимися сильной болью в животе, неврологическими и психиатрическими патологиями.
Лечение порфирий
Пациентов с острыми и эритропоэтическими порфириями необходимо госпитализировать отделение гематологии. Лечение ПКП возможно как в стационаре, так и в амбулаторных условиях. На сегодняшний день не существует эффективных методов, полностью ликвидирующих нарушения обмена порфиринов. Основной упор делается на патогенетическую и симптоматическую терапию, а также на устранение провоцирующих факторов. Способы лечения зависят от вида порфирий:
Прогноз и профилактика
Сложности диагностики и лечения порфирийной полинейропатии (разбор клинического случая)
Рассмотрена классификация порфирий, описана клиническая картина заболевания, даны подходы к диагностике и сложности лечения (единственным патогенетическим методом лечения являются препараты гема). Приведено подробное описание клинического случая.
Porfirius classification is examined, the clinical picture of disease is described, approaches to diagnostics and complexity of the treatment (only pathogenetic method of treatment they are the preparations of hem) are given. The detailed description of the clinical case is given.
Порфирии — это группа наследственных заболеваний, обусловленных нарушениями синтеза гема с повышением содержания промежуточных продуктов порфиринов в крови и тканях.
Гем является небелковой частью сложных белков гемпротеидов. По биохимическим функциям гемпротеиды делятся на неферментные (гемоглобин, находящийся в эритроцитах крови и клетках костного мозга, около 83%; миоглобин скелетных мышц и сердца, около 17%) и ферментные (цитохромы, каталаза, пероксидаза и др., менее 1%). Биологическая ценность гема состоит в том, что большинству белков, принимающих участие в обмене веществ, гем необходим в качестве простетической группы. Гем играет ключевую роль в связывании и транспортировке кислорода белками (гемоглобин, миоглобин). Гем, содержащийся в ферментах, принимает участие в процессах кумуляции энергии и окислительно-восстановительных процессах в клетках (цитохромы переносят электроны и входят в состав дыхательной цепи митохондрий и цепи микросом, цитохром Р-450 выполняет многочисленные функции, включая детоксикацию в печени; каталазы и пероксидазы участвуют в разложении пероксида водорода).
Характерной особенностью гемпротеидов является обмен небелковой части этих сложных белков. Биосинтез гема проходит восемь этапов; исходными веществами в синтезе служат глицин и сукцинил-КоА. В дальнейшем гем комплексируется с глобином с образованием гемоглобина или миоглобина. При синтезе других гемпротеидов гем соединяется с характерной белковой частью цитохромов и других гемсодержащих ферментов. Если белка недостаточно, чтобы связать образовавшийся гем, то происходит окисление гема с кислородом в гемин (комплекс протопорфирана IX с Fe 3+ ), который угнетает первую реакцию синтеза порфиринов.
Ферменты, участвующие в биосинтезе гема, имеются в костном мозге, ядросодержащих эритроцитах, печени, а также в почках и слизистой кишечника. В связи с чем порфирии подразделяются на эритропоэтические и печеночные в зависимости от ткани, где происходит преимущественное нарушение метаболизма порфиринов.
Классификация порфирий
1. Печеночные формы порфирий:
2. Эритропоэтические формы порфирий:
ОПП самая частая форма порфирий, распространенность в европейских странах составляет 7–12 случаев на 100 000 населения, и, как правило, она наиболее тяжело клинически протекает. У 80% носителей патологического гена ни разу в жизни не возникает каких-либо клинических проявлений (латентная, субклиническая порфирия). Лишь у 20% носителей патологического гена в течение жизни возникают клинически явные приступы ОПП.
Приступы могут спровоцировать: прием лекарственных веществ (в 70% случаев ОПП, перечень лекарств постоянно увеличивается), эндогенные колебания гормонального фона (менструация, беременность), инфекции, оперативные вмешательства, алкоголь, мышьяк, свинец, гипокалорийная низкоуглеводная диета.
Течение приступа ОПП вариабельно. Общая продолжительность приступа колеблется от нескольких дней до нескольких месяцев. Полиневропатия обычно развивается остро или подостро. В большинстве случаев симптоматика достигает максимального развития в течение 1–4 недель, но иногда фаза прогрессирования продолжается до 2–3 месяцев. Прогрессирование происходит непрерывно или ступенеобразно.
Клиническая картина
Первый приступ обычно развивается в возрасте от 15 до 35 лет (значительно реже у детей или лиц старше 50 лет). У женщин клинические проявления возникают примерно в 1,5–2 раза чаще, чем у мужчин. В типичных случаях приступ ОПП начинается с вегетативных симптомов, к ним присоединяются психические расстройства, а затем преимущественно моторная полиневропатия, но процесс может остановиться на любой из этих стадий.
Первым симптомом приступа почти во всех случаях бывает боль в животе. Отмечаются также боли в пояснице и конечностях, которые часто не укладываются в определенные зоны иннервации. Характер и локализация болей варьируют, но иногда бывают столь сильными, что это служит поводом для диагностики почечной колики, острого живота или кишечной непроходимости и проведения лапаротомии. Ошибочной диагностике острого живота может способствовать и часто наблюдающаяся тахикардия. Синусовая тахикардия (до 120–160 уд. в минуту) наблюдается в среднем в 60% случаев и почти во всех тяжелых случаях. У 15–20% больных отмечается субфебрилитет, однако выраженная гипертермия не характерна и, скорее, указывает на развитие интеркуррентной инфекции или абсцесса. Операция, особенно под барбитуровым наркозом, может приводить к быстрому развитию тяжелой полиневропатии.
В 60% случаев отмечается повышение артериального давления (АД) и иногда бывает весьма значительным, приводя к острой гипертонической энцефалопатии. Иногда возникают пароксизмальные нарушения сердечного ритма, которые могут сопровождаться коллаптоидными состояниями.
Те или иные психические расстройства (тревога, депрессия, гипоманиакальное состояние, нарушение сна и другие) развиваются во время приступа у подавляющего большинства больных ОПП. В тяжелых случаях развиваются делирий и угнетение сознания. Иногда психические расстройства бывают единственными или доминирующими проявлениями приступа ОПП. Зачастую на раннем этапе многим больным с порфирией ошибочно ставят диагноз истерии, маниакально-депрессивного психоза, шизофрении, деменции.
У 5% больных развиваются генерализованные судорожные припадки, которые обычно служат неблагоприятным прогностическим признаком. Их причиной, помимо предполагаемого нейротоксического действия предшественников порфиринов, могут быть острая гипертоническая энцефалопатия или гипонатриемия, обусловленная синдромом неадекватной секреции антидиуретического гормона (АДГ). Гипонатриемия возникает во время более трети приступов ОПП. В отдельных случаях наблюдаются мигренеподобные головные боли, преходящие нарушения зрения по типу гемианопсии или корковой слепоты.
Ярким, часто встречающимся маркером острых печеночных порфирий является выделение разных оттенков красной или бурой мочи (порфирины — органические пигменты, имеющие в кислых растворах ярко-пурпурный, а в щелочных — красно-коричневый цвет).
Но наиболее опасные осложнения порфирии связаны с полинейропатией, которая развивается в 10–60% приступов, часто через 2–4 дня после появления боли в животе или психических расстройств. Полинейропатия имеет преимущественно моторный характер — ее основным проявлением служит нарастающий вялый тетрапарез. Симптомы порфирийной полинейропатии отмечаются вариабельностью и динамичностью. В отличие от других аксональных полинейропатий, при порфирии первыми нередко вовлекаются не ноги, а руки (с развитием бибрахиального пареза), причем проксимальные отделы иногда страдают в большей степени, чем дистальные. В тяжелых случаях вовлекаются мышцы туловища, в том числе в 10% случаев — дыхательные мышцы. Поражение черепных нервов с развитием бульбарного синдрома, слабости мимических мышц, глазодвигательных нарушений также происходит лишь в тяжелых случаях и обычно на фоне выраженного вовлечения конечностей.
По мере прогрессирования полинейропатии симптомы раздражения вегетативной нервной системы сменяются симптомами выпадения: ортостатической гипотензией, фиксированным пульсом, ослаблением моторики желудочно-кишечного тракта, тенденцией к гипогидрозу (иногда с эпизодическим профузным потоотделением), затруднениями при мочеиспускании.
У выживших восстановление начинается спустя 2–3 недели после того, как полинейропатия достигает максимума. Полное восстановление наблюдается часто, но может растянуться на несколько лет, в течение которых у больных сохраняются парезы кистей и стоп, вегетативная дисфункция. На фоне восстановления могут происходить рецидивы, часто более тяжелые, чем первый приступ.
Все клинические проявления приступа ОПП объясняются вовлечением вегетативной нервной системы, дисфункцией периферической или центральной нервной системы. Однако механизмы поражения нервной системы остаются неясными. Определенное значение в патогенезе имеют сосудистые и нейроэндокринные нарушения. Аминолевулиновая кислота и порфобилиноген обладают непосредственным тоногенным влиянием на сосудистую стенку и гладкую мускулатуру; а локальный спазм сосудов может приводить к ишемии и сегментарной демиелинизации в периферической и центральной нервной системе. Во время обострения происходит повышение содержания в крови катехоламинов, иногда до уровня, наблюдаемого при феохромоцитоме. ОПП — одна из частых причин синдрома неадекватной секреции АДГ, который связан с поражением гипоталамуса и приводит к гипонатриемии и гипоосмолярности плазмы и, вследствие этого, к выраженным общемозговым проявлениям (угнетению или помрачнению сознания, эпилептическим припадкам). Поражение нервной системы и других органов и тканей также связано с цитотоксическим воздействием избытка порфиринов и их предшественников. С кровью порфирины разносятся по всему организму и попадают в кожу. Там они при инсоляции взаимодействуют с фотонами (фотохимические реакции), передают поглощенную энергию молекулам кислорода с образованием свободных радикалов (в частности, супероксидного радикала) и вызывают фототоксическую реакцию.
Для подтверждения диагноза определяют концентрацию порфиринов в моче и плазме, активность ферментов, участвующих в синтезе гема. Окончательным этапом диагностики больных, особенно асимптомных носителей порфирии и в фазе ремиссии, является проведение ДНК-анализа.
Приводим подробное описание клинического случая
Лечение больных порфирией представляет определенные сложности. Специфическую, патогенетическую, терапию провести невозможно ввиду отсутствия препаратов гема в России, а от введения 40% глюкозы до 1000 мл/сут отказывались врачи-реаниматологи из-за незнания подобной методики лечения и отсутствия опыта. Нейрометаболическая терапия проводилась крайне осторожно и была очень ограничена ввиду большого количества порфириногенных препаратов из числа лекарственных средств, применяемых в каждодневной практике врача. По данным ВОЗ список порфириногенных препаратов ежегодно пополняется. Препараты Актовегин® и Цераксон® одни из немногочисленных лекарственных средств, не входящих в список порфириногенных, и обладают высоким цитопротективным, мембраностабилизирующим и антигипоксантными свойствами по отношению к клеткам как центральной, так и периферической нервной системы. А как уже указывалось выше, все клинические проявления приступа ОПП объясняются дисфункцией периферической (полинейропатия) или центральной нервной системы (острая гипертоническая энцефалопатия). С учетом высокого риска развития у этих больных таких грозных осложнений, как пароксизмальные нарушения сердечного ритма и судорожные эпиприступы, особое значение имеет отсутствие подобных противопоказаний у препаратов Актовегин® и Цераксон®.
Общее состояние больного стабилизировалось, но подтвердить диагноз лабораторно не удавалось в связи с отсутствием методики исследования в г. Ростове-на-Дону. 22.10.00 г., несмотря на положительную неврологическую динамику на фоне неспецифической терапии (Актовегин®, Цераксон®) и энтерального приема глюкозы, отмечалось покраснение мочи. Выполнено исследование мочи (cito) — эритроциты не выявлены, что явилось косвенным подтверждением наличия в моче порфиринов или их промежуточных продуктов метаболизма, приведших к окраске мочи в красный цвет. 29.10.00 г., при непосредственном участии родственников больного, удалось организовать исследование мочи в Гематологическом научном центре РАМН: содержание общих порфиринов 0,31 мг/л (норма до 0,15 мг/л), порфобилиногенов 60,5 мг/л (норма 0–2,0 мг/л), дельта-аминолевулиновой кислоты 21,7 мг/л (норма 0,1–4,5 мг/л).
10.11.00 г. больной переведен в гематологическое отделение Областной клинической больницы № 1 с положительной динамикой — уменьшилась выраженность тетрапареза (мышечная сила в проксимальных отделах рук 2,5–3 балла, в кистях — 4 балла, в проксимальных отделах ног 3–3,5 балла, в стопах — 5 баллов, сухожильные рефлексы с верхних конечностей отсутствуют, появились коленные рефлексы d = s, ахилловы живые с двух сторон), регрессировали тазовые нарушения, дисфония, дыхание самостоятельное адекватное, без участия вспомогательной мускулатуры, уменьшилась дисфагия, вегетативная лабильность (АД 120/80 мм рт. ст., пульс 100 уд. в мин, синкопальных состояний не отмечалось, нормализовалась температура тела), больной самостоятельно передвигается в пределах палаты, сохраняется астенизация. После проведения лечения Нормосангом в дозе 3 мг/кг внутривенно капельно в течение трех дней состояние больного значительно улучшилось, к концу декабря 2010 г. неврологический дефицит практически полностью регрессировал.
Сложности диагностики и лечения данного заболевания состоят в следующем:
Литература
А. К. Григорян
ГБУ РО ОКБ № 2, Ростов-на-Дону