Что такое перинатальная инфекция
Что такое перинатальная инфекция
Перинатальные инфекции: бактериемия и пневмония. В первые дни жизни новорождённого существует лишь несколько характерных клинических симптомов, указывающих на бактериемию: увеличение количества нейтрофилов (этот показатель не всегда диагностически значим), уменьшение содержания тромбоцитов, брадикардия, повышение концентрации С-реактивного белка.
Развитие менингита не считают характерным признаком инфекции. Для установления окончательного диагноза для анализа отбирают кровь, мочу и спинномозговую жидкость, но лечение необходимо начать до получения результатов. Основное направление медикаментозной терапии — эрадикация Escherichia coli и стрептококка группы В (бензилпенициллин в сочетании с гентамицином или цефотаксимом).
В некоторых странах исследование на стрептококк группы В проводят ещё во время беременности и иногда назначают профилактический интранатальный курс антибиотикотерапии пенициллином. В других регионах обследуют только женщин из группы риска.
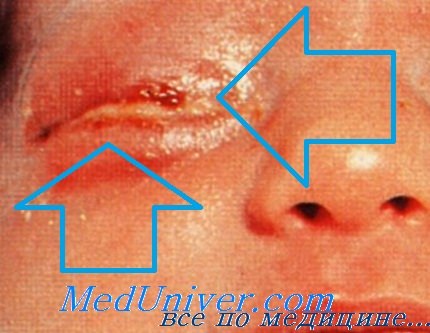
Перинатальные инфекции: гонококковая бленнорея новорождённых. Во время родов может произойти заражение Neisseria gonorrhoeae, вызывающей бленнорею новорождённых (гнойный конъюнктивит). Диагноз устанавливают после микроскопии мазков, окрашенных по Граму. Для лечения системной инфекции применяют пенициллин или цефотаксим (при возникновении устойчивости).
Перинатальные инфекции: хламидиоз. Хламидийная бленнорея новорождённых — тяжелейший конъюнктивит, возникающий в течение первых четырёх дней жизни. На исходе 6-й нед обычно развивается пневмония, характеризующаяся учащением дыхания и кашлем. Для лечения конъюнктивита применяют местные лекарственные средства, содержащие тетрациклин. При хламидийной пневмонии препаратом выбора считают эритромицин.
Перинатальные инфекции: буллёзное импетиго (синдром Лайелла). При заражении Staphylococcus aureus эксфолиативный токсин, вырабатываемый возбудителем, вызывает возникновение поверхностных волдырей или булл, вскрывающихся с образованием обширных зон токсического эпидермального некролиза («синдром ошпаренной кожи»).
Для лечения применяют флуклоксациллин. Мать и ребёнка помещают в отдельный бокс.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Современный взгляд на проблему внутриутробной инфекции
Рассмотрена проблема внутриутробного инфицирования и внутриутробной инфекции (ВУИ) плода, факторы риска внутриутробных инфекций, патогенетические механизмы возникновения, развития и воздействия ВУИ, подходы к диагностике и лечению.
The issue of fetal intrauterine infecting and intrauterine infection (IUI) was considered, as well as the risk factors of intrauterine infections, pathogenic mechanisms of their occurrence, development and effect of IUI, and approaches to the diagnostics and treatment.
Проблема внутриутробной инфекции особо актуальна в современных условиях в связи с распространенностью и тяжестью воспалительных процессов. Проблема внутриутробного инфицирования и внутриутробной инфекции (ВУИ) плода является одной из ведущих в акушерской практике и в перинатологии в связи с высоким уровнем инфицирования беременных, рожениц и родильниц, опасностью нарушения развития плода и рождения больного ребенка. Наличие инфекции у матери является фактором риска ВУИ плода, но не всегда означает его заболевание [1, 5–7, 13].
Внутриутробная инфекция — группа инфекционно-воспалительных заболеваний плода и детей раннего возраста, которые вызываются различными возбудителями, но характеризуются сходными эпидемиологическими параметрами и нередко имеют однотипные клинические проявления. Заболевания развиваются в результате внутриутробного (анте- и/или интранатального) инфицирования плода. При этом в подавляющем большинстве случаев источником инфекции для плода является мать. Истинная частота врожденных инфекций до настоящего времени не установлена, но, по данным ряда авторов, распространенность данной патологии в человеческой популяции может достигать 10%. В структуре перинатальной смертности ВУИ составляет более 30% [1, 5–7].
Кроме этого, ВУИ относятся к тяжелым заболеваниям и во многом определяют уровень младенческой смертности.
Согласно данным многих авторов, причиной внезапной смерти грудных детей является инфекционное заболевание, протекающее без ясной симптоматики. В числе причин или фоновых состояний скоропостижной смерти могут быть ВУИ [2].
Под внутриутробным инфицированием понимают процесс внутриутробного проникновения микроорганизмов к плоду, при котором отсутствуют признаки инфекционной болезни плода. Как правило, инфекционный процесс затрагивает плаценту, в которой развивается плацентит, хориоамнионит и т. д. Диагноз внутриутробного инфицирования у новорожденного устанавливается на основании выделения возбудителя из клеток крови, ликвора и других источников, выявления IgM и низкоавидных IgG в пуповинной крови, а также при морфологическом исследовании плаценты [1, 5–7].
Внутриутробное инфицирование не означает неизбежного развития инфекционного заболевания. Для выявления ВУИ необходимо наличие данных лабораторного исследования в сочетании с клинической картиной инфекционного заболевания. Под ВУИ подразумевают не только процесс распространения инфекционных агентов в организме плода, но и вызванные ими морфофункциональные нарушения различных органов и систем, характерные для инфекционной болезни (сепсис, пневмония, менингит, гепатит и т. д.), возникшей анте- или интранатально и выявляемой пренатально или после рождения [10, 11].
Инфекционно-воспалительные заболевания во время беременности имеют особенности: инфицирование плода и новорожденного может быть вызвано как острой инфекцией матери, так и активацией хронической, персистирующей инфекции во время беременности; большая часть заболеваний беременных, приводящих к внутриматочной инфекции, протекает в латентной или субклинической форме; активация персистирующей инфекции возможна при любом нарушении гомеостаза в организме беременной (стресс, острые респираторные вирусные инфекции, переохлаждение и др.) [1, 2].
Зачастую ВУИ ассоциируются с наличием инфекций TORCH — то есть синдромом комплекса. Данный термин образован первыми буквами латинских названий наиболее часто верифицируемых врожденных инфекций: T — токсоплазмоз (Тoxoplasmоsis), R — краснуха (Rubella), С — цитомегалия (Cytomegalia), Н — герпес (Herpes) и О — другие инфекции (Оther). К последним относят сифилис, листериоз, вирусные гепатиты, хламидиоз, ВИЧ-инфекцию, микоплазмоз и др. [9, 11].
Принимая во внимание, что источником инфекции для плода всегда является его мать, особое значение приобретают следующие факторы риска внутриутробных инфекций:
Патогенетические механизмы возникновения, развития и воздействия ВУИ разнообразны и зависят от многих факторов:
Влияние инфекции на эмбрион и плод заключается в воздействии комплекса следующих факторов:
Таким образом, реализуется ли внутриутробное инфицирование в ВУИ или нет, зависит от ряда факторов, которые мы представили выше.
Учитывая неспецифичность клинических проявлений ВУИ во время беременности, диагностика данной патологии в большинстве случаев затруднена и возможна лишь в результате сочетания клинических и лабораторно-диагностических методов обследования.
Клинический метод исследования позволяет выявить различные осложнения гестационного периода, такие как невынашивание беременности и синдром задержки роста плода (СЗРП). Кроме этого, немаловажное значение имеет наличие проявлений инфекции у матери (отит, гайморит, пиелонефрит, цистит и т. д.).
Методы, позволяющие оценить состояние фетоплацентарной системы:
Микробиологические и серологические исследования:
Исследование хориона (биопсия хориона): бактериологический метод, ПЦР-диагностика.
Исследование околоплодных вод (амниоцентез): бактериологический метод, ПЦР-диагностика.
Исследование пуповинной крови плода (кордоцентез): бактериологический метод, ПЦР-диагностика и специфический иммунный ответ (IgM) плода.
Морфологическое исследование плаценты, данные аутопсии.
Клиническая оценка состояния новорожденного («незрелость» при доношенном сроке беременности, манифестация инфекционного заболевания, врожденные пороки развития) [1, 9, 11, 14, 15].
Предположительный диагноз внутриутробного инфицирования и ВУИ помогают поставить косвенные методы:
К прямым методам диагностики внутриутробного инфицирования и ВУИ относятся: выявление возбудителя в материале, полученном при биопсии хориона, амниоцентезе (ПЦР, бактериологический метод), кордоцентезе (ПЦР, бактериологический метод и определение уровня специфических IgM).
Характер течения беременности при внутриутробной инфекции зависит от срока воздействия возбудителя.
На ранних этапах зародыша (1–3 недели беременности) из-за отсутствия механизмов взаимодействия инфекционного агента и плодного яйца реализации воспалительной реакции чаще всего не происходит. Контакт с инфекцией может закончиться альтернативным процессом и гибелью плодного яйца. Повреждение эмбриона инфекцией на 4–12 неделях беременности связано с вирусной инфекцией, проникновением микроорганизмов через хорион. Плод еще не имеет защитных механизмов. Нарушение закладки органов и систем вызывает тератогенный и эмбриотоксический эффект [13, 15].
В I триместре беременности специфических клинических признаков наличия ВУИ нет, косвенно о ней свидетельствуют некоторые эхографические признаки:
Инфекционные фетопатии возникают с 16-й недели, когда происходит генерализация инфекции у плода. Могут возникать такие пороки развития, как фиброэластоз эндокарда, поликистоз легких, микро- и гидроцефалия (ранние фетопатии) [12–15].
В III триместре плод реагирует на внедрение возбудителя локальной реакцией. Могут возникнуть энцефалит, гепатит, пневмония, интерстициальный нефрит. Влияние вирусов чаще всего проявляется признаками незрелости, дисэмбриогенетическими стигмами, затяжным адаптационным периодом, значительной потерей массы тела в раннем постнатальном периоде. Данные эхографии во II и III триместрах беременности, указывающие на развитие инфекции у плода:
После верификации диагноза ВУИ лечебные мероприятии проводят с помощью этиотропной, антимикробной терапии: препараты пенициллинового ряда и макролиды. Целесообразность назначения антимикробных препаратов не вызывает сомнения, если ВУИ обусловлено наличием патогенных возбудителей (бледная спирохета, токсоплазма, хламидии, гонококк и т. д.) [8, 14].
В настоящее время одним из наиболее дискутабельных вопросов в акушерстве является выяснение истинной этиологической роли генитальных микоплазм (Mycoplasma hominis, Mycoplasma genitalis, Ureaplasma urealyticum) в развитии патологии матери и плода. Инфицирование плода генитальными микоплазмами происходит преимущественно интранатально: в 18–55% — у доношенных новорожденных и в 29–55% — у недоношенных [3, 16, 20].
Актуальность проблемы урогенитального микоплазмоза обусловлена не только значительным распространением этой инфекции в популяции, но и неоднозначностью ее оценки как эпидемиологами, так и клиницистами [16].
По данным различных исследователей, микоплазмы являются возможной причиной развития конъюнктивитов, врожденных пневмоний, респираторного дистресс-синдрома, хронических заболеваний легких, менингита и неонатального сепсиса. Вопрос о терапии микоплазменной инфекции до настоящего времени остается открытым. В схемах терапии предусматривается 7–10-дневные курсы макролидов [1, 3, 21, 22].
Во время беременности противовирусная терапия при генитальном герпесе, цитомегаловирусной инфекции, вирусе ветряной оспы проводится с помощью этиотропных препаратов (ацикловир) начиная со II триместра гестационного периода. Целью лечения является профилактика рецидивирования и антенатального инфицирования [14, 17, 19].
Трихомонадная инфекция относится к группе негонококковых воспалительных заболеваний мочеполовых органов. Лечение трихомониаза во время беременности осуществляется с помощью метронидазол-содержащих препаратов начиная со II триместра гестационного периода [8].
Появление новых методов диагностики, разработка и внедрение новых лекарственных средств не изменяют ситуацию с внутриутробными инфекциями, оставляя это по-прежнему актуальной проблемой в акушерстве. Все это обуславливает неуклонный рост инфекции в человеческой популяции, высокий процент рецидивов инфекции даже у пациентов, получавших курс антибиотикотерапии в соответствии с действующими инструкциями и схемами лечения. Проблема осложняется тем, что в настоящее время отсутствует единая концепция механизма рецидивирования, недостаточно изучена роль микст-инфекции в возникновении, течении и персистировании инфекции, не учитываются особенности гормонального и иммунного статуса больного, не сформированы диагностические критерии контроля излеченности патологического процесса. Это все вместе взятое является стимулом для продолжения исследований, направленных на решение данных проблем. Несмотря на то что роль вирусных и бактериальных инфекций в этиологии и патогенезе многих патологических процессов не вызывает сомнений, вопрос о значении инфекций в качестве моновозбудителя на сегодняшний день окончательно не решен. Актуальным по-прежнему остается вопрос разработки алгоритма лабораторной диагностики заболеваний.
Только совершенствование диагностических подходов, разработка оптимальных алгоритмов и методов обследования и предупреждение распространения резистентных штаммов путем адекватного отношения к каждому пациенту индивидуально (обязательное проведение посевов на определение чувствительности к антибиотикам до назначения терапии) может изменить данную ситуацию.
Исследование выполнено за счет гранта Российского научного фонда (проект № 15-15-00109).
Литература
ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
Динамика активности персистирующих инфекций
На основании собственных многолетних данных произведен ретроспективный анализ особенностей динамики активной репликации персистирующих инфекций у детей. В статье описано, как изменяются показатели активной репликации геномов облигатных внутриклеточных пар
Based on our own multi-year data, a retrospective analysis of the dynamics of active replication of persistent infections in children was made. The article describes how the indicators of active replication genomes of obligate intracellular parasites and herpesviruses vary with age and seasonal changes.
Персистирующие инфекции могут являться причиной целого ряда заболеваний. Некоторые из них характеризуются тяжелым клиническим течением, особенно в раннем возрасте. В России, к сожалению, сохраняется высокий уровень детской инфекционной заболеваемости [1]. Известно, что в основном передача инфекции осуществляется в первые годы жизни человека, иногда — внутриутробно. Так, заражение герпес-вирусами человека 1–2, а также 4–6 типов в большинстве случаев реализуется в возрасте до двух лет. Источником инфекции чаще всего является ближайшее окружение ребенка, которое в первые два года его жизни представлено членами семьи и/или обслуживающим персоналом (няни, воспитатели и пр.). За последние пять лет увеличилось число детей в возрасте до одного года, умерших от генерализованных вирусных инфекций [2]. При этом, по данным литературы, у детей маркеры активной персистирующей инфекции выявляют чаще, чем у взрослых [3]. Одним из факторов, обусловливающих высокий уровень репликации инфекционных агентов, является незрелость иммунной системы в раннем возрасте [4]. Несмотря на обилие научных работ, посвященных проблеме персистирующих инфекций, вопрос особенностей динамики их активности остается открытым.
Объект и материалы исследования
Предметом анализа явились данные, полученные при обследовании детей и подростков, находившихся на стационарном лечении в клинике Московского НИИ педиатрии и детской хирургии (в последние годы — Обособленное структурное подразделение Научно-исследовательский клинический институт педиатрии им. акад. Ю. Е. Вельтищева ФГБОУ ВО РНИМУ им. Н. И. Пирогова) Минздрава РФ, и их родителей.
Проанализированы результаты обследования 1079 пациентов, из которых 1064 (98,6%) составили дети и подростки в возрасте от 2 месяцев до 17 лет и 15 (1,4%) взрослых в возрасте от 23 до 52 лет.
У каждого пациента одновременно исследовали от одного до трех образцов различных биологических материалов, всего 2051 образец. Из них осадков мочи — 877 (42,8%); буккальных соскобов — 104 (5,1%); объединенного материала, включающего осадок мочи и буккальный соскоб, — 901 (43,9%); крови — 169 (8,2%) (табл. 1).
Методы исследования
ДНК персистирующих инфекций в исследованных материалах выявляли посредством полимеразной цепной реакции, при постановке которой использовали полные наборы реактивов (kits) для лабораторной диагностики in vitro производства «ВСМ», «Диасан» и «Гентех», г. Москва, Россия. Использовали моноспецифические наборы, укомплектованные нелиофилизированными супермиксами, готовыми к употреблению, замороженными и хранившимися при температуре от –25 до –28 °С. По нашим данным, использование именно таких наборов позволяет достичь наиболее качественных результатов.
Оценивали активность репликации следующих микроорганизмов: Chlamydia trachomatis, Mycoplasma hominis, Ureaplasma urealyticum, цитомегаловирус, вирус Эпштейна–Барр, вирус простого герпеса 1–2 типов.
Среди пациентов девочки и женщины составили 56,7% от числа обследованных, мальчики и мужчины — 43,3%.
Возрастная характеристика пациентов отражена в табл. 2: возраст большинства пациентов составил от двух до 16 лет.
При определении периодов активной репликации персистирующих инфекций в зависимости от возраста фрагмент исследования включал данные, полученные при обследовании 876 пациентов.
Основным критерием отбора явилось одновременное исследование в материале не менее 3 инфекций (герпес-вирусов 4–6 типов и/или облигатных внутриклеточных паразитов). У каждого больного, соответственно, исследовали 3 или 6 инфекций. Такой подход позволил снизить избирательность выборки по той или иной инфекции.
Результаты исследования и их обсуждение
Выявлены следующие закономерности (рис. 1):
Отчетливая закономерность показана для цитомегаловируса: частота выявления ДНК в образцах стабильно снижается до 0 у обследованных взрослых, что можно рассматривать как доказательство зависимости активной репликации цитомегаловируса именно от зрелости иммунной системы (рис. 2).
Аналогичные, хотя и не столь четко выраженные изменения частоты активной репликации в зависимости от возраста можно проследить и для вирусов Эпштейна–Барр и вируса простого герпеса 1–2 типов.
Для ответа на вопрос, существуют ли сезонные изменения активности персистирующих инфекций, мы проанализировали частоту положительных проб в течение двух полных лет; был обследован 871 пациент.
Диаграмма отражает закономерности изменения количества положительных проб Chlamydia trachomatis, Mycoplasma hominis и Ureaplasma urealyticum в течение года (рис. 3).
Вопреки ожиданиям, наибольшая активность Chlamydia trachomatis приходится на период с апреля по июнь. Отмечаются существенные колебания показателя в первом полугодии с максимумом в июне и минимумом в марте и стабильно низкие показатели во втором полугодии.
Период наибольшей репликационной активности Mycoplasma hominis зарегистрирован с марта по июнь. В целом в течение всего первого полугодия регистрируется высокий уровень положительных проб, за исключением февраля. Во втором полугодии число положительных проб снижается и остается стабильным в течение всего периода, за исключением октября.
Частота выявления ДНК Ureaplasma urealyticum крайне нестабильна с декабря по июнь, а в июле резко уменьшается и сохраняется на относительно низком уровне до ноября. В декабре значение показателя возрастает, достигая максимума. Таким образом, общим для исследованных внутриклеточных паразитов является нестабильность и более высокие значения показателя в первом полугодии (для Ureaplasma urealyticum — с декабря по июнь) и, напротив, относительно низкое и стабильное число положительных проб во втором полугодии. Не исключено, что снижение и стабилизация показателя в период с июля по декабрь вызвана улучшением метаболизма, а значит, и адаптивного иммунитета во второй половине лета и осенью.
Для персистирующих герпес-вирусов какой-либо четкой сезонной закономерности не выявлено, однако частота выявления ДНК вируса простого герпеса 1–2 типов стабильно повышается, в мае достигая максимума, а затем снижается к концу года до минимального значения (рис. 4).
Выводы
Проведенное нами исследование позволило сделать следующие выводы:
При исследовании сезонной активности всех облигатных внутриклеточных паразитов выявлена ее существенная вариативность в первом полугодии с максимумом в июне и относительное снижение и стабилизация во втором полугодии.
Литература
ФГБОУ ВО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
Динамика активности персистирующих инфекций/ Е. И. Шабельникова, В. С. Сухоруков, Е. А. Ружицкая, А. В. Семенов, М. В. Кушнарева
Для цитирования: Лечащий врач № 5/2018; Номера страниц в выпуске: 68-71
Теги: вирусная инфекция, активная репликация геномов, облигатные внутриклеточные паразиты
Пренатальная вирусная инфекция
УЗИ сканер RS80
Эталон новых стандартов! Беспрецедентная четкость, разрешение, сверхбыстрая обработка данных, а также исчерпывающий набор современных ультразвуковых технологий для решения самых сложных задач диагностики.
Различают внутриутробную инфекцию и внутриутробное инфицирование плода и новорожденного. При этих состояниях заражение происходит во время беременности или в родах, и его источником является мать. Внутриутробное инфицирование плода характеризуется только тем, что в организм плода проникает возбудитель инфекции, но плод при этом не заболевает, что, вероятно, связано с активацией защитных механизмов в системе мать-плацента-плод. При внутриутробной инфекции вследствие инфицирования развивается заболевание с соответствующими клиническими проявлениями и поражением плода и новорожденного. При этом внутриутробная инфекция занимает одно из ведущих мест в структуре причин перинатальной заболеваемости и смертности плода и новорожденных. Характер клинических проявлений и тяжесть течения заболевания зависят от вида возбудителя, его активности, массивности заражения, путей проникновения инфекции в организм беременной и степени выраженности защитных сил ее организма.
При внутриутробном инфицировании, которое происходит в первые 3 месяца беременности, возникают истинные пороки развития, формируется первичная фетоплацентарная недостаточность, неразвивающаяся беременность, происходят самопроизвольные выкидыши. При развитии внутриутробной инфекции после 3 месяцев беременности формируется внутриутробная задержка развития, вторичная фетоплацентарная недостаточность, отмечаются признаки инфекционного поражения плода. Наиболее характерными клиническими симптомами внутриутробной инфекции являются: многоводие или маловодие, стойкая тахикардия у плода, задержка развития плода, нарушение его дыхательной и двигательной активности.
В диагностике внутриутробного инфицирования используют иммунологические тесты для выявления специфических антител к возбудителям, культуральный метод (посев), а также метод полимеразной цепной реакции (ПЦР). Для исследования используют кровь и материал, взятый из влагалища и из канала шейки матки. В ряде случаев для исследования используют околоплодные воды, полученные путем амниоцентеза. Для диагностики широко используется также и ультразвуковое исследование. Остановимся на наиболее типичных вирусных заболеваниях эмбриона и плода.
Краснуха
Вирус краснухи представляет, пожалуй, наибольшую опасность для эмбриона и плода с точки зрения возникновения аномалий развития и существенного повреждения плода. Риск заражения краснухой беременной отмечается при отсутствии в крови матери антител к вирусу краснухи. Если заболевание краснухой происходит в первые 2 месяца беременности, то вероятность инфицирования эмбриона достигает 80 %, а возникновение аномалий развития возможно с вероятностью 25%. Заражение эмбриона вирусом краснухи может привести к его гибели или приводит к формированию врожденных пороков сердца, глухоты, катаракты, микроофтальмии, хориоретинита и микроцефалии. Инфицирование плода в более поздние сроки может сопровождаться появлением у новорожденного типичных кожных высыпаний, которые исчезают через некоторое время.
Принимая во внимание высокий риск возникновения аномалий развития при заболевании в первые 2-3 месяца беременности, ее необходимо прерывать. Ребенок, который родился у женщины, перенесшей во время беременности краснуху, сам является носителем вируса, и поэтому необходима его изоляция. В случае контакта беременной с больным краснухой, если она не болела ею ранее, необходима вакцинация, но не ранее 8-10 недели беременности, так как с этой целью используют живую ослабленную вакцину, и возможно негативное влияние на эмбрион.
Цитомегаловирус (ЦМВ)
Цитомегаловирус (ЦМВ) является одним из наиболее распространенных вирусов, передающихся плоду. При заражении ЦМВ велика вероятность неразвивающейся беременности, самопроизвольного ее прерывания, преждевременных родов, гибели плода, аномалий его развития. Выявление ЦМВ в организме беременной еще не означает наличия у нее острого заболевания, так как в большинстве случаев имеет место только бессимптомное вирусоносительство или субклиническая хроническая инфекция. У 10-20 %, у которых выявляются в крови специфические антитела к ЦМВ, может возникать обострение заболевания, а развитие внутриутробной инфекции только у 1-2 % среди этих беременных. Заражение ЦМВ впервые происходит у 1-4% беременных, и соответственно у 40-50% из них возникает риск развития внутриутробной инфекции.
Летальность при врожденной ЦМВ-инфекции достигает 20-30 %. У 90 % выживших детей отмечаются такие поздние осложнения, как потеря слуха, задержка умственного и физического развития, атрофия зрительного нерва, дефекты роста зубов и т.д. При ведении беременных с ЦМВ специфический противовирусный препарат ацикловир применяют только по строгим жизненным показаниям, обусловленным состоянием матери и новорожденного. Возможно также применение иммуномодуляторов на основе рекомбинантного альфа-2 интерферона, который вводят в виде свечей в прямую кишку в течение 10 дней.
Вирус простого герпеса (ВПГ)
Метод родоразрешения зависит от наличия или отсутствия поражения половых органов в конце беременности, выделения вируса герпеса и времени, прошедшего с момента разрыва плодных оболочек. При выявлении признаков свежего герпетического поражения половых органов незадолго до родов целесообразно провести родоразрешение путем кесарева сечения. В послеродовом периоде рекомендуется обязательное грудное вскармливание новорожденных вне зависимости от вида герпетической инфекции у матери, так как грудное молоко является источником противогерпетических антител, даже при выявлении в нем антигена ВПГ.
Вирусный гепатит
Вирусный гепатит представляет собой тяжелое заболевание печени. В зависимости от разновидности вируса вызывающего гепатит, различают следующие их типы: гепатит А, гепатит В, гепатит С, гепатит D, гепатит Е, гепатит F и гепатит G.
Гепатит А. Заболевание вызывается РНК-содержащим вирусом. Инфекция к матери передается фекально-оральным путем. Заражение плода происходит редко. Заражение новорожденного происходит при кормлении грудью в период нахождения вируса в крови у пациентки. Инкубационный период составляет 15-45 дней. У беременной заболевание протекает обычно в легкой или в среднетяжелой форме. Отмечается тошнота, рвота, увеличение печени, желтуха, боль в правом подреберье. В связи с тем, что вирус гепатита А не проникает через плаценту, он не приводит к возникновению пороков развития у плода. Острый вирусный гепатит А излечивается после короткой вирусемической фазы, не переходит в хроническую форму и не вызывает цирроз печени. Диагностику острого гепатита А проводят путем определения специфических антител в крови, которые выявляются уже через 2 недели после инфицирования. Лечение гепатита А проводят по общетерапевтическим, симптоматическим критериям. В случае контакта беременной с больным гепатитом А с профилактической целью вводят g-глобулин.
Гепатит В в настоящее время представляет одну из важных проблем здравоохранения, что связано с увеличением частоты заболевания и с развитием неблагоприятных исходов в виде формирования хронического гепатита, цирроза печени и гепатоцеллюлярной карциномы. Возбудителем гепатита В является ДНК-содержащий вирус. Предполагается, что этот вирус является онкогенным. У беременных регистрируется 1-2 случая острого гепатита В на 1000 беременностей и 5-15 случаев хронического гепатита В. Источником инфекции являются больные с острым и хроническим гепатитом и вирусоносители. Передается вирус при переливании крови и препаратов крови, при половых контактах. Также возможно заражение при тесных бытовых контактах (использование общих зубных щеток, расчесок, носовых платков) и при использовании плохо обработанных медицинских инструментов.
При гепатите В отмечается повышенная частота преждевременных родов и самопроизвольных абортов, число преждевременных родов возрастает втрое. У большинства инфицированных детей острый гепатит В протекает в легкой форме. В подавляющем большинстве случаев (90 %) у детей в последующем развивается состояние хронического носительства вируса с риском последующей передачи инфекции. Имеет место также и риск последующего возникновения первичной карциномы или цирроза печени.
Диагностика гепатита В основана на выявлении в крови пациентки различных антигенов и антител к вирусу. При развитии острого гепатита В во время беременности терапия состоит из поддерживающего лечения (диета, коррекция водно-электролитного баланса, постельный режим). При развитии коагулопатии переливается свежезамороженная плазма, криопреципитат. Беременным с различными формами гепатита В следует избегать проведения различных инвазивных процедур во время беременности и в родах. Следует также стремиться к уменьшению продолжительности безводного промежутка и родов в целом.
Гепатит С характеризуется тенденцией к развитию хронического процесса, ограниченными клиническими симптомами и плохой реакцией на противовирусную терапию. В последствии высока вероятность развития гепатоцеллюлярной карциномы.
Возбудителем гепатита С является РНК-содержащий вирус. Источниками инфекции являются больные с хронической и острой формами гепатита С, а также латентные носители вируса. Вирус передается при трансфузии зараженной крови или ее компонентов. Контактно-бытовой и половой пути заражения являются довольно редкими. Основным путем инфицирования детей является вертикальный путь передачи инфекции от матери. Инкубационный период составляет в среднем 7- 8 нед. Заболевание делится на три фазы: острую, латентную и фазу реактивации. Острая фаза в большинстве наблюдений протекает без клинических проявлений и приблизительно в 60-85 % случаев переходит в хроническую форму гепатита с риском развития цирроза печени и гепатоцеллюлярной карциномы.
Острый гепатит С как латентный, так и клинически проявляющийся в 30-50 % случаев может закончиться выздоровлением с полной элиминацией НСV. Однако в большинстве случаев он сменяется латентной фазой В период латентной фазы инфицированные лица считают себя здоровыми и никаких жалоб не предъявляют. Фаза реактивации соответствует началу новых клинических проявлений гепатита С с последующим развитием хронического гепатита, цирроза печени и гепатоцеллюлярной карциномы.
Вакцины от гепатита С на сегодняшний день не существует. Всем беременным проводится обязательное скрининговое обследование на гепатит С трижды за беременность. Несмотря на то, что возможна вертикальная передача вируса плоду, гепатит С не является противопоказанием к беременности. Риск заражения плода гепатитом С не зависит от времени заражения матери и составляет около 6%. Передача вируса возможна как во время беременности, так и во время родов.
Нет единого мнения об оптимальном способе родоразрешения беременных с гепатитом С. Некоторые специалисты считают, что кесарево сечение снижает риск инфицирования плода, тогда как другие отрицают это. Преждевременный разрыв плодного пузыря и длительный безводный промежуток увеличивает риск передачи инфекции.
Вирус гепатита С обнаруживается и в грудном материнском молоке, и в этой связи нет также единого мнения о безопасности грудного вскармливания. У всех детей, рожденных от матерей с гепатитом С, в крови также будут отмечаться антитела к вирусу в течение первых 12 мес жизни. Если антитела сохраняются более чем через 18 мес после рождения, то это является подтверждением инфицированности ребенка гепатитом С.
Гепатит D. Возбудителем заболевания является вирус гепатита D, который представляет собой дефектный РНК-содержащий вирус, который способен производить репликацию только с помощью HBsAg-антигена вируса гепатита В. Инфекция передается при трансфузии крови или ее компонентов, а также половым путем. Инфицирование плода происходит вертикальным путем. Диагностика вирусного гепатита D основывается на выявлении антител в сыворотке крови. При инфицировании у новорожденного развивается хронический гепатит D с высоким риском цирроза печени. При гепатите D беременную следует иммунизировать по схеме вакцинации как при гепатите В. Лечение заболевания проводится в рамках общетерапевтических мероприятий.
Гепатит Е. Возбудителем инфекции является РНК-содержащий вирус, который распространяется фекально-оральным путем и вызывает острый гепатит. К плоду вирус попадает путем вертикальной передачи. При гепатите Е повышена частота самопроизвольных выкидышей. Диагноз заболевания основан на прямом выявлении вируса и определении специфических антител. Лечение острого гепатита Е проводят по общим принципам симптоматической терапии.
Гепатит G. Отмечается высокий инфекционный риск для новорожденного при данном заболевании. При наличии гепатита G у беременных в 33 % имеется вертикальная передача плоду и новорожденному. Однако у новорожденных до настоящего времени пока ни в одном случае не было выявлено клинических симптомов гепатита. НЕ обнаружено также наличие вируса в молоке, однако по аналогии с гепатитом С целесообразно воздержаться от кормления ребенка грудью. Диагноз устанавливают путем выявления вируса методом ПЦР. Лечение и профилактика острой и хронической форм вирусного гепатита G до сих пор окончательно не разработаны.
Грипп
Грипп, который может протекать у беременных в тяжелой форме, способен приводить к поражению эмбриона и плода. При данном заболевании может происходить самопроизвольное прерывание беременности, гибель плода, аномалии его развития. В результате инфекции возможно рождение недоношенных и функционально незрелых детей, а также детей с недостаточной массой тела.
Влияние вируса гриппа при внутриутробной инфекции обусловлено воздействием возбудителей на плаценту и плод, а также выраженной интоксикацией, повышенной температурой тела, нарушением маточно-плацентарного кровообращения с развитием в последующем гипоксии плода. Во время вспышек гриппа беременных следует иммунизировать поливалентной убитой вакциной.
Парвовирусная инфекция
Диагностика осуществляется путем использования ПЦР. Обнаружение специфических антител к вирусу в крови подтверждает диагноз. Обнаружение и IgG, и IgМ свидетельствует об острой инфекции, обнаружение только IgG подтверждает перенесенную в прошлом парвовирусную инфекцию. Специфического лечения заболевания не существует. Внутриматочную терапию концентратом эритроцитов проводят при уровне гемоглобина меньше 80 г/л. Перед лечением берут пробы крови с целью выявления ДНК парвовируса.
Коксаки-вирусная инфекция
При коксаки-вирусной инфекции внутриутробное инфицирование в I триместре беременности происходит редко. Однако, если это происходит, то могут сформироваться пороки развития желудочно-кишечного тракта, мочеполовой системы и центральной нервной системы. При инфицировании в поздние сроки беременности у новорожденного возможны такие проявления, как: лихорадка, отказ от еды, рвота, кожные высыпания, судороги. У некоторых новорожденных может отмечаться отит, назофарингит, пневмония.
ВИЧ-инфекция
Течение ВИЧ-инфекции во время беременности может усугубляться в связи с естественным ослаблением иммунной защиты организма беременной. Наиболее частыми и выраженными осложнениями при ВИЧ-инфекции во время беременности являются: генитальный кандидоз; цервикальная неоплазия; преждевременные роды; преждевременный разрыв плодного пузыря; задержка развития плода; хориоамнионит. Наиболее опасным осложнением беременности является инфицирование плода ВИЧ-инфекцией, которое наблюдается в 30-60 % случаев независимо от наличия симптомов заболевания у матери. Заражение ВИЧ может происходить во время беременности, в родах и в послеродовом периоде. При этом возможны 3 пути переноса вируса к плоду.
Инфекция к плоду может передаваться через плаценту при ее повреждении вследствие фетоплацентарной недостаточности или при отслойке плаценты. Инфицирование возможно также при первичном заражении плаценты и накоплении вируса в клетках Гофбауэра с последующим размножением вируса и переходом его к плоду. Инфицирование плода может происходить и в родах при контакте слизистых оболочек плода с инфицированной кровью или выделениями родового канала. После родов инфицируется от 15 до 45 % детей от ВИЧ-инфицированных матерей. Большинство из этих женщин не знают о наличии у себя инфекции и в основном инфицируют детей при грудном вскармливании.
Заражение ВИЧ-инфекцией плода или новорожденного приводит к развитию у него иммунодефицита, который отличается от такового у взрослых. До 5 лет жизни СПИД развивается у 80 % детей, инфицированных ВИЧ во время беременности. Первыми признаками внутриутробной ВИЧ-инфекции являются недостаточная масса тела, гипотрофия и различная неврологическая симптоматика. Вскоре после рождения присоединяются: упорный понос, лимфаденопатия, увеличение печени и селезенки, грибковое поражение ротовой полости, задержка развития. Часто отмечаются пневмонии и рецидивирующие инфекции. Симптомы поражения центральной нервной системы связаны с диффузной энцефалопатией, атрофией мозжечка, микроцефалией, отложением внутричерепных кальцификатов.
ВИЧ-инфекция у пациентки, получающей противовирусные препараты, не является показанием для кесарева сечения у женщин, так как риск инфицирования плода при кесаревом сечении и естественных родах примерно одинаков. У ВИЧ-инфицированных женщин, не получавших терапии во время беременности, в настоящее время методом выбора является кесарево сечение. В случае ведения родов через естественные пути следует придерживаться правил ведения родов при любых вирусных инфекциях. Для предотвращения постнатального инфицирования естественное вскармливание при ВИЧ-инфекции противопоказано.
С целью сокращения случаев внутриутробного инфицирования проводят обязательное обследование всех беременных женщин на ВИЧ-инфекцию трижды за беременность: при постановке на учет, при сроке 24-28 недель и перед родами. Также рекомендуется обследование на ВИЧ половых партнеров беременных пациенток.
УЗИ сканер RS80
Эталон новых стандартов! Беспрецедентная четкость, разрешение, сверхбыстрая обработка данных, а также исчерпывающий набор современных ультразвуковых технологий для решения самых сложных задач диагностики.
_575.gif)
_575.gif)
.gif)
_575.gif)
.gif)
.gif)