Что такое первое начало термодинамики
Первый закон термодинамики
Первый закон термодинамики представляет собой некое обобщение закона сохранения и превращения энергии для термодинамической системы, и формулируется следующим образом:
Формула первого закона термодинамики, зачастую записывается в ином виде:
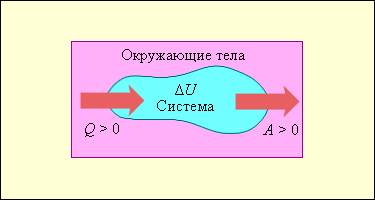
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Первый закон термодинамики представляет из себя, по сути, обобщение опытных фактов. Если руководствоваться им, то можно заявить, что энергия не возникает и не исчезает бесследно, а передается от одной системы к другой, меняя свои формы. Невозможность создания вечного двигателя (perpetuum mobile) первого рода, то есть машины, которая может совершать полезную работу, не потребляя энергию извне и не претерпевая каких-либо изменений во внутренней конструкции агрегата, являлась важным следствием первого закона термодинамики. В подтверждение этого выступает тот факт, что каждая из огромного множества попыток создания такого устройства неизменно заканчивалась неудачей. Реальная машина может совершать положительную работу A над внешними объектами, только получая некоторое количество теплоты Q от окружающих тел или уменьшая Δ U своей внутренней энергии.
Первый закон термодинамики в процессах газов
Первый закон термодинамики может применяться к изопроцессам в газах.
В этом случае справедливой будет формула внутренней энергии газа:
Первый закон термодинамики для изобарного процесса дает:
Первый закон термодинамики для изотермического процесса выражается соотношением
Вместе с изохорным, изотермическим и изобарным процессами в термодинамике нередко исследуют процессы, происходящие в условиях отсутствующего теплообмена с окружающими объектами.
Адиабатическая оболочка – это сосуд с теплонепроницаемыми стенками.
Процессы сжатия или расширения газа в подобных емкостях называют адиабатическими.
Выходит, что газ производит работу за счет падения значения его внутренней энергии.
Работа газа в адиабатическом процессе выражается через температуры начального T 1 и конечного T 2 состояний и принимает вид:
Адиабатический процесс относится к изопроцессам.
Любые изопроцессы, в том числе и адиабатические, являются квазистатическими. Промежуточные состояния газа в таких процессах близки к состояниям термодинамического равновесия. Каждая точка, принадлежащая адиабате, описывает равновесное состояние. Однако, процесс, который проводится в адиабатической оболочке, то есть при отсутствующем теплообмене с окружающими объектами, не обязательно удовлетворяет данному условию.
Расширение газа в пустоту – пример необратимого процесса. Его нельзя провести в противоположном направлении.
Первое начало термодинамики
В физике работой называется перемещение массы на определенное расстояние под воздействием силы. Чтобы поднять эту книгу, например, вам нужно приложить силу, направленную вверх, чтобы преодолеть направленную вниз силу гравитационного притяжения на всём отрезке пути, на который вы поднимаете книгу, и тем самым вы совершаете работу. Для совершения работы тело, которое ее совершает, должно обладать запасом энергии, необходимым для совершения этой работы. То есть энергия — это способность совершить работу. С научной точки зрения энергия обладает тремя важнейшими свойствами: во-первых, она может проявляться в различных формах; во-вторых, различные виды энергии могут переходить друг в друга; в-третьих, при любых физических процессах совокупная энергия в замкнутой системе сохраняется.
Энергия движения
Движущееся тело способно оказывать силовое воздействие на другие тела на отрезке своего пути, и вы такие явления, бесспорно, наблюдали. Представьте себе стрелу, летящую к мишени. Врезаясь в мишень, стрела оказывает силовое воздействие на ее волокна и раздвигает их. Следовательно, движущееся тело способно совершить работу, и значит, по определению, оно обладает энергией. Энергия движения такого рода называется кинетической энергией (от греческого kinezis — «движение»). Согласно механической теории теплоты, теплота — это проявление движения молекул вещества, и значит, ее можно считать особым видом кинетической энергии.
Энергия положения
Точно так же электрически заряженная частица, помещенная в электрическое поле, обладает электрической потенциальной энергией. Мы видим это в атоме (см. Атомная теория строения вещества): энергия электрона зависит от удаленности его орбиты от положительно заряженного ядра. Электрическая потенциальная энергия особого рода участвует в химических взаимодействиях между атомами. Электроны в каждом атоме обладают определенной электрической потенциальной энергией, зависящей от их места в атоме. После объединения атомов в молекулы эти же электроны будут обладать уже другой энергией, обусловленной их новым положением. Обычно суммарная энергия до и после химического взаимодействия не одинакова. Энергию, обеспечивающую возможность такого изменения электронной конфигурации атомов, мы называем химической потенциальной энергией.
Имеется множество видов потенциальной энергии, связанных с магнитными и электрическими полями, с различными свойствами веществ и т. д. Потенциальная энергия присутствует в любой системе, где может быть совершена работа, которая до сих пор не совершена.
Энергия массы
Превращение и сохранение энергии
Различные виды энергии взаимозаменяемы — энергия может переходить из одного вида в другой. Например, когда лучник выпускает стрелу, потенциальная энергия упругого натяжения тетивы преобразуется в кинетическую энергию летящей стрелы, а при попадании стрелы в мишень — в тепловую энергию рассеяния. Все виды энергии, за исключением тепловой, могут полностью преобразовываться друг в друга (тепловая энергия, согласно второму началу термодинамики, может преобразовываться в работу лишь частично).
Преобразование одного вида энергии в другой носит отнюдь не случайный характер, поскольку в замкнутых системах выполняется закон сохранения энергии. Это значит, что в замкнутой изолированной системе совокупное количество энергии со временем не меняется, хотя энергия может принимать различную форму. Предположим, вы располагаете фиксированной суммой денежных средств, распределенных по различным банковским счетам и депозитам: часть ваших денег хранится на текущем сберегательном счете, часть вложена в акции и облигации и т. д. С вашими деньгами вы можете поступить по-разному: можно их все перечислить на единственный счет, можно распределить их по всем счетам равномерно или же положить на разные счета разное количество денег. Однако, что бы вы ни делали, ваш совокупный капитал останется неизменным. (Для простоты мы не учитываем начисление процентов по вкладам и ценным бумагам.) Точно так же, принимая различные формы и перераспределяясь, энергия ниоткуда не поступает и никуда не исчезает. В этом и заключается закон сохранения энергии, который гласит: полная энергия замкнутой системы остается постоянной.
* На первый взгляд, это противоречит нашим интуитивным представлениям. Объяснение же таково. В открытом космосе, где нет значительных гравитационных полей, потенциальная энергия, очевидно, должна быть равна нулю. Поскольку при падении тела в направлении звезды или планеты потенциальная энергия теряется, ее значение должно стать отрицательным. Потенциальная энергия книги массой 1 кг в гравитационном поле у поверхности Земли составит около –6 x 10 7 Джоулей, а если книгу поднять на высоту 1000 км, ее потенциальная энергия возрастет до –5 x 10 7 Джоулей. (Примечание автора)
Первый закон термодинамики.
Первое начало (первый закон) термодинамики — это закон сохранения и превращения энергии для термодинамической системы.
Согласно первому началу термодинамики, работа может совершаться только за счет теплоты или какой-либо другой формы энергии. Следовательно, работу и количество теплоты измеряют в одних единицах — джоулях (как и энергию).
Первое начало термодинамики было сформулировано немецким ученым Ю. Л. Манером в 1842 г. и подтверждено экспериментально английским ученым Дж. Джоулем в 1843 г.
Первый закон термодинамики формулируется так:
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
где ΔU — изменение внутренней энергии, A — работа внешних сил, Q — количество теплоты, переданной системе.
При любых процессах, происходящих в изолированной системе, ее внутренняя энергия остается постоянной.
Если работу совершает система, а не внешние силы, то уравнение (ΔU = A + Q) записывается в виде:

Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
Первое начало термодинамики может быть сформулировано как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника (т. е. только за счет внутренней энергии).
Следует помнить, что как работа, так и количество теплоты, являются характеристиками процесса изменения внутренней энергии, поэтому нельзя говорить, что в системе содержится определенное количество теплоты или работы. Система в любом состоянии обладает лишь определенной внутренней энергией.
Рассмотрим применение первого закона термодинамики к различным термодинамическим процессам.
Изохорный процесс.
Зависимость р(Т) на термодинамической диаграмме изображается изохорой.
Изохорный (изохорический) процесс — термодинамический процесс, происходящий в системе при постоянном объеме.
Изохорный процесс можно осуществить в газах и жидкостях, заключенных в сосуд с постоянным объемом.
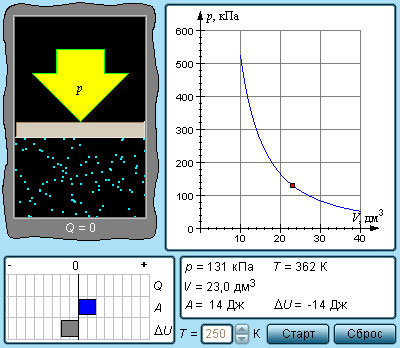
При изохорном процессе объем газа не меняется (ΔV= 0), и, согласно первому началу термодинамики 
т. е. изменение внутренней энергии равно количеству переданного тепла, т. к. работа (А = рΔV=0) газом не совершается.
Первое начало термодинамики
теория по физике 🧲 термодинамика
Первое начало термодинамики (первый закон термодинамики) представляет собой закон сохранения энергии в тепловых процессах.
Первое начало термодинамики
Внутренняя энергия идеального газа изменяется двумя способами: за счет теплопередачи или при совершении работы.
Внимание! Знак перед работой показывает, как процесс совершения работы влияет на изменение внутренней энергии газа.
Пример №1. В некотором процессе внутренняя энергия газа уменьшилась на 300 Дж, а газ совершил работу 500 Дж. Какое количество теплоты было сообщено газу?
Чтобы рассчитать количество теплоты, сообщенное газу, нужно найти разность между изменением внутренней энергии и работой, совершенным газом. Для этого нужно правильно определить их знаки. Так как внутренняя энергия уменьшилась, она отрицательна. Но работа положительна. Поэтому газу было сообщено следующее количество теплоты:
Q = A – U = 500 – 300 = 200 (Дж)
Зависимость физических величин
Выясним, от чего зависят величины, входящие в формулу первого начала термодинамики. Изменение внутренней энергии идеального газа зависит от изменения температуры:
Работа идеального газа зависит от изменения его объема:
Первое начало термодинамики для изопроцессов
Пример №2. Идеальный одноатомный газ находится в сосуде с жесткими стенками объемом 0,6 куб. м. При нагревании его внутренняя энергия увеличилась на 18 кДж. На сколько возросло давление газа?
Внутреннюю энергию газа можно определить по формуле:
Отсюда изменение температуры равно:
Уравнение состояния идеального газа для 1 и 2 состояния:
Отсюда давления равны:
Графические задачи на первое начало термодинамики
Рассмотрим графический способ решения задачи на первое начало термодинамики на конкретном примере.
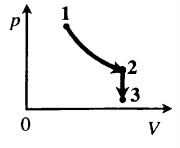
Задача: Один моль идеального одноатомного газа сначала изотермически расширился (T1 = 300 К). Затем газ охладили, понизив давление в 3 раза (см. рисунок). Какое количество теплоты отдал газ на участке 2–3?
1. Определить температуры для всех указанных точек, учитывая графики процессов, масштаб и условие задачи.
2. Определить, к какому изопроцессу относится тот участок графика, о котором спрашивают в задаче.
Участок 2–3 на графике — это изохорный процесс, так как давление остается постоянным.
3. Записать для него первое начало термодинамики.
5. Подставляя в первое начало термодинамики формулы для расчета изменения внутренней энергии и работы газа, решить задачу.
Формула изменения внутренней энергии газа:
Формула работы газа:
Так как процесс изохорный, работа газа равна нулю. Поэтому количество теплоты, отданное газом на участке 2–3, равно изменению внутренней энергии газа:
Изменение внутренней энергии равно:
Алгоритм решения
Решение
Так как это твердые тела, поверхности которых соприкасаются друг с другом, и перенос тепла происходит без переноса вещества, то этот вид теплопередачи является теплопроводностью. Тепло всегда направлено от более нагретого тела к менее нагретому.
На рисунке видно, что самым нагретым телом является нижний брусок, так как он только отдает тепло, но не принимает его. Средний брусок справа менее нагрет, чем нижний, так как принимает от него тепло. Но он более теплый по сравнению со средним бруском слева, так как он делится с ним теплом. И оба этих бруска отдают свою энергию верхнему бруску, который сам только принимает тепло, но не отдает его. Следовательно, именно он имеет температуру +40 о С.
pазбирался: Алиса Никитина | обсудить разбор | оценить
Один моль аргона, находящийся в цилиндре при температуре T1=600 K и давлении p1=4⋅10 5 Па, расширяется и одновременно охлаждается так, что его температура при расширении обратно пропорциональна объёму. Конечное давление газа p2=10 5 Па. Какое количество теплоты газ отдал при расширении, если при этом он совершил работу A=2493 Дж?
Первое начало термодинамики
| Начала термодинамики |
|---|
 |
| Статья является частью серии «Термодинамика». |
| Нулевое начало термодинамики |
| Первое начало термодинамики |
| Второе начало термодинамики |
| Третье начало термодинамики |
| Разделы термодинамики |
| Начала термодинамики |
| Уравнение состояния |
| Термодинамические величины |
| Термодинамические потенциалы |
| Термодинамические циклы |
| Фазовые переходы |
| править |
| См. также «Физический портал» |
Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии для термодинамических систем.
Содержание
Формулировка
Существует несколько эквивалентных формулировок первого начала термодинамики
В любой изолированной системе запас энергии остаётся постоянным. [2] Это — формулировка Дж. П. Джоуля (1842 г.).
Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход. Это определение особенно важно для химической термодинамики [2] (ввиду сложности рассматриваемых процессов). Иными словами, внутренняя энергия является функцией состояния. В циклическом процессе внутренняя энергия не изменяется.

Для элементарного количества теплоты 



Разделение работы на две части, одна из которых описывает работу, совершённую над системой, а вторая — работу, совершённую самой системой, подчёркивает, что эти работы могут быть совершены силами разной природы вследствие разных источников сил.
Важно заметить, что 



Частные случаи
Рассмотрим несколько частных случаев:
Обобщая: в конечном процессе 

При отсутствии работы над системой и потоков энергии-вещества, когда 






Первое начало термодинамики:
Здесь 



См. также
Примечания
Ссылки
Полезное
Смотреть что такое «Первое начало термодинамики» в других словарях:
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ — один из двух осн. законов термодинамики, представляет собой закон сохранения энергии для систем, в к рых существ. значение имеют тепловые процессы. П. н. т. было сформулировано в сер. 19 в. в результате работ нем. учёного Ю. Р. Майера, англ.… … Физическая энциклопедия
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ — одно из основных положений термодинамики, являющееся по существу законом сохранения энергии в применении к термодинамическим процессам: Q=?U + A, где Q сообщаемое термодинамической системе (напр., пару в тепловой машине) количество теплоты, А… … Большой Энциклопедический словарь
первое начало термодинамики — – теплота, подведенная к закрытой системе, расходуется на изменение внутренней энергии системы и совершение работы. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
первое начало термодинамики — одно из основных положений термодинамики, являющееся по существу законом сохранения энергии в применении к термодинамическим процессам: Q = ΔU + А, где Q сообщаемое термодинамической системе (например, пару в тепловой машине) количество теплоты … Энциклопедический словарь
Первое начало термодинамики — он же первый закон термодинамики закон сохранения энергии в термодинамической системе, согласно которому работа может совершаться только за счет теплоты или какой либо другой формы энергии. Первое начало термодинамики можно формулировать также… … Начала современного естествознания
первое начало термодинамики — pirmasis termodinamikos dėsnis statusas T sritis Energetika apibrėžtis Termodinaminės sistemos energijos tvermės dėsnio išraiška: sistemai suteiktas šilumos kiekis eikvojamas jos vidinei energijai didinti ir darbui išorinių jėgų lauke atlikti.… … Aiškinamasis šiluminės ir branduolinės technikos terminų žodynas
Первое начало термодинамики — один из двух основных законов термодинамики (См. Термодинамика), представляет собой закон сохранения энергии для систем, в которых существенное значение имеют тепловые процессы. П. н. т. было сформулировано в середине 19 в. в результате… … Большая советская энциклопедия
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ — один из осн. законов термодинамики; является законом сохранения энергии для систем, в к рых существ, значение имеют тепловые процессы (поглощение или выделение тепла). Согласно П. н. т., термодинамич. система (напр., пар в тепловой машине) может… … Химическая энциклопедия
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ — один из осн. законов термодинамики, являющийся выражением закона сохранения энергии для термодина мич. системы. Согласно П. н. т. теплота Q, сообщаемая системе, расходуется на изменение внутренней энергии системы Дельта U и совершение системой… … Большой энциклопедический политехнический словарь
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ — одно из осн. положений термодинамики, являющееся но существу законом сохранения энергии в применении к термодинамич. процессам: Q = Дельта U +A, где Q сообщаемое термодинамич. системе (напр., пару в тепловой машине) кол во теплоты, А совершаемая… … Естествознание. Энциклопедический словарь