Что такое планарность пептидной связи
Что такое планарность пептидной связи
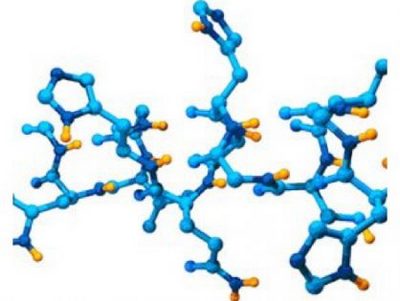
Биомолекулы. Пептиды и белки
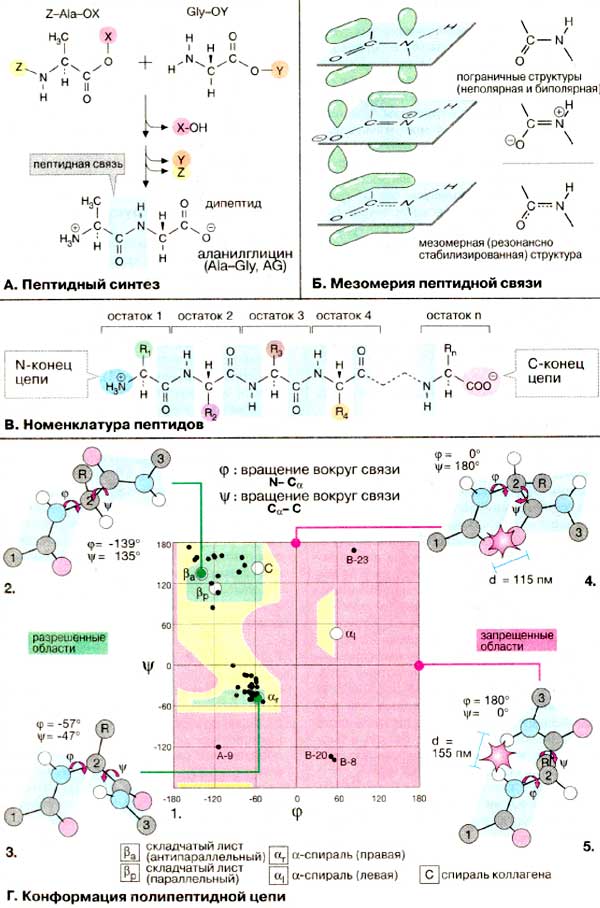
A. Пептидный синтез
В клетках пептиды и белки синтезируются в процессе трансляции на рибосомах (см. сс. 244-249). При химическом синтезе пептидов следует помнить, что целевой продукт образуется с высоким выходом лишь при условии, что функциональные группы, не участвующие в реакции, заблокированы защитными группировками (X,Y). В противном случае в приведенном примере наряду с целевым дипептидом AIa-Gly должны образовываться Gly-Ala, Gly-Gly и Ala-Ala. Кроме того, необходимо активировать карбоксильную группу (Z), что облегчает нуклеофильное присоединение по аминогруппе. В настоящее время пептиды с определенной аминокислотной последовательностью получают с помощью автоматических пептидных синтезаторов.
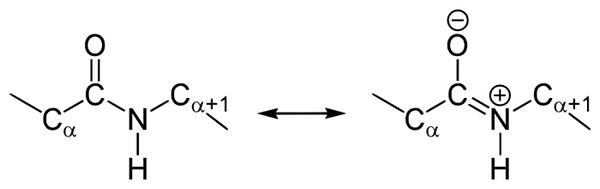
Б. Мезомерия пептидной связи
B. Номенклатура пептидов
Г. Конформация полипептидной цепи
Для каждого конкретного аминокислотного остатка ввиду стерических ограничений разрешены только определенные комбинации углов вращения φ и ψ. Для наглядности информацию о связи между углами φ и ψ в каждом пептидном звене представляют графически с помощью φ/ψ-карты ( 1 ). На карте видно, что большинство комбинаций двугранных углов оказываются запрещенными (поля, выделенные красным цветом). Так, например, при комбинации φ = 0 о / ψ = 180 о ( 4 ) атомы кислорода карбонильных групп должны сблизиться на расстояние 115 пм, что намного меньше, чем сумма вандерваальсовых радиусов двух атомов. Аналогичным образом, при комбинации φ = 180 о / ψ = 0 о ( 5 ) происходит наложение водородных атомов двух ΝΗ-групп. Поэтому для углов φ и ψ остаются разрешенными сочетания, лежащие в пределах дискретных областей, окрашенных в зеленый цвет ( 2, 3 ). В эти разрешенные области попадают все приведенные на последующей схеме вторичные структуры. Конформации, попадающие в зоны, выделенные желтым цветом, энергетически невыгодны, но возможны.
Конформационные карты ( карты Рамачандрана ) построены на основе модельных экспериментов с небольшими пептидами. Однако конформационные параметры большинства аминокислотных остатков в белках также попадают в разрешенные области карты. На карте 1 черными точками показаны пары углов φ и ψ в небольшом белке инсулине (см. с. 78).
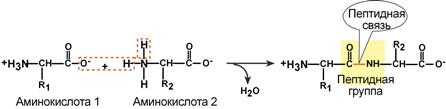
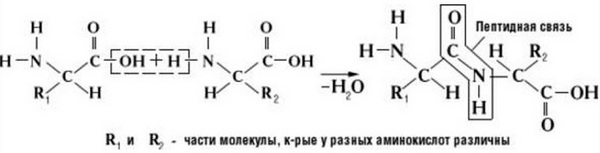
Аминокислоты соединяются пептидной связью
Пептидная связь – это связь между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой аминокислоты.
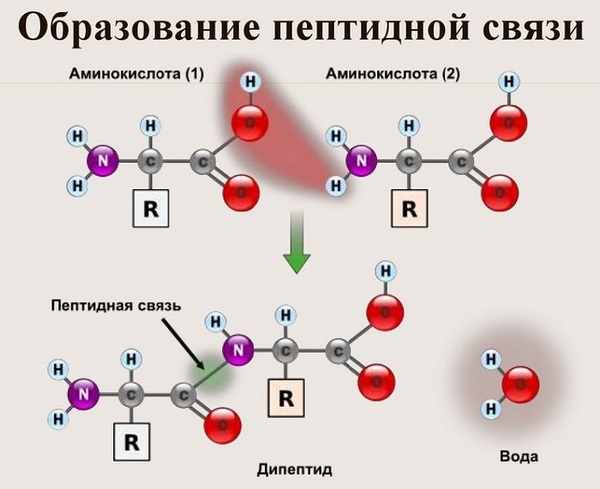
Образование пептидной связи
При необходимости назвать пептид ко всем названиям аминокислот добавляют суффикс «-ил», только последняя аминокислота сохраняет свое название неизменным. Например,
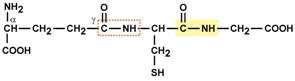
Строение трипептида глутатиона
Особенностью глутатиона является связывание глутамата и цистеина не истинной пептидной связью, а через γ-карбоксильную группу радикала глутаминовой кислоты.
К свойствам пептидной связи относятся:
1. Копланарность
Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы «Н» и «О» расположены по разные стороны от пептидной связи.
2.Транс-положение заместителей
Радикалы аминокислот по отношению к оси пептидной C—N-связи находятся по «разные» стороны, в транс-положении.
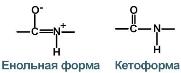
3. Две равнозначные формы
Пептидная связь находится в кетоформе и енольной форме.
4. Способность к образованию водородных связей.
Атомы кислорода и водорода, входящие в пептидную группу, обладают способностью образовывать водородные связи с атомами кислорода и водорода других пептидных групп.
5. Пептидная связь имеет частично характер двойной связи.
Длина пептидной связи меньше, чем одинарной связи, она является жесткой структурой, и вращение вокруг нее затруднено. Но так как, кроме пептидной, в белке есть и другие связи, цепочка аминокислот способна вращаться вокруг основной оси, что придает белкам различную конформацию (пространственное расположение атомов).
Пептидная связь — характеристика, свойства и строение
Пептидная связь возникает между аминокислотами при взаимодействии аминогруппы (-NH2) и карбоксильной группы (-СООН). Две соединенные между собой аминокислоты дают дипептид, три – трипепетид и так далее. Более длинные цепи называют полипептиды и белки.
Образование полипептидной связи внутри клеток идет на рибосомах, при участии ферментов с затратой энергии. Аминокислоты являются мономерами — строительными блоками белков. Для синтеза белка живые организмы используют 20 видов аминокислот.
Как образуется пептидная связь
Данный вид образуется при оттягивании электронной плотности с атома водорода аминогруппы одной и атомом кислорода карбоксильной группы другой аминокислоты.
В результате разрываются соединение между N и Н в аминогруппе и между С и ОН в карбоксильной группе. Протон и гидроксильная группа, объединяясь, дают воду. Два аминокислотных остатка – дипептид.
Свойства пептидной связи
Пептидная связь, характерная для первичной структуры белков, не является полностью одинарной. Её длина составляет 0.132 нм. Это среднее значение между значением истинной двойной связью (C = N, 0,127 нм) и значением истинной одинарной связью (C – N, 0,149 нм).
Атомы, непосредственно вступающие во взаимодействие (углерод, азот, кислород, водород) и два атома α-углерода расположены в общей плоскости. Радикальные группы аминокислот и водорода при α-углеродах лежат за пределами плоскости.
Водород и кислород пептидной связи и α-углероды аминокислот находятся в транс-ориентации. Во всех белковых и пептидных молекулах естественного происхождения, аминокислотные R-группы тоже ориентированы в транс-модификацию.
Резонансные формы пептидных связей
В основе феномена резонанса пептидной связи лежит то, что она на 40% является двойной.
В результате этот вид существует в трех формах:
Кетольная (0,132 нм). Когда взаимодействие между атомами азота и углерода стабилизируется и становится полностью одиночной.
Переходная или мезомерная форма с неопределенными, промежуточными характеристиками.
Енольная (0,127 нм). В этой форме электронная плотность переходит с пептидной на связь между углеродом и кислородом, делая её полностью двойной, вследствие атом кислорода становится заряжен частично отрицательно.
Таким образом, причиной резонанса является делокализованность электронной плотности между азотом и углеродом.
Строение пептидной связи
В итоге электронная плотность пептидной группы смещается к кислороду. В результате такого сопряжения выравниваются длины связей внутри радикала.
Структура и формула отражены на картинке:
Методы определения пептидных связей
Качественной является биуретовая реакция. Такое название она получила, так как впервые была проведена для биурета, хоть и не являющегося аминокислотой, но обладающего двумя пептидными связями.
Принцип определения сводится к тому, что аминокислоты, могущие образовать минимум две пептидные связи, в щелочной среде, при добавлении сульфата меди (II), образуют медьсодержащее комплексное соединение фиолетового цвета.
Комплекс меди с биуретом образуется по схеме:
Заключение
Пептидная связь является основой построения белковых молекул, из которых, в конечном итоге, строятся все живые организмы. Особенности её строения и пространственной конфигурации оказали огромное влияние на саму возможность существования жизни на нашей планете.
Последовательность аминокислот в белке определяется другой важнейшей молекулой – ДНК.
Пептидная связь: образование, строение, свойства
Содержание:
Именно пептидная связь является основой построения всех белковых молекул, из которых, в конечном счете, образуется вся живая материя. Особенности строения пептидной связи, ее структура оказали огромное влияние на саму возможность существования жизни на нашей планете. О том, что такое пептидная связь, как она образуется и какими свойствами обладает, читайте дальше.
Определение
Пептидная связь это связь, возникающая между аминокислотами при взаимодействии аминогруппы (-NH2) и карбоксильной группы (-COOH). Две соединенные одна с другой кислоты образуют дипептид, три – трипепетид и так далее. Длинные цепи подобного рода зовутся полипептидами и белками.
Также академическое определение пептидной связи звучит так: пептидная связь – это вид химической связи, возникающей вследствие взаимодействия α-аминогруппы одной аминокислоты и α-карбоксигруппы другой аминокислоты.
Само же слово «пептид» происходит от греческого «питательный» и означает семейство веществ, молекулы которых построены из двух или более остатков аминокислот, соединенных в цепь пептидными связями —C(O)NH—.
Образование
Как образуется пептидная связь? Образование пептидной связи происходит внутри клеток на рибосомах при активном участии ферментов с затратой энергии. Аминокислоты при этом, будучи мономерами, играют роль таких себе строительных блоков белков. Для синтеза белка живыми организмами используется 20 видов различных аминокислот.
Что же касается самого процесса образования пептидной связи между аминокислотами, то она образуется при оттягивании электронной плотности с атома водорода аминогруппы одной аминокислоты и атомом кислорода карбоксильной группы другой аминокислоты.
Вот так процесс образования пептидной связи в молекуле выглядит схематически.
Как следствие разрываются соединения между N и H в аминогруппе и между C и OH в карбоксильной группе. Соединение протона и гидроксильной группы в результате образует воду, а два аминокислотных остатка – дипептид.
Свойства
Пептидная связь, которая имеет место при первичной структуре белков, не является полностью одинарной. Длина ее равна 0,132 нм. Это среднее значение между истинной двойной и одинарной связями.
Важными свойствами пептидной связи являются копланарность и трансположение, далее подробно их поясним.
Копланарность означает, что все атомы, входящие в пептидную группу находятся на одной плоскости, а атомы H и О располагаются по разные стороны от пептидной связи. Но стоит заметить, что радикальные группы аминокислот и водорода при α-углеродах лежат за пределами плоскости.
Трансположение означает, что кислород и водород пептидной связи находятся в транс-ориентации. Также в транс-ориентации ориентированы аминокислотные R-группы во всех белковых и пептидных молекулах естественного происхождения.
Строение
Структура подобной пептидной связи и формула отражена на картинке.
Методы определения связей
Наилучшим методом для определения пептидных связей является биуретовая реакция. Такое название она имеет потому, что впервые эта реакция была использована для получения биурета, который хотя и не является аминокислотой, но обладает при этом двумя пептидными связями.
Сам механизм определения сводится к тому, что аминокислоты, способные образовать как минимум две пептидные связи в щелочной среде при добавлении сульфата меди образуют медьсодержащее комплексное соединение фиолетового цвета.
Рекомендованная литература и полезные ссылки
Видео
Пептидный связь
Пептидные связи чаще всего встречаются в природе в составе пептидов и белков, они соединяют между собой остатки аминокислот. Пепдидни связи также является основой пептидной нуклеиновой кислоты (ПНА). Полиамиды, такие как нейлон и арамид, — синтетические молекулы (полимеры), которые также содержат пептидные связи.
Образование пептидной связи
Пептидный связь образуется в результате реакции конденсации между карбоксильной и аминогруппой. При этом аминогруппа играет роль нуклеофила, замещая гидроксил карбоксильной группы:
Реакция конденсации, в результате которой происходит формирование пептидной связи, требует вклада свободной энергии. Как в химическом синтезе, так и в биосинтезе белков, это обеспечивается активацией карбоксильных групп, в результате чего отхождения гироксильнои группы облегчается.
Резонансные формы пептидной группы
В 1930-1940-х годах Лайнус Полинг и Роберт Кори проводили рентгеноструктурный анализ нескольких аминокислот и дипептидов. Им удалось установить, что пептидная группа жесткую планарную структуру, шесть атомов лежат в одной плоскости: α-атом углерода и C = O группа первой аминокислоты и N-H группа и α-атом углерода второй аминокислоты. Полинг объяснил это существованием двух резонансных форм пептидной группы, на что указывала меньше длина C-N связи в пептидной группе (133 пм), чем того же связи в простых аминов (149 пм). Итак вследствие частичного разделения электронной пары между карбонильным кислорода и амидной азотом, пептидный связь на 40% имеет свойства двойного:
В пептидных группе вращения вокруг C-N связи не происходит вследствие его частичной двойственности. Вращение разрешено только вокруг связей С-С α и N-С α. В результате остов пептида может быть представлен как серия полей, разделенных совместными точками вращения (С α атомы). Такая структура ограничивает количество возможных конформаций пептидных цепей.
Кроме того, эффект резонанса стабилизирует группу добавляя энергию примерно 84 ккал / моль, что делает ее менее химически активным, чем много подобных групп (например эфиров). Эта группа незаряженная за физиологических значений pH, но вследствие существования двух резонансных форм карбонильный кислород несет частичный отрицательный заряд, а амидный азот — частичный положительный. Таким образом возникает диполь с дипольным моментом, около 3,5 Дебай (0,7 электрон-ангстрем). Эти дипольные моменты могут ориентироваться параллельно в определенных типах вторичной структуры (например α-спирали).
Стереоизомерия
Возможные конфигурации
Возможны конформации
Конформация пептида определяется тремя торсионными углами, отражающие вращения вокруг трех последовательных связей в пептидной остове: ψ (пси) — вокруг C α1-С, ω (омега) — вокруг С-N, и φ (фи) — вокруг N- С α2.
Поскольку связи N-С α2 и C α1-С по обе стороны от пептидной являются обычными одинарными связями, вращения вокруг них неограничен, в результате чего пептидные цепи могут принимать различные пространственные конформации. Однако возможны не все комбинации торсионных углов, при некоторых из них происходит пространственное столкновения атомов. Допустимые значения визуализируют на двухмерном графике, называется диаграммой Рамахандрана.
Методы определения
Пептидная группа имеет характерную полосу поглощения в диапазоне 190-230 нм.
Качественной реакцией на пептидный связь является биуретовая реакция с концентрированным раствором меди (II) сульфата (CuSO 4) в щелочной среде. Продуктом является комплекс сине-фиолетовой окраски между атомом меди и амтомамы азота.
Биуретовая реакция может быть использована для колориметрического измерения концентрации белков и пептидов, однако из-за низкой чувствительности этого метода значительно чаще используют его модификации. Одной из таких модификаций является метод Лоури, в котором биуретовая реакция сочетается с окислением остатков ароматических аминокислот.