Что такое планетарное строение атома
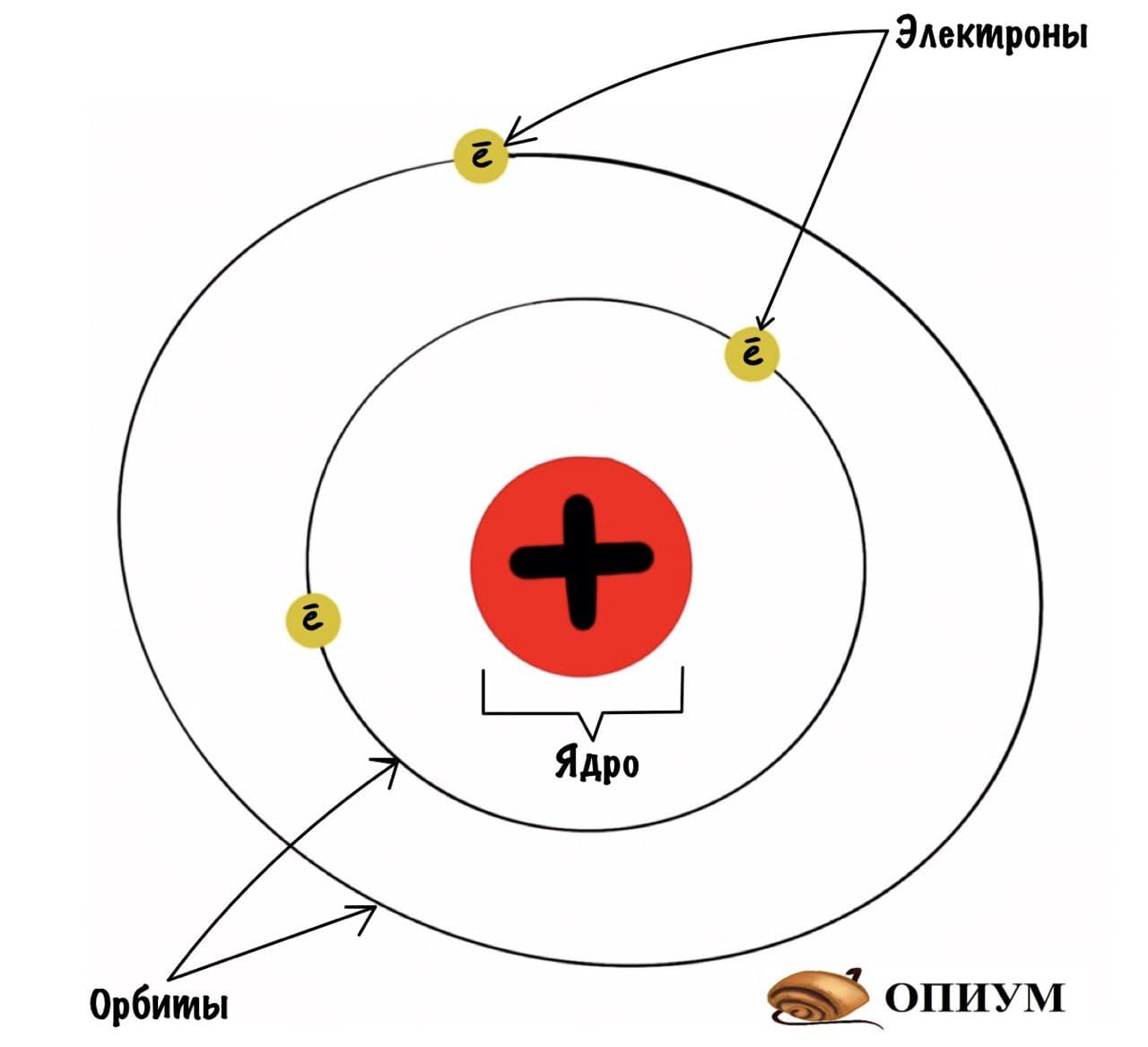
Планетарная модель атома
Недостатком планетарной модели была её несовместимость с законами классической физики. Если электроны движутся вокруг ядра как планеты вокруг Солнца, то их движение ускоренное, и, следовательно, по законам классической электродинамики они должны были бы излучать электромагнитные волны, терять энергию и падать на ядро. Следующим шагом в развитии планетарной модели стала модель Бора, постулирующая другие, отличные от классических, законы движения электронов. Полностью противоречия электродинамики смогла решить квантовая механика.
Полезное
Смотреть что такое «Планетарная модель атома» в других словарях:
планетарная модель атома — planetinis atomo modelis statusas T sritis fizika atitikmenys: angl. planetary atom model vok. Planetenmodell des Atoms, n rus. планетарная модель атома, f pranc. modèle planétaire de l’atome, m … Fizikos terminų žodynas
Боровская модель атома — Боровская модель водородоподобного атома (Z заряд ядра), где отрицательно заряженный электрон заключен в атомной оболочке, окружающей малое, положительно заряженное атомное ядро … Википедия
Модель — I Модель (Model) Вальтер (24.1.1891, Гентин, Восточная Пруссия, 21.4.1945, близ Дуйсбурга), немецко фашистский генерал фельдмаршал (1944). В армии с 1909, участвовал в 1 й мировой войне 1914 18. С ноября 1940 командовал 3 й танковой… … Большая советская энциклопедия
СТРОЕНИЕ АТОМА — (см.) построен из элементарных частиц трёх видов (см.), (см.) и (см.), образующих устойчивую систему. Протон и нейтрон входят в состав атомного (см.), электроны образуют электронную оболочку. В ядре действуют силы (см.), благодаря которым… … Большая политехническая энциклопедия
Атом — У этого термина существуют и другие значения, см. Атом (значения). Атом гелия Атом (от др. греч … Википедия
Резерфорд Эрнест — (1871 1937), английский физик, один из создателей учения о радиоактивности и строении атома, основатель научной школы, иностранный член корреспондент РАН (1922) и почетный член АН СССР (1925). Родился в Новой Зеландии, после окончания… … Энциклопедический словарь
Άτομο — Атом гелия Атом (др. греч. ἄτομος неделимый) наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и… … Википедия
Корпускул — Атом гелия Атом (др. греч. ἄτομος неделимый) наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и… … Википедия
Корпускулы — Атом гелия Атом (др. греч. ἄτομος неделимый) наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и… … Википедия
Строение атома. Гибридизация орбиталей
Обычно в начале статьи пишут краткий план того, о чем пойдет речь в статье. Еще добавляют зачем и почему на нее нужно тратить время. Но здесь такого не будет, потому что я не уверен — нужна ли она вообще.
Но я расскажу историю. Вообще статья должна была быть про белок, как формируется первичная, вторичная структура, ну и так далее. И вот идет подготовка материала, а там довольно большую роль играет электроотрицательность. На самом деле не очень и большую, но все-таки роль у нее есть. И вот мне стало интересно, а как она формируется? Ты конечно знаешь, что она растет в периодической таблице слева направо и зависит от радиуса атома. Но почему? В общем-то эти вопросы привели меня к строению атома и закону Кулона. Поэтому сейчас мы устроим маленькое путешествие в химию и физику. Начнем со строения атома. А уже в следующей статье будем разбираться с электроотрицательностью.
Планетарная модель строения атома от Резерфорда
Это модель ключевая, потому что на ее основе строились все остальные. Вообще Резерфорд крутой мужик, который очень любил всякие опыты. Вот один из них:
Какие выводы делает Резерфорд из этого опыта? Он предполагает, что основная масса атома сосредоточена в его ядре — когда альфа-частицы попадают в него, то отскакивают в обратную сторону. Ядро очень маленькое и заряжено положительно, а вокруг него по орбитам летают отрицательно заряженные электроны. Он называет это планетарной моделью. Очень красиво, согласитесь? Мы живем в мире, который находится в солнечной системе. А атомы, из которых состоит все вокруг, имеют строение такой же системы.
Это все очень поэтично и красиво, но есть парочка проблем:
Были и еще проблемы, но это основные. Как же их решить?
Полуклассическая модель атома по Бору
Появляется второй крутой мужик. Может быть, он даже круче первого, потому что говорит такое — от чего волосы у физиков встают дыбом. Бор взял модель атома по Резерфорду и сказал что-то вроде: «Давайте предположим, что электроны движутся по орбитам, но никакую энергию они не излучают. Но если электрон перепрыгивает с одной орбиты на другую, то он выделяет энергию — фотоны. Это и есть спектр!»
Бор назвал состояние атома, когда его электроны движутся по свои орбитам, стационарным состоянием. При перепрыгивании одного электрона на другую орбиту атом становится возбужденным и может выделять энергию. Атом становится возбужденным не просто так — он поглощает какую-то энергию извне, она представляет собой фотон или фотоны.
Переведем Бора на язык физиков: “Вся ваша физика полная туфта. Атому на нее плевать, он живет по другим законам”. И все как бы в шоке, но больше всех Эйнштейн — он становится главным хейтером Бора. Но экспериментально модель Бора подтверждается.
Модель Бора чем-то похожа на дом. Представьте себе панельку. Если электрон упадет с 7 этажа на первый, то он выделит энергию — это и есть фотон. А вот если зарядить как следует атом, то электрон может прыгнуть с первого этажа на пятый. Чем больше зарядишь, тем выше прыгнет. Чем с большей высоты упадет, тем больше выделит энергии. Примерно так. Оказалось, что Бор был прав и дальше мы это увидим.
Резерфорд, кстати, сделал предположение, что ядро состоит из положительно заряженных протонов. Но Резерфорд и Бор еще не знали, от чего зависит количество электронов и протонов, но с этим разберутся попозже.
Современная модель атома
Ну а дальше началось самое интересное — физики взяли модель атома по Бору и добавили к ней своего добра. Так получилась современная модель атома. Конец! Ну или не совсем. Атом состоит из ядра и электронной оболочки. Начинаем с ядра.
Ядро атома
У атома есть ядро, которое состоит из протонов и нейтронов. Протоны заряжены положительно, а у нейтронов заряда нет. Количество протонов и электронов равно — зависит от порядкового номера в таблице Менделеева. Если это атом азота, то у него 7 протонов и 7 электронов. Нейтрон такому правилу не подчиняется — их может быть больше, а может и меньше. Протон и нейтрон весят в примерно 1800 раз больше, чем электрон. Поэтому основная масса атома находится в ядре.
На самом деле протон и нейтрон состоят из других частиц, но не будем слишком глубоко копать. Можешь почитать, если интересно.
Электронная оболочка
Электронная оболочка — это все электроны атома. Она состоит из слоев, на которых располагается какая-то часть электронов.
Каждый слой состоит из орбиталей. Заметили? Не орбит, а орбиталей. Орбита — это траектория движения тела, на которой в какой-то момент времени можно его встретить. Помните круговые поливалки в деревне? Вода из них движется по определенной траектории. Можно встать и подождать пока тебя польют в жаркий день. Орбиталь — это другое дело, на ней электрон проводит 90 процентов времени, но как он там движется — одному ему известно. Поэтому можно стоять очень долго, но так и не дождаться пока тебя польют. Пример не очень, согласен. Лучше бы привел Луну или какую-нибудь планету, но вы поняли…
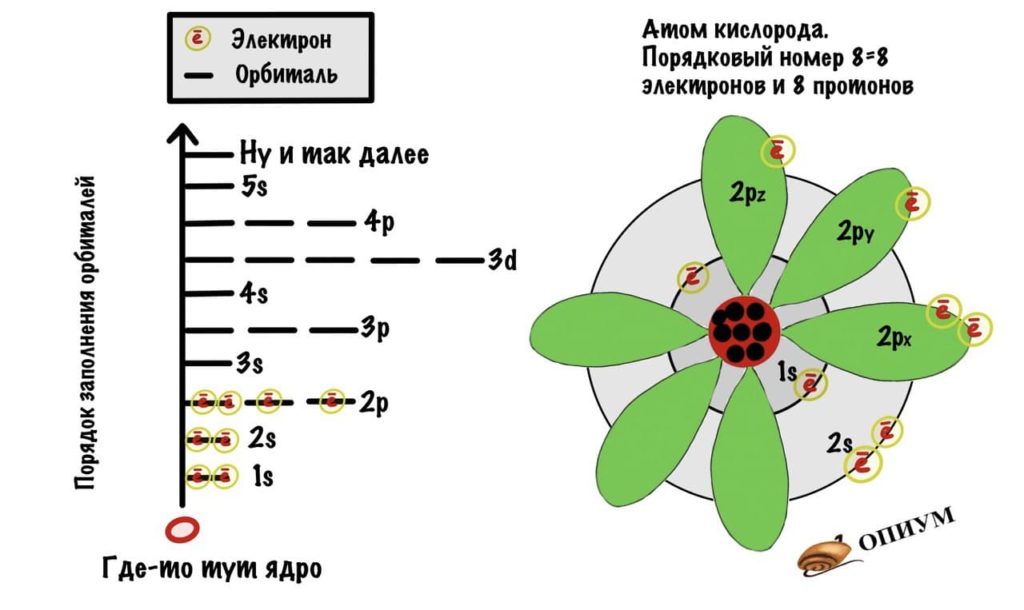
Есть 4 вида орбиталей: s, p, d и f. S- это сфера, p — бесконечность или гантелька, d и f сложнее. Я их рисовать не буду, потому что они нас не интересуют. P-орбиталей всегда 3 — px, py, pz.
Слои электронной оболочки
Теперь подробнее про слои. Первый слой состоит только из одной орбитали — s. Второй слой: одна s и три p орбиталей. Третий слой — одна s, три p и пять d орбиталей. Ну а на четвертом за 5d орбиталями добавятся еще 7f. Количество слоев зависит от количества электронов, а значит от порядкового номера атома.
Тут есть определенные правила:
Добавим к атому лития, который я показывал до этого, орбитали и получим что-то такое.
Можно еще попробовать свести орбитали в один рисунок, смотрите.
Химические связи чаще всего образуются за счет неспаренных электронов, но подробнее об этом поговорим в следующей статье. А сейчас нас интересует углерод и гибридизация его орбиталей.
Гибридизация орбиталей
Сначала посмотрим на электронную формулу углерода и вспомним о Боре. В стационарном состоянии у углерода всего два электрона на 2p-орбиталях. Однако, если атом углерода поглотит энергию фотона, то электрон с 2s-орбитали может перейти на 2p-орбиталь — атом углерода становится возбужденным. В таком состоянии он может образовать 4 связи, т.к. у него 4 неспаренных электрона.
И тут встал вопрос. Атом углерода в возбужденном состоянии может образовать четыре связи, так как у него четыре неспаренных электрона. Но энергия связей будет разной, потому что эти электроны располагаются на разных орбиталях (у p орбитали энергия побольше). Это не очень хорошо сказывается на стабильности системы. Как выйти из этого положения? Атом придумал интересную штуку — он изменил форму и размеры орбиталей. Это и есть гибридизация.
У азота есть одна неподеленная электронная пара на втором энергетическом слое, а именно на 2s-орбитали — там находится два электрона и третий туда уже не засунуть. Но азот может отдать протону водорода один электрон по донорно-акцептерному механизму и образовать связь. Так возникает ион аммония. Такая же тема с водой, но кислород не может отдать по электрону от каждой электронной пары — только с одной! Так образуется ион гидроксония.
sp 2 и sp-гибридизация
Куда пропала p-связь? Ну ладно, держите формулу этилена со всеми связями.
На рисунке видно, что p-орбитали без гибридизации находятся над и под плоскостью, они образуют сигма-связь — эта связь более жесткая, чем пи-связь. Поэтому вращение вокруг нее ограничено.
sp-гибридизацию нарисовать не смогу, сорян. Но смысл вы поняли: без изменений останутся две p-орбитали, а две sp-орбитали будут похожи на палочку — угол между ними будет 180 градусов. Одна p-орбиталь будет идти над плоскостью, а другая смотреть в лицо. Надеюсь, что у тебя получилось представить. Едем дальше.
Атомный остов
Электронный слой бывает завершенным или незавершенным:
Заряд ядра атома (количество протонов) + заряд завершенных слоев (количество электронов) = атомный остов. Картинка….
У кислорода заряд атомного остова больше, чем у натрия. Это нам понадобится, когда будем считать электроотрицательность.
Фух, со строением атома закончили. Поздравляю всех, кто дочитал до этого момента. Дальше можно переходить к электроотрицательности, но это уже в следующей статье.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.
Планетарная модель атома Резерфорда
«Каждый, кто надеется, что преобразования атомных ядер станут источником энергии, исповедует вздор.»
Эрнест Резерфорд
Модель Томсона была первым пробным шагом в познании микромира. Однако она не отвечала на многие вопросы. Требовался новый нестандартный взгляд для создания модели, способной разрешить возникшие противоречия.
Модель атома, предложенная Томсоном, давала только общее представление о строении атома и не согласовывалась со все новыми данными экспериментов и теоретических вычислений. Настало время создания другой модели, способной согласовать теорию и эксперимент.
Этого не может быть. Или факты — упрямая вещь
К 1904 году японский физик Хантаро Нагаока разработал раннюю «планетарную модель» атома — так называемый «атом типа Сатурна». Модель была разработана по аналогии с расчетами устойчивости колец Сатурна. И хотя впоследствии модель и оказалась ошибочной, два следствия из нее все-таки оказались пророческими:
Годом раньше немецкий физик Филипп фон Ленард попытался создать модель, которая не предполагала раздельное существование в атоме противоположных зарядов. Атом, согласно модели Ленарда, состоит из нейтральных частиц — динамид, каждая из которых является электрическим дуплетом. Расчеты, выполненные Ленардом, показали, что эти частицы должны иметь очень маленькие размеры, то есть большая часть объема атома представляет собой пустоту.
В 1909 году Ганс Гейгер и Эрнест Марсден под руководством Эрнеста Резерфорда решили попытаться найти экспериментальное подтверждение модели Томсона и провели ставшие классическими опыты по рассеиванию альфа-частиц на тонкой золотой фольге. Альфа-частицы были выбраны благодаря своей большей массе (в 7350 раз больше массы электрона), поэтому они не должны претерпевать сколь-нибудь заметного отклонения при взаимодействии с электронами. Это позволяет исследовать только положительную составляющую атома. Источником альфа-частиц послужил радий. Частицы, проходящие через золотую фольгу, рассеивались, и это рассеяние регистрировалось по сцинтилляционным вспышкам на экране из сульфида цинка.
В начале эксперимента исследовались только малые углы отклонения альфа-частицы. И тут выяснилось, что подавляющее большинство частиц проходили сквозь фольгу, как раскаленная дробинка через кусок масла, словно мишень была прозрачна для бомбардирующих ее частиц. Наблюдалось лишь весьма незначительное отклонение порядка одного градуса.
Затем Резерфорд поручил молодому сотруднику Марсдену выяснить, могут ли частицы рассеиваться на большие углы. В частности, до 180°. И вот зимним днем 1909 года Марсден остановил на университетской лестнице Резерфорда и сказал: «Вы были правы, профессор: они возвращаются». Это было невероятно и противоречило существующей модели атома. Таким образом, вместо доказательства правоты Томсона эксперименты Резерфорда доказали ее несостоятельность.
Тот факт, что альфа-частицы возвращались, говорил о том, что они столкнулись с преградой — очень массивной положительно заряженной частицей, но эти столкновения происходили очень редко, в среднем — одно на восемь тысяч. А это уже свидетельство о том, что. Впрочем, именно над этим и задумался Резерфорд.
Альфа-частица (а-частица)— положительно заряженная частица, образованная двумя протонами и двумя нейтронами, по сути это ядро атома гелия. Поток альфа-частиц называют альфа-лучами, или альфа-излучением.
И все-таки он вертится!
И задумался он на целых два года. К 1911 году результатом его раздумий явилась новая модель строения атома. Однако обо всем по порядку.
Альфа-частицы, проходя через фольгу, проходят сквозь атомы золота в большинстве случаев без отклонений.
Из этого следуют два вывода. Первый: легкие электроны практически не влияют на движение тяжелой альфа-частицы. Вывод второй: так как альфа-частицы в большинстве случаев отклоняются на малые углы, атом в большей части своего объема пустой.
Небольшая часть альфа-частиц все же отклоняется на значительные углы. А значит, вывод третий такой: центральная часть атома очень маленьких размеров, но в ней сосредоточена почти вся масса атома, и эта центральная часть имеет положительный заряд. Она и получила название ядра атома.
Согласно Резерфорду, атом состоит из массивного положительного ядра и вращающихся по определенным орбитам вокруг него электронов, что само по себе напомнило Солнечную систему, поэтому модель и получила название планетарной.
Если представить атом в виде сферы диаметром один километр — его ядро будет размером с мелкую монету.
Однако и эта модель атома оказалась в противоречии с классической физикой. Согласно теории Максвелла, любой ускоренно движущийся заряд должен непрерывно излучать электромагнитные волны. Поскольку электроны, вращаясь вокруг ядра, движутся с центростремительным ускорением, они должны непрерывно излучать электромагнитные волны. На самом же деле в нормальном состоянии атомы не излучают!
Таким образом, эти факты были несовместимы с планетарной моделью атома Резерфорда, если рассматривать ее с позиции классической электродинамики.
Разрешения этих противоречий были еще впереди. Пока же количество вопросов значительно превышало число удобоваримых объяснений. Тем не менее, это был значительный шаг на пути понимания устройства мира. Добавим лишь, что рассеяние микрочастиц на других частицах или атомных ядрах — это квантовый процесс, а для его описания необходимо уравнение Шредингера, которого в 1911 году еще попросту не было.
Планетарная модель атома.
Планетарная модель атома, или модель Резерфорда — это историческая модель строения атома, предложенная Эрнестом Резерфордом как результат эксперимента с рассеиванием альфа-частиц.
Для вычисления распределения «+» заряда в атоме, английский ученый Э. Резерфорд провел исследование рассеяния α-частиц фольгой из разных веществ. Большинство α-частиц беспрепятственно, практически не отклоняясь, проходило сквозь фольгу, и лишь 1 из 2000 частиц отклонялась на углы, большие 90°. Результатом этих экспериментов в 1911 г. стало предложение Резерфордом следующей модели строения атома.
Атом состоит из положительно заряженного ядра, вокруг него обращаются электроны, каждый по своей орбите, как планеты Солнечной системы, обращающиеся вокруг Солнца. Именно поэтому модель назвали планетарной.
Положительный заряд ядра qядра связан с числом электронов Z в атоме при помощи соотношения:

Заряд ядра и число электронов в атоме, соответственно, совпадает с порядковым номером элемента в таблице Д. И. Менделеева.
В целом атом является электронейтральным. Электрон, отрываясь или присоединяясь к атому (как результат столкновения, например, либо при разных химических процессах) может образовывать положительно либо отрицательно заряженные ионы.
Простая и наглядная модель атома Резерфорда отлично объясняла результаты этих опытов. Но основываясь на этой модели строения атома нельзя объяснить факт существования атома и его устойчивость.
Это несоответствие опыта выводам теории связано с попыткой применения законов классической физики к внутриатомным явлениям (которые, как выяснилось, подчиняются законам квантовой механики).
Выход из образовавшейся в теории атома ситуации нашел датский физик Нильсом Бором.
Строение атома
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: планетарная модель атома.
Атомы каждого химического элемента имеют строго индивидуальный линейчатый спектр, присущий только данному элементу и не меняющийся от опыта к опыту. Как это можно объяснить? Как вывести формулу, дающую весь набор частот атомного спектра? Чтобы сделать это, нужно узнать, как устроен атом.
Модель Томсона
Первую модель строения атома придумал английский физик Джозеф Джон Томсон (удостоенный Нобелевской премии за открытие электрона). В конечном счёте она оказалась неверной, но сыграла важную роль, будучи стимулом последующих экспериментальных исследований Резерфорда. Физики называли модель Томсона «пудинг с изюмом».
Согласно Томсону атом представляет собой шар размером порядка см. По этому шару некоторым образом распределён положительный заряд, а внутри шара, подобно изюминкам, находятся электроны (рис. 1 ).
Рис. 1. Модель атома Томсона
Суммарный заряд электронов в точности равен положительному заряду шара, поэтому атом в целом электрически нейтрален.
Излучение атомов объясняется колебаниями электронов около положений равновесия (как вы помните, любой ускоренно движущийся заряд излучает электромагнитные волны). Однако вся совокупность экспериментальных данных по атомным спектрам не укладывалась в модель Томсона. Например, для некоторых химических элементов были подобраны формулы, хорошо описывающие их спектры, но эти формулы из модели Томсона никак не следовали.
Опыты Резерфорда
Но в те времена об атомных ядрах ещё ничего не знали — о них Резерфорду лишь предстояло догадаться, глядя на результаты своих знаменитых опытов!
Планетарная модель атома
Эта величина на пять порядков (в сто тысяч раз!) меньше размера атома. Так на смену модели Томсона пришла планетарная модель атома (рис. 3 ).
Рис. 3. Планетарная модель атома
В центре атома находится крошечное положительно заряженное ядро, вокруг которого, словно планеты вокруг Солнца, движутся электроны. Между ядром и электронами действуют силы кулоновского притяжения, но упасть на ядро электроны не могут за счёт своего движения — точно так же, как и планеты не падают на Солнце, хоть и притягиваются к нему.
Заряд ядра по модулю равен суммарному заряду электронов, так что атом в целом электрически нейтрален. Однако электроны могут быть выбиты из своих орбит и покинуть атом — тогда атом превращается в положительно заряженный ион.
Масса электронов составляет очень малую часть общей массы атома. Например, в атоме водорода всего один электрон, и его масса в раз меньше массы ядра. Следовательно, почти вся масса атома сосредоточена в ядре — и это при том, что ядро в сто тысяч раз меньше самого атома.
Чтобы лучше почувствовать соотношение масштабов атома и ядра, представьте себе, что атом стал размером с Останкинскую телебашню ( м). Тогда ядро окажется горошиной размером мм, лежащей у вас на ладони. И тем не менее, почти вся масса атома заключена в этой горошине!