Что такое пня в гинекологии
Что такое пня в гинекологии
Диагноз преждевременной яичниковой недостаточности (ПЯН) ставят при аменорее, дефиците эстрогенов и повышенном количестве ФСГ у женщин до 40 лет. Распространенность составляет около 1%. Большинство случаев преждевременной яичниковой недостаточности (ПЯН) связано с химиотерапией и лучевой терапией по поводу рака. Преждевременная яичниковая недостаточность (ПЯН) обычно необратима, хотя возможно спонтанное восстановление функций яичников. Преждевременная яичниковая недостаточность (ПЯН) — частая причина вторичной аменореи (4-18% наблюдений).
В ряде случаев этиология преждевременной яичниковой недостаточности (ПЯН) остается невыясненной. Тем не менее у больных с аменореей до 30-летнего возраста нужно исследовать кариотип на транслокацию половой хромосомы, а также наличие Y-хромосомы, потому что эти состояния связаны с повышенным риском существования злокачественных опухолей яичников. Некоторые эксперты рекомендуют подвергать хромосомному анализу всех больных с преждевременной яичниковой недостаточностью (ПЯН). Тем не менее у больных с вторичной аменореей, связанной с преждевременной яичниковой недостаточностью (ПЯН), чаще всего идентифицируют кариотип 46ХХ.
Дисгенезия гонад как причина преждевременной яичниковой недостаточности (ПЯН)
В редких случаях у больных с дисгенезией гонад происходит нормальное пубертатное развитие, а затем у них наступает вторичная аменорея, чаще в возрасте до 30 лет.
У женщин со вторичной аменореей в результате дисгенезии гонад обычно выявляют нормальный кариотип 46ХХ, хотя у некоторых могут быть обнаружены 47ХХХ или 46X0. У больных с дисгенезией гонад и нормальным кариотипом возможны другие пороки, такие как нейросенсорная глухота (синдром Перро) или синдром ломкой Х-хромосомы — наиболее частая генетическая причина нарушений развития.
Приблизительно у 16% женщин-носителей премутированного аллеля синдрома ломкой Х-хромосомы возникает преждевременная яичниковая недостаточность (ПЯН), особенно если в семейном анамнезе прослеживается преждевременная яичниковая недостаточность (ПЯН) или умственная отсталость. Когда у женщин со спорадической преждевременной яичниковой недостаточностью (ПЯН) проводят скрининго-вое исследование, 3% из них оказываются носителями генных мутаций. У некоторых обнаруживают умеренную умственную отсталость и плохую обучаемость.
Существует также связь между преждевременной яичниковой недостаточностью (ПЯН) и наследуемой аутосомно-доминантным путем патологией глазного яблока — инверсивным синдромом блефарофимоза-птоза-эпикантуса. Этот синдром сопровождается мутацией FOXL2 гена, транскрипционного фактора, расположенного на хромосоме 3. Некоторые другие аутосомные нарушения связаны с яичниковой недостаточностью, они приводят к повышению содержания ФСГ без истощения запаса ооцитов. Некоторые из них включают мутации в генах фосфоманомутазы 2 (РММ2), галактоза-1-фосфатуридитрансферазы (CALT), рецептора к ФСГ и аутоиммунорегулирующего гена (АРГ), который ответствен за полиэндокринопатию — эктодермальную дистрофию.
Аутоиммунные причины преждевременной яичниковой недостаточностью (ПЯН)
Часто причиной преждевременной яичниковой недостаточностью (ПЯН) бывают аутоиммунные заболевания. У 40% женщин с преждевременной яичниковой недостаточностью (ПЯН) есть аутоиммунная патология, чаще всего аутоиммунный тиреоидит с развитием гипотиреоза. ПЯН чаще встречается у пациенток с инсулинозависимым сахарным диабетом, myasthenia gravis и заболеваниями паращитовидных желез, чем у здоровых женщин. От 10 до 60% женщин, страдающих болезнью Аддисона, имеют ПЯН.
Поскольку у этих больных повышен риск аутоиммунных эндокринных заболеваний, они должны ежегодно проходить обследование по поводу различных аномалий, что позволяет своевременно начать лечение. Больные с преждевременной яичниковой недостаточностью (ПЯН) невыясненной этиологии должны пройти полное обследование для выявления аутоиммунных расстройств. Необходимо оценить уровень кальция, фосфор, глюкозу натощак, антитела к 21-гидроксилазе, свободный Т4, ТТГ и антитиреоидные антитела. Обследование необходимо проводить ежегодно.
Скрининг на антиовариальные антитела проводить не рекомендуется в свете низкой информативности и специфичности. Необходимо проводить скрининг пациентов на наличие патологии надпочечников при помощи определения уровня антиандреналовых антител. Если этот тест оказывается положительным, необходимы более сложные исследования, например тест стимуляции кортикотропином. Определение содержания кортизола в сыворотке крови утром натощак не информативно.
Преждевременная яичниковая недостаточность: другие причины
Хотя повышенное содержание ФСГ в сыворотке крови почти всегда связано с патологией яичников, встречаются необычные ситуации, когда повышение количества ФСГ связано не с овариальными, а с центральными проблемами. К последним относятся аденомы гипофиза, секретирующие ФСГ, или специфические дефекты ферментов, например дефицит 17-гидролазы (Р450с17) или галактоза-1-фосфат уридилтрансферазы (галактоземия).
Есть несколько сообщений об изолированном дефиците гонадотропинов. Одновременное определение количества ЛГ и ФСГ позволяет распознать это редкое состояние. В случае преждевременной яичниковой недостаточности (ПЯН) обнаруживают оба этих гормона, повышение содержания одного из них нетипично. Большинство таких нарушений связано с изменением одного гена или заменой аминокислоты. В этих случаях МРТ гипофиза позволит распознать гипофизарную аденому, секретирующую оба гормона, особенно если это связано с повышением секреции а-субъединицы. Тем не менее эти опухоли обычно не связаны с аменореей.
Может также происходить мутация гонадотропных рецепторов. У таких больных диагностируют синдром резистентных яичников. Обычно у этих женщин присутствует вторичная аменорея в сочетании с нормальными вторичными половыми признаками. Реакции на гонадотропины нет, а при УЗИ яичников выявляются мелкие антральные фолликулы.
Существует мутация гена, отвечающего за ФСГ-рецепторы (как у мужчин, так и у женщин) [74]. У женщин обнаруживают гипергонадотропный гипогонадизм из-за нечувствительности к ФСГ. Этот фенотип проявляется как отсутствием развития молочных желез, так и нормальными молочными железами, а также первичной или вторичной аменореей. Эти относительно необычные находки обнаружены у определенной части населения Финляндии (1% женщин — гетерозиготы).
Мутация рецептора к ЛГ у женщин с кариотипом 46,XX приводит к сочетанию нормального полового развития и аменореи. Количество ЛГ в сыворотке крови колеблется от нормального до повышенного, содержание ФСГ нормальное, эстрадиола в фолликулярную фазу — нормальное, прогестерона — снижено. Матка маленькая, состояние яичников характеризуется стойкой ановуляцией.
Диагностика преждевременной яичниковой недостаточности
Первичное обследование, как и во всех случаях аменореи, состоит из определения количества ТТГ, пролактина и ФСГ в сыворотке крови. Диагноз ПЯН ставят при повышении концентрации ФСГ, нормальном количестве пролактина и ТТГ. Показатели эстрадиола будут снижены, таким образом, тест с прогестином не будет вызывать менструацию — подобное кровотечение в ответ на отмену.
Женщинам с ПЯН необязательно проводить биопсию яичников. Цена и риск хирургического вмешательства значительны, а влияния на тактику лечения это исследование не окажет. Необходимо выполнить ТВУЗИ для определения количества фолликулов в яичнике.
Лечение преждевременной яичниковой недостаточности
Женщинам с ПЯН следует предложить заместительную терапию эстрогенами и прогестероном, чтобы сохранить их вторичные половые признаки и уменьшить риск развития остеопороза. Этого можно достичь с помощью комбинированных пероральных контрацептивов до возраста естественной менопаузы, если нет противопоказаний. У некоторых женщин, принимающих малые дозы экзогенных эстрогенов с прогестином, возможно спонтанное появление овуляции и (в редких случаях) наступает беременность.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
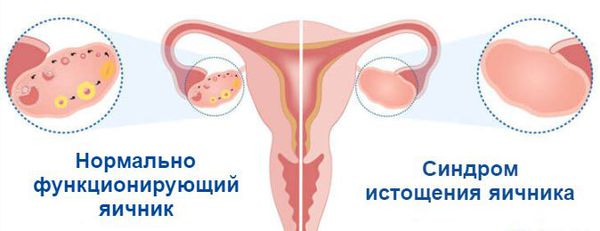
Что такое синдром истощения яичников? Причины возникновения, диагностику и методы лечения разберем в статье доктора Вихаревой М. А., врача УЗИ со стажем в 19 лет.
Определение болезни. Причины заболевания
Причинами заболевания могут быть несколько факторов. Первое место среди них занимает наследственность: если у матери была данная проблема, то с высокой долей вероятности она возникнет и у её дочери. Этот фактор вызван нарушением в половой Х-хромосоме. Именно в ней находится большинство генов, отвечающих за функционирование репродуктивной системы.
К генетическим дефектам, которые вызывают ранний «климакс», относятся:
На втором месте причин появления синдрома — негативное влияние факторов во время внутриутробного развития, когда у девочки идёт закладка фолликулов (части яичника). Приём беременной антибиотиков и других препаратов, которые не рекомендуются при беременности, перенесённое простудное заболевание — всё это откладывает отпечаток на репродуктивное здоровье девочки.
На третьем месте — оперативное вмешательство, например, удаление яичника или его части (резекция яичника), операция по удалению кисты, образования или эндометриоидного очага на яичнике. После удаления одного яичника второй работает усиленно, но этого бывает недостаточно, впоследствии развивается синдром истощения яичников.
Поддерживать функцию яичников очень важно для женщины. Контролировать данный процесс нужно с молодости. Строгая диета, малый вес, отказ от пищи — всё это приводит к разрушению нормальной работы яичников, происходит их разрушение и снижение функции.
Симптомы синдрома истощения яичников
Первым проявлением болезни является нарушение менструального цикла. На первом этапе задержки могут быть до 1-2 недель, а затем до 2-3 месяцев или полугода, вплоть до полного прекращения месячных. В такой ситуации нужно срочно обратиться к врачу. Зачастую женщины готовы пойти на любые жертвы, чтобы улучшить ситуацию, но самолечение, как правило, только ухудшает и ускоряет процесс. Поэтому в первую очередь необходимо посетить врача и сдать все анализы, чтобы правильно оценить ситуацию и начать лечение.
Вероятность того, что женщина при таком синдроме сможет забеременеть, всё же есть, но не большая. Так как синдром истощение яичников — длительный процесс снижения репродуктивной функции, временами менструальный цикл может возобновляться без какого-либо медицинского вмешательства. В этот период может произойти зачатие. Однако в дальнейшем возникает сложность в вынашивании ребёнка.
Патогенез синдрома истощения яичников
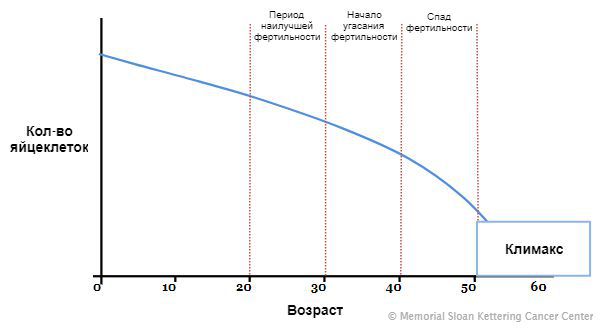
На седьмой неделе внутриутробного развития в организме девочки формируются яичники. В них, в зависимости от генетики, закладывается определённое количество яйцеклеток: обычно около одного миллиона. Их число со временем сокращается, так как новые яйцеклетки после формирования резерва уже не образуются, а уже существующие выделяются в овуляции и постепенно отмирают. Этот естественный процесс приводит к тому, что к 45 годам их количество снижается. Поэтому данный возраст считают окончанием репродуктивного периода. Как только запас яйцеклеток иссякает, яичники перестают вырабатывать женские половые гормоны, ежемесячные менструации прекращаются, и наступает климакс (менопауза) .
Классификация и стадии развития синдрома истощения яичников
В зависимости от причин возникновения синдром истощения яичников бывает двух типов:
Отдельно выделяют классификацию первичного синдрома истощения яичников. Она основана на клинических проявлениях и уровне фолликулостимулирующего гормона:
Также выделяют несколько стадий развития синдрома:
Осложнения синдрома истощения яичников
Со стороны сердечно сосудистой системы могут проявиться осложнения в виде гипертонических кризов (чрезмерного повышения артериального давления), инсультов и инфарктов в молодом возрасте. Проявляются эти осложнения болью в сердце, головной болью, нарушением сознания и координации.
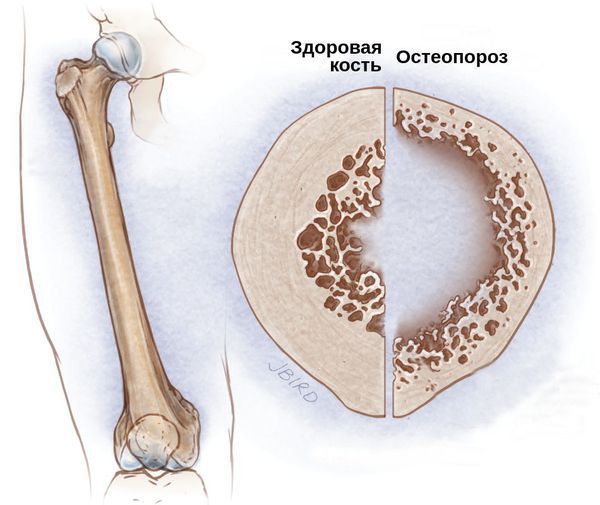
Со стороны костной системы возможны переломы шейки бедра, патологические переломы различных остей и позвоночника, грыжи и осложнённые формы остеохондроза. Развитие подобных осложнений связано с гормональным дисбалансом. Из-за дефицита половых гормонов костный метаболизм начинает ускоряться, что приводит к преобладанию процесса резорбции — разрушения костных тканей и, следовательно, к остеопорозу и переломам.
В самых тяжёлых случаях при отсутствии лечения возникают все перечисленные осложнения.
Диагностика синдрома истощения яичников
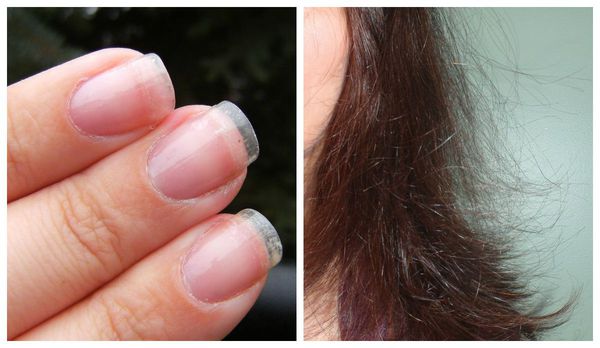
Первичную диагностику осуществляет врач акушер-гинеколог. Он собирает жалобы, изучает историю болезни (анамнез), проводит осмотр. Всё это позволяет заподозрить синдром истощения яичников. Пациентка с таким синдромом выглядит, как правило, старше своих лет: у неё появляются преждевременные морщины, волосы становятся тонкими, безжизненными, тусклыми, ногти — ломкими.
Для подтверждения диагноза необходимо сдать кровь для определения уровня нескольких гормонов: фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ) и эстрадиола. Анализ крови на ФСГ, ЛГ и эстрадиол нужно делать 2-3 раза независимо от цикла. Кровь сдаётся один раз в неделю. На наличие синдрома будет указывать повышение ФСГ, ЛГ и снижение эстрадиола.
Женщинам с семейным анамнезом раннего «климакса» требуется генетическое консультирование для изучения кариотипа женщины (набор хромосом). В рамках данного исследования необходимо сдать кровь из вены.
Лечение синдрома истощения яичников
Основные цели гормонотерапии:
Побочные эффекты гормонотерапии :
Противопоказания к заместительной гормонотерапии:
Физиотерапевтические процедуры также показаны при выявлении раннего «климакса». Они включают в себя:
Прогноз. Профилактика
Если женщина не планирует зачатие ребёнка, ей необходимо продолжать приём гормональных средств до тех пор, пока не наступит естественный климакс. Вылечить бесплодие и восстановить фертильность при синдроме истощения яичников крайне сложно. Наступление беременности у женщин с таким диагнозом возможно только благодаря ЭКО с использованием донорской яйцеклетки. Но если изменения в эндометрии (внутреннем слое матки) из-за гормональных нарушений уже стали необратимыми (атрофическими), то и эту программу выполнить не удастся.
Для профилактики данного заболевания беременная женщина должна внимательно следить за своим здоровьем и стараться оградить свой организм от вредных внешних факторов. Особенно это касается тех, кто вынашивает девочку, так как основной причиной развития синдрома являются заболевания, возникшие у плода во время внутриутробного развития. Саму новорождённую девочку по возможности нужно также ограждать от инфекционных заболеваний и стресса.
С целью профилактического осмотра нужно минимум два раза в год обследоваться у гинеколога. Это позволит выявить синдром на ранних стадиях заболевания и вовремя начать лечение.
Ведение пациенток с преждевременным выключением функции яичников
Угасание функции яичников — сложный и продолжительный по времени процесс. В отношении различных вариантов этого состояния имеется своя терминология, хотя разграничение терминов в значительной степени искусственное. Некоторые исследователи считают целесоо
Угасание функции яичников — сложный и продолжительный по времени процесс. В отношении различных вариантов этого состояния имеется своя терминология, хотя разграничение терминов в значительной степени искусственное. Некоторые исследователи считают целесообразным выделять «раннее выключение функции яичников» — симптомокомплекс, формирующийся у женщин 40–45 лет, и «преждевременное выключение функции яичников», возникающее в возрасте до 40 лет [13]. Примечательно, что две тысячи лет назад менопауза в 40 лет рассматривалась как нормальное явление (Аристотель, IV век до н. э.). С увеличением продолжительности жизни возрастает и средний возраст наступления менопаузы.
История систематизированного изучения преждевременного выключения функции яичников, или преждевременной недостаточности функции яичников (ПНЯ), началась в 30-е гг. XX столетия, когда впервые было выявлено повышение уровня гонадотропинов у молодых женщин, которые ранее регулярно менструировали. В 1950 г. Аtria [10] представил основную клиническую характеристику больных с преждевременным эстрогенным дефицитом. В начале 1960-х гг. Hertz [20] описал четырех пациенток с повышенным уровнем фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ), у которых в биоптатах яичников при последующем их гистологическом исследовании были обнаружены фолликулы на различной стадии зрелости. Подобные клинико-анатомические находки сделали в 1969 г. Jones и de Morales-Ruchsen [18], описавшие трех пациенток с вторичной аменореей, бесплодием, высоким уровнем гонадотропинов и сохраненным фолликулярным аппаратом. Подобное состояние было ими охарактеризовано как синдром резистентных яичников, или Савадж-синдром — по имени одной из этих пациенток. Согласно данным Fenichel [17], у половины женщин с ПНЯ в яичнике имеются единичные фолликулы, которые периодически функционируют, поэтому у этих пациенток изредка могут спонтанно наступать овуляции и в отдельных случаях даже возникать беременности. Подобные клинико-гормональные взаимоотношения прослеживаются на протяжении 6 и более лет после наступления гипергонадотропной аменореи.
С 1967 г. под ПНЯ подразумевается нефизиологическое прекращение менструации у женщин до 40 лет. Частота данной патологии среди женской популяции репродуктивного возраста составляет приблизительно 1% [4, 7, 14, 20].
Дефицит половых гормонов в возрасте до 40 лет способствует формированию не только целой гаммы вазомоторных и эмоционально вегетативных проявлений, но также является ведущим фактором риска развития сердечно-сосудистой патологии и снижения минеральной плотности костной ткани. В связи с тем что все представленные выше метаболические нарушения сохраняются по крайней мере на протяжении 7–10 лет, предшествующих возрасту физиологической менопаузы, пациенток с ПНЯ следует выделять в особую группу риска, требующую постоянного диспансерного наблюдения и обязательного назначения заместительной гормональной терапии (ЗГТ).
Установлено, что с момента рождения и до 50 лет число примордиальных фолликулов у женщин постепенно снижается с 1–2 млн до 10 тыс. в каждом. Большинство фолликулов подвергается атрезии на стадии малых антральных [22]. Следует отметить, что в 37–38 лет помимо этого выявляется выраженная атрезия — за счет примордиальных фолликулов, что значительно ускоряет процесс их исчезновения из яичника [16]. О процессах, контролирующих эти «возрастные коридоры» жизни яичников, известно крайне мало.
Время прекращения функционирования яичников может зависеть как от величины яичникового пула, так и от скорости атрезии. Время наступления менопаузы у женщин — наследственный признак. Количество родов и факторы внешней среды, такие, как питание, социально-экономический статус, также оказывают влияние на возраст наступления менопаузы. Вредные привычки, в особенности курение, могут приблизить ее наступление.
Точная природа ПНЯ неясна. Это состояние описывается как «многофакторный синдром», в развитии которого могут принимать участие генетические, аутоиммунные, инфекционно-токсические, психогенные факторы внешней среды, а также дефекты в структурах и /или действия гонадотропинов.
В ходе последних исследований Krauss и соавторы [19] обнаружили ген (ПНЯ 1), расположенный на участке Xq21.3–q27 или Xq26.l–q27, ответственный зa преждевременное истощение яичников. Powell и соавторы открыли второй ген (ПНЯ 2) родственного происхождения, расположенный проксимальнее к локусу Хq в ql3.3–q21.1.
Преждевременное истощение яичников нередко выявляется в семьях, где имеются редкие наследственные патологии, такие, как галактоземия (лактазная недостаточность), блефарофимоз, причем механизм повреждения яичников при этих генетических расстройствах неизвестен. При галактоземии у девочек развивается первичная или вторичная аменорея, в то время как у мужчин репродуктивная функция остается интактной. При блефарофимозе только у каждой второй женщины развивается ПНЯ, при этом клиническая картина заболевания часто сходна с синдромом резистентных яичников.
К наиболее редким генетическим причинам семейных случаев ПНЯ относится дефект гена, кодирующего синтез рецептора к ФСГ. У таких женщин выявляются гипоплазия яичников, множество примордиальных фолликулов, остановившихся в развитии на ранней стадии.
Степень повреждения яичников в результате лучевого и химического воздействия зависит от величины, дозы и продолжительности воздействия, а также от возраста пациентки. Доза порядка 6 Грей обычно приводит к стойкому повреждению яичников.
Препараты, используемые в онкологической практике и обладающие антимитотическим и цитотоксическим действием, могут приводить к выраженному угнетению функции яичника у женщин [12]. Данные, опубликованные в 1998 г. [8, 23], подтверждают, что гранулезные клетки являются в яичнике главной мишенью для циклофосфана, что приводит к ПНЯ за счет истощения фолликулярного аппарата в связи с активацией процесса апоптоза, который, в свою очередь, приводит к стойкой атрезии примордиальных фолликулов, в норме протекающей в циклическом режиме. Выявленная в пубертатном возрасте устойчивость яичников к воздействию химиопрепаратов натолкнула исследователей на мысль о возможности осуществления непосредственно перед назначением химиопрепаратов медикаментозного подавления роста и созревания фолликулов. В 1995 г. Ataya и соавторы [9] доказали на женских особях резус-обезьян, что агонисты гонадотропинрелизинг-гормона (ГнРГ) защищают яичник от воздействия циклофосфамидов. Назначение агониста ГнРГ параллельно с химиопрепаратом значительно снизило скорость ежедневной гибели примордиальных фолликулов.
Согласно современным представлениям ПНЯ следует относить к органоспецифическим аутоиммунным заболеваниям. До настоящего времени не ясно, является ли развитие аутоиммунного процесса (срыв толерантности) первичной причиной возникновения заболевания или результатом воздействия длительной хронической патологии, как бы замыкая «порочный» круг патогенеза. Сегодня предложено около двух десятков теорий, объясняющих причины срыва толерантности и, как следствие, развитие аутоиммунитета. Наиболее доказуемыми из них в плане формирования ПНЯ являются теория «запретных» клонов, а также теория генетической предрасположенности, молекулярной мимикрии.
Механизм развития аутопроцесса в яичнике представляется в виде последовательности следующих событий. Под влиянием внешних факторов (видимо, это некоторые вирусы и ферменты ДНК, другие экзогенные вещества и соединения) лимфоциты приобретают аномальную чувствительность к различным белкам, выступающим в виде аутоантигенов, взаимодействующих с Т-лимфоцитами и образующих эпитоны с молекулами антигенов системы HLA. После такого комплексирования с молекулами II класса системы HLA антигены «представляются» Т-лимфоцитами, что является сигналом для инициации иммунного ответа.
Активирование таких аутореактивных Т-лимфоцитов становится потенциальной причиной деструкции яичника.
По данным Fenischel, у больных с идиопатической формой ПНЯ методом ELISА аутоантитела к яичнику были обнаружены в 59% случаев. Согласно нашим исследованиям, яичниковые антитела выявлены у 25% больных [5].
Частота выявления яичниковых аутоантител зависит от метода, с помощью которого они определялись, и разновидности биологического материала, в котором они идентифицировались. Более высокая чувствительность продемонстрирована при использовании метода ELISА (в сравнении с методом иммуноферментного анализа), а наиболее значимой биологической средой оказалась ткань яичника (в сравнении с сывороткой крови).
Согласно проведенным нами исследованиям, для больных с преждевременной недостаточностью яичников характерно носительство аллелей DRB1*О1, DRB1*О3, DRB1*О4, DRB1*3О2, DRB1*5О1, показатель относительного риска составил 1,74; 1,78; 2,09; 2,46; 1,73 соответственно, что может указывать на значимость аутоиммунного процесса при этой патологии. Представленные аллельные варианты НLА II класса встречались у 25% больных с подтвержденным аутоиммунным генезом заболевания и у всех пациенток с промежуточным вариантом ПНЯ.
К наиболее распространенным сочетаниям ПНЯ и аутоиммунной патологии относятся поражения внутренней секреции, а также различные заболевания неэндокринного генеза; среди них следует особо выделить болезнь Аддисона, аутоиммунный тиреоидит, гипопаратиреоз, сахарный диабет, системную красную волчанку, ревматоидный артрит, витилиго, миастению, пернициозную анемию, гломерулонефрит [23]. Согласно полученным нами данным, гипофункция щитовидной железы (тиреотропный гормон (ТТГ)) — 7,34 ± 1,1 мМЕ/л выявляется у 23,3% больных с ПНЯ, т. е. в 3–4 раза чаще, чем в популяции. Манифестная форма заболевания диагностирована у 16,3% и субклиническая — у 7,0% обследованных.
На фоне прекращения менструаций ранние симптомы дефицита женских половых гормонов в виде вазомоторных и эмоциональных вегетативных проявлений отмечены у 77,5% пациенток. При этом их выраженность, согласно индексу Куппермана (15,2 ± 1,8 балла) и оценке качества жизни на основании анкеты MENQOL (вазомоторные симптомы — 8,2 ± 3,8 балла, физическое состояние — 37,5 ± 8,3 балла, сексуальная сфера — 8,1 ± 3,4 балла, психологическое состоя-ние — 25,6 ± 6,8 балла), свидетельствовала о среднетяжелом дефиците эстрогенов. Относительно незначительные клинические проявления изменения гормонального гомеостаза можно объяснить тем, что, в отличие от женщин в периоде физиологической менопаузы, у этих пациенток еще не произошло старения структур гипоталамической и лимбической систем. ПНЯ с исходом в гипергонадотропный гипогонадизм в конечном итоге приводит к изменению функционирования гипоталамической и лимбической систем и секреции нейрогормонов, в результате чего снижается допаминергический и повышается норадренергический тонус, а это, в свою очередь, ведет к снижению уровня b-эндорфиновой активности, уровней серотонина, допамина; у пациенток изменяется терморегуляция, появляются приливы, гипертензия, гипергидроз, ожирение [3].
Чем раньше наступает менопауза, тем более выраженный стресс она вызывает. У женщин, достигших менопаузы одновременно или раньше своих матерей, нередко возникает чувство несправедливости. Исследования показывают, что стресс, обусловленный осознанием своего отличия от сверстниц, — важнейший психологический фактор, превалирующий над всеми остальными психологическими и социальными проблемами, связанными с менопаузой, которые не зависят от семейного положения, образования и количества детей [21].
В генезе развития урогенитальных расстройств у больных с ПНЯ, безусловно, определенную роль играет наличие определенного числа эстрогеновых рецепторов в эпителии и строме влагалищной стенки, состав соединительной ткани и ее биохимические характеристики (снижение соотношения протеогликана/коллагена). Описанные изменения в парауретральной соединительной ткани обусловлены не только низким уровнем эстрадиола, но и включением возрастного механизма старения уротелия. Пациентки с ПНЯ составляют относительно молодую группу, у них еще не задействованы сложные механизмы старения уротелия, поэтому симптомы урогенитальной атрофии встречаются только в 15,6% случаев, в то время как у 1/3 женщин после 55 лет эти изменения являются ведущими среди поздних осложнений климактерия.
Оценка гормонального статуса пациенток с ПНЯ свидетельствует о достоверном повышении содержания ФСГ и ЛГ до уровня более 40 МЕ/л и снижении содержания менее 80 пмоль/л, что значительно ниже показателей, характерных для ранней фолликулярной фазы у женщин с регулярными менструациями. Особый, с нашей точки зрения, интерес представляет анализ у больных с ПНЯ секреции андрогенов как яичникового, так и надпочечникового генеза.
С одной стороны, с наступлением естественной менопаузы основная часть тестостерона образуется путем периферической конверсии из андростендиона и дегидроэпиандростерона-сульфата, при этом содержание его, в отличие от эстрогенов, резко не снижается, а наоборот, может возрастать, особенно его свободные фракции.
С другой стороны, на фоне снижения уровня эстрадиола и закономерного уменьшения продукции полового стероидсвязывающего глобулина (ПССГ), а значит и уровня связанного тестостерона отмечается повышение содержания его свободных, биологически активных фракций, вследствие чего у значительного числа женщин в менопаузе наблюдается относительная гиперандрогения. Несколько другие гормональные соотношения, касающиеся баланса андрогенов, были выявлены у женщин с ПНЯ. По данным N. Doldi и соавторов, при ПНЯ обнаружено достоверное снижение уровня 17-оксипрогестерона, андростандиона, тестостерона в сравнении с женщинами с нормальной функцией яичников.
Согласно нашим данным, у 55,7% больных с ПНЯ на фоне закономерных для данной патологии соотношений ФСГ, ЛГ и эстрадиола отмечено андрогендефицитное состояние (снижение уровня тестостерона до 0,8 ± 0,1 пмоль/л).
Мы считаем, что снижение секреции андрогенов яичниками у больных с ПНЯ является еще одним неоспоримым доказательством справедливости нашего суждения об аутоиммунном генезе ПНЯ, так как при любом аутопроцессе в конечном итоге развивается сочетанная недостаточность эндокринных желез. Со временем этот процесс охватывает не только яичник, но и надпочечник.
До настоящего времени, согласно мнению P. Fenichel и многих других авторов, эффективного специфического лечения ПНЯ (кроме ЗГТ и донации ооцитов) предложено не было [17].
Решение о проведении ЗГТ должно приниматься больной совместно с лечащим врачом. Несмотря на проявления дефицита эстрогенов, согласие на прием гормонопрепаратов нам удалось получить у 62,7% пациенток.
На первом этапе следует определиться с базовым лечением, которое должно быть направлено на патогенетическое звено заболевания. Использование препаратов женских половых стероидов, способствующих восполнению гипоэстрогенного состояния, следует рассматривать как «первую линию» лечебного воздействия. Назначение ЗГТ является универсальным средством ликвидации дефицита половых гормонов. В отличие от тактики, принятой при естественной менопаузе, режим проведения ЗГТ при ПНЯ имеет некоторые особенности. Согласно точке зрения V. Beral, у женщин репродуктивного возраста риск развития рака молочной железы низок, в связи с чем пятилетний срок, на который назначается непрерывная ЗГТ, может быть пролонгирован во времени, по крайней мере до возраста естественной менопаузы. При этом, безусловно, необходимо соблюдать все принципы и рекомендации, направленные на безопасное использование половых гормонов.
По мнению L. Giotto и соавторов, которые с 1992 по 2002 г. наблюдали 72 женщины с ПНЯ, получавшие в течение 10 лет ЗГТ, необходимо дифференцировать подходы к назначению длительной гормонотерапии с учетом противопоказаний и возрастных критериев. Так, пациентам до 35 лет при отсутствии генетических тромбофилий, эпизодов венозной тромбоэмболии или ишемической кардиомиопатии, а также сопутствующей аутоиммунной патологии (ревматоидный артрит) следует рекомендовать пероральный прием препаратов. Через 10 лет их необходимо переводить на трансдермальные формы препаратов. В возрасте после 38 лет и при наличии факторов риска целесообразно гормонотерапию начинать сразу с трансдермальных форм. Назначение селективных эстроген-рецепторных модуляторов (ралоксифен), с точки зрения этих ученых, не целесообразно, так как при ПНЯ мы имеем дело с молодыми женщинами, нуждающимися в восполнении дефицита половых гормонов натуральными эстрогенами в связи с множественными проявлениями симптомов выключения функции яичников.
Некоторые ученые полагают [2], что пациенткам с ПНЯ требуются более высокие дозы гормонов, поскольку, в отличие от естественной менопаузы, при которой наблюдается постепенное растянутое во времени уменьшение эндогенного образования женских половых гормонов и в значительном проценте случаев формируется относительная гиперандрогения, при ПНЯ этот процесс ускорен во времени, и у 55,7% больных, согласно полученным нами данным, отмечается гипоандрогенное состояние. Установлено, что эстрогены оказывают выраженное положительное влияние не только на вазомоторные проявления дефицита эстрогенов, но и на сексуальность женщины — благодаря своему центральному и периферическому воздействию.
В настоящее время для профилактики и лечения патологических состояний, обусловленных снижением эстрогенной насыщаемости организма в молодом возрасте, применяют натуральные эстрогены: конъюгированный эстроген (per os) в дозе 0,625 мг/сут, эстрадиол валерат — 2 мг/сут, 17b-эстрадиол — 2 мг/сут. Перечисленные препараты обладают системным влиянием и при использовании в указанной общепринятой дозировке применяются для коррекции ранних, средневременных и поздних обменных нарушений [3].
С целью профилактики гиперпластических процессов эндометрия женщинам с ПНЯ терапию эстрогенами необходимо назначать в сочетании с гестагенами и предпочтительно в циклическом режиме. При подборе наиболее подходящего режима ЗГТ крайне важно учитывать степень индивидуальной чувствительности к гестагенам.
Проводя ЗГТ, не следует забывать об основных принципах ее назначения. В основном избирается циклический режим назначения (сочетание эстрогена и гестагена), при этом надо стремиться обеспечить физиологическое соотношение эстрогенов (эстрадиол/эстрон) в плазме крови, характерное для данного возрастного периода жизни, и не упускать из виду необходимость индивидуального подбора препаратов для минимизации побочных эффектов ЗГТ. С целью купирования дефицита эстрогенов и коррекции выявленных метаболических нарушений могут использоваться: 2 мг 17β-эстрадиола и 10 мг дидрогестерона в циклическом непрерывном режиме (фемостон 2/10), а также 2 мг эстрадиола валерата и медроксипрогестерона ацетат.
А. И. Гус, доктор медицинских наук, профессор
Л. А. Марченко, доктор медицинских наук, профессор
Н. В. Александрова
З. Т. Габибуллаева
Г. В. Тагиева, кандидат медицинских наук
НЦГАиП, Москва