Что такое подуровни как они заполняются электронами
Что такое подуровни как они заполняются электронами
Почему в химии уделяют такое большое внимание распределению электронов по энергетическим уровням и подуровням в атоме?
Химические свойства элементов и их соединений определяются электронным строением валентного уровня их атомов. Именно с участием электронов валентного уровня возникают химические связи между атомами и образуется соединение (вещество). Поэтому важно понимать правила заполнения электронных оболочек, строение валентного уровня и составлять электронную конфигурацию атомов элементов.
Распределение электронов по атомным орбиталям (АО) происходит в соответствии с принципом наименьшей энергии, принципом Паули и правилом Гунда.
В многоэлектронных атомах электрон взаимодействует не только с ядром (электростатическое притяжение), но и с другими электронами (электростатическое отталкивание). В этом случае его энергия определяется не только главным `n`, но и орбитальным `l` квантовыми числами. Орбитальное число определяет форму орбиталей, и чем сложнее их форма, тем выше энергия подуровня, который они составляют. Таким образом, при одном и том же значении `n` энергия возрастает с ростом `l:`
В этом случае сумма спинов всех трех электронов (суммарный спин подуровня) будет равна `1/2+1/2+1/2=1 1/2`.
Если бы электроны расп оло жились так:
то суммарный спин был бы равен `1/2-1/2+1/2=1/2`.
Правило Гунда выведено на основании изучения атомных спектров. Квантово-механическая природа этого правила основана на том, что электроны с разными значениями `m_l` (в нашем примере `–1`; `0`; `+1`) наиболее пространственно удалены друг от друга и энергия их электростатического отталкивания минимальна.
3. Принцип Паули (или принцип запрета Паули) утверждает, что в атоме не может быть двух электронов с одинаковым набором всех четырёх квантовых чисел.
Как следствие, на одной орбитали не может существовать более двух электронов. При этом их спины будут противоположными.
Все вышеизложенные правила определяют энергию электрона, электронную конфигурацию атома и местоположение элемента в Периодической системе Д. И. Менделеева.
Атомы и электроны
Атомно-молекулярное учение
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
Правила заполнения электронных орбиталей и примеры
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Внешний уровень и валентные электроны
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
Как заполняются электронные уровни, подуровни и орбитали по мере усложнения атома.



Если говорить более строго, то относительное расположение подуровней обусловлено не столько их большей или меньшей энергией, сколько требованием минимума полной энергии атома.
Распределение электронов по атомным орбиталям происходит, начиная с орбитали, имеющей наименьшую энергию (принцип минимума энергии), т.е. электрон садится на ближайшую к ядру орбиталь. Это значит, что сначала заполняются электронами те подуровни, для которых сумма значений квантовых чисел (n + l) была минимальной. Так энергия электрона на 4s-подуровне меньше энергии электрона, находящегося на 3d-подуровне. Следовательно, заполнение электронами подуровней происходит в следующем порядке: 1s
Рис.2.1.1. Энергетические диаграммы валентных подуровней атомов хрома и меди
Правила заполнения электронных оболочек:
1. Сначала выясняем, сколько всего электронов содержит атом интересующего нас элемента. Для этого достаточно знать заряд его ядра, который, всегда равен порядковому номеру элемента в Периодической таблице Д.И. Менделеева. Порядковый номер (число протонов в ядре) в точности равен и числу электронов во всем атоме.
2. Последовательно заполняем орбитали, начиная с 1s-орбитали, имеющимися электронами, учитывая принцип минимальной энергии. При этом нельзя располагать на каждой орбитали более двух электронов с противоположно направленными спинами (правило Паули).
3. Записываем электронную формулу элемента.
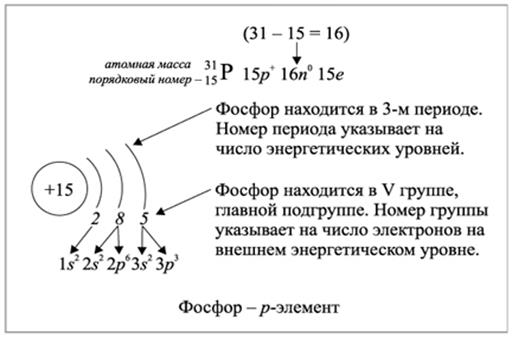
Рис.2.1.2. Заполнение энергетических уровней электронами элемента фосфора
Электронную структуру атома водорода (z = 1) можно изобразить следующим образом:
Каждый атом последующего химического элемента в периодической системе представляет собой многоэлектронный атом.
Атом лития, так же как и атом водорода и гелия, имеет электронную структуру s-элемента, т.к. последний электрон атома лития «садится» на s-подуровень:
+3Li 1s 2 2s 1 2p 0
В атоме бора появляется первый электрон в p-состоянии:
+5В 1s 2 2s 2 2p 1
Запись электронной формулы проще показать на конкретном примере. Допустим, нам надо выяснить электронную формулу элемента с порядковым номером 7. В атоме такого элемента должно быть 7 электронов. Заполним орбитали семью электронами, начиная с нижней 1s-орбитали.
Электронная формула элемента с порядковым номером 7 (это элемент азот, имеющий символ “N”) выглядит так:
+7N 1s 2 2s 2 2p 3
Внешним уровнем атома называется самый далекий от ядра уровень, на котором есть валентные электроны. Именно эта оболочка соприкасается при столкновении с внешними уровнями других атомов в химических реакциях. При взаимодействии с другими атомами азот способен принять 3 дополнительных электрона на свой внешний уровень. При этом атом азота получит завершенный, то есть максимально заполненный внешний электронный уровень, на котором расположатся 8 электронов.
Завершенный уровень энергетически выгоднее незавершенного, поэтому атом азота должен легко реагировать с любым другим атомом, способным предоставить ему 3 дополнительных электрона для завершения его внешнего уровня.
Рис.2.1.3. Заполнение энергетических уровней у s-, p-,d- и f- элементов электронами
Электронная конфигурация атома
Для чего изучать электронную конфигурацию элементов?
Атомы как конструктор: есть определённое количество деталей, они отличаются друг от друга, но две детали одного типа абсолютно одинаковы. Но этот конструктор куда интереснее, чем пластмассовый и вот почему. Конфигурация меняется в зависимости от того, кто есть рядом. Например, кислород рядом с водородом может превратиться в воду, рядом с натрием в газ, а находясь рядом с железом вовсе превращает его в ржавчину. Что бы ответить на вопрос почему так происходит и предугадать поведение атома рядом с другим необходимо изучить электронную конфигурацию, о чём и пойдёт речь ниже.
Сколько электронов в атоме?
Где искать электрон?
Наблюдая поведение электрона были выведены определённые закономерности, они описываются квантовыми числами, всего их четыре:
Орбиталь
Орбитальное квантовое число l
Магнитное квантовое число ml
Внутри оболочки электронам легче располагаться на разных орбиталях, поэтому первые электроны заполняют по одному на каждую орбиталь, а затем уже к каждому присоединяется его пара.
Рассмотрим d-оболочку:
d-оболочке соответствует значение L=2, то есть пять орбиталей (-2,-1,0,1 и 2), первые пять электронов заполняют оболочку принимая значения Ml=-2,Ml=-1,Ml=0, Ml=1,Ml=2.
Спиновое квантовое число ms
Главное квантовое число n
Номер электрона
Итак, любой электрон можно описать четырьмя квантовыми числами, комбинация из этих чисел уникальна для каждой позиции электрона, возьмём первый электрон, самый низкий энергетический уровень это N=1, на первом уровне распологается одна оболочка, первая оболочка на любом уровне имеет форму шара (s-оболочка), т.е. L=0, магнитное квантовое число может принять только одно значение, Ml=0 и спин будет равен +1/2. Если мы возьмём пятый электрон (в каком бы атоме он не был), то главные квантовые числа для него будут: N=2, L=1, M=-1, спин 1/2.
Энергетические уровни с подуровнями для наглядности изображены ниже, сверху вниз расположены уровни и цветом разделены подуровни:
| 1 | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2 | |||||||||||||||||||
| 3 | |||||||||||||||||||
| 4 | |||||||||||||||||||
| 5 | |||||||||||||||||||
| 6 | |||||||||||||||||||
| 7 | |||||||||||||||||||
| 8 | |||||||||||||||||||
| Таблица 1. Распределение электронов по энергетическим уровням | |||||||||||||||||||
Здесь, сверху-вниз показаны энергетические уровни (1-7), слева-направо разделены по группам электронные подуровни (s,p,d,f), в каждой ячейке располагаются по два электрона в противоположных направлениях. Общий принцип распределения электронов такой, что энергетические подуровни заполняются в порядке суммы главного и орбитального квантовых чисел, то есть: 1S, 2S, 2P, 3S, 3P, 4S, 3D и так далее, если сумма одинакова, то сначала заполняется уровень с меньшим главным квантовым числом N.
У некоторых элементов имеются отклонения в формировании электронной конфигурации, а именно у 24Cr, 29Cu, 41Nb, 42Mo, 44Ru, 45Rh, 46Pd, 47Ag, 78Pt, 79Au
Элементы
Проверьте себя, составьте электронную конфигурацию для элементов #3, #11 и #16, затем проверьте себя по таблице ниже.
| № | Элемент | Название | Электронная конфигурация | Энергетических уровней |
|---|---|---|---|---|
| 1 | H | водород | 1s 1 | 1 |
| 2 | He | гелий | 1s 2 | 1 |
| 3 | Li | литий | 1s 2 2s 1 | 2 |
| 4 | Be | бериллий | 1s 2 2s 2 | 2 |
| 5 | B | бор | 1s 2 2s 2 2p 1 | 2 |
| 6 | C | углерод | 1s 2 2s 2 2p 2 | 2 |
| 7 | N | азот | 1s 2 2s 2 2p 3 | 2 |
| 8 | O | кислород | 1s 2 2s 2 2p 4 | 2 |
| 9 | F | фтор | 1s 2 2s 2 2p 5 | 2 |
| 10 | Ne | неон | 1s 2 2s 2 2p 6 | 2 |
| 11 | Na | натрий | 1s 2 2s 2 2p 6 3s 1 | 3 |
| 12 | Mg | магний | 1s 2 2s 2 2p 6 3s 2 | 3 |
| 13 | Al | алюминий | 1s 2 2s 2 2p 6 3s 2 3p 1 | 3 |
| 14 | Si | кремний | 1s 2 2s 2 2p 6 3s 2 3p 2 | 3 |
| 15 | P | фосфор | 1s 2 2s 2 2p 6 3s 2 3p 3 | 3 |
| 16 | S | сера | 1s 2 2s 2 2p 6 3s 2 3p 4 | 3 |
| 17 | Cl | хлор | 1s 2 2s 2 2p 6 3s 2 3p 5 | 3 |
| 18 | Ar | аргон | 1s 2 2s 2 2p 6 3s 2 3p 6 | 3 |
| 19 | K | калий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 | 4 |
| 20 | Ca | кальций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 | 4 |
| 21 | Sc | скандий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 | 4 |
| 22 | Ti | титан | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 | 4 |
| 23 | V | ванадий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3 | 4 |
| 24 | Cr | хром | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5 | 4 |
| 25 | Mn | марганец | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 | 4 |
| 26 | Fe | железо | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 | 4 |
| 27 | Co | кобальт | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 7 | 4 |
| 28 | Ni | никель | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 8 | 4 |
| 29 | Cu | медь | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 | 4 |
| 30 | Zn | цинк | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 | 4 |
| 31 | Ga | галлий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 1 | 4 |
| 32 | Ge | германий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 2 | 4 |
| 33 | As | мышьяк | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 3 | 4 |
| 34 | Se | селен | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 4 | 4 |
| 35 | Br | бром | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5 | 4 |
| 36 | Kr | криптон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 | 4 |
| 37 | Rb | рубидий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 | 5 |
| 38 | Sr | стронций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 | 5 |
| 39 | Y | иттрий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 1 | 5 |
| 40 | Zr | цирконий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 2 | 5 |
| 41 | Nb | ниобий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 4 | 5 |
| 42 | Mo | молибден | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 5 | 5 |
| 43 | Tc | технеций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 5 | 5 |
| 44 | Ru | рутений | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 7 | 5 |
| 45 | Rh | родий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 8 | 5 |
| 46 | Pd | палладий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 4d 10 | 5 |
| 47 | Ag | серебро | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 10 | 5 |
| 48 | Cd | кадмий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 | 5 |
| 49 | In | индий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 1 | 5 |
| 50 | Sn | олово | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 2 | 5 |
| 51 | Sb | сурьма | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 3 | 5 |
| 52 | Te | теллур | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 4 | 5 |
| 53 | I | йод | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 5 | 5 |
| 54 | Xe | ксенон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 | 5 |
| 55 | Cs | цезий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 1 | 6 |
| 56 | Ba | барий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 | 6 |
| 57 | La | лантан | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 5d 1 | 6 |
| 58 | Ce | церий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 2 | 6 |
| 59 | Pr | празеодим | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 3 | 6 |
| 60 | Nd | неодим | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 4 | 6 |
| 61 | Pm | прометий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 5 | 6 |
| 62 | Sm | самарий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 6 | 6 |
| 63 | Eu | европий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 7 | 6 |
| 64 | Gd | гадолиний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 7 5d 1 | 6 |
| 65 | Tb | тербий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 9 | 6 |
| 66 | Dy | диспрозий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 10 | 6 |
| 67 | Ho | гольмий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 11 | 6 |
| 68 | Er | эрбий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 12 | 6 |
| 68 | Tm | тулий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 13 | 6 |
| 70 | Yb | иттербий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 | 6 |
| 71 | Lu | лютеций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 1 | 6 |
| 72 | Hf | гафний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 2 | 6 |
| 73 | Ta | тантал | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 3 | 6 |
| 74 | W | вольфрам | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 4 | 6 |
| 75 | Re | рений | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 5 | 6 |
| 76 | Os | осмий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 6 | 6 |
| 77 | Ir | иридий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 7 | 6 |
| 78 | Pt | платина | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 1 4f 14 5d 9 | 6 |
| 79 | Au | золото | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 1 4f 14 5d 10 | 6 |
| 80 | Hg | ртуть | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 | 6 |
| 81 | Tl | таллий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 1 | 6 |
| 82 | Pb | свинец | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 2 | 6 |
| 83 | Bi | висмут | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 3 | 6 |
| 84 | Po | полоний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 4 | 6 |
| 85 | At | астат | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 5 | 6 |
| 86 | Rn | радон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 | 6 |
| 87 | Fr | франций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 1 | 7 |
| 88 | Ra | радий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 | 7 |
| 89 | Ac | актиний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 6d 1 | 7 |
| 90 | Th | торий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 6d 2 5f 0 | 7 |
| 91 | Pa | протактиний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 2 6d 1 | 7 |
| 92 | U | уран | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 3 6d 1 | 7 |
| 93 | Np | нептуний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 4 6d 1 | 7 |
| 94 | Pu | плутоний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 5 6d 1 | 7 |
| 95 | Am | америций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 7 | 7 |
| 96 | Cm | кюрий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 7 6d 1 | 7 |
| 97 | Bk | берклий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 8 6d 1 | 7 |
| 98 | Cf | калифорний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 10 | 7 |
| 99 | Es | эйнштейний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 11 | 7 |
| 100 | Fm | фермий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 12 | 7 |
| 101 | Md | менделеевий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 13 | 7 |
| 102 | No | нобелий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 | 7 |
| 103 | Lr | лоуренсий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 1 | 7 |
| 104 | Rf | резерфордий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 2 | 7 |
| 105 | Db | дубний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 3 | 7 |
| 106 | Sg | сиборгий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 4 | 7 |
| 107 | Bh | борий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 5 | 7 |
| 108 | Hs | хассий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 6 | 7 |
| 109 | Mt | мейтнерий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 7 | 7 |
| 110 | Ds | дармштадтий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 8 | 7 |
| 111 | Rg | рентгений | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 9 | 7 |
| 112 | Cn | коперниций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 | 7 |
| 113 | Nh | нихоний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 1 | 7 |
| 114 | Fl | флеровий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 2 | 7 |
| 115 | Mc | московий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 3 | 7 |
| 116 | Lv | ливерморий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 4 | 7 |
| 117 | Ts | теннесcин | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 5 | 7 |
| 118 | Og | оганесон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 6 | 7 |
| Таблица 2. Электронная конфигурация атомов | ||||
Если Вы хотите узнать, как составить электронную конфигурацию, обратитесь к статье «как написать электронную конфигурацию»