Что такое положительный хемотаксис
Хемотаксизм в чем он состоит, примеры
хемотаксис Это биологический процесс, в котором движение или смещение некоторых клеток происходит, когда они привлекаются хемотаксическими агентами (химическими веществами). Клетки могут быть прокариотическими или эукариотическими; например, бактерии и лейкоциты.
Это явление встречается у одноклеточных и многоклеточных организмов, у которых есть органы передвижения, которые позволяют им двигаться. Это чрезвычайно важно для всех живых существ. Это требуется с того момента, когда генерируется новое существо, и его важно выполнять на разных стадиях эмбрионального и внутриутробного развития..
Хемотаксизм жизненно важен для выполнения нормальных функций многоклеточных организмов; например, питание и защита организма.
Бактериальный хемотаксис был открыт Энгельманом и Пфеффером более века назад. Было установлено, что эти микроорганизмы могут представлять различные типы хемотаксиса в зависимости от того, является ли стимул притяжением или отталкиванием к хемотаксическому агенту..
Способ, которым происходит хемотаксический ответ или характеристики смещения, варьируется в зависимости от органов передвижения, которыми обладают организмы.
Что такое хемотаксис??
Хемотаксические факторы представляют собой неорганические или органические вещества. В клеточной мембране организмов есть белки хемотаксиса, которые функционируют как рецепторы, обнаруживая различные типы химических градиентов этих веществ..
Движение бактерий
Бактерия плавает по прямой линии, вращая жгутики в направлении, противоположном стрелкам часов. Через определенные промежутки времени происходит изменение направления жгутиков; что проявляется в движениях бактерий, таких как прыжки или прыжки.
В целом, хемотаксические сигналы среды влияют на движение бактерий. Когда бактерии приближаются к привлекательному фактору, плавайте по прямой в течение длительного времени, время от времени прыгая; тогда как когда он отходит от химического фактора, он делает это с большим количеством прыжков.
Хемотаксизм отличается от хемокинеза или хемокинеза тем, что градиент изменяет вероятность движения только в одном направлении; то есть при хемокинезе химическое вещество производит неориентированное или случайное движение организма.
тип
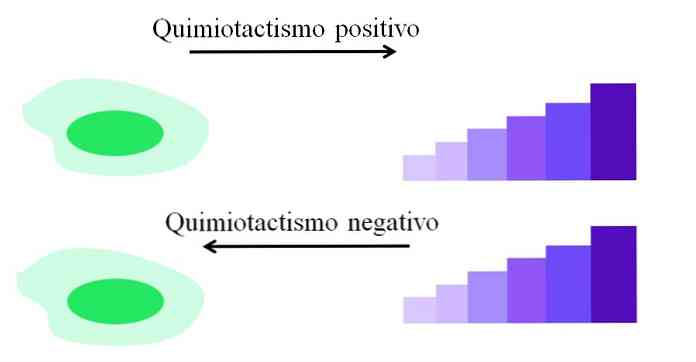
Учитывая смысл или направление движения клеток по отношению к фактору притяжения, описывается существование двух типов хемотаксиса: положительный и отрицательный..
Положительный хемотаксис
Движение организма происходит в направлении большей концентрации химического вещества, найденного в его среде.
Например: когда бактерии движутся или плавают, притягиваются к самой высокой концентрации углерода в форме глюкозы.
Этот тип хемотаксиса представлен на изображении. Организм перемещается в области, где есть большая концентрация вещества, полезного для него; тогда как при отрицательном хемотаксисе происходит обратное: ничто в направлении области, где концентрация вредного вещества ниже.
Отрицательный хемотаксис
Происходит, когда движение организма происходит в противоположном направлении от места, где имеется более высокая концентрация диффундирующего химического вещества..
Пример такого типа отрицательного хемотаксиса возникает, когда бактерии могут отойти от определенных химических веществ, которые им вредны. Они выходят на пенсию, они бегут из того места, где есть вещества, такие как, например, фенол, который для них является ядом.
Помимо описанного хемотаксиса, существует другая классификация движения, которая генерируется в ответ на тип модификации, которая происходит в среде:
-Аэротаксия, то есть движение клеток к месту, где есть оптимальная концентрация кислорода.
-Фототаксия, или движение бактерий в местах, где больше света.
примеров
-Хемотаксизм в бактериальном питании
Присутствие хемотаксического фактора или химического аттрактанта, такого как сахар или аминокислота, фиксируется специфическими рецепторами для этого вещества, расположенного в бактериальной мембране..
Было описано, что метилирование и деметилирование мембранно-специфических белков, опосредованных циклическим гуанозинмонофосфатом (цГМФ), является одним из механизмов, побуждающих бактерии выполнять различные типы хемотаксиса..
Аттрактантные хемотаксические факторы вызывают временное ингибирование деметилирования, тогда как репеллентные факторы стимулируют деметилирование.
-В оплодотворении и эмбриональном развитии
Хемотаксизм ответственен за оплодотворение. В этом случае градиент концентрации обусловлен выбросом прогестерона клубочковыми клетками (которые окружают zona pellucida ооцита). Это заставляет сперму перемещаться к яйцеклетке, расположенной в маточной трубе..
На разных стадиях эмбрионального развития и во время органогенеза клетки мигрируют и организуются в ответ на большое количество специфических хемотаксических факторов; как факторы роста.
-Хемотаксизм при воспалении
Факторы, продуцируемые микроорганизмами
В реакциях воспаления, возникающих в ответ на инфекцию, те же самые микроорганизмы, такие как бактерии, продуцируют хемотаксические вещества. Они вызывают хемотаксис, быструю миграцию или прибытие полиморфных ядерных лейкоцитов в место, где происходит инфекция..
Бактериальные пептиды инициируют с помощью N-формилметионина, который является хемоаттрактантом многочисленных фагоцитарных клеток-хозяев.
Хемотаксический фактор, генерируемый комплементом
Комплемент представляет собой набор сывороточных белков, которые выполняют функцию защиты организма и активируются серией протеолитических реакций в последовательном или каскадном режиме..
Основной функцией фрагмента комплемента C5a является хемотаксис, посредством которого привлекаются нейтрофильные лейкоциты и моноциты. Эти клетки при диапедезе проходят через эндотелий сосудов и достигают инфицированной ткани или слизистой оболочки, вызывая фагоцитоз или проглатывание патогенов или инородных частиц..
Хемотаксические факторы, генерируемые клетками
Некоторые клетки, такие как моноциты и макрофаги, продуцируют хемотаксические вещества, включая лейкотриены и несколько интерлейкинов. В и Т-лимфоциты также выделяют хемотаксические цитокины, действие которых усиливает реакции иммунитета.
-Изменение хемотаксиса при инфекционных заболеваниях
В целом, хемотаксис модифицируется у пациентов с инфекционными заболеваниями, такими как СПИД и бруцеллез.
Хемотаксизм может уменьшаться при нескольких синдромах, при которых ингибируется фагоцитоз. Это может происходить при воспалительных заболеваниях, таких как артрит, метастазирование опухоли, интоксикации асбестом, среди других состояний.
Хемотаксис
Смотреть что такое «Хемотаксис» в других словарях:
хемотаксис — хемотаксис … Орфографический словарь-справочник
хемотаксис — движение подвижных организмов под влиянием одностороннего раздражения хим. веществами. См. также таксис. (Источник: «Микробиология: словарь терминов», Фирсов Н.Н., М: Дрофа, 2006 г.) Хемотаксис направленное движение бактерий, клеток крови или др … Словарь микробиологии
хемотаксис — химиотаксис Словарь русских синонимов. хемотаксис сущ., кол во синонимов: 1 • химиотаксис (1) Словарь синонимов ASIS. В.Н. Тришин … Словарь синонимов
ХЕМОТАКСИС — см. Таксисы … Большой Энциклопедический словарь
ХЕМОТАКСИС — (от хемо. и таксисы), перемещение свободно передвигающихся организмов под влиянием химических веществ. Может быть положительным (движение направлено к источнику химического раздражителя) и отрицательным (от источника). Явление хемотаксиса… … Экологический словарь
ХЕМОТАКСИС — ХЕМОТАКСИС, явление движения низших организмов и подвижных клеток высших животных к определенным хим. раздражителям или от них. В мире растений, когда имеется не передвижение в пространстве, а лишь изменение направления роста, явление это… … Большая медицинская энциклопедия
хемотаксис — Свойство живых свободноперемещающихся клеток (бактерий, макрофагов, нейтрофилов и др.) двигаться на встречу или прочь от специфического химического вещества [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN… … Справочник технического переводчика
Хемотаксис — Хемотаксис двигательная реакция микроорганизмов на химический раздражитель. Содержание … Википедия
хемотаксис — см. Таксисы. * * * ХЕМОТАКСИС ХЕМОТАКСИС, см. Таксисы (см. ТАКСИСЫ) … Энциклопедический словарь
хемотаксис — ЭМБРИОЛОГИЯ ЖИВОТНЫХ ХЕМОТАКСИС – способность сперматозоидов двигаться в направлении биологически активных веществ, выделяемых яйцеклеткой … Общая эмбриология: Терминологический словарь
Хемотаксис
Хемота́ксис — двигательная реакция микроорганизмов на химический раздражитель.
Содержание
Хемотаксис бактерий
Бактерии способны двигаться по направлению к аттрактантам (зачастую питательным веществам) и от репеллентов (например, токсинов). В качестве аттрактантов выступают практически все сахара и аминокислоты, в качестве репеллентов — жирные кислоты, спирты и другие потенциально вредоносные вещества. Чувствительность бактерии впечатляет — они легко детектируют изменение концентрации на 0,1 % при микромолярных концентрациях веществ, а диапазон детектируемых концентраций перекрывает пять порядков.
Аттрактанты и репелленты детектируются за счет непосредственного взаимодействия со специфическими хеморецепторами, а не за счет каких-либо внутриклеточных эффектов детектируемого вещества.
Мембранные рецепторы группируются в кластеры, как правило расположенные на полюсах клетки, однако это не может помочь бактерии уловить разницу концентраций между полюсами, поскольку она будет слишком маленькой из-за малого размера самой клетки.
Вместо этого бактерии ориентируются в химических градиентах путем измерения временных изменений концентраций при движении. Обычно скорость движения Escherichia coli составляет 10—20 своих длин в секунду.
Сравнивая текущую загруженность хеморецепторов специфическими лигандами с таковой несколько секунд назад, клетка фактически может «измерить» разницу концентраций определенного вещества на расстоянии, во много раз превышающем длину самой клетки.
Такое измерение концентрации лиганда во времени возможно за счет адаптивного метилирования хеморецепторов, которое зависит от загруженности их лигандами.
Задержка во времени, между связыванием лиганда и метилированием рецептора, представляет собой своеобразную молекулярную «память», которая и позволяет измерять изменение концентраций лиганда.
Если выбранное направление движения соответствует увеличению концентрации аттрактанта (снижению концентрации репеллента), то время до следующего кувыркания увеличивается. К сожалению, из-за своего малого размера, клетка постоянно сбивается с «верного» пути броуновским движением и, поэтому, просто не может продолжительно двигаться прямо. Такой механизм только в общем обеспечивает движение бактерии по градиенту концентрации в нужном направлении, но для бактерии является достаточно эффективным.
Механизм, основанный на переключении направления вращения жгутиков, приводящий к прямолинейному движению, которое через варьирующиеся промежутки времени сменяется кувырканием на месте, не является единственным.
У Rhodobacter sphaeroides вращение единственного жгутика сменяется его полной остановкой, а у Rhizohium meliloli вращение жгутика никогда не прекращается — изменяется только его скорость. Но, во всех этих случаях, результат работы сенсорной системы хемотаксиса один и тот же: если бактерия движется в «нужном» направлении — продолжительность такого движения увеличивается.
Сенсорный механизм хемотаксиса более сложен, чем рассмотренные ранее. Это объясняется, прежде всего, двумя причинами.
Во-первых, поскольку броуновское движение может очень быстро изменить ориентацию бактериальной клетки, бактерии должны обрабатывать хемотаксические сигналы очень быстро и, действительно, от стимула до переключения «моторов», у бактериальной клетки, проходит не более 0,2 секунды.
Во-вторых, для правильного сравнения пространственных градиентов, клеткам необходимо такое устройство сенсорного механизма, которое «гасило» бы сенсорную стимуляцию в статических условиях, то есть в отсутствие градиента концентрации, как бы много какого-то аттрактанта или репеллента ни присутствовало бы в среде.
Белковый аппарат хемотаксиса бактерий
Три класса белков участвуют в хемотаксисе: трансмембранные рецепторы, цитоплазматические сигнальные белки и ферменты адаптивного метилирования.
Рецепторы хемотаксиса
Эти белки являются мембранными сенсорами, в принципе аналогичными по своей структуре HnvZ, с тем только отличием, что цитоплазматический сигнальный домен не является автокиназой.
Функцию автокиназы выполняет другой белок — CheA, а сигнальные домены МСР обеспечивают взаимодействие с CheA.
Еще одно отличие от типичного сенсора — по обе стороны сигнального домена располагаются сайты метилирования, необходимые для адаптации рецепторов.
МСР-белки состоят приблизительно из 550 аминокислотных остатков и являются димерами.
Хорошо изучены 4 МСР-белка из Е. coli, реагирующие на серин (Tsr), аспартат и мальтозу (Таr), рибозу, глюкозу и галактозу (Trg) и дипептиды (Тар).
У сальмонелл нет Тар, но есть сенсор цитрата Тер.
Серин, аспартат и цитрат связываются непосредственно с рецепторами, тогда как сахара и дипептиды сначала связываются с соответствующими периплазматическими белками, а уже эти комплексы взаимодействуют с рецепторами.
Кроме того, МСР реагируют на изменения температуры и рН, а также являются рецепторами для различных репеллентов.
Классический рецептор хемотаксиса состоит из
Цитоплазматические домены сенсоров содержат 4 или 5 остатков глутамата, доступных для метилирования.
Трансляция внеклеточного стимула во внутриклеточный сигнал
Для объяснения механизма трансмембранной передачи сигнала молекулой хеморецептора было предложено две модели. Имеющиеся экспериментальные данные не позволяют полностью исключить ни одну из них, однако большинство исследователей склоняется в пользу второй модели (модели пистона).
В соответствии с первой моделью (моделью ножниц) контакт лиганда с дистальными концами связанных с мембраной спиралей хеморецептора может индуцировать значительное перемещение трансмембранных сегментов. В несвязанном с лигандом состоянии субъединицы рецептора предположительно взаимодействуют между собой только в области первого трансмембранного сегмента.
Связывание с лигандом вызывает сближение сенсорных и периплазматических субъединиц, что передается сигнальным субъединицам и обеспечивает их взаимодействие между собой, а в таком виде они уже не могут взаимодействовать с CheA и стимулировать его автокиназную активность. Метилирование создает стерические препятствия для взаимодействия сигнальных доменов между собой, что снова позволяет им стимулировать автокиназную активность CheA.
Сейчас все больше и больше данных накапливается в пользу другого механизма (модель пистона), основанного на скольжении трансмембранных сегментов (ТМС) друг относительно друга. В соответствии с этой моделью аминоконцевой ТМС закреплен в мембране жестко, тогда как второй более подвижен и, при связывании лиганда, скользит «вниз», то есть в сторону цитоплазмы, что и вызывает конформационное изменение цитоплазматического сигнального домена, инактивирующее его. Вариация на эту тему — участие двух амфипатических спиралей линкерного домена в изменении конформации.
Цитоплазматические сигнальные белки и регуляторный механизм хемотаксиса
Взаимодействие между рецепторами и переключателем жгутика осуществляется четырьмя белками:
Пара белков CheA-CheY представляет собой двухкомпонентную регуляторную систему. Наиболее существенным отличием от классических систем является то, что CheY не является транскрипционным фактором и, соответственно, у него отсутствует ДНК-связывающий домен. Гистидинкиназа CheA функционирует в виде димера, с которым связываются два мономера CheW, и уже этот комплекс вступает в ассоциацию с димерным рецептором. В составе такого комплекса автокиназная активность CheA резко возрастает, что усиливает перенос фосфата от CheA
P связывается с FliM моторно-переключательного комплекса базального тела, что приводит к вращению жгутика по часовой стрелке. CheZ предотвращает накопление CheY
P, стимулируя автофосфатазную активность CheY.
При отсутствии аттрактанта концентрация CheY-P поддерживается на уровне, способствующем вращению жгутика преимущественно по часовой стрелке и, следовательно, отсутствию упорядоченного движения бактерии. Связывание аттрактанта с рецептором индуцирует конформационное изменение, которое передается через мембрану и подавляет автокиназную активность CheA. Концентрация CheY
P падает, и жгутики бактерии более продолжительное время вращаются против часовой стрелки. Поэтому клетки будут дольше двигаться прямолинейно, если они попадают в среду с более высокой концентрацией аттрактанта. Однако этот механизм не объясняет, как клетка может реагировать на постоянно возрастающую концентрацию аттрактанта. Этой цели служит сенсорная адаптация.
Метилазы хемотаксиса и сенсорная адаптация
Адаптация сенсорного аппарата достигается путем обратимого метилирования рецепторов, в котором участвуют два белка — метилтрансфераза CheR и метилэстераза CheB. Метилирование рецепторов оказывает действие, противоположное связыванию аттрактанта. Интересно, что метилирование стимулируется связыванием аттрактанта с рецептором и в конечном итоге нейтрализует эффект связывания аттрактанта. Однако между связыванием аттрактанта и метилированием рецептора проходит некоторое время, в течение которого бактерии движутся прямолинейно, что и составляет основу молекулярной памяти аппарата хемотаксиса.
Метилтрансфераза CheR метилирует остатки глутамата в цитоплазматических доменах МСР с постоянной скоростью, перенося метильную группу с S-аденозилметионина. Регуляции со стороны сенсорного аппарата хемотаксиса подвергается не метилирование рецепторов, а обратный процесс, зависящий от белка CheB. CheB является мишенью для переноса фосфата с CheA
P, и в фосфорилированном состоянии CheB является метилэстеразой, деметилирующей МСР.
В отсутствие стимула метилирование МСР, осуществляемое CheR, компенсируется удалением метильных групп фосфорилированным CheB, что поддерживает метилирование МСР на уровне 0,5-1 метильная группа на субъединицу рецептора.
Когда аттрактант связывается с рецептором и ингибирует активность CheA, концентрация CheB
P падает, хотя и более медленно, чем концентрация CheY
P не является субстратом для CheZ. Повышение степени метилирования восстанавливает способность рецептора стимулировать CheA. Однако, даже после того как базальные уровни CheY
P восстанавливаются, связанный с аттрактантом рецептор остается метилированным, поскольку метилированный рецептор — более плохой субстрат для метилэстеразы CheB
Таким образом, с учетом метилирования принцип работы молекулярной машины хемотаксиса выглядит следующим образом.
P происходит дефосфорилирование CheB
P, хотя и с меньшей скоростью (поскольку CheB-P не является субстратом для CheZ), что приводит к повышению степени метилирования рецептора и восстановлению его сигнальной активности.
Поскольку и CheY, и CheB являются свободными цитоплазматическими белками, степень их фосфорилирования будет зависеть от степени метилирования рецепторов и их загруженности лигандами. Это делает возможным вместо ответа «все или ничего» плавно регулировать подвижность бактерий в широком диапазоне концентраций аттрактантов и репеллентов. Метилирование рецепторов обеспечивает простейшую молекулярную память, позволяющую бактерии контролировать «правильность» направления движения. Уровень метилирования будет высоким, если концентрация аттрактанта была высокой некоторое время назад. Когда клетка движется, она «сравнивает» сиюмоментную концентрацию аттрактанта (определяемую по степени занятости рецепторов) с концентрацией в недавнем прошлом (как зафиксировано степенью метилирования рецепторов). Если окружающие условия значительно улучшились или ухудшились, активность гистидинкиназы СheА будет соответственно снижена или повышена, изменяя продолжительность прямолинейного движения бактерии соответствующим образом.
Послеоперационный метаболизм и иммунный статус
Механизмы иммунологических изменений многообразны, однако бесспорно, что они являются неотъемлемой частью всего комплекса патофизиологических реакций послеоперационного периода, инициируемые одними и теми же триггерами альтерации и физиологического стресса и имеющими тесную связь с процессами катаболизма. Основными инициаторами иммунных реакций в послеоперационном периоде являются вышеописанные эндокринные изменения, которые воздействуют на составляющие иммунитета через активацию симпатоадреналовой, ренин-ангиотензин-альдостероновой систем, освобождение антидиуретического гормона и нарушение утилизации глюкозы. Как в норме, так и на фоне развития различных патологических процессов, на функционирование иммунной системы влияют адренокортикотропный гормон (АКТГ), соматотропный гормон, кортикостероиды, инсулин.
Одним из триггерных механизмов, реализующих иммуносупрессию у хирургических больных, является гиперфункция коры надпочечников при активации всей гипоталамо–гипофизарно–надпочечниковой системы. Большинство исследователей иммуносупрессию при хирургическом стрессе связывают именно с усилением секреции АКТГ гипофизом, что приводит к увеличению концентрации глюкокортикоидов в плазме при усилением их выработки в коре надпочечников. При этом высокие концентрации глюкокортикоидов ингибируют развитие воспалительной реакции, вызывают деградацию и гибель лимфоцитов и плазматических клеток, особенно снижая количество Т-лимфоцитов, главным образом, за счет уменьшения доли Т-хелперов, а также уменьшают число эозинофилов. Кроме этого показано, что АКТГ способствует снижению миграционной способности лимфоцитов периферических лимфатических узлов, селезенки, тимуса, а также тормозит миграцию стволовых клеток и В-лимфоцитов из костного мозга.
Повышение содержания эндогенных катехоламинов обусловливает увеличение содержания в периферической крови нейтрофилов и лимфоцитов, а также изменения их мобилизации и разрушения. Большую часть лимфоцитов, включающихся в циркуляцию при гиперкатехоламинемии, многие авторы именуют “стрессовыми лимфоцитами», так как функционально и морфологически они отличаются от нормальных популяций. При этом снижается процент Т-хелперов при сохраняющемся проценте Т-супрессоров. Одним из следствий повышенной секреции катехоламинов является активация перекисного окисления липидов с накоплением продуктов свободно-радикального окисления, повреждающими биологические мембраны клетки. В результате происходит повреждение важнейших регуляторных механизмов клеток, в том числе и лейкоцитов: нарушаются рецепторная и транспортная функции мембран, контактные свойства клеточных поверхностей и, что самое важное — межклеточные взаимодействия.
К гормонам, оказывающим противоположное, иммуностимулирующее действие, относят соматотропный гормон и инсулин. Соматотропный гормон оказывает активное влияние на лимфоидную ткань за счет его специфической активации тимуса. Экспериментально показано, что введение в организм экзогенного соматотропного гормона вызвает стимуляцию как гуморальных, так и клеточных иммунных реакций. Известно, что лимфоциты имеют два вида рецепторов для инсулина: гормональный рецептор для метаболических функций, находящийся на всех активированных лимфоцитах, и иммунологический рецептор, расположенный на Т- и В-лимфоцитах. При этом инсулин усиливает цитолитический эффект у сенсибилизированных Т-киллеров. С другой стороны, некоторые авторы иммуностимулирующий эффект инсулина связывают не столько с прямым действием на лимфоциты, сколько с предотвращением иммуносупрессивного влияния гипергликемии.
Таким образом в условиях стрессорных влияний операционной травмы отчетливое иммуносупрессивное действие оказывает АКТГ и кортикостероиды. Несмотря на то, что прямое влияние катехоламинов на различные механизмы функционирования иммунной системы требуют дальнейших исследований, большинство авторов сходятся на наличии опосредованного влияния катехоламинов на иммунитет, такого, например, как стимуляция секреции кортикостероидов. Анаболические агенты инсулин и соматотропный гормон, напротив, оказывают иммуностимулирующий эффект.
Катаболический тренд обмена веществ в послеоперационном периоде и связанная с ним белково-энергетическая недостаточность являются причиной дисфункции всех компонентов иммунной системы — фагоцитоза, гуморального и клеточного иммунитета. Взаимосвязь иммунитета и послеоперационной нутритивной недостаточности по мнению подавляющего большинства исследователей настолько очевидна, что отдельные показатели состояния иммунной системы используются для оценки динамики нутритивного статуса у оперированных пациентов (см. ниже).
Белково-энергетическая недостаточность, присущая послеоперационному периоду, сопровождается снижением количества лимфоцитов в периферической крови. Наблюдается преимущественное уменьшение числа CD3+ Т-лимфоцитов при относительно стабильном содержании В-лимфоцитов и увеличении доли нулевых клеток. Считается, что среди Т-лимфоцитов белковому голоданию наиболее подвержены CD4+ лимфоциты. На фоне снижение общего уровня Т-лимфоцитов в периферической крови отмечается снижение Th0 лимфоцитов в результате увеличения числа Th2 лимфоцитов.
Как правило, максимум иммунодепрессии практически по всем параметрам иммунной системы наблюдается на 2-й день после операции и в зависимости от характера и объема этой операции, а также исходного состояния больного ее длительность может составлять от одной до четырех недель.
Возникающие в послеоперационном периоде девиации иммунной системы от гипервоспаления до иммунносупрессии большинство современных исследователей объясняют с точки зрения нарушения баланса между про- и противовоспалительными цитокинами. Как известно продукция провоспалительных медиаторов, являясь изначально типичной защитной реакцией, при чрезмерной активации может привести к развитию синдрома системной воспалительной реакции (ССВР) с последующими критическими нарушениями гемоперфузии и развитием синдрома полиорганной недостаточности (СПОН). С другой стороны призванный компенсировать гипервоспаление противоспалительный медиаторный ответ также может играть крайне неблаговидную роль, открывая возможности для развития назокомиальных инфекций и опухолевой прогрессии на фоне развивающейся иммуносупрессии. Очевидно, что именно деликатная регуляция продукции медиаторов с противоположными биологическими эффектами позволяет организму поддерживать иммунный гомеостаз на тонкой грани, разделяющей гипервоспаление и иммуносупрессию (см. табл. 1).
Таблица 1. Медиаторы воспалительного ответа.
Провоспалительные цитокины
Противовоспалительные цитокины