Что такое положительный хирургический край
Что такое положительный хирургический край
Рак молочной железы (РМЖ) в настоящее время занимает лидирующее место среди заболеваний женского населения планеты, особенно в возрастной группе старше 50 лет. Так, из 10 млн выявляемых в мире онкологических заболеваний РМЖ составляет > 10%, а за последнее десятилетие данная патология превзошла по частоте встречаемости рак шейки матки. Консервативная хирургия по сохранению груди с последующим облучением всей груди является стандартным вариантом лечения рака молочной железы (РМЖ) на ранней стадии на протяжении уже более 25 лет. Со временем частота местных рецидивов (в сроки до 10 лет) неуклонно снижалась и в настоящее время составляет 2 см [8, c. 990].
Также имеются другие факторы, кроме края резекции, которые влияют на частоту рецидивов. В метаанализе, включившем 7174 пациента, получавших органосохранную хирургию и ЛТ, относительный риск (ОР) развития местного рецидива у пациентов с опухолями, экспрессирующими гормональные рецепторы или HER2, составил 0,49 (95%-ный доверительный интервал [ДИ] 0,33–0,73) по сравнению с пациентами с тройным негативным раком (OP=0,33) [9, c. 840]. Влияние биологии опухоли на местный рецидив настолько глубокое, что статистически значимые различия в частоте наблюдаются среди опухолей размером 1 см и менее в зависимости от рецептора эстрогена (РЭ), рецептора прогестерона (РП) и статуса HER2 [10, c. 715]. Даже в подгруппе пациентов с отрицательными лимфоузлами, но с положительными РП и отрицательным HER2 показаны химиотерапия и тамоксифен – Mamounas и соавт. [11, c. 1682].
Другим фактором, существенно влияющим на частоту локального рецидива, является широкое применение адъювантной системной терапии. В одном метаанализе было показано, что тамоксифен в течение 5 лет уменьшил ОР рецидива до 0,47 по сравнению с плацебо (ОР=0,63) [12, c. 2091]. Достижения таргетной терапии также улучшили результаты выживаемости. Например, применение ингибиторов ароматазы или продолжительной гормональной терапии снизило ОР локального рецидива с 0,83 до 0,50 по сравнению с только тамоксифеном [13, c. 22]. Добавление трастузумаба к химиотерапии снижает ОР локального рецидива до 0,47 по сравнению с одной только химиотерапией, что приводит к снижению 3-летней частоты локального рецидива с 7% до 1% (р=0,01) [14, c. 1988]. В крупном анализе (n=86 598) пациентов, участвовавших в 53 рандомизированных исследованиях за период с 1990 по 2011 гг., доля локального рецидива в общем числе уменьшилась с 30% до 15% (p 2 см и клиническая болезнь N2 или N3 были статистически значимыми предикторами локального рецидива после органосохранного лечения РМЖ [30, c. 2303].
Все предостережения, касающиеся отсутствия стандартного подхода к патологической оценке полей при инвазивном раке, применимы к экстенсивным внутрипротоковым карциномам, а данные рандомизированных исследований уровня I о влиянии увеличения ширины полей на локальный рецидив отсутствуют. Существует несколько причин, по которым оптимальная ширина полей для этого типа может отличаться от инвазивного рака. Было продемонстрировано, что экстенсивная внутрипротоковая карцинома развивается в протоках прерывисто, что способствует возникновению остаточной опухоли. Поэтому ретроспективные исследования показали, что отрицательный край резекции ≥ 1 см и ЛТ снижают частоту локального рецидива. Это служило основой решения SSO, ASTRO и ASCO о разработке междисциплинарного, основанного на фактических данных консенсусного руководства для этих типов рака в 2015 г. Это руководство опирается на большой метаанализ, который включал 7 883 пациента в 20 исследованиях и 865 случаев локального рецидива. Медиана наблюдения составила 78,3 месяца, а частота локального рецидива – 8,3% [31, c. 3811]. Из-за неоднородности исследований был проведен как частотный, так и байесовский сетевой анализ, который подтвердил, что отрицательные поля по сравнению с положительными полями уменьшили риск локального рецидива примерно на 50%.
Заключение. Таким образом, рак молочной железы остается актуальной проблемой в онкологии. Несмотря на имеющиеся достижения, результаты еще остаются не вполне удовлетворительными. На результаты лечения влияют многие факторы, такие как биологические особенности опухоли, стадия опухолевого процесса, гормональный статус, возраст, гистологическая структура опухоли, выбор метода лечения и др. В последнее время мастэктомию упорно вытесняют органосохранные операции. Такой консервативный подход с использованием лучевой и гормонотерапии с учетом гормонального статуса позволил достичь хороших результатов в лечении. Однако до сих пор нет единого мнения, каковы должны быть величины ширины размеров края резекции при ранних стадиях рака молочной железы. Обзор литературных данных показал, что, к сожалению, количество повторных иссечений еще наблюдается, несмотря на четкую маркировку операционного поля. Диапазон дискутируемой разными авторами ширины резекции широк и колеблется от 1 мм до 10 мм. Однако метаанализы многочисленных исследований показали, что отрицательным край должен считаться при ширине 2 мм и менее.
Рак предстательной железы: диагностика и результаты хирургического лечения локализованных и местнораспространенных форм
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Военно-медицинская академия, Санкт-Петербург
Р ак предстательной железы (РПЖ) является большой социальной и медицинской проблемой. В 1999 г. в США было зарегистрировано более 179 тыс новых случаев РПЖ и 37 тыс человек умерло от РПЖ [2]. РПЖ является самым частым злокачественным новообразованием, встречающимся у мужчин в США, занимает второе место в списке смертей от рака и составляет 29% среди всех диагностированных новообразований. В России сведения противоречивы из–за отсутствия скрининговых программ. Введение подобных программ в США и других странах привело к повышению числа выявляемых случаев РПЖ, которые можно лечить радикально [4].
РПЖ характеризуется непредсказуемостью клинического течения. Некоторые опухоли остаются латентными многие годы, а некоторые быстро прогрессируют в некурабельные метастатические заболевания [13]. Лечение пациентов с локализованным РПЖ является центральным вопросом для практикующих урологов. В течение 10 лет увеличилась не только частота РПЖ, но и возросли возможности различных способов лечения. В настоящее время пациент и его врач могут выбирать между хирургическим лечением – радикальной простатэктомией (РПЭ), наружной лучевой терапией, брахитерапией, криоаблацией, андрогенной блокадой и комбинацией этих методов.
| Безрецидивная выживаемость после РПЭ у пациентов с негативными хирургическими краями составляет 80%. |
Наиболее частым выбором радикального лечения у мужчин с локализованным РПЖ являются РПЭ или лучевая терапия. РПЭ выбирают 30–60% пациентов с клинически локализованным РПЖ, и тем самым они получают шанс излечиться. К сожалению, от 29 до 59% клинически локализованных опухолей, удаляемых посредством РПЭ, имеют экстрапростатическое распространение при послеоперационном изучении и не могут быть излечены полностью одной лишь РПЭ. Необнаруженная экстракапсулярная опухолевая экстензия может привести к ее неполному иссечению и повышает риск рецидивирования [5].
Диагностика и стадирование РПЖ
Современные методы локального стадирования включают пальцевое ректальное исследование (ПРИ), определение простатического специфического антигена (ПСА), трансректальное УЗИ, секстантную биопсию, компьютерное аксиальное сканирование и эндоректальное ядерно–магнитнорезонансное (ЯМР) исследование. Недостаточная чувствительность этих методов приводит к недооценке стадии почти в 50% случаев.
Первое исследование, анализирующее края резекции при РПЭ, было опубликовано в 1983 г. Однако многочисленные материалы трудносопоставимы среди клиник, так как представлены бригадами с различной техникой и в разные периоды. Примерно половина мужчин, подвергшихся РПЭ при клинически локализованном РПЖ, имели экстракапсулярную экстензию при патоморфологическом изучении. При этом 5,9% имели позитивные л/узлы, 7,8% – метастазы, 15,6% вовлечение семенных пузырьков [1].
Частота позитивных краев (ПК) при РПЭ варьирует от 16 до 46%. Совершенно очевидно, что главную роль в этих вариациях играют:
• различие в хирургической технике;
• метод подготовки образцов удаленной ПЖ.
В развитых странах происходит существенное изменение структуры пациентов. С 1988 по 1992 гг. только 1,4% кандидатов для РПЭ имели Т1с (непальпируемое заболевание, выявленное при биопсии). В последний год, по данным клиники Johns Hopkins, 46% мужчин имели Т1с. Эти изменения нехарактерны для России, так как, по данным клиники урологии Военно–медицинской академии, 87% пациентов имеют пальпаторные изменения на момент выполнения биопсии простаты (стадия Т2а и более). Непальпируемая опухоль ассоциируется с низкой патологической стадией, малой частотой ПК и меньшим объемом опухоли в сравнении с пальпируемой. Это, как правило, сочетается с более благоприятными исходами.
Традиционными показаниями для РПЭ являются:
• клинически локализованные формы РПЖ Т1b; T1с; T2, в некоторых случаях Т3;
• ожидаемая продолжительность жизни более 10 лет;
• возраст не более 70–72 лет.
Технические различия в выполнении РПЭ
Снижение позитивных хирургических краев может быть обусловлено модификацией хирургической техники. Термин «анатомический подход при РПЭ», заменяется на «нервосохраняющий». Эти изменения в номенклатуре показывают, что решение сохранить или резецировать заднелатеральные сосудисто–нервные пучки (СНП) принимается индивидуально от случая к случаю и основано на пред– и интраоперационных находках. Техника широкого иссечения СНП не была частью стандартной РПЭ. С дальнейшим улучшением понимания перипростатической анатомии стала возможной более тщательная и точная диссекция апикальной части простаты, что уменьшило вероятность позитивного края на этой стороне.
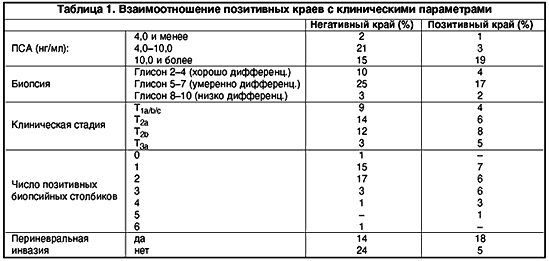
В настоящее время анатомический подход к РПЭ предлагается пациентам с пальпируемыми латеральными очагами, частично в апексе железы, выявленными в предоперационном периоде. В этих случаях прибегают к широкому иссечению одного или обоих СНП. Все мужчины, которые не были потентны до операции, также подвергаются широкой эксцизии обоих СНП. У пациентов с протяженной капсулярной пенетрацией, широкое иссечение СНП ассоциируется с низкой вероятностью позитивных краев в сравнении со случаями, когда эта процедура не выполнялась. По данным клиники Baylor, позитивный хирургический край наиболее часто встречается заднелатерально, в области СНП. Поэтому они модифицировали хирургическую технику и начали резецировать весь или часть СНП более часто. Это привело к снижению частоты ПК на протяжении 1987–90 гг. с 24% до 19%. Опасным является дополнительное иссечение и удаление тканей апикальной области, так как оно приводит к увеличению риска послеоперационного недержания мочи. В клинике урологии ВМА при выполнении 61 радикальной простатэктомии, техника операции (би– или монолатеральное сохранение СНП и пубопростатических связок, объем апикальной резекции) определялась в соответствии с предварительными биопсийными находками. При нахождении злокачественных клеток в двух биопсийных столбиках одной доли, один из которых был выполнен опухолью на всем протяжении, СНП на стороне поражения иссекался. При локализации опухолевых клеток в 3–х биопсийных столбиках производили билатеральное иссечение пучков. Материалы предоперационной биопсии сопоставляли с патологическими находками при изучении удаленной предстательной железы. Частота экстракапсулярной экстензии и позитивных хирургических краев возрастала с увеличением числа позитивных биопсийных столбиков и объема опухолевых клеток в них (табл. 1.)
Влияние ПК на прогрессию РПЖ после РПЭ
Безрецидивная выживаемость для пациентов с негативными хирургическими краями составляет 80%. У пациентов с ПК – от 42 до 64% в течение 5 лет. Только два института имеют 10–летние наблюдения. У пациентов с негативными краями из клиники Hopkins – 74,8% в сравнении с 41,9% у пациентов с ПК. Данные из клиники Duke свидетельствуют о 10–летней безрецидивной выживаемости у 38%.
Безрецидивная выживаемость для пациентов с негативными хирургическими краями составляет 80%. У пациентов с ПК – от 42 до 64% в течение 5 лет. Только два института имеют 10–летние наблюдения. У пациентов с негативными краями из клиники Hopkins – 74,8% в сравнении с 41,9% у пациентов с ПК. Данные из клиники Duke свидетельствуют о 10–летней безрецидивной выживаемости у 38%.
Расхождения между ПК и прогрессией
1. Негативный край и степень злокачественности низка;
2. Позитивный край или степень злокачественности высока;
3. Сочетание ПК и высокой степени злокачественности.
Биохимический и клинический рецидивы после РПЭ
Неудачное радикальное лечение определяется биохимически, как повышенный уровень сывороточного ПСА (> 0,25 нг/мл) при локальном рецидиве или дистантном метастазировании. Биохимический рецидив может быть результатом неполного иссечения опухоли или ростом микрометастазов. В серии Partin et al. вероятность рецидива была прямопропорциональна повышению клинической и биохимической стадии, предоперационному уровню ПСА и сумме Глисона. При ПСА > 10нг/мл частота рецидивирования была 44% в сравнении с 17% при ПСА от 4 до 10нг/мл. Предикторами рецидива являются истинная патологическая стадия, вовлечение ЛУ и семенных пузырьков, сумма Глисона при биопсии, сывороточный ПСА и клиническая стадия при пальцевом ректальном исследовании. Они могут быть использованы для определения вероятности рецидивирования после РПЭ или отбора пациентов для адъювантной терапии [12].
Пациентов после РПЭ можно распределить по прогнозу на 3 группы:
1. Плохой прогноз – вовлечение семенных пузырьков или лимфоузлов или обширная экстракапсулярная пенетрация с суммой Глисона >7;
2. Умеренный – орган-ограниченный рак или незначительная экстракапсулярная пенетрация с суммой Глисона 7 или обширная экстракапсулярная пенетрация с суммой Глисона 6;
Современная хирургическая техника дает возможность полностью удалять экстракапсулярные формы РПЖ у пациентов в стадии Т3N0M0, а также выделять пациентов группы риска, которым при необходимости может назначаться адъювантная терапия [9].
Низкое соотношение метастазирования в ЛУ показывает, что рост опухоли в этой стадии еще длительное время ограничен и поэтому может быть локально излечен. В литературе описывается зависимость частоты поражения ЛУ от объема опухоли и степени ее дифференцировки. При этом отмечают, что подавляющее большинство опухолей в стадии Т3 перед операцией относят к Т2.
Следует остановиться и на комбинированных методах лечения. Так, в клинике Mayo сравнивали равноценные группы пациентов после РПЭ в сочетании с орхэктомией и после одной лишь орхэктомии. С 1967 г. по 1995 г. было оценено 1110 пациентов с позитивными ЛУ. Достигнута общая выживаемость более 10 лет для комбинированной группы (66 ±6%) в сравнении с орхэктомией (28 ±6%). Раковоспецифическая выживаемость в первой группе была выше (79 ±5%), чем в группе с орхэктомией (39 ±7%). Это ретроспективное исследование пациентов в стадии рТХN+ подтверждает, что РПЭ с ранней адъювантной орхэктомией обеспечивает существенные достижения в общей и раковоспецифической выживаемости в сравнении с одной лишь орхэктомией [8].
Теоретически хирургическая циторедукция, уменьшая объем опухоли, делает системную терапию более эффективной. В комбинации РПЭ с андрогенной аблацией 5- и 10–летняя выживаемость без прогрессии составила 80 и 76% соответственно [4]. Исследования позволили сделать вывод, что первичное локальное лечение (РПЭ) приводит к существенному увеличению выживаемости пациентов в сравнении с нелеченными подобным образом.
Эти сообщения указывают на возможность и целесообразность применения активной хирургической тактики как для «традиционных» стадий РПЖ – Т1–Т2, так и в отношении местнораспространенных процессов без вовлечения лимфоузлов (Т3N0M0). Этот опыт особенно бесценен и убедителен у молодых пациентов. Наши результаты подтверждают, что РПЭ является безопасной операцией у тщательно отобранных пациентов при наличии опытной хирургической команды. Кроме того, текущие исследования, возможно, позволят рационально использовать новые методы лечения, такие как использование аутовакцин и дендритных клеток, усиливающие циторедуктивный эффект. Окончательный же ответ на вопрос, показана ли РПЖ и при Т3, может быть дан после очень длительного наблюдения.
1. Brewster S.F., Oxley J.D., Trivella M., Abbott C.D. Preoperative p53, bcl – 2, CD44 and e–cadherin immunohistochemistry as predictors of biochemical relapse after radical prostatectomy. // J.Urol. – 1999. – Vol. 161, №4. – Р.1238–1243.]
2. Сadeddu J.A. Partin A.W., Epstein J.I., Walsh P.C. Stade D1 (T1–3, N1–3, Мо) prostate cancer: a case–controlled comparison of concervative treatment versus radical prostatectomy // Urology. – 1997. – Vol. 50.– P.251–256.
3. Carter H.B. Is sextant prostate biopsy the standard of care in the PSA era. // AUA NEWS. – September/October 1999. – Vol. – 4, – Number 5.
4. Catalona W.J., Partin A.W., Slawin K.M. A multicenter clinical trial evaluation of free PSA in differentiation of prostate cancer from benign disease.// J. Urol., part 2.– 1997.– Vol.157.– P. 111, abstract 434.
5. Editorial: new methods for predicting extracapsular extension before surgery for prostate cancer // J. Urol. – 1999. – Vol. 162, №4. – Р. 1359 – 1360.
6. Epstein J.I., CarMichael M., Walsh P.S. Adenocarcinoma of the prostate invading the seminal vesicle: definition and relation of tumor volume, grade and margins of resection to prognosis// J.Urol.– 1993.– Vol. 149.– P.1040–1046.
7. Garg S., Fortling B., Chadwick D., Robinson M.C., Hamdy F.С. Staging of prostate cancer using 3–dimensional transrectal ultrasound images: a pilot study // J. Urol. – 1999. – Vol. 162, №4. – Р. 1318 – 1321
8. Ghavamian R., Bergstralh E.J., Blute M.L., Slezak J. Radical retropubic prostatectomy plus orchiectomy versus orchiectomy alone for pTxN + prostate cancer: a matched comparison. // J.Urol. – 1999. – Vol. 161, №4. – Р.1223–1228.
9. Gilliland F.D., Hoffman R.M., Hamilton A., Albertsen P., Eley J.W., Harlan L., Stanford J.L., Hunt W.C., Potosky A. Predicting extracapsular extension of prostate cancer in men treated with radical prostatectomy: results from the population based prostate cancer outcomes study // J. Urol. – 1999. – Vol. 162, №4. – Р. 1341 – 1345.
10. Perrotti M., Han K–R., Epstein R E., Kennedy E C., Rabbani F., Badani K., Pantuck A. J., Weiss R. E., Cummings K.B. Prospective evaluation of endorectal magnetic resonance imaging to detect tumor foci in men with prior negative prostatic biopsy: a pilot study // J. Urol. – 1999. – Vol. 162, №4. – Р. 1314–1317.
11. Pound C.R., Сhristens–Barry O.W., Gurganus R.Т., Partin A.W., Walsh Р.С. Digital rectal examination and imaging studies are unnecessary in men with undetectable prostate specific antigen following radical prostatectomy // J. Urol. – 1999. – Vol. 162, №4. – Р. 1337 – 1340.
12. Richie J.P. Screening for prostate cancer. Why the controversy? // Сontemporary Urology. – 1998. – Vol. 10, №7. – P. 26 – 38.
13. Walsh P.С. Detectable PSA after surgery for prostate cancer: what I tell my patients. // AUA NEWS – September / October 1999. – Р. 25.
Положительный хирургический край после радикальной простатэктомии: систематический обзор и последняя информация
Positive surgical margins after radical prostatectomy: a systematic review and contemporary update
Источник
Клиническое значение положительного хирургического края (ПХК) в препаратах после радикальной простатэктомии (РПЭ) и лечение после его диагностики остаются неясными.
Цель
Исправить ошибки в интерпретации патологического состояния хирургического края; представить обновленную информацию о заболеваемости, предикторах и отдаленных онкологических последствиях ПХК в эпоху роботассистированной лапароскопической РПЭ (РАЛРПЭ) и предложить практический научно-обоснованный подход к лечению.
Доказательная база
Систематический обзор литературы был проведен в апреле 2013 года в базах данных Medline/PubMed, Web Science, Scopus и Cochrane. Были включены исследования, посвященные РПЭ при ПХК и связанные с целями настоящего обзора. Особое внимание было уделено публикациям за последние 5 лет, посвященным РАЛРПЭ.
Синтез доказательств
В общей сложности были обнаружены 74 публикации. Недавно Международным обществом урологической патогистологии для преодоления разночтений в публикациях был введен стандарт интерпретации хирургического края. Средневзвешенная частота ПХК в современной серии РАЛРПЭ составляет 15% (диапазон: 6,5-32%) с увеличением у пациентов с более высокой патогистологической стадией и эквивалентно частоте подобных исследований открытой и лапароскопической простатэктомии. Вероятность ПХК сильно зависит от опыта хирурга, независимо от хирургического подхода.
Выводы
Ключевые слова
Анализ замороженных срезов, метастазы, нервосбережение, положительный хирургический край, рак предстательной железы, лучевая терапия, роботассистированная лапароскопическая радикальная простатэктомия, выживание
Патоморфологическая оценка простаты после радикальной простатэктомии
Полный текст:
Аннотация
В статье приведены сведения о зональном строении предстательной железы (ПЖ), схема вырезки макропрепарата после радикальной простатэктомии (РПЭ), частота встречаемости рака предстательной железы (РПЖ) по зонам. Приведён обзор классификации ВОЗ (2016) опухолей предстательной железы, отмечены внесённые изменения, описаны подходы к диагностике вариантов рака, оценка по Глисон, определение градации, клинические прогностические группы риска РПЖ, оценки первичной опухоли согласно международной классификации РПЖ по системе TNM (AjCC 8-е изд.), которая была дополнена и пересмотрена в 2017 году, определены прогностические факторы для ацинарной карциномы и роль иммуногистохимической диагностики в материале ПЖ. В заключении указаны основные значимые параметры, которые должны быть отражены в протоколе прижизненного патологоанатомического исследования по материалу РПЭ.
Ключевые слова
Для цитирования:
Лаптева Т.О. Патоморфологическая оценка простаты после радикальной простатэктомии. Вестник урологии. 2019;7(1):74-83. https://doi.org/10.21886/2308-6424-2019-7-1-74-83
For citation:
Lapteva T.O. Prostate pathological evaluation after radical prostatectomy. Vestnik Urologii. 2019;7(1):74-83. (In Russ.) https://doi.org/10.21886/2308-6424-2019-7-1-74-83
Введение
Одним из самых важных вопросов, стоящих перед урологами и патоморфологами, является определение прогноза после радикальной простатэктомии (РПЭ). Наиболее ценной информацией для ответа на этот вопрос являются результаты патоморфологического исследования препарата после РПЭ. Так, по данным Stamey с соавт. [1] рецидив рака предстательной железы (РПЖ) после РПЭ может быть предсказан с высокой степенью точности на основании результатов патоморфологического исследования.
Для того, чтобы правильно сориентировать и провести вырезку препарата «предстательная железа», нужно знать топографическую анатомию и гистологическое строение органа.
Зональная анатомия предстательной железы
МcNеаl предложил различать периферическую, центральную и переходную зоны, а также передний сегмент и зону сфинктера мочевого пузыря. В широкой урологической практике пользуются упрощённой схемой зональности ПЖ, где выделяют центральную, периферическую, переходную зоны и фибромускулярную строму:
Так же различают периуретральные железы и переднюю фибромускулярную строму («капсула») (рис. 1).
Рисунок 1. Соотношение доли позадилонной РПЭ к роботической РПЭ в США
Figure 1. Number’s ratio of performed retropubic to robotic radical prostatectomy in the United States of America
Периферическая и центральная зоны имеют чёткие различия в строении стромы, протоков, что обусловлено различным эмбриогенезом и демонстрирует различия в их функциях. Переходная зона мало отличима от периферической, а с возрастом и при патологии различия вообще стираются.
Рак предстательной железы развивается с различной частотой в каждой зоне, и эта частота не пропорциональна массе железистой ткани в ней.
Периферическая зона предстательной железы пальпируется через прямую кишку, она окружает центральную зону, в ней возникает около 70% аденокарцином ПЖ. Наиболее часто рак локализуется по задней и заднебоковой поверхностям ПЖ. Карциномы периферической зоны часто прорастают в перипростатические мягкие ткани по периневральным пространствам.
В переходной зоне самой частой патологией является доброкачественная гиперплазия предстательной железы (ДГПЖ), которая может приводить к значительному увеличению этой зоны, иногда превышающему по объёму остальные участки ПЖ. РПЖ в переходной зоне развивается реже, чем ДГПЖ, частота его составляет около 20%. В случае карцином переходной зоны экстра- простатическое распространение происходит по передней поверхности железы. Опухоли из переходной зоны очень редко прорастают в периферическую зону.
Периуретральные железы располагаются между простатической уретрой и проксимальным гладкомышечным сфинктером мочевого пузыря. Фибромускулярная строма занимает переднюю поверхность ПЖ и состоит преимущественно из мышечной ткани.
Простатическая «капсула» не является истинной капсулой, а представляет собой периферическое уплотнение фибромускулярной стромы.
Правила вырезки препарата «предстательная железа» после РПЭ
Препарат, фиксированный в 10% забуференном формалине в течение 24-36 часов, патолог разрезает по определенной схеме (рис. 2). Данная схема вырезки операционного материала позволяет более точно определить локализацию и объём опухолевых очагов.
Рисунок 2. Схема вырезки предстательной железы [2]
Figure 2. Prostate preparation [2]
Макроскопически опухоль обычно представлена очагами неправильной формы диаметром около 5 мм, желтовато-белого цвета, плотной консистенции, что связано с диспластическими изменениями стромы. Некоторые опухоли выглядят как желтоватые зернистые участки, что отличает их от нормальной губчатой ткани предстательной железы. РПЖ имеет тенденцию к мультилокулярному расположению и очень часто не выявляется макроскопически, что требует взятия большого количества материала для микроскопического исследования.
Патогистологический диагноз строится с учётом гистоархитектоники (структурно-тканевых) и цитологических признаков. Подавляющее большинство (до 95%) случаев РПЖ составляет обычная ацинарная аденокарцинома, и только небольшое количество представлено другими вариантами.
Обычно для установления диагноза РПЖ бывает достаточно светооптического микроскопического исследования, прежде всего с определением гистологического варианта опухоли ПЖ.
В 2016 году вышла в свет обновлённая классификация опухолей выделительной и мужской половой системы предстательной железы (WHO Classification of Tumors: Pathology and Genetics). В разделе новообразований предстательной железы наибольшие изменения коснулись группы эпителиальных опухолей. В классификации Всемирной Организации Здравоохранения (ВОЗ) нашли отражение многие положения, принятые на консенсусе ISUP 2014 года. [3].
Таблица 1. Классификация опухолей предстательной железы, ВОЗ (2016)
Table 1. Prostate tumors’ classification by WHO (2016)
Нозологическая форма/Nosological form
Эпителиальные опухоли,/Epithelial tumors
Железистые опухоли/Glandular tumors
Ацинарная аденокарцинома/Acinar adenocarcinoma
Из пенистых клеток/From foam gland
Муцинозная (коллоидная)/Mucinous (colloid)
Перстневидно-клеточного типа/Signet ring-like cell
Плеоморфная гигантоклеточная/Pleomorphic giant cell
Простатическая интраэпителиальная неоплазия
Prostatic intraepithelial neoplasia
Внутрипротоковая карцинома/intraductal carcinoma
Протоковая аденокарцинома/Ductal adenocarcinoma
Уротелиальный рак/Urothelial cancer
Плоскоклеточные опухоли/Squamous tumors
Аденоплоскоклеточный рак/Adenocellular cancer
Плоскоклеточный рак/Squamous cell carcinoma
Базально-клеточный рак/Basal cell carcinoma
Нейроэндокринные опухоли/Neuroendocrine tumors
Аденокарицнома с нейроэндокринной дифференцировкой
Adenocaricinoma with neuroendocrine differentiation
Высокодифференцированная нейроэндокринная опухоль
Highly differentiated neuroendocrine tumor
Мелкоклеточный нейроэндокринный рак
Small cell neuroendocrine cancer
Крупноклеточный нейроэндокринный рак
Giant cell neuroendocrine cancer
Мезенхимальные опухоли/Mesenchymal tumors
Стромальная опухоль с неопределенным потенциалом злокачественности
Stromal tumor with uncertain potential for malignancy.
Стромальная саркома/Stromal sarcoma
Синовиальная саркома/Synovial sarcoma
Воспалительная миофибробластическая опухоль
Inflammatory myofibroblastic tumor
Недифференцированная плеоморфная саркома
Undifferentiated pleomorphic sarcoma
Солитарная фиброзная опухоль/Solitary fibroid
Злокачественная солитарная фиброзная опухоль
Malignant solitary fibrous tumor
Зернистоклеточная опухоль/Granular cell tumor
Гематолимфоидные опухоли/Hematolymphoid tumors
Опухоли неясного происхождения/Tumors of unclear origin
Рабдоидная опухоль/Rhabdoid tumor
Герминогенные опухоли/Germ cell tumors
Светлоклеточная карцинома/Clear cell carcinoma
Метастатические опухоли/Metastatic tumors
Опухоли семенных пузырьков,/Tumors of seminal vesicles
В новой классификации пересмотрены подходы к определению степени дифференцировки и оценке индекса Глисона.
По степени дифференцировки опухоли можно судить о месте возникновения аденокарциномы. Так, аденокарцинома, возникающая в переходной зоне ПЖ, обычно имеет низкую степень и клинически отличается меньшей агрессивностью, чем часто встречающаяся аденокарцинома периферической зоны ПЖ.
Степень дифференцировки опухоли является одним из самых надёжных и полезных признаков определения стадии РПЖ. Определение степени имеет прогностическую ценность, в частности, в отношении признаков распространения РПЖ за пределы ПЖ, инвазии семенных пузырьков, метастазов в лимфатические узлы или в кости.
Фактически все временные показатели наступления рецидивов и выживаемости напрямую коррелируют со степенью, включая показатели выживаемости, продолжительность жизни без метастазов.
Для оценки степени гистологической дифференцировки опухолевой ткани ПЖ используют систему Глисона (D.F. Gleason).
Подсчёт по степени Gleason является прогностически наиболее точным относительно времени наступления рецидива после РПЭ.
Система градации по D.F. Gleason
В 1965 году Дональд Ф. Глисон предложил систему градирования РПЖ, основанную на гистологических критериях опухоли. Новым аспектом этой системы было определение степени дифференцировки рака не по наиболее злокачественному компоненту, а по сумме баллов распространённых структурных характеристик опухоли. В 1974 году система была несколько модифицирована. В 1993 году система градирования по Глисону была рекомендована конференцией ВОЗ и до сих пор остаётся одной из наиболее важных параметров для определения прогноза РПЖ. Система подвергалась минимальным изменениям, нашедшим отражение в 3 корректировках, принятых Международным Обществом Уропатоло- гов в 2005, 2010 и 2014 годах (рис. 3).
Рисунок 4. Схематическая классификация рака предстательной железы по системе TNM (2010)
Figure 4. Schematic representation of prostate cancer classification by TNM system (2010)
Система градации по Глисону определяет пять степеней с уменьшающейся дифференцировкой: от максимально приближенной к строению нормальной железы простаты до недифференцируемых структур. В различных отделах опухоли степень дифференцировки железистых структур может быть различной. Сумма Глисон складывается из градаций 2-х преобладающих структурных компонентов [4]. Каждая степень дифференцировки, из пяти возможных, описывается цифрой от 1 до 5.
Правила составления суммы Глисон:
При этом не следует указывать в биопсии сумму Глисона менее 6 баллов [1], так как отмечена низкая воспроизводимость результатов при последующем исследовании материала РПЭ, в виде повышения индекса Глисона. В отличие от предыдущего издания классификации ВОЗ (2004), описание градации по Глисону начинается со структур, соответствующих 3 баллам. Например, сумма Глисон 6 (3+3), 7 (3+4) или 7 (4+3), 8 (4+4), 8 (3+5) и т. д. На практике значения Глисона 1 и 2 балла используются лишь в исключительных случаях. Опухоль с суммой Глисона 3-4 определена как «встречающаяся иногда при трансуретральной резекции и при мультифокальных опухолях в материале радикальной простатэктомии» [6].
При оценке аденокарциномы в материале РПЭ градируется по системе Глисон больший опухолевый узел, а мелкие фокусы высокодифференцированного рака не подлежат оценке. Исключением является случай, когда в мелком фокусе определяется низкодифференцированный рак [6].
Новая градирующая система аденокарциномы предстательной железы
Наряду с определением нозологического типа РПЖ и степени дифференцировки в классификации ВОЗ (2016) предусмотрены морфологические прогностические группы, принятые на согласительной конференции Международного общества уропатологов (ISUP), 2014 года [7] предусмотрено 5 прогностических градирующих групп (grading group), соответствующих определенной сумме по шкале Глисона (табл. 2). ISUP рекомендует указывать прогностическую группу в гистологическом заключении после суммы баллов по Глисону, например, «7 баллов по Глисону (3+4), группа 2 (G2) или 7 баллов по Глисону (4+3), группа 3 (G3)».
Таблица 2. Определение прогностической группы ацинарной аденокарицномы
Table 2. The definition of the Acinar Adenocarcinoma prognostic group
При этом в классификации сохранены прогностические группы ацинарной аденокарциномы, рассчитывающиеся на основании показателей TNM, уровня ПСА и индекса Глисон (табл. 3).
Таблица 3. Клинические прогностические группы риска рака предстательной железы
Table 3. Clinical prognostics risk groups for prostate cancer
Сумма Глисон, баллы
Gleason Score, points
Прогностические факторы при РПЭ
Ценным прогностическим фактором является наличие экстрапростатической инвазии с определением характера инвазии: фокальная или протяжённая. Опухолевые структуры могут определяться в парапростатической жировой клетчатке, вокруг структур сосудисто-нервного пучка, при выходе опухоли за пределы контура нормальной ткани простаты. Инвазия в семенные пузырьки диагностируется только в случае наличия опухолевого роста в мышечном слое свободной части семенных пузырьков и является плохим прогностическим признаком. Инвазия в интрапростатическую часть семенных пузырьков не является истинной инвазией и имеет лучший прогноз [6].
Оценка статуса краёв резекции является обязательным критерием в оценке материала РПЭ. Положительным хирургическим краем резекции считается непосредственное наличие структур опухоли в маркированной красителем линии. В этом случае необходимо указать локализацию и протяжённость в мм положительного края, если позитивный край локализуется не в области верхушки и основания, указывается интра- или экстрапростаитческий край. Это информация необходима для планирования тактики послеоперационного лечения [8].
Периневральная инвазия в ткани простаты после РПЭ не является значимым прогностическим фактором для ацинарной карциномы, несмотря на это рекомендуется указывать наличие периневральной инвазии в протоколе гистологического заключения. Периневральная инвазия в большинстве случаев обнаруживается вблизи капсулы железы, т. к. там располагается основная масса нервных стволиков. Наличие периневральной инвазии в 50% случаев сопровождается капсулярной пенетрацией через инвазию и распространением по периневральному пространству. Риск прогрессирования после РПЭ у пациентов с наличием периневральной инвазии выше в 2 раза, чем у больных без неё [6].
Лимфоваскулярная инвазия — это стойкий прогностический фактор. Наличие лимфоваскулярная инвазии не влияет на стадию РПЖ, её рекомендовано подтверждать иммуногистохимическим методом.
При морфологической оценке ПЖ по материалу РПЭ после проведённой дооперационной терапии в гистологическом заключении отражаются изменения опухоли, объём опухолевой ткани, при возможности отображается сумма Глисона (она может повышаться). При выраженных изменениях после терапевтического и/или лучевого воздействия сумма Глисон не определяется [8].
Иммуногистохимическая диагностика РПЖ
Раздел иммуногистохимической диагностики в материале ПЖ имеет достаточно ограниченный набор антител и включает в себя [6][8]:
Применение иммуногистохимической диагностики ацинарной аденокарциномы при исследовании материала РПЭ имеет ограниченное значение, т. к. первичная диагностика опухоли была проведена в материале пункционной биопсии. Диагностическую значимость ИГХ исследование в материалах РПЭ имеет в случае:
Заключение
С учётом важности оценки значимых параметров в гистологическом заключении по материалу РПЭ должны быть отображены: гистологический вариант опухоли, степень дифференцировки, сумма Глисона, прогностическая группа, распространённость опухоли по зонам (периферическая, центральная, переходная, апекс) и долям, объем (%) поражения опухолью, степень распространённости: врастает/прорастает псевдокапсулу железы, инвазия в семенные пузырьки, в простатический отдел уретры, в шейку мочевого пузыря, наличие периваскулярной, лимфоваскулярной инвазии, интра-, экстрапериневральной инвазии, состояние краёв резекции, оценка лимфатических узлов на наличие метастазов опухоли, стадия (рTNM), МКБ-О код (ICD-О code). Проводится оценка лечебного патоморфоза опухоли в случаях предоперационного лечения.
Список литературы
1. Stamey TA, Yemoto CM, McNeal JE, Sigal BM, Johnstone IM. Prostate cancer is highly predictable: a prognostic equation based on all morphological variables in radical prostatectomy specimens. J Urol. 2000;163(4):1155-1160. PMID: 10737486
2. Пушкарь Д.Ю., Говоров А.В., Сидоренков А.В., При-лепская Е.А., Ковылина М.В. Ранняя диагностика рака предстательной железы. Методические рекомендации №19. М.: ИД «АБВ-пресс»; 2015:8-9.
3. Berney DM, Beltran L, Fisher G, North BV, Greenberg D, M0ller H, Soosay G, Scardino P, Cuzick J. Validation of a contemporary prostate cancer grading system using prostate cancer death as outcome. Br J Cancer. 2016;114(10):1078-1083. DOI: 10.1038/bjc.2016.86
4. Moch H, Humphrey PA, Ulbright TM, Reuter VE, eds. WHO Classification of Tumours of the Urinary System and Male Genital Organs. vol. 8. 4th ed. WHO Press; 2016. ISBN-13 (Print Book) 978-92-832-2437-2.
5. Франк Г.А., Андреева Ю.Ю., Москвина Л.В., Ефремов Г.Д., Самойлова С.И. Новая классификация ВОЗ опухолей предстательной железы. Архив патологии. 2016;78(4):32-42. DOI: 10.17116/patol201678432-42
6. Горбань Н.А., Кудайбергенова А.Г. Трепанобиопсия предстательной железы: взгляд морфолога. М.: ИД «АБВ-пресс»; 2017:101-117.
7. Adam M, Hannah A, Budaus L, Steuber T, Salomon G, Michl U, Haese A, Fisch M, Wittmer C, Steurer S, Minner S, Heinzer H, Huland H, Graefen M, Sauter G, Schlomm T, Isbarn H. A tertiary Gleason pattern in the prostatectomy specimen and its association with adverse outcome after radical prostatectomy. J Urol. 2014;192(1):97-101. DOI: 10.1016/j.juro.2014.01.029
8. Опухоли мочевыделительной системы и мужских половых органов. Морфологическая диагностика и генетика: Руководство для врачей. Под ред. Андреевой Ю.Ю., Франка Г.А. М.: Практическая Медицина; 2012:110-167.
Об авторе
Ростов-на-Дону, тел.: +7 (988) 533-46-45
Для цитирования:
Лаптева Т.О. Патоморфологическая оценка простаты после радикальной простатэктомии. Вестник урологии. 2019;7(1):74-83. https://doi.org/10.21886/2308-6424-2019-7-1-74-83
For citation:
Lapteva T.O. Prostate pathological evaluation after radical prostatectomy. Vestnik Urologii. 2019;7(1):74-83. (In Russ.) https://doi.org/10.21886/2308-6424-2019-7-1-74-83