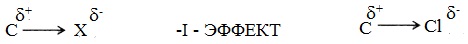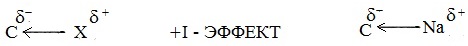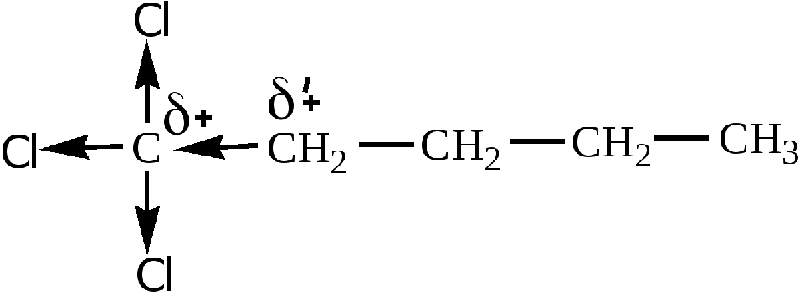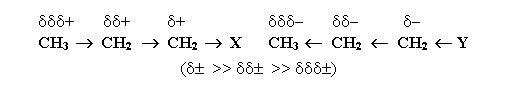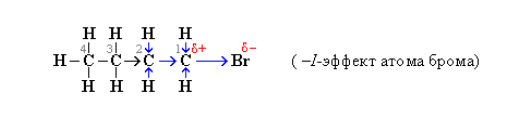Что такое положительный индуктивный эффект
Что такое положительный индуктивный эффект
Индуктивный (индукционный) эффект (I) – это смещение электронной плотности вдоль σ–связи от одного атома к другому вследствие их разной электроотрицательности. При этом происходит поляризация связи.
Наличие в молекуле полярной σ–связи вызывает поляризацию ближайших двух-трех σ–связей и ведет к возникновению частичных зарядов δ+ (дельта плюс) или δ– (дельта минус) на соседних атомах.
Направление смещения электронной плотности всех σ-связей обозначается прямыми стрелками (по линии связи) и символами частичных зарядов.
Из-за слабой поляризуемости σ-связей I-эффект быстро затухает с удалением от заместителя и через 3-4 связи становится практически равным нулю.
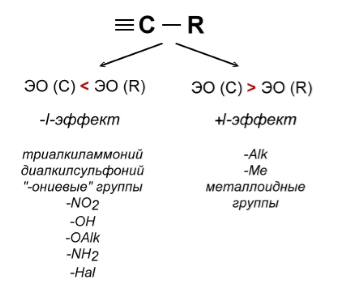
Атомы и группы атомов, электроотрицательность которых больше электроотрицательности атома углерода, в связах с ним оттягивают на себя электроны связи и обладают отрицательным индуктивным эффектом –I (электроноакцепторы). При этом заместитель приобретает частичный отрицательный заряд (δ-), а атом углерода – частичный положительный заряд (δ+).
Атомы и группы атомов с меньшей электротрицательностью отталкивают от себя электроны в связях с углеродом и обладают положительным индуктивным эффектом +I (электронодоноры). При этом заместитель приобретает частичный положительный заряд (δ+), а атом углерода частичный отрицательный заряд (δ-).
Заместители, вызывающие отрицательный индуктивный эффект:
Заместители, вызывающие положительный индуктивный эффект:
Что такое положительный индуктивный эффект
Теоретические представления в органической химии
Индуктивным эффектом называют смещение электронов σ-связи (полярность связи). Он определяется разницей электроотрицательностей связываемых атомов элементов. Если атом или группа атомов оттягивает электронную плотность, она проявляет отрицательный индуктивный эффект. В результате на атоме углерода наводится частичный положительный заряд (-I-эффект). Напротив, атомы более электроположительных, чем углерод элементов проявляют положительный индуктивный эффект (+I-эффект), благодаря которому на С-атоме возникает частичный отрицательный заряд.
По углеродной цепи индуктивный эффект передается плохо, он быстро затухает:
Индуктивный эффект аддитивен:
Явление перераспределения электронной плотности в молекуле, происходящее с участием p-орбиталей, называется мезомерным эффектом. Он может быть положительным, если атом (группа атомов) повышает электронную плотность на реакционном центре (+М-эффект).
В противоположном случае эффект отрицателен (-М-эффект).
Индуктивный и мезомерный эффекты действуют в нереагирующей молекуле. При поляризации молекулы в реакционном акте электронные эффекты называются индуктомерный (±ID) и электромерный (±Е) и характеризуют поляризуемость молекулы.
Структурные формулы не отражают реальное распределение электронной плотности. Поэтому была разработана теория резонанса, согласно которой состояние молекулы может быть описано набором структур, в которых атомы остаются на своих местах, а электроны смещаются в крайние положения (граничные, резонансные или канонические структуры). Реальная молекула представляет собой гибрид резонансных структур. Чем большим числом неразличимых структур описывается молекула, тем она стабильнее.
Резонанс не является физическим явлением. Это – лишь один из способов приблизить изображения химических структур к выражению их реального состояния.
Индуктивный эффект в органической химии (для «чайников»)
Химия… Как много в этом слове, не так ли? Не переживайте, дорогие студенты, мы сделаем все, чтобы максимально понятно донести до вас всю суть этого странного инопланетного предмета так, чтобы хотя бы сдать сессию.
И сегодня темой нашего обсуждения становится индукционный или индуктивный эффект, который довольно непонятно описывают разные книги по органической химии с нуля (даже те, что для чайников).
Карты на стол: что такое I-эффект?
Из школьных уроков химии мы выяснили (или должны были выяснить), что ковалентная связь возникает лишь среди атомов с разной электроотрицательностью.
Имеющаяся в молекуле полярная сигма-связь способствует поляризации ближайших 2-3-х сигма-связей, что приводит к образованию частичных зарядов дельта плюс или дельта минус на соседних атомах.
Прямые стрелки по линии связи, а также индуцируемые заместителем символы частичных зарядов показывают направление смещения электронной плотности всех сигма-связей.
Так получается, что Х(Y)-заместители способствуют поляризации не только собственной связи, но и соседних.
Данный вид влияния атомов приводит к поляризации ковалентных связей, а также к индуцированию зарядов на атомах, благодаря чему процесс и получил название индукционного (индуктивного) эффекта.
Индукционный (индуктивный) эффект – сдвижение электронной плотности по цепи сигма-связей из-за различий электроотрицательности атомов.
А так как поляризуемость сигма-связей слабая, индукционный эффект довольно быстро пропадает, постепенно удаляясь от заместителя. Так что уже к третьей-четвертой связи он становится практически нулевым.
Когда индукционный эффект называют отрицательным и положительным?
Как вы видите, индукционный эффект может быть положительным и отрицательным.
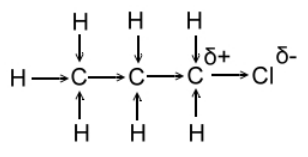
В первом случае заместитель будет увеличивать электронную плотность на атоме углерода, образуя (или вырабатывая) на нем частично отрицательный заряд. А тем временем сам он приобретает положительный заряд.
Во втором случае (то есть при индукционномэффекте со знаком минус) заместитель будет уменьшать электронную плотностьна атоме углерода, с которым наш с вами заместитель собственно и связан. В это время у заместителя образуется частичный отрицательный заряд (дельта-), а у атома углерода – частично положительный (дельта+).
Направление (то есть определяющий знак – минус или плюс) индукционного эффекта заместителя можно оценить при сравнивании с атомом водорода, чей индукционный эффект равен нулю:
Вот, в принципе и вся органическая химия индукционного эффекта. С нуля вы можете просмотреть традиционно подобранный нами по этой теме видеоурок для «чайников»:
И совершенно не обязательно сидеть и читать днем и ночью учебник по органической химии, чтобы понять какие-то сложные понятия – мы будем помогать вам разбираться в сложных понятиях. А как понять органическую химию с нуля, если вам на днях предстоит сложнейший экзамен или контрольная? Ну и тут все просто – не надо понимать, надо обратиться за помощью к тем, кто всегда рядом – к нашим авторам, знающим о химии все! Купить недорого курсовую работу на заказ вы всегда можете обратившись в Заочник.
Наталья – контент-маркетолог и блогер, но все это не мешает ей оставаться адекватным человеком. Верит во все цвета радуги и не верит в теорию всемирного заговора. Увлекается «нейрохиромантией» и тайно мечтает воссоздать дома Александрийскую библиотеку.
Индуктивный эффект и эффект поля
Вы будете перенаправлены на Автор24
Основные понятия и определения
Рисунок 1. Знак индуктивного эффекта
Дипольный момент молекулы может рассматриваться с двух точек зрения:
общий дипольный момент как векторная сумма диполей отдельных связей;
молекула как система нескольких фрагментов, поляризующихся в поле, создаваемом диполем полярной группы.
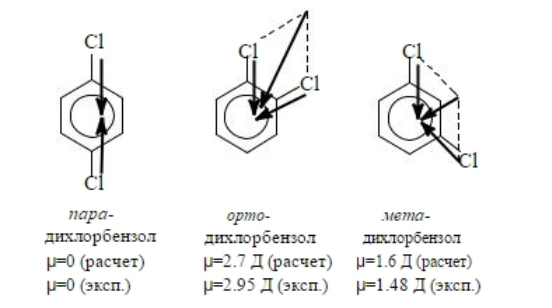
Первый подход удобен при оценке наличия дипольного момента у симметричных молекул и их несимметричных изомеров (рис. 2).
Рисунок 2. Дипольный момент изомеровдихлорбензола
Однако рассчитанные таким образом значения дипольных моментов могут существенно отличаться от экспериментально определенных, что связано с внутримолекулярным взаимодействием полярных групп, которое выражается в увеличении дипольного момента с увеличением размеров алкильной группы.
Индуктивный эффект
Готовые работы на аналогичную тему
Представление об индуктивном эффекте объясняет, почему происходит изменение констант скоростей и равновесий при введении в молекулу какого-либо полярного заместителя.
Эффект поля
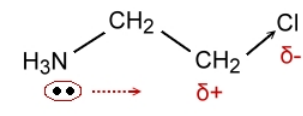
При рассмотрении эффекта поля учитывается пространственное строение органической молекулы и диэлектрическая проницаемости среды, в которой эта молекула находится. В данном случае взаимное влияние частичных электрических зарядов функциональных групп молекулы передается по кратчайшему расстоянию между ними. Рассмотрим это явление на примере молекулы 2-хлорэтиламина (рис. 5). Атом хлора создает частичный положительный заряд на связанном с ним атоме углерода. В результате неподеленная электронная пара атома азота в соответствии с законом Кулона смещается в сторону этого атома углерода, что, в свою очередь, снижает основность аминогруппы.
Рисунок 5. 2-хлорэтиламин
В большинстве случаев индуктивный эффект и эффект поля действуют в одном направлении. Поэтому отделить один эффект от другого очень трудно и их часто рассматривают совместно. Комбинацию индуктивного эффекта и эффекта поля называют полярным эффектом. Однако используют и простой термин «индуктивный эффект», подразумевая, что в это понятие включается и индуктивный эффект Льюиса, и эффект поля.
Что такое положительный индуктивный эффект
2. ХИМИЧЕСКАЯ СВЯЗЬ. ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Остановимся на одном из важнейших вопросов химии, как осуществляется связь атомов в молекулах? Используя знания, полученные в курсе неорганической химии, рассмотрим вопросы природы химической связи между атомами или типы химических связей.
Современная теория химической связи базируется на квантово-механических представлениях о строении молекулы. Впервые электронную теорию химической связи, предложили в 1916 г. немецкий ученый В. Коссель и американский ученый Дж. Н. Льюис. Авторы электронной теории выдвинули идею о том, что химическая связь – результат взаимодействия внешних электронных оболочек атомов. Образуя химическую связь, каждый атом стремится заполнить внешнюю электронную оболочку до конфигурации, присущей инертным газам. При этом он принимает участие в образовании обшей электронной пары, отдает или принимает электроны. Принцип заполнения валентных оболочек до конфигурации инертных газов получил название октетное правило.
ТИПЫ ХИМИЧЕСКИХ СВЯЗЕЙ
Согласно принятой в настоящее время классификации существует несколько типов химической связи: ионная, ковалентная, водородная, металлическая и др. По способу образования химической связи различают две основные: ионную и ковалентную.
Ионная связь – характерна для атомов значительно отличающихся по электроотрицательности. Ионный тип связи характерен для неорганических соединений.
Рассмотрим, как осуществляется связь в хлориде натрия:
Хлор по сравнению с натрием обладает большей электроотрицательностью, то есть большим сродством к электрону. Вследствие этого электрон переходит с внешней оболочки натрия на внешнюю оболочку хлора, при этом образуются положительный и отрицательный заряды, между которыми действуют силы электростатического притяжения. Ион натрия приобретает электронную конфигурацию неона, а ион хлора – конфигурацию аргона.
Соединения с ионной связью характеризуются относительно большим дипольным моментом, хорошей электропроводимостью, высокими температурами плавления.
Ковалентная связь – основной тип связи в органических соединениях, характеризующийся увеличением электронной плотности между химически связанными атомами в молекуле по сравнению с распределением электронной плотности в свободных атомах.
Ковалентная связь возникает между атомами, имеющими одинаковую или близкую по значению электроотрицательность. Для образования ковалентной связи каждый из атомов предоставляет по одному электрону, при этом образуется общая пара электронов, которая в равной степени принадлежит обоим атомам. На письме ковалентная связь изображается черточкой между атомами.
Классическим примером ковалентной связи является молекула метана:
Атом углерода содержит на внешнем электронном уровне четыре валентных электрона и, чтобы доукомплектовать этот слой до октетной конфигурации, он образует четыре общие электронные пары с четырьмя атомами водорода.
В зависимости от электроотрицательности атомов между которыми образовалась ковалентная связь, она может быть полярной или неполярной.
Если электроотрицательность атомов одинакова, то общая электронная пара находится на одинаковом расстоянии от ядра каждого из атомов. Такая связь называется ковалентной неполярной:
При возникновении ковалентной связи между атомами с различной электроотрицательностью общая электронная пара смещается к более электроотрицательному атому. В этом случае образуется ковалентная полярная связь.
Стрелка в формуле указывает на полярность ковалентной связи. С помощью греческой буквы δ («дельта») обозначают частичные заряды на атомах: δ + – пониженную, δ – – повышенную электронную плотность.
По числу электронных пар, образующих ковалентную связь, различают связи простые – с одной парой электронов и кратные – с двумя или тремя парами.
Основные характеристики ковалентной связи: длина связи (расстояние между центрами атомов в молекуле); энергия связи (энергия, которую необходимо затратить на разрыв связи); полярность связи (неравномерное распределение электронной плотности между атомами, обусловленное различной электроотрицательностью); поляризуемость (легкость, с которой смещается электронная плотность связи к одному из атомов под влиянием внешних факторов); направленность (ковалентная связь, направленная до линии, соединяющей центры атомов).
Атомы некоторых элементов (кислорода, азота, серы, галогенов и др.) расходуют не все внешние электроны для формирования октетной оболочки. Такие электроны называют неподеленные, необобществленные или n-электроны.
Донорно-акцепторная связь или координационная – разновидность ковалентной связи, которая отличается способом образования.
Донор – атом, который должен иметь пару неподеленных электронов, а акцептором может быть любой атом (в том числе и протон), у которого не хватает до образования октета двух электронов.
Например, образование иона аммония протекает по донорно-акцепторному механизму. Ковалентная связь образуется за счет того, что атом азота (донор электронов) отдает неподеленную пару электронов на образование ковалентной связи протону (акцептору электронов):
Вновь образовавшаяся связь Н–N ничем не отличается от остальных связей Н–N, которые имелись у аммиака. Такая связь называется еще координационной.
Семиполярная связь – частный случай донорно-акцепторной связи. Она образуется между атомами, один из которых имеет неподеленную пару электронов, а другой содержит на внешнем энергетическом уровне шесть электронов (секстет), то есть имеет вакантную атомную орбиталь.
Рассмотрим образование семиполярной связи в молекуле оксида триметиламина:
В результате образования связи атом кислорода (акцептор) приобретает отрицательный заряд, а атом азота (донор) – положительный. Такой вид связи обозначают следующим образом:
Соединения с семиполярной связью не проводят электрический ток, несмотря на наличие наряду с ковалентной связью и ионного взаимодействия.
Водородная связь образуется в результате электростатического взаимодействия между атомом водорода, несущим дробный положительный заряд, и неподеленной парой электронов другого атома. Обычно такие атомы водорода называют активными.
Водородную связь графически изображают тремя точками:
Водородная связь бывает внутримолекулярная и межмолекулярная.
Примером соединений с внутримолекулярной водородной связью могут быть салициловый альдегид и о-хлорфенол.
Межмолекулярные водородные связи (МВС) возникают между двумя или большим числом молекул с образованием димеров или ассоциатов:
Прежде чем говорить о строении молекулы и о свойствах различных классов соединений, остановимся на строении атома с точки зрения квантово-механических представлений.
Как уже отмечалось, современная теория химической связи основана на квантово-механическом рассмотрении молекулы как системы из электронов и атомных ядер.
Из курса неорганической химии и физики известно, что электроны представляют собой вид материи, обладающий одновременно свойствами частицы и электромагнитной волны.
Согласно квантовой теории состояние электронов в атоме описывается с помощью четырех квантовых чисел: п – главное квантовое число, l – азимутальное квантовое число, т – магнитное квантовое число и s – спиновое квантовое число.
Электрон в атоме находится на определенной атомной орбитали. Атомная орбиталь – это область пространства внутри которой наиболее вероятно нахождение электрона.
Состояние электрона определяется расстоянием электронного облака от ядра, его формой, ориентацией в пространстве и вращением электрона вокруг собственной оси.
Для атомных орбиталей s-типа характерна сферическая симметрия, для электронов р-типа существуют три одинаковых по энергии гантелеобразной формы орбитали, которые отличаются друг от друга лишь ориентацией в пространстве: рx, рy рz-атомные орбитали. В каждой из них существует узловая область р-орбитали. где вероятность нахождения электрона равна нулю. Для f-атомных орбиталей существуют пять более сложных геометрических форм.
Атомная орбиталь. не занятая электронами, называется вакантной и условно обозначается как □.
ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ
Согласно квантово-механическим представлениям о химической связи число образуемых атомом ковалентных связей определяется количеством одноэлектронных атомных орбиталей, то есть количеством неспаренных электронов. Однако в действительности атомы элементов образуют большее число ковалентных связей, чем содержат неспаренных электронов на внешнем энергетическом уровне. Например, атом углерода в основном состоянии имеет два неспаренных электрона (1s2 2s2 2р2), а образует четыре ковалентных связи. Это можно объяснить возможностью перехода 2s-электрона на 2p-подуровень (1s2 2s1 2р1).
Таким образом, на внешнем энергетическом уровне атома углерода находятся четыре неспаренных электрона: один s и три р. Поскольку химические связи образуются валентными электронами, то связи, например, в молекуле метана СН4 должны были бы быть неравноценными: одна связь С–Н образована s-электроном, а три остальные – р. В действительности в молекуле метана все связи совершенно равноценны. Для объяснения этого факта в квантовой механике вводится понятие о гибридизации атомных орбиталей (АО). Слово гибридизация означает взаимодействие, перекрывание, перемешивание. При взаимодействии одного s-электронного облака с тремя р-электронны-ми облаками образуются четыре качественно новых гибридизированных электронных облака или атомные орбитали: 1s + 3р = 4sp3
Таким образом, из нескольких различных по форме и близких по энергии АО путем комбинирования (смешивания, сочетания) образуется такое же количество одинаковых по форме и равных по энергии гибридизованных атомных орбиталей.
Гибридизованные орбитали по сравнению с негибридизованными более выгодны геометрически, т. к. позволяют увеличить площадь перекрывания с орбиталями других атомов, что ведет к образованию более прочных связей. Результатом перекрывания большей доли гибридной орбитали с орбиталями других атомов является ковалентная связь.
Атом углерода характеризуется тремя видами гибридизации с участием s- и p-орбиталей, каждому из которых соответствует определенное валентное состояние атома.
Состояние sр3-гибридизаиии – результат взаимодействия одной s- и трех р-атомных орбиталей.
Четыре равноценные орбитали между собой образуют угол 109°28′ и ориентированы в пространстве от центра правильного тетраэдра к его вершинам. Такое размещение связано со стремлением АО к максимальному удалению друг от друга за счет взаимного электростатического отталкивания. Расположение атомных орбиталей определяет название состояния sp3 гибридизации как тетраэдрическое.
Состояние sp2-гибридизации – результат взаимодействия одной s- и двух р-орбиталей (рх, pv).\
Образованные три эквивалентные sр2-гибридные орбитали находятся в одной плоскости под углом 120°, поэтому sр2-гибридизация называется тригональной Негибридизованная р-орбиталь расположена в плоскости, которая перпендикулярна плоскости расположения гибридных орбиталей. Условно доля s-облака в каждой из трех sp2-гибридных орбиталей равна 1/3. Такая гибридизация характерна для соединений с двойными связями, например, для этилена.
Третье валентное состояние (sp-гибридизация)
Состояние sp-гибридизации – результат взаимодействия одной s- и одной р-орбитали (рх).
Для описания химической связи с позиций квантовой механики пользуются двумя основными методами: валентных связей (ВС) и молекулярных орбиталей (МО).
Метод валентных связей был предложен в 1927 году В. Гайтлером и Ф. Лондоном. Основные положения метода заключаются в следующем. Химическая связь представлена в виде пары электронов с противоположными спинами. Она образуется в результате перекрывания атомных орбиталей.
При образовании молекулы атомные орбитали остаются без изменений, а пара связывающих электронов локализована между двумя атомами.
В отличие от метода валентных связей метод молекулярных орбиталей рассматривает молекулу не как совокупность атомов, сохраняющих свою индивидуальность, а как единое целое. Предполагается, что каждый электрон в молекуле движется в суммарном поле, создаваемом остальными электронами и всеми ядрами атомов. Иначе говоря, в молекуле различные АО взаимодействуют между собой с образованием нового типа орбиталей, называемых молекулярными орбиталями (МО).
Перекрывание двух атомных орбиталей приводит к образованию двух молекулярных орбиталей.
Одна из них имеет более низкую энергию, чем исходные АО, и называется связывающей орбиталью, другая обладает более высокой энергией, чем образующая ее АО, и называется разрыхляющей или антисвязывающей орбиталью. Заполнение молекулярных орбиталей электронами происходит аналогично заполнению атомных, то есть по принципу Паули и в соответствии с правилом Гунда. Молекулярная разрыхляющая орбиталь в основном состоянии остается вакантной. Ее заполнение электронами происходит при возбуждении молекулы, что ведет к разрыхлению связи и распаду молекулы на атомы.
ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Согласно современным представлениям, природа и механизм взаимного влияния атомов определяется характером распределения электронной плотности в молекуле и поляризуемостью ковалентных связей.
Поляризация одной связи углерод-галоген вызывает поляризацию молекулы в целом и следовательно появление дипольного момента.
По направлению электронного влияния заместителей различают положительный +I и отрицательный –I индуктивный эффект.
Отрицательный индуктивный эффект, как правило, увеличивается с ростом электроотрицательности атомов. Он сильнее выражен для заместителя с тройной связью, т. к. в его составе находится более электроотрицательный sp-гибридизованный атом углерода. В свою очередь атом углерода в sp3-гибридизации, как менее электроотрицательный, в составе заместителя проявляет +I по отношению к атомам углерода в sp и sp2-гибридизации:
Суммируя вышеизложенное, кратко остановимся на основных свойствах индуктивного эффекта:
Сопряженной называется система, в которой имеет место чередование простых и кратных связей, либо соседство атома, имеющего вакантную р-орбиталь или неподеленную пару р-электронов. Сопряженные системы бывают с открытой и замкнутой цепью:
Сопряжение – энергетически выгодный процесс, происходящий с выделением энергии. Сопряженные системы характеризуются повышенной термодинамической устойчивостью.
Дав определение сопряжению и сопряженным системам, рассмотрим электронные эффекты, которые наблюдаются при введении в такие системы различного рода заместителей.
Мезомерный эффект обозначают буквой М, а смещение электронной плотности в сопряженной системе – изогнутой стрелкой. По направляющему действию заместителя мезомерный эффект делится на положительный (+М) и отрицательный (-М).
Положительный мезомерный эффект проявляют заместители (электронодонорные атомы или атомные группы), предоставляющих электроны в сопряженную систему, т. е. имеющие неподеленные пары электронов или отрицательный заряд:
Максимальный +М у атомов с отрицательным зарядом. Заместители, содержащие неподеленные пары электронов, имеют тем больше +М, чем меньше в пределах периода электроотрицательность атомов, содержащих неподеленные пары электронов.
Отрицательный мезомерный эффект проявляют заместители, смещающие на себя электронную плотность сопряженной системы:
Максимальный –М проявляют заместители, несущие положительный заряд. В ненасыщенных группировках –М- эффект возрастает с увеличением разности электроотрицательности атомов кратной связи.
Рассмотрим несколько примеров проявления мезомерного эффекта:
Мезомерный эффект по сравнению с индуктивным вызывает более сильное смещение электронной плотности и практически не затухает.
Совместное проявление индуктивного и мезомерного эффектов заместителя
Мезомерный и индуктивный эффекты одного заместителя могут совпадать и не совпадать по направлению. Например, в молекуле акролеина альдегидная группа – С проявляет –I и –М, а гидроксильная группа в молекуле фенола обладает –I, но +М- эффектом.
Как видно из приведенного примера, в молекуле фенола противоположное электронное смешение приводит к тому, что эти два эффекта как бы «гасят» друг друга. А в молекуле акролеина индуктивный и мезомерный эффекты усиливают друг друга. Мезомерный эффект заместителя обычно больше, чем индуктивный, так как л-связи поляризуются легче, чем о-связи.
В молекулах с открытой цепью сопряжения обычно указывают частичные заряды, которые сосредоточены на концах сопряженной системы:
Величина эффекта гиперконъюгации тем выше, чем больше атомов водорода при углероде, связанном с ненасыщенной системой. Понятие о сверхсопряжении объясняет повышенную реакционную способность, подвижность а-водородных атомов в молекулах альдегидов, кетонов, кислот и их производных. Иногда сверхсопряжение называют по имени открывших его ученых эффектом Натана – Бекера.