Что такое поляризация электродов
Поляризация электродов
Семестр. Лекция 8
Химические источники тока нашли еще более широкое применение, если бы удалось преодолеть их главный недостаток – нестабильность во времени значений потенциалов электродов. Состояние равновесия возможно только при отсутствии тока в цепи. В зависимости от величины тока эти потенциалы «съезжают» от своих исходных равновесных значений.
Смещение потенциала электрода от исходного равновесного или стационарного значения называется поляризацией электрода.Изменение во времени потенциала анода – анодная поляризация (Δεа). При этом потенциал анода смещается в положительную сторону от исходного значения. Потенциал катода вследствие катодной поляризации (Δεк)смещается в отрицательную сторону от своего начального значения. Потенциалы электродов сближают значения разность потенциалов (э.д.с.) снижается и в конечном счете стремится к нулю:
При Е =0 происходит прекращение работы гальванического элемента, это состояние полной поляризации.
Основных причин нестабильности значений потенциалов две. Первая связана с медленным протеканием процессов диффузии ионов в растворе электролита – это так называемая концентрационная поляризация. Вторая причина химическая, это замедление работы из-за кинетических проблем у самой электродной реакции окисления или восстановления. Такую поляризацию называют электрохимической или перенапряжением (η).
Выше на рис.6.4 изображен двойной электрический слой на цинковом электроде (аноде). Хорошо видно, что катионы цинка притягиваются к отрицательно заряженной поверхности цинка и «зависают» на ней, мешают следующим катионам выходить из металла в раствор и диффундировать по всему объему электролита. Катионы цинка на поверхности электрода гасят его отрицательный заряд, и тем самым потенциал смещается в положительную сторону. На катоде все наоборот. Катионы металла из объема раствора должны диффундировать к поверхности катода и восстанавливаться на ней. Эта диффузия не может протекать достаточно быстро, подвижность катионов металлов (см. рис.3.1) в растворе ограничена из-за большой гидратной «шубы», они не успевают подходить к поверхности катода в требуемом количестве, а потенциал смещается в отрицательную сторону.
Для снижения последствий концентрационной поляризации необходимо «заставить» ионы перемещаться быстрее, для этого раствор можно нагреть или перемешивать. Известно, что для восстановления работы сухого элемента требуется постучать по нему. Происходит смещение, частичное перемешивание электролита, поляризация устраняется, хотя и не надолго. Надежность работы батарейки определяется величиной тока. Чем меньше ток, тем поляризация меньше и элемент работает дольше (аккумулятор телефона в режиме ожидания). При увеличении силы тока электроды поляризуются очень сильно. Все основные усилия компаний-производителей химических источников тока направлены на решение проблемы снижения поляризуемости электродов, здесь все имеет значение – состояние поверхности электрода, его форма, состав электролита и т.д.
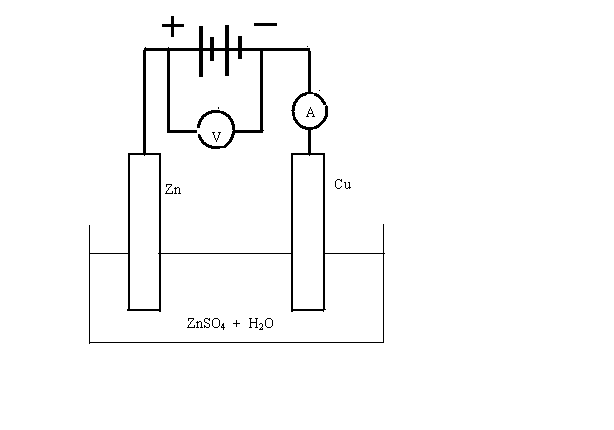
Представим себе теперь противоположный случай двухэлектродной системы, в которой под действием электрической энергии в растворе или расплаве электролита происходят окислительно-восстановительные реакции – процессы электролиза. Если воспользоваться сетью переменного тока, электроэнергия превращается только в тепло. Для электролиза необходим источник постоянного тока. Кроме того, нужна ванна с электролитом, называемая электролизером и два электрода. Важно то, из какого материала изготавливается анод. На аноде (при электролизе это положительно заряженный электрод) протекает процесс окисления. Большинство металлических материалов окисляются под действие электрического тока, материал катода особого значения не имеет. На этом электроде происходит реакция восстановления и необходимо лишь его способность проводить ток. Например, рассмотрим процесс электролиза раствора сернокислого цинка. В качестве анода используем металлический цинк, а в роли катода – медную пластину. Схема установки представлена на рис.8.1.
Рис.8.1 Электролиз раствора сульфата цинка
Под действие электрического тока на цинковом аноде начнется реакция его окисления, материал анода растворяется. Такие аноды так и называют растворимыми:
Катионы цинка, имеющиеся в растворе при диссоциации сульфата, диффундируют к поверхности отрицательно заряженного катода и восстанавливаются на нем:
(─)Zn 2+ +2e ↔ Zn ↓.
На поверхности меди образуется слой металлического цинка. Процесс называют гальваническим цинкованием, так на металл можно нанести слой или слои других металлов с целью защиты от коррозии или для улучшения внешнего вида изделия. Процесс используется также на предприятиях цветной металлургии. В результате металлургических операций полученные металлические медь, никель, кобальт загрязнены другими металлами, серой. Окончательная очистка проводится в цехах электролиза. Изделия погружаются в ванны и выполняют роль растворимого анода, на катоде осаждается только нужный чистый металл. Электролитической очисткой получают катодную медь, никель, кобальт.
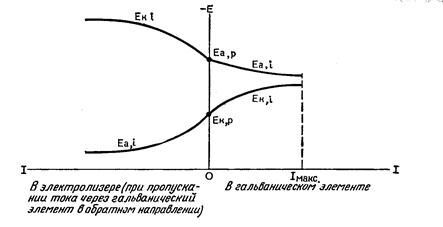
Как и в гальваническом элементе, электроды при электролизе поляризуются. Потенциал анода во времени растет (а он заряжен положительно), потенциал катода снижается (этот электрод заряжен отрицательно). Минимальная разность потенциалов внешнего источника тока, при которой начинается процесс электролиза, называется потенциалом разложения электролита. Процесс начинается, но в результате поляризации разность потенциалов становится больше, и процесс останавливается, необходимо увеличивать разность потенциалов, но в конечном счете опять произойдет остановка. Результат – перерасход электроэнергии. Для снижения концентрационной поляризации электролит в ваннах нагревают практически до кипения (!). Соли тяжелых металлов механически в больших количествах попадают в атмосферу цеха электролиза. Это одно из самых вредных производств.
Электролиз проводят и в расплаве электролита, например при получении металлического алюминия. В этом случае ванна – это высокотемпературная печь для получения расплава. Допустим, в электролизер загружен расплав хлорида никеля, а в качестве анода использован графит, инертный по отношению к окислению электрическим током материал. Такой процесс называют электролизом с нерастворимым (инертным) анодом. На поверхности графита будет окисляться анион хлора, имеющийся в расплаве при диссоциации соли. Катион никеля будет восстанавливаться на катоде:
(+)2CI ─ ─ 2e ↔ CI2 ↑
(─)Ni 2+ + 2e ↔ Ni ↓.
Случай электролиза раствора сложнее в сравнении с расплавом, потому что электролизу может подвергаться и сама вода. Под действием электрического тока она разлагается на газообразные водород и кислород. Обсудим все возможные конкурирующие процессы при электролизе растворов электролитов.
1. Анодные процессы.
1.1 Анод растворимый. Материал анода М= Mg, AI, Zn, Fe, Mn, Cr, Sn и др.:
1.2 Анод инертный (графит, Pt, Ti, Nb).
(+)2CI ─ ─ 2e ↔ CI2 ↑
(+)2Br ─ ─ 2e ↔ Br2
(+)S 2─ ─ 2e ↔ S↓.
(+)2H2O ─ 4e ↔ O2↑ + 4H + при рН ≤ 7
(+)4OH ─ ─ 4e ↔ O2↑ + 2H2O при рН > 7.
2. Катодные процессы.
На этом электроде конкурируют два процесса восстановления:
(─)M n+ + ne ↔ M↓.
(─)2H + + 2e ↔ H2↑.
Чем больше электродный потенциал, тем легче происходит восстановление на катоде. Получается, что электролизом можно получить только металлы с положительными значениями стандартных электродных потенциалов, так как у водорода ε о Н2 = 0 (см. табл.6.1). на самом деле восстанавливаются катионы свинца, олова, никеля, железа, цинка, и только в случае очень активных металлов на катоде выделяется водород. Рассмотрим механизм реакции восстановления водорода на катоде:
Эта, казалось бы, простая реакция протекает совсем не просто, у нее пятистадийный механизм:
а) диффузия гидратированных ионов водорода к поверхности электрода из объема электролита;
б) стадия дегидратации Н3О + → Н + + Н2О;
в) стадия разряда H + + e → H;
г) стадия рекомбинации (образования молекул) H + H → H2;
д) стадия образования пузырьков газообразного водорода, покидающих его поверхность – H2↑. Только теперь можно считать процесс законченным.
Следствием такого сложного механизма является торможение процесса в целом, его невозможности протекать быстро и гладко без препятствий, иными словами речь идет о катодной электрохимической поляризации. В электрохимии создано две основных теории водородного перенапряжения. В теории замедленного разряда предполагается, что лимитирующей стадией процесса является стадия «в», а в теории замедленной рекомбинации – стадия «г». Вывод этих теорий по величине перенапряжения совпадает: ηH2 = 1,7В. От величины равновесного (стандартного) потенциала водорода нужно сместиться в отрицательную сторону (процесс катодный) на величину 1,7В (см. табл.6.1). Попадаем на алюминий. С учетом перенапряжения реакции восстановления водорода на катоде он оказывается на месте алюминия, совсем в другой области ряда напряжений. У всех металлов, расположенных в ряду ниже алюминия, потенциал оказывается больше, чем у водорода. Такие металлы и восстанавливаются на катоде:
(─)M n + + ne ↔ M↓. при условии ε о м > ε о AI
(─)2H + + 2e ↔ H2↑ при условии ε о м ≤ ε о AI и при рН ─ при pH ≥ 7.
Продемонстрируем общие закономерности на некоторых примерах.
Электролизу подвергается водный раствор йодистой меди CuI2. Анод инертный (по умолчанию).
Ион иода может окисляться, а ион меди легко восстанавливаться, так как ε о Cu > ε о AI.
(+)2I ─ ─ 2e ↔ I2↓.
(─)Cu 2 + + 2e ↔ Cu↓.
Пропускаем электрический ток через раствор фосфата калия K3PO4. Фосфат-ион не окисляется, а катион калия не восстанавливается. Имеет место электролиз воды. Сама вода практически не пропускает электрический ток, поэтому для ее электролиза делают добавки нейтрального по отношению к этому процессу электролита, который сам не подвергается электролизу:
Имеем раствор бромистоводородной кислоты HBr:
(+)2Br ─ ─ 2e ↔ Br2
(─)2H + + 2e ↔ H2↑.
Проводим электролиз раствора гидроксида натрия:
(+)4OH ─ ─ 4e ↔ O2↑ + 2H2O
Вместо раствора используем расплавленный гидроксид. Температура расплава выше 100 о С, вода улетает из электролизера в виде пара, на катоде образуется металлический натрий. Именно так и получают все активные щелочные, щелочноземельные металлы и алюминий:
(+)4OH ─ ─ 4e ↔ O2↑ + 2H2O↑
(─)Na + + e ↔ Na.
Для количественного расчета продуктов электролиза используют классический закон Фарадея: одинаковые количества электричества выделяют на электродах при электролизе эквивалентные массы различных веществ.
Один Фарадей электричества выделяет один эквивалент любого вещества. 1F = 96500 Кл (А•с) = 26,8 А•час. Примеры определения эквивалентной массы элементов приведены в лекции 5. Для цинка это (65/2) г/моль, алюминия (27/3) г/моль и т.д. Газы принято измерять в виде объема, а не массы. Для водорода эквивалентная масса 1г/моль, который при нормальных условиях занимает объем 11,2л. Для кислорода 8г/моль или 5,6л. Закон Фарадея можно записать в виде:
uде I – ток,А; t – время электролиза, с,ч; F – число Фарадея, m – масса продукта, г или V – его объем, л.
Поляризация электродов
На сегодня химические источники тока находят все большее применение во многих сферах жизни человека. С их помощью сейчас работают не только ноутбуки и телефоны, но и важное оборудование, резервные системы электроснабжения, электромобили. Эти источники имеют и ряд недостатков, не позволяющих использовать их полностью. Главным изъяном является то, что при прохождении тока через такое устройство, оно начинает менять свои свойства в сторону ухудшения характеристик. Поляризация электродов играет важную роль в этом процессе.
Определение поляризации 
Явление поляризации электродов состоит в изменении их свойств, а также характеристик близлежащего электролита при пропускании через них электрического тока. Этот эффект негативно влияет на производительность батареи, ибо возникает разность потенциалов, направленная в противоположную сторону внешней ЭДС, что приводит к ослаблению последней.
Виды поляризации 
В зависимости от механизма возникновения, поляризация электродов при прохождении электрического тока делится на три вида:
Все три вида имеют под собой различную природу, но в то же время привносят серьезное ухудшение производительности батареи.
Концентрационный вид 
Поляризация электродов первого типа возникает на положительном участке — аноде. Рассмотрим в качестве примера анод, изготовленный из серебра. В результате электролиза молекулы электролита H2SO4 распадаются на ионы 2H + направляющиеся к отрицательно заряженному катоду и SO4 2- стремящиеся к положительному аноду:
В результате концентрация ионов серебра на аноде будет превышать концентрацию в остальном растворе, вследствие чего ионы будут диффундировать от анода к катоду. Тем не менее, скорость диффузии невысока, поэтому ионы будут накапливаться на аноде, что приведет к появлению разности потенциалов между анодом и катодом. Она будет направлена в противоположную сторону по отношению к внешнему напряжению и будет ослаблять его.
Данный вид поляризации сравнительно легко устраняется путем перемешивания электролита. При этом концентрации вещества на аноде и в объеме выравниваются, и паразитная ЭДС пропадает.»
Электрохимический вид 
Электрохимическая поляризация электродов возникает, в случае если они сделаны из инертных материалов. В результате поляризации их химические свойства как бы меняются, что дало название виду поляризации. Рассмотрим реакцию, где происходит поляризация электродов при электролизе платины:
На катоде положительный ион водорода восстанавливается до газообразного водорода, а отрицательный ион хлора восстанавливается до газообразного хлора на аноде:
Инертные электроды хорошо поглощают данные газы:
Следовательно, платиновый электрод на катоде насыщается водородом, а анод — хлором. Так как хлор способен только восстанавливаться, а водород — окисляться, то появляется разность потенциалов, которая ослабляет внешнее напряжение:
Описанный эффект приводит к повышенному потреблению электроэнергии и поэтому является вредным. Для борьбы с ним в раствор электролита добавляют вещества, очищающие рабочие участки от газов.
Омический вид 
Омическая поляризация электродов возникает из-за сопротивления электрическому току, которое появляется как в них самих, так и в электролите. Данное явление приводит к потерям в гальваническом элементе и значительно усиливается при образовании на рабочих участках окислов или различных пленок.
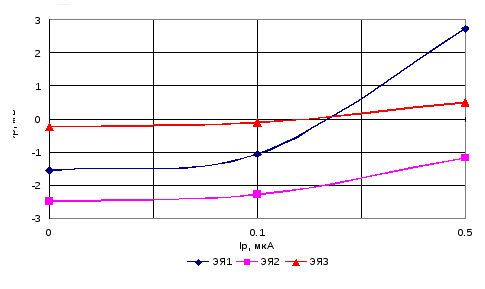
График зависимости поляризации электродов от величины тока
Результатом является снижение КПД и пониженное напряжение на клеммах батареи. Получается, что нежелателен такой процесс, как омическая поляризация электродов, и борьба с ней просто необходима. Для уменьшения влияния омической поляризации на производительность батареи проводят повышение электрической проводимости в электролите и уменьшают расстояние между электродами.
Снижение напряжения при поляризации электродов
Поляризация и перенапряжение 
На положительно и отрицательно заряженных участках электрических элементах всегда происходят химические взаимодействия. Если осуществить поляризацию заряженного участка, то результатом протекания реакций станет изменение структуры двойного гальванического слоя и электродного потенциала.
Выяснили, что поляризация электродов – это отклонение электродного заряда от равновесного значения, а вот степень колебания потенциала будет именоваться перенапряжением. Ни в коем случае, не следует путать эти процессы. Поляризация электродов и перенапряжение – это абсолютно разные вещи, так как один эффект относится к электроду, а другой к реакции.
Немного практики 
Какова полярность электродов при сварке? Процесс дугового сваривания осуществляется с применением специального оборудования, производящего ток постоянного либо переменного типа. Сварка оснований на постоянном источнике питания совершенно отличается от сваривания на переменном токе, поэтому полярность сварочных электродов очень значима.
Выбирая типы электродов для ручной дуговой сварки, необходимо обращать внимание на полюса рабочего оборудования:
Заключение
Поляризация электродов оказывает значительное влияние на производительность химических источников тока. Однако знание природы этих явлений позволит выяснить, как правильно варить сваркой электродами, оценивать их вклад в ухудшение КПД и принимать максимально эффективные меры для их минимизации.
Электрохимическая коррозия
Электрохимическая коррозия относится к наиболее часто встречающимся процессам постепенного разрушения металла.
Как мы знаем, наше окружение наполнено электричеством.
В зависимости от среды, меняются показатели проводимости. Не отличается то, что при контакте с такой средой сталь начинает постепенно портиться.
У процесса есть несколько важных отличий.
В первую очередь – неодновременное протекание восстановления окислительного процесса и ионизации атомов металла.
На интенсивность распространения при этом влияет такой параметр, как электродный потенциал металла.
Главная причина электрохимической коррозии в том, что большинство металлов проявляют термодинамическую неустойчивость.
Примеры распространения коррозии такого типа встречаются в воде, почве, на открытом воздухе.
Она часто становится причиной потери прочности и постепенного разрушения металла на днище судов, трубопроводов, опор ЛЭП и других объектов.
Если говорить о типах электрохимической коррозии, то называют 3 разновидности:
Повреждаться могут разные типы металлов в зависимости от их расположения. Ржавчина появляется при контакте со стоячей и текущей водой, в местах соединения разных металлов, а также на сварных швах.
Какие механизмы отвечают за протекание электрохимической коррозии
Такое повреждение металла проводится двумя механизмами – гомогенным и гетерогенным. Рассмотрим каждый из них подробно.
У такого вида процесса есть несколько особенностей.
В первую очередь – четкое деление на катодный и анодный процесс. Один из основных факторов, влияющих на их скорость протекания относительно друг друга – это время.
Схема электрохимической коррозии
В зависимости от типа металла, коррозия может быть локализована на отдельных участках. Также наблюдается растворение поверхностного слоя на анодах, что позволяет поражению затронуть обширные площади.
Здесь появляется еще одна особенность протекания процесса – формирование гальванических элементов. Это происходит из-за специфики структуры поверхности, на которой присутствуют микроэлектроды.
Из-за чего начинает развиваться коррозия
После того, как мы рассмотрели суть электрохимической коррозии, пришло время обратить внимание на причины распространения коррозии.
Среди них три распространенные:
Именно по причине различия в критических факторах, скорость электрохимической коррозии может сильно меняться.
Главные внутренние факторы протекания электрохимической коррозии
На интенсивность распространения коррозийного поражения влияют две группы факторов – внешние и внутренние.
Текущее состояние поверхности металла
Когда поверхность металла неровная, коррозийный процесс протекает намного интенсивнее. Если на поверхности присутствуют небольшие выступы, они начинают накапливать воду.
Это может негативно повлиять на интенсивность распространения.
Чтобы не допустить такого фактора, важно использовать отшлифованный или отполированный металл.
Когда сталь гладкая, вода не так сильно повреждает ее, потому что постепенно происходит формирование равномерной пленки по всей поверхности.
Также хорошим средством для уменьшения поражения становится применение пассивирования, а также ряд других способов.
Степень термодинамической стойкости металла
Разные виды материалов отличаются разными показателями термодинамической устойчивости.
Наиболее стойкие разновидности материала не разрушаются при помещении в агрессивную среду.
Чтобы понять, есть ли у металла склонность к коррозии под действием термодинамических факторов, измеряют потенциал анодного и катодного процесса, а также изобарно-изотермического.
Именно такой фактор оказывает большое влияние на потенциальное воздействие среды на постепенное развитие коррозии.
К сожалению, у большинства представленных в продаже марок металлов стойкость невысокая. Есть и неустойчивые разновидности, у которых этот риск нивелируется благодаря склонности к образованию пассивных пленок на поверхности.
Кристаллографическая структура
Оказывает прямое воздействие на металл.
Как известно, атомы в кристаллической решетке располагаются по-разному. Лучше защищены те разновидности, у которых атомы упакованы неплотно.
Особенности решетки также учитывают при планировании защиты материала методом создания на нем специальных пленок. И пленка и сам основной материал должны четко соответствовать по составу друг другу или быть максимально приближенными.
В этом случае исключается появление напряжения, которое негативно отражается на текущем состоянии заготовки. Если контакт с агрессивной средой все-таки происходит, материал начинает разрушаться слой за слоем.
Гетерогенность
Этот фактор рассматривается в непосредственной связи с величиной зерна металла.
Если в сплаве есть выраженные анодные включения, они сильно влияют на ускорение протекания коррозии.
Катодные включения не столь опасны, потому что на интенсивности процесса не отражаются. Величина зерна как фактор риска рассматривается не так часто и этим показателем можно пренебречь.
Не стоит сбрасывать со счетов и механические факторы
Важно понимать, что многие конструкции из металла используются под постоянным напряжением.
К этой категории относится повышенное внутреннее напряжение, когда сильно увеличивается риск деформации.
Негативно влияют на качество металла также воздействие истирания, периодические контакты с другими металлическими изделиями.
Такой фактор оказывает значительное влияние на интенсивность распространения повреждения.
Даже если само сырье первоначально обладало стойкостью к потенциальным повреждениям, в таком случае она уменьшится – формируемые пленки просто не будут закрепляться на поверхности.
Потому лучше сразу исключить это условие электрохимической коррозии – постараться не использовать металлоконструкции под пиковыми сильными нагрузками, не допускать возникновения трения и соприкосновения между собой стальных деталей.
Основные внешние факторы электрохимической коррозии
Кроме внутренних, на металл также влияют и внешние факторы.
Они могут не только ускорять, но и замедлять процесс, а также влиять на характер его протекания.
К ним относятся следующие:
Если деталь помещается в растворы неокисляющихся кислот, наблюдается коррозия с водородной деполяризацией.
Повышение температуры уменьшает скорость распространения повреждений, потому что сильно снижается перенапряжение водорода.
Отдельно стоит отметить ситуацию, когда металл уже покрывается специальной защитной пленкой. В этом случае сам тип пленки будет влиять на то, как именно она поведет себя при контакте с разными видами внешних угроз, в том числе, с повышением температуры.
Нагрев и охлаждение могут отразиться на состоянии катодов и анодов через их внутренние процессы.
В некоторых случаях полярность электродов значительно меняется.
Как мы уже отмечали выше, проблемы могу возникать из-за того, что разные участки детали нагреты до отличающихся друг от друга температур.
В этом случае стремительно увеличивается количество термогальванических пар, стимулирующих распространение коррозии на новые участки.
Если по каким-то причинам металлическая заготовка оказалась помещена в раствор, большое значение будет иметь скорость, с которой он движется, а также само наличие внутренних колебаний.
Заранее определить точное воздействие будет сложно по той причине, что всегда непросто предсказать, как поведут себя нейтральные электролиты.
Cчитается, что при смешении электролита, меняются показатели диффузии кислорода, что значительно отражается на процессе протекания коррозии.
Можно уделять меньше внимания скорости движения электролита в том случае, если вы имеете дело со средами повышенной кислотности.
На них подобное поражение оказывает минимум влияния.
Чем отличаются анодный и катодный процессы
Если вы внимательно проследите за тем, как работает гальванический элемент, то увидите, что в нем протекают сразу два связанных друг с другом процесса – анодный и катодный.
Рассмотрим их более подробно.
Анодный процесс
В химии показывается формулой Fe → Fe2+ + 2e. Она показывает, что постепенно запускается окисление, ионы металла начинают переход в раствор.
Катодный процесс
Может протекать по-разному.
В частности, переизбыток электронов решается ассимиляцией атомами электролита и его молекул. На фоне этого происходит восстановительная реакция непосредственно на самом катоде.
Формула будет зависеть от того, в каких условиях протекает реакция.
Так при наличии водородной деполяризации можно записать процесс как 2 H+ + 2e → H2.
Важно понимать, что оба процесса сильно связаны друг с другом под влиянием кинетического фактора.
С течением времени может происходить взаимное замедление или ускорение анодного или катодного процесса. При этом сам анод всегда будет оставаться тем местом, на котором формируется коррозия металла.
Во время анализа протекания процесса коррозии часто обращают внимание на электропроводящие фазы и момент после их соприкосновения.
Обычно одна фаза имеет положительный заряд, в то время как другая – отрицательный. Это приводит к появлению разности потенциалов.
Таким образом возникает ДЭС или как его часто называют ученые – двойной электрический слой с ассиметричным расположением частиц в местах, где фазы разделяются.
Опасным для металла становится скачок потенциалов. Он может стимулироваться двумя центральными причинами:
Что происходит в том случае, если поверхностный слой металла совсем не имеет определенного заряда?
В таком случае ДЭС наблюдаться не будет, возникнет явление нулевого заряда.
Его потенциал будет отличаться в зависимости от того, с каким металлом вам приходится работать.
Описанный процесс значительно отражается на том, как протекает коррозия и как быстро она захватывает все новые и новые участки металла.
В современной науке нет средств, которые могли бы точно измерить величину скачка потенциала, значит и процесс формирования электродвижущей силы оказывается на таким интенсивным.
Если рассматривать вопросы, связанные с процессом поляризации, можно написать отдельную статью на эту тему.
Потому далее мы рассмотрим другой важный показатель – поляризацию.
Поляризация и ее влияние на скорость протекания коррозии
Процесс поляризации связан с интенсивностью распространения электрохимической коррозии.
Этот показатель отражает, насколько сильное перенапряжение наблюдается на определенном участке.
Принято выделять три вида поляризации:
Особенности поляризации также стоит учитывать в том случае, если вы заинтересованы в дополнительной защите металлов от постепенного разрушения.
Обеспечиваем эффективную защиту от коррозии
Наша компания предлагает заказчикам защиту металлоконструкций разных типов от коррозии.
В пользу работы с нами говорит сразу несколько факторов:
Мы используем в процессе проверенное европейское оборудование. Даем гарантию соответствия качества товаров требованиям ГОСТ 9.307-89.
Чтобы получить дополнительные консультации и ответы на интересующие вас вопросы, звоните нам или оставляйте заявку на сайте.