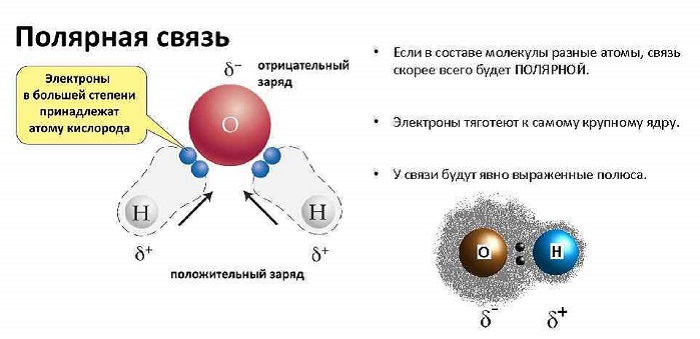
Что такое полярная молекула в химии
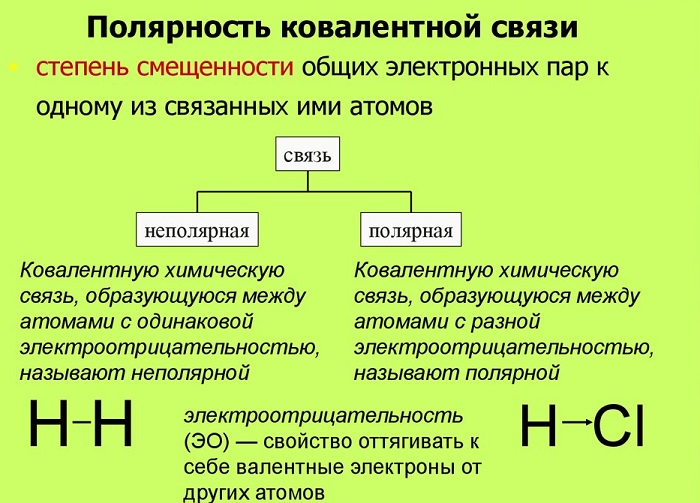
Полярные и неполярные молекулы – две группы, на которые подразделяются все диэлектрики.
Полярные по-другому называются дипольными. А неполярные являются нейтральными или бездипольными.
Что такое полярность в химии
Полярность – свойство, показывающее изменение распределения электронной плотности около ядер, если сравнивать с изначальным ее распределением в образующих данную связь нейтральных частицах.
Поляризуемость — способность поляризоваться под воздействием электрического поля.
Мерой полярности называется электрический момент диполя. В нейтральных соединениях он равен нулю. Его значение зависит от разности электроотрицательностей элементов.
Длина диполя — расстояние между его полюсами. Данная характеристика также влияет на степень полярности.
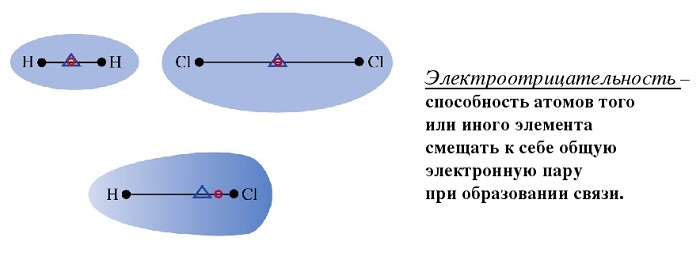
Любое соединение состоит из ядра (положительные частицы) и электронов (отрицательные частицы). И положительные, и отрицательные частицы имеют свой электрический центр тяжести.
Если центры тяжести частиц совпадают, то соединение считается неполярным. Если же полюса не накладываются друг на друга, то в этом случае речь идет о дипольной связи.
Примеры полярных молекул
Эта связь образуется, если вещество состоит из атомов разных элементов и ассиметрична (имеются неспаренные электроны). Такие соединения имеют угловую, изогнутую геометрическую форму.
Примеры неполярных молекул
Эта связь также может встречаться в соединениях, состоящих из атомов разных элементов и при этом являющихся симметричными (линейные, тетраэдрические и т. д.). Такими веществами являются: BeH2, BF3, CH4, CO2(углекислый газ) и SO3.
При нейтральной связи электронное облако равномерно распределяется между ядрами всех атомов данного вещества. Поэтому ядра действуют на него в равной мере.
Как определить полярность молекулы и от чего она зависит
Чтобы определить, является ковалентная связь дипольной или нет, необходимо посмотреть на химическую формулу вещества.
Если молекула состоит из атомов одного и того же вещества, то она в любом случае нейтральна.
Если же молекулярное строение является сложным, то речь может идти как о полярной, так и неполярной ковалентной связи. Это зависит от геометрической формы.
Разница между полярными и неполярными молекулами
Атомы разных или одинаковых элементов объединяются в молекулы. Связь, которая образуется при совместном использовании пары электронов между двумя атомами, называется «ковалентной связью». Р
Содержание:
Атомы разных или одинаковых элементов объединяются в молекулы. Связь, которая образуется при совместном использовании пары электронов между двумя атомами, называется «ковалентной связью». Разные атомы проявляют притяжение к электронам в разной степени. Их способность притягивать к себе электроны называется электроотрицательностью. Такие атомы, как F, Cl, O, обладают большей электроотрицательностью по сравнению с атомами, такими как C, P, S. Когда два атома с разницей электроотрицательности 0,4 0,4.
Молекулярные силы
Полярные молекулы:Молекулярные силы довольно сильны и образуют Н-связи или диполь-дипольные связи.
Неполярные молекулы: Молекулярные силы являются самыми слабыми из доступных; образует лондонские рассеянные силы.
Физические свойства
Полярные молекулы:Полярные молекулы имеют высокую температуру кипения, температуру плавления, низкое давление пара и высокое поверхностное натяжение.
Неполярные молекулы:Неполярные молекулы имеют низкую температуру кипения, температуру плавления, высокое давление пара и низкое поверхностное натяжение.
Примеры
Полярные молекулы:Примеры включают воду, HF и CHF3.
Неполярные молекулы:Примеры включают пентан, гексан и диоксид углерода.
В химия, полярность это разделение электрический заряд приводит к молекуле или ее химические группы имея электрический дипольный момент, с отрицательно заряженным концом и положительно заряженным концом.
Полярные молекулы должны содержать полярные облигации из-за разницы в электроотрицательность между связанными атомами. Полярная молекула с двумя или более полярными связями должна иметь геометрия который асимметричен хотя бы в одном направлении, так что диполи облигаций не отменяют друг друга.
Полярные молекулы взаимодействуют через диполь-диполь. межмолекулярные силы и водородные связи. Полярность лежит в основе ряда физических свойств, включая поверхностное натяжение, растворимость, а также температуры плавления и кипения.
Содержание
Полярность облигаций
Поскольку электроны имеют отрицательный заряд, неравное распределение электронов внутри связи приводит к образованию электрический диполь: разделение положительного и отрицательного электрического заряда. Поскольку количество разделенного заряда в таких диполях обычно меньше, чем основной заряд, они называются частичные сборы, обозначаемый как δ + (дельта плюс) и δ− (дельта минус). Эти символы были введены Сэр Кристофер Ингольд и Доктор Эдит Хильда (Ашервуд) Ингольд в 1926 г. [1] [2] Дипольный момент связи рассчитывается путем умножения количества разделенных зарядов на расстояние между зарядами.
Эти диполи в молекулах могут взаимодействовать с диполями в других молекулах, создавая диполь-дипольные межмолекулярные силы.
Классификация
Полярность связи обычно делится на три группы, которые в общих чертах основаны на разнице в электроотрицательности между двумя связанными атомами. Согласно Шкала Полинга:
Полинг основал эту схему классификации на частичный ионный характер связи, которая является приблизительной функцией разницы в электроотрицательности между двумя связанными атомами. Он оценил, что разница в 1,7 соответствует 50% ионному характеру, так что большая разница соответствует преимущественно ионной связи. [3]
Полярность молекул
Хотя молекулы можно описать как «полярные ковалентные», «неполярные ковалентные» или «ионные», это часто относительный термин, когда одна молекула просто более полярный или же более неполярный чем другой. Однако для таких молекул характерны следующие свойства.
Молекула состоит из одной или нескольких химических связей между молекулярные орбитали разных атомов. Молекула может быть полярной либо в результате полярных связей из-за различий в электроотрицательность как описано выше, или в результате асимметричного расположения неполярных ковалентных связей и несвязывающих пар электронов, известного как полный молекулярная орбиталь.
Полярные молекулы
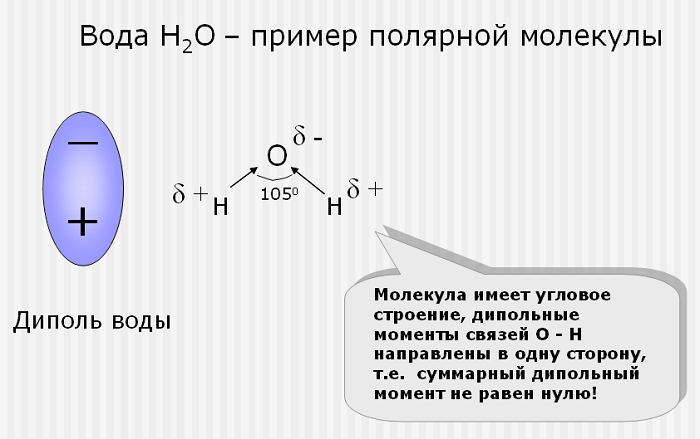
Если дипольные моменты связи молекулы не сокращаются, молекула полярна. Например, молекула воды (ЧАС2O) содержит две полярные связи O − H в согнутый (нелинейная) геометрия. Дипольные моменты связи не сокращаются, так что молекула образует молекулярный диполь с отрицательным полюсом у кислорода и положительным полюсом на полпути между двумя атомами водорода. На рисунке каждая связь соединяет центральный атом O с отрицательным зарядом (красный) с атомом H с положительным зарядом (синий).
Аммиак, NH3, представляет собой молекулу, у которой три связи N-H имеют лишь небольшую полярность (по отношению к более электроотрицательному атому азота). Молекула имеет два неподеленных электрона на орбитали, которая указывает на четвертую вершину приблизительно правильного тетраэдра, как предсказано (Теория VSEPR). Эта орбиталь не участвует в ковалентном связывании; он богат электронами, что приводит к образованию мощного диполя во всей молекуле аммиака.
Неполярные молекулы
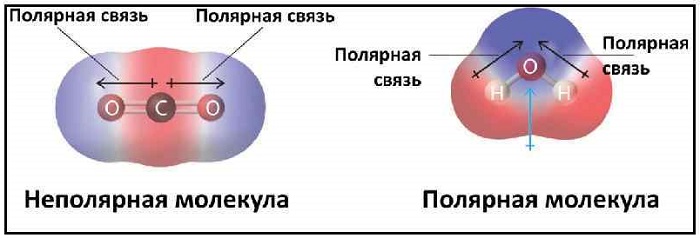
Молекула может быть неполярной либо при равном распределении электронов между двумя атомами двухатомной молекулы, либо из-за симметричного расположения полярных связей в более сложной молекуле. Например, трифторид бора (BF3) имеет тригональное плоское расположение трех полярных связей под углом 120 °. Это приводит к отсутствию полного диполя в молекуле.
Углекислый газ (CO2) имеет две полярные связи C = O, но геометрия CO2 является линейным, так что два дипольных момента связи сокращаются и нет чистого молекулярного дипольного момента; молекула неполярна.
Примеры бытовых неполярных соединений включают жиры, масло и бензин / бензин. Большинство неполярных молекул нерастворимы в воде (гидрофобный) при комнатной температуре. Многие неполярные органические растворители, Такие как скипидар, способны растворять неполярные вещества.
Амфифильные молекулы
Эта амфифильная молекула имеет несколько полярных групп (гидрофильный, любящий воду) с правой стороны и длинной неполярной цепочкой (липофильный, жиролюбивый) с левой стороны. Это дает поверхностно-активное вещество характеристики
Фосфолипиды эффективные натуральные поверхностно-активные вещества, которые выполняют важные биологические функции
Поперечный разрез конструкций, которые могут быть образованы фосфолипиды. Они могут сформировать мицелла и жизненно важны для формирования клеточные мембраны
Прогнозирование полярности молекул
| Формула | Описание | Пример | Имя | Дипольный момент | |
|---|---|---|---|---|---|
| Полярный | AB | Линейные молекулы | CO | Монооксид углерода | 0.112 |
| HAИкс | Молекулы с одним H | HF | Фтористый водород | 1.86 | |
| АИксОЙ | Молекулы с ОН на одном конце | C2ЧАС5ОЙ | Этиловый спирт | 1.69 | |
| ОИксАy | Молекулы с буквой O на одном конце | ЧАС2О | Вода | 1.85 | |
| NИксАy | Молекулы с буквой N на одном конце | NH3 | Аммиак | 1.42 | |
| Неполярный | А2 | Двухатомные молекулы того же элемента | О2 | Диоксид | 0.0 |
| CИксАy | Большинство углеводородных соединений | C3ЧАС8 | Пропан | 0.083 | |
| CИксАy | Углеводород с центр инверсии | C4ЧАС10 | Бутан | 0.0 |
Определение точечная группа это полезный способ предсказать полярность молекулы. В общем, молекула не будет обладать дипольным моментом, если отдельные дипольные моменты связи молекулы компенсируют друг друга. Это потому, что дипольные моменты евклидов вектор величины с величиной и направлением, и два равных вектора, которые противостоят друг другу, уравняются.
Любая молекула с центром инверсии («i») или горизонтальной зеркальной плоскостью («σчас«) не будет обладать дипольными моментами. Точно так же молекула с более чем одним Cп ось вращения не будет обладать дипольным моментом, потому что дипольные моменты не могут лежать более чем в одном измерение. Вследствие этого ограничения все молекулы с двугранная симметрия (Dп) не будет иметь дипольного момента, потому что, по определению, точечные группы D имеют два или несколько Cп топоры.
Поскольку C1, Сs, С∞h Cп и Cпv точечные группы не имеют центра инверсии, горизонтальных зеркальных плоскостей или кратных Cп оси молекулы в одной из этих точечных групп будут иметь дипольный момент.
Электрическое отклонение воды
Вопреки распространенному заблуждению, электрическое отклонение струи воды от заряженного объекта не зависит от полярности. Отклонение происходит из-за электрически заряженных капель в потоке, который индуцирует заряженный объект. Струя воды также может отклоняться в однородном электрическом поле, которое не может воздействовать на полярные молекулы. Кроме того, после того, как поток воды заземлен, его больше нельзя отклонить. Слабый прогиб возможен даже для неполярных жидкостей. [5]
В химия, полярность это разделение электрический заряд приводит к молекуле или ее химические группы имея электрический дипольный момент, с отрицательно заряженным концом и положительно заряженным концом.
Полярные молекулы должны содержать полярные облигации из-за разницы в электроотрицательность между связанными атомами. Полярная молекула с двумя или более полярными связями должна иметь геометрия который асимметричен хотя бы в одном направлении, так что диполи облигаций не отменяют друг друга.
Полярные молекулы взаимодействуют через диполь-диполь. межмолекулярные силы и водородные связи. Полярность лежит в основе ряда физических свойств, включая поверхностное натяжение, растворимость, а также температуры плавления и кипения.
Содержание
Полярность облигаций
Поскольку электроны имеют отрицательный заряд, неравное распределение электронов внутри связи приводит к образованию электрический диполь: разделение положительного и отрицательного электрического заряда. Поскольку количество разделенного заряда в таких диполях обычно меньше, чем основной заряд, они называются частичные сборы, обозначаемый как δ + (дельта плюс) и δ− (дельта минус). Эти символы были введены Сэр Кристофер Ингольд и Доктор Эдит Хильда (Ашервуд) Ингольд в 1926 г. [1] [2] Дипольный момент связи рассчитывается путем умножения количества разделенных зарядов на расстояние между зарядами.
Эти диполи в молекулах могут взаимодействовать с диполями в других молекулах, создавая диполь-дипольные межмолекулярные силы.
Классификация
Полярность связи обычно делится на три группы, которые в общих чертах основаны на разнице в электроотрицательности между двумя связанными атомами. Согласно Шкала Полинга:
Полинг основал эту схему классификации на частичный ионный характер связи, которая является приблизительной функцией разницы в электроотрицательности между двумя связанными атомами. Он оценил, что разница в 1,7 соответствует 50% ионному характеру, так что большая разница соответствует преимущественно ионной связи. [3]
Полярность молекул
Хотя молекулы можно описать как «полярные ковалентные», «неполярные ковалентные» или «ионные», это часто относительный термин, когда одна молекула просто более полярный или же более неполярный чем другой. Однако для таких молекул характерны следующие свойства.
Молекула состоит из одной или нескольких химических связей между молекулярные орбитали разных атомов. Молекула может быть полярной либо в результате полярных связей из-за различий в электроотрицательность как описано выше, или в результате асимметричного расположения неполярных ковалентных связей и несвязывающих пар электронов, известного как полный молекулярная орбиталь.
Полярные молекулы
Если дипольные моменты связи молекулы не сокращаются, молекула полярна. Например, молекула воды (ЧАС2O) содержит две полярные связи O − H в согнутый (нелинейная) геометрия. Дипольные моменты связи не сокращаются, так что молекула образует молекулярный диполь с отрицательным полюсом у кислорода и положительным полюсом на полпути между двумя атомами водорода. На рисунке каждая связь соединяет центральный атом O с отрицательным зарядом (красный) с атомом H с положительным зарядом (синий).
Аммиак, NH3, представляет собой молекулу, у которой три связи N-H имеют лишь небольшую полярность (по отношению к более электроотрицательному атому азота). Молекула имеет два неподеленных электрона на орбитали, которая указывает на четвертую вершину приблизительно правильного тетраэдра, как предсказано (Теория VSEPR). Эта орбиталь не участвует в ковалентном связывании; он богат электронами, что приводит к образованию мощного диполя во всей молекуле аммиака.
Неполярные молекулы
Молекула может быть неполярной либо при равном распределении электронов между двумя атомами двухатомной молекулы, либо из-за симметричного расположения полярных связей в более сложной молекуле. Например, трифторид бора (BF3) имеет тригональное плоское расположение трех полярных связей под углом 120 °. Это приводит к отсутствию полного диполя в молекуле.
Углекислый газ (CO2) имеет две полярные связи C = O, но геометрия CO2 является линейным, так что два дипольных момента связи сокращаются и нет чистого молекулярного дипольного момента; молекула неполярна.
Примеры бытовых неполярных соединений включают жиры, масло и бензин / бензин. Большинство неполярных молекул нерастворимы в воде (гидрофобный) при комнатной температуре. Многие неполярные органические растворители, Такие как скипидар, способны растворять неполярные вещества.
Амфифильные молекулы
Эта амфифильная молекула имеет несколько полярных групп (гидрофильный, любящий воду) с правой стороны и длинной неполярной цепочкой (липофильный, жиролюбивый) с левой стороны. Это дает поверхностно-активное вещество характеристики
Фосфолипиды эффективные натуральные поверхностно-активные вещества, которые выполняют важные биологические функции
Поперечный разрез конструкций, которые могут быть образованы фосфолипиды. Они могут сформировать мицелла и жизненно важны для формирования клеточные мембраны
Прогнозирование полярности молекул
| Формула | Описание | Пример | Имя | Дипольный момент | |
|---|---|---|---|---|---|
| Полярный | AB | Линейные молекулы | CO | Монооксид углерода | 0.112 |
| HAИкс | Молекулы с одним H | HF | Фтористый водород | 1.86 | |
| АИксОЙ | Молекулы с ОН на одном конце | C2ЧАС5ОЙ | Этиловый спирт | 1.69 | |
| ОИксАy | Молекулы с буквой O на одном конце | ЧАС2О | Вода | 1.85 | |
| NИксАy | Молекулы с буквой N на одном конце | NH3 | Аммиак | 1.42 | |
| Неполярный | А2 | Двухатомные молекулы того же элемента | О2 | Диоксид | 0.0 |
| CИксАy | Большинство углеводородных соединений | C3ЧАС8 | Пропан | 0.083 | |
| CИксАy | Углеводород с центр инверсии | C4ЧАС10 | Бутан | 0.0 |
Определение точечная группа это полезный способ предсказать полярность молекулы. В общем, молекула не будет обладать дипольным моментом, если отдельные дипольные моменты связи молекулы компенсируют друг друга. Это потому, что дипольные моменты евклидов вектор величины с величиной и направлением, и два равных вектора, которые противостоят друг другу, уравняются.
Любая молекула с центром инверсии («i») или горизонтальной зеркальной плоскостью («σчас«) не будет обладать дипольными моментами. Точно так же молекула с более чем одним Cп ось вращения не будет обладать дипольным моментом, потому что дипольные моменты не могут лежать более чем в одном измерение. Вследствие этого ограничения все молекулы с двугранная симметрия (Dп) не будет иметь дипольного момента, потому что, по определению, точечные группы D имеют два или несколько Cп топоры.
Поскольку C1, Сs, С∞h Cп и Cпv точечные группы не имеют центра инверсии, горизонтальных зеркальных плоскостей или кратных Cп оси молекулы в одной из этих точечных групп будут иметь дипольный момент.
Электрическое отклонение воды
Вопреки распространенному заблуждению, электрическое отклонение струи воды от заряженного объекта не зависит от полярности. Отклонение происходит из-за электрически заряженных капель в потоке, который индуцирует заряженный объект. Струя воды также может отклоняться в однородном электрическом поле, которое не может воздействовать на полярные молекулы. Кроме того, после того, как поток воды заземлен, его больше нельзя отклонить. Слабый прогиб возможен даже для неполярных жидкостей. [5]