Что такое постуральная неустойчивость
Постуральная неустойчивость
Постуральная неустойчивость – это синдром, при котором возникают затруднения в удержании равновесия в определенной позе или при смене позы. Достаточно часто постуральная неустойчивость отмечается при развитии паралича и болезни Паркинсона, хотя не исключено развитие постуральной неустойчивости как самостоятельного заболевания. Синдром развивается в результате нарушений в головном мозге: поражения базальных ганглиев, ствола мозга, лобных долей. Постуральная неустойчивость характеризуется шаткой походкой, склонностью к падению. В тяжелых случаях пациенты не могут стоять или сидеть самостоятельно.
Лечение постуральной неустойчивости успешно выполняют в Юсуповской больнице. Квалифицированные неврологи и психотерапевты используют в своей работе высокотехнологичное оборудование и современные методики лечения заболеваний нервной системы, что позволяет получать наиболее благоприятные результаты.
Агорафобия: постуральная фобическая неустойчивость
Постуральная неустойчивость возникает в результате развития фобии у человека. Агорафобия представляет собой боязнь открытого пространства и скопления людей. При данном расстройстве психики возникают следующие страхи:
Агорафобия обычно связана с боязнью прилюдно опозориться в случае приступа паники. Поскольку приступ паники обычно возникает спонтанно, постоянное ожидание его появления усугубляет ситуацию. Человек боится покинуть зону комфорта, избегает ситуаций, способных вызвать чувство страха. Во время приступа паники у больного агорафобией может развиваться постуральная фобическая неустойчивость. Ее характеристиками будут:
У человека с агорафобией постепенно увеличивается количество ситуаций, которые приводят к постуральной неустойчивости. В результате нарастает стремление исключить подобные ситуации в жизни, результатом чего становится замкнутость и отстраненность. Люди с агорафобией могут неделями и даже годами не покидать свое жилище. Постуральная фобическая неустойчивость больше связана с эмоциональным расстройством, чем с физическими нарушениями головного мозга.
Постуральная неустойчивость при болезни Паркинсона
При болезни Паркинсона постуральная неустойчивость является одним из основных симптомов развития заболевания. Возникновение болезни Паркинсона связано с дегенерацией нейронов и нарушением работы базальных ганглиев, которые отвечают за прямохождение и походку человека.
Нарушение походки сопровождается изменением положения тела, когда центр тяжести смещается и человек наклоняется вперед. При постуральной неустойчивости человек вынужден «следовать» за собственным телом, которое клонит в разные стороны, что приводит к угрозе падения вперед (пропульсия), назад (ретропульсия) и вбок (латеропульсия). Человеку становится сложно начинать движение и останавливаться. Набирая темп, очень сложно погасить инерцию движения, что нередко приводит к падению.
Прогрессирующая дегенерация участка головного мозга, который отвечает за постуральные механизмы и рефлексы (прямохождение, координацию движений и сохранение равновесия тела), постепенно все больше склоняет тело больного вперед. Вначале это приводит к нарушениям походки и утрате чувства равновесия, а в дальнейшем лишает человека способности самостоятельно сидеть и передвигаться. В результате человек остается прикованным к инвалидному креслу.
Постуральная неустойчивость: лечение
Для лечения синдрома постуральной неустойчивости прежде всего требуется исключить заболевание, которое ее вызывает. В случае психологических причин развития состояния необходима помощь психолога для устранения фобии, приводящей к постуральной неустойчивости. Психотерапия может занимать длительный период времени, в зависимости от степени углубления страхов в подсознание пациента. Для облегчения состояния больного ему могут назначаться антидепрессанты и успокоительные. Выбор препаратов определяет только лечащий врач в зависимости от индивидуальных особенностей больного. Нельзя самостоятельно назначать подобные препараты, что чревато ухудшением состояния здоровья.
В лечении постуральной неустойчивости, связанной с болезнью Паркинсона, применяют комплексный подход. В настоящее время болезнь Паркинсона считается неизлечимой, поэтому все терапевтические мероприятия направлены на облегчение состояния пациента и снижение темпов развития заболевания. Основными препаратами, устраняющими двигательные нарушения, являются леводопа, агонисты дофаминовых рецепторов и ингибиторы МАО-Б. Поскольку болезнь Паркинсона связана со снижением уровня дофамина в головном мозге, его восполняют с помощью данных медикаментов.
При неэффективности консервативной терапии, для устранения двигательных нарушений может быть применена паллидотомия. Это хирургическая операция на головном мозге, при которой происходит частичное разрушение бледного шара. Также для лечения болезни Паркинсона применяют нейростимуляцию – малоинвазивная нейрохирургическая операция с направленной симуляцией определенных структур головного мозга электрическим током.
Специалисты Юсуповской больницы берутся за самые сложные случаи и достигают максимального терапевтического эффекта. Обратившись в Юсуповскую больницу, пациент получает квалифицированную медицинскую помощь и психологическую поддержку, что позволяет значительно улучшить качество его жизни.
Юсуповская больница расположена недалеко от центра Москвы, здесь принимают пациентов круглосуточно. Записаться на прием и получить консультацию специалистов можно по телефону клиники.
Что такое постуральная неустойчивость
Во всем мире от болезни Паркинсона (БП) страдает более 1% населения старше 65 лет. Основная причина болезни Паркинсона — гибель нигростриарных нейронов с последующим снижением количества дофамина в полосатом теле. [ 18 F]флюородопа — вещество с умеренной радиоактивностью, которое после внутривенного введения способно к связыванию с дофаминовыми рецепторами полосатого тела. У пациентов с симптомами БП при ПЭТ определяют выраженное снижение связывания [ 18 F]флюородопы с дофаминовыми рецепторами (и, соответственно, снижение числа самих рецепторов).
[Иофлупан-I-123 — это радиофармпрепарат, представляющий собой аналог кокаина, который поглощают нейроны полосатого тела. Его захват можно оценить при помощи однофотонной эмиссионной компьютерной томографии (БРЕСТ) головного мозга; подобный метод исследования помогает обследовать пациентов с подозрением на болезнь Паркинсона]. В результате у пациентов повышается активность полосатого тела, а прямой двигательный путь начинает преобладать над непрямым.
Разрушение нигростриарного пути, вероятно, имеет форму «дистальной нейропатии», поскольку в полосатом теле дофамин начинает разрушаться раньше, чем в среднем мозге. Шипиковые нейроны полосатого тела также погибают, уменьшается длина дендритов, снижается число шипиков. Возможно, что дофаминергическая активность необходима шипиковым нейронам для защиты от потенциально токсичного влияния глутамата.
Для появления первых признаков заболевания необходима гибель около 60% нейронов верной субстанции. Задержка в развитии симптомов связана с (а) повышением продукции дофамина оставшимися нейронами; (б) повышением экспрессии дофаминовых рецепторов нейронами полосатого тела (положительная регуляция).
Для болезни Паркинсона (БП) характерны следующие симптомы/признаки: тремор, брадикинезия, ригидность и нарушение постуральных рефлексов. Однако все симптомы одновременно проявляются не у всех пациентов.
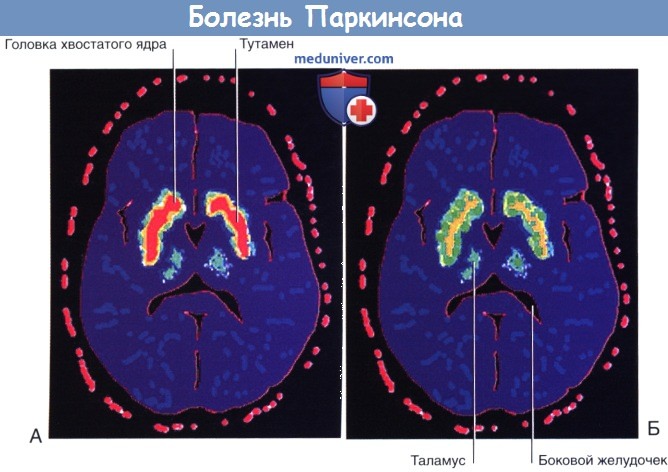
Интенсивность поглощения отображена красным (максимальная), желтым, зеленым и синим (минимальная) цветами.
(А) Здоровый человек. (Б) Болезнь Паркинсона.
а) Тремор. Тремор, имеющий частоту 3—6 Гц в одной конечности, — первый симптом болезни у двух третей пациентов. Выраженность тремора не коррелирует с другими двигательными симптомами БП; также тремор не прогрессирует с той же скоростью, что и брадикинезия, ригидность или нарушения походки. Чаще всего тремор сначала появляется в одной из рук, затем в течение 1 года начинает страдать нога с этой же стороны, затем в течение еще трех лет тремор появляется на противоположной стороне. Отчетливо определяют тремор губ и языка, постоянные пронацию и супинацию предплечий, сгибание и разгибание пальцев.
Характерен также признак «скатывания пилюль» (в русскоязычной литературе чаще используют термин «счет монет»), когда пациент постоянно проводит II и III пальцами кисти вдоль большого пальца. Обычно тремор проявляется только в покое и исчезает при начале движения. Пациент, у которого имеется только тремор покоя, может без больших проблем поднять и выпить стакан воды. Для БП характерен именно тремор покоя, в то время как при расстройствах мозжечка развивается интенционный тремор. Интенционный тремор отсутствует в покое (за исключением случаев тяжелого повреждения мозжечка) и появляется только при произвольных движениях. (Причиной тремора при болезни Паркинсона (БП) может стать сочетание дисфункции базальных ганглиев и мозжечково-таламо-корковых путей.)
Тремор связан с ритмичным возбуждением нейронов всех пяти клеточных групп прямого пути двигательной петли и нейронов переднего рога спинного мозга. Ниже будет описано, как нарушение аутогенного торможения приводит к проявлению тремора покоя и ригидности.
Небольшой тремор действия обычно можно наблюдать у пациентов с выраженным тремором покоя; как правило, он более выражен на той же стороне, где сильнее проявляется тремор покоя. Сильнее всего тремор действия проявляется в пальцах кисти при полностью вытянутых руках. Одно из его проявлений—нарушение почерка. Следует отметить, что при отсутствии тремора покоя наличие небольшого тремора действия свидетельствует о доброкачественном эссенциаль-ном треморе (см. далее).
б) Ригидность. Ригидность захватывает одновременно все соматические мышцы, однако из-за того, что в большей степени ей подвержены мышцы-сгибатели, у пациента возникает характерная «поза просителя». Сопротивление пассивному сгибанию и разгибанию крупных суставов имеется на протяжении всего диапазона движения. Такую ригидность называют ригидностью «по типу свинцовой трубы». Она отличает болезнь Паркинсона (БП) от заболеваний, сопровождающихся повреждением верхних мотонейронов, при которых возникает спастичность по типу «складного ножа». При этом врач может также обнаружить небольшой тремор, возникающий при пассивных движениях. Именно поэтому кажется, что мышцы напрягаются «прерывисто», по типу «зубчатого колеса» (тремор накладывается на ригидность).
Ранее для устранения ригидности прибегали к хирургическому пересечению задних нервных корешков. Это доказывает, что ригидность имеет периферическое чувствительное происхождение. Ригидность также можно устранить путем хирургического разрушения бледного шара или ВЛЯ таламуса. Поскольку при болезни Паркинсона не происходит усиления сгибательных рефлексов, внимание исследователей сосредоточено на афферентных волокнах сухожильного органа Гольджи, отвечающего за аутогенное торможение. Эти афферентные волокна образуют синапсы с тормозными вставочными нейронами 1b, которые активируются во время мышечного сокращения и подавляют активность мотонейронов, иннервирующих эту же мышцу и все гомонимные мышцы (т. е. нервный импульс, возникший в сухожильном органе двуглавой мышцы плеча, будет тормозить нейроны самого бицепса и плечевой мышцы).
У пациентов с болезнью Паркинсона (БП) эндогенное торможение снижено, оно замедляется до такой степени, что начинает смешиваться со стимулами, нисходящими от головного мозга, в результате чего усугубляется тремор. Нарушение торможения также способствует и развитию ригидности, поскольку при болезни Паркинсона во время движения может происходить одновременное сокращение основной мышцы и ее антагониста.
Учитывая, что для активации сухожильных органов требуется сокращение мышцы, возникает вопрос: почему у пациентов проявляется «тремор покоя», если мышцы, предположительно, неактивны? На самом деле, даже если руки человека лежат на коленях или подлокотниках кресла, мышцы рук/кистей не находятся в полном покое. Тремор исчезает только в том случае, если рука полностью фиксирована на уровне локтевого сустава и запястья. Тремор также исчезает во время сна.
В норме волокна корково-спинномозгового и ретикуло-спинномозгового путей постоянно активируют тормозные вставочные нейроны 1b. При болезни Паркинсона активация первичной двигательной коры за счет ДМО снижена и происходит неравномерно, поэтому и появляются характерные симптомы со стороны руки и кисти. Нарушение работы ретикуло-спинномозгового пути, вероятно, сильнее влияет на состояние мышц нижних конечностей.
От нейронов скорлупы проекции отходят не только к бледному шару, но и к ГАМК-ергическим нейронам, в первую очередь, нейронам СЧЧС. Компактная часть черной субстанции также отдает волокна к сетчатой части. Последняя, в свою очередь, имеет связи с локомоторным центром ствола мозга. Один из ожидаемых вторичных эффектов повышенной активности скорлупы при болезни Паркинсона — торможение нервных импульсов, идущих от локомоторного центра к волокнам ретикуло-спинномозгового пути моста и продолговатого мозга.
Один из ранних симптомов болезни Паркинсона — сложности при письме. Отдельные буквы становятся мелкими и неровными. Нарушение письма, вероятно, связано с одновременным сокращением сгибателей и разгибателей кисти, которое возникает из-за выраженного нарушения супраспинальной активации вставочных нейронов 1а, образующих синапсы с мотонейронами мышц-антагонистов.
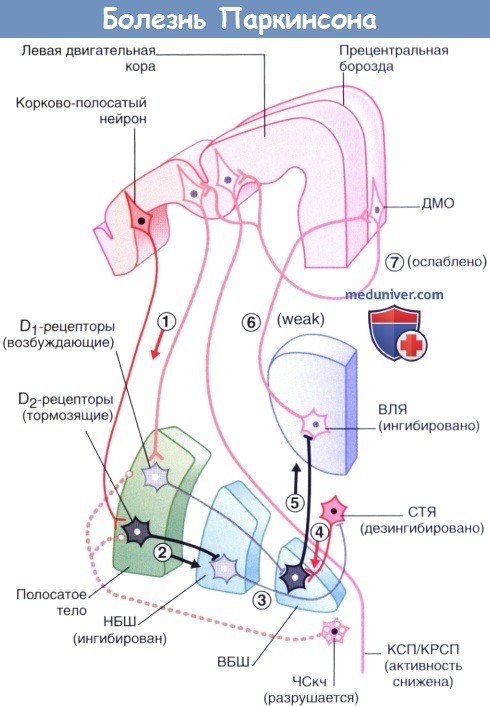
Клинические проявления болезни становятся следствием нарушения тонического возбуждения шипиковых нейронов полосатого тела, экспрессирующих D1-рецепторы, а также следствием нарушения тонического ингибирования нейронов, экспрессирующих D2-рецепторы.
Целостность прямого пути нарушена, активным по умолчанию становится непрямой путь.
(1) Корково-полосатый нейрон активирует ГАМК-ергические нейроны (2) полосатого тела, которые образуют синапсы с нейронами (3) наружного сегмента бледного шара (НБШ).
В результате такого двойного эффекта происходит дезингибирование субталамического ядра (СТЯ).
Нейроны СТЯ влияют на (4) ГАМК-ергические нейроны внутреннего сегмента бледного шара (ВБШ), которые затем воздействуют на (5) вентральное латеральное ядро (ВЛЯ) таламуса, в результате чего снижается передача нервного импульса таламо-корковых волокон, (6) идущих к дополнительной моторной области (ДМО).
Сигналы (7) от ДМО к волокнам корково-спинномозгового и корково-ретикуло-спинномозгового путей (КСП/КРСП) становятся все слабее, в результате чего у пациента появляются сложности с началом движений и их выполнением.
в) Брадикинезия. Под брадикинезией понимают замедление движений. Пациенты жалуются на то, что повседневные действия, например открывание двери, начинают требовать тщательного планирования и сознательного контроля. При электромиографии мышц конечностей определяют снижение начальной электрической активности мышц-агонистов, которая в норме возникает при первом сокращении соответствующих мышц. В норме базальные ганглии начинают контролировать двигательный акт через миллисекунды после того, как премоторная кора и мозжечок подняли частоту генерации потенциала действия нейронами двигательной коры до уровня, необходимого для активации нижних мотонейронов спинного мозга. При болезни Паркинсона нервные импульсы, идущие к мотонейронам спинного мозга, становятся слабее из-за сниженного влияния ДМО.
г) Постуральная неустойчивость. Пациенты легко теряют равновесие, их легко сбить с ног простым случайным толчком («падают как телеграфный столб»). Это происходит из-за нарушения корректирующих постуральных движений: в норме при толкании верхней половины туловища должно произойти немедленное сокращение мышц нижних конечностей, достаточное для восстановления равновесия.
Два других симптома болезни Паркинсона — глазодвигательная дискинезия и деменция — описаны в отдельных статьях на сайте.
д) Дифференциальная диагностика. Болезнь Паркинсона имеет два основных клинических варианта. В первом случае ведущим симптомом выступает тремор, во втором доминируют акинезия и ригидность. В настоящее время известно, что более чем у 20% пациентов, которым был поставлен диагноз БП и начато соответствующее лечение, болезнь Паркинсона отсутствует вовсе либо имеет место синдром «паркинсонизм-плюс» (при мультисистемной дегенерации).
1. Доброкачественный эссенциапьный тремор, который очень часто принимают за БП, встречают в два раза чаще БП. Сначала это заболевание проявляется лишь небольшим тремором, который лучше всего заметен при полностью вытянутых руках. Позднее появляются дрожание головы (не характерное для болезни Паркинсона) и ортостатический (проявляющийся в положении стоя) тремор туловища. Из-за тремора диафрагмы может развиться вокальный тремор. Иногда доброкачественный эссенциальный тремор называют семейным, поскольку его наследуют по аутосомно-доминантному механизму; чаще всего он проявляется на пятом десятилетии жизни. Эссенциальный тремор, наблюдаемый у пожилых, раньше называли сенильным.
Причина заболевания неизвестна. Леводопа (L-допа, см. далее) неэффективна, хотя у больных с болезнью Паркинсона она облегчает оба вида тремора.
В руководствах по клинической неврологии описаны и другие заболевания со схожей клинической картиной, например прогрессирующий надъядерный паралич и корково-базальная дегенерация.
е) Лечение болезни Паркинсона:
1. Консервативное. Наиболее эффективный метод лечения болезни Паркинсона — прием L-допы. Этот препарат проникает через гематоэнцефалический барьер и затем выжившими нейронами черной субстанции метаболизируется в дофамин. Назначение L-допы эффективно примерно у 75% пациентов, выраженность симптомов снижается на 50% и более. Спустя несколько лет приема у пациентов могут развиваться побочные эффекты терапии, в том числе спонтанные хореиформные движения, вызванные чрезмерной активацией полосатого тела. Спустя год и более, по мере прогрессирующей гибели нейронов черной субстанции, эффективность L-допы начинает снижаться. В этом случае для стимуляции постсинаптических дофаминовых рецепторов полосатого тела можно использовать агонисты дофамина (иногда их применяют в качестве терапии первой линии в надежде уменьшить выраженность или замедлить появление побочных эффектов L-допы).
Антихолинергические препараты снижают активность холинергических вставочных нейронов полосатого тела. Они способны снижать выраженность обоих видов тремора, но необходимые для этого дозы могут вызывать побочные реакции со стороны вегетативной нервной системы.
2. Хирургическое лечение болезни Паркинсона. В настоящее время оптимальным методом хирургического лечения болезни Паркинсона считают высокочастотную (133 Гц) стимуляцию СТЯ посредством имплантируемых электродов. Однако механизм(ы) действия этого способа лечения полностью не установлены. При помощи высокочастотной стимуляции удается уменьшить проявления тремора, брадикинезии и ригидности у пациентов с болезнью Паркинсона. Часто стимуляцию необходимо проводить с двух сторон. Посредством введения электродов в СТЯ можно судить о его когнитивных и поведенческих функциях. Подобные изменения, не относящиеся к двигательной сфере, наблюдают при установке электродов в вентральные отделы СТЯ.
Следовательно, в пределах СТЯ имеются различные функциональные отделы. Другой возможный участок стимуляции при болезни Паркинсона — ножкомостовое ядро. Стимуляцию ВБШ в последнее время используют редко.
К другим методам лечения, эффективность которых только определяют, относят использование черной субстанции плода в качестве трансплантата, введение в полосатое тело факторов роста, генотерапию.
Видео этиология, патогенез болезни Паркинсона
Редактор: Искандер Милевски. Дата публикации: 23.11.2018
Паркинсонизм и его основные нозологические формы
Болезнь Паркинсона (БП) – хроническое, неуклонно прогрессирующее заболевание центральной нервной системы.
Болезнь Паркинсона (БП) – хроническое, неуклонно прогрессирующее заболевание центральной нервной системы с дегенерацией нигростриарных нейронов и нарушением функции базальных ганглиев. Она относится к одним из наиболее частых нейродегенеративных заболеваний, которые стоят на третьем месте среди причин смертности после сердечно-сосудистых и онкологических заболеваний.
Паркинсонизм известен давно, первые сообщения о лечении похожих расстройств были сделаны 1000-2500 лет до н.э.
Первое клиническое описание принадлежит английскому врачу Джеймсу Паркинсону, который опубликовал в 1817 году «Эссе о дрожательном параличе».
Подробный клинический анализ комплекса патологии был сделан в 1879 г. знаменитым французским неврологом Жаном Мартеном Шарко.
В настоящее время в классификации паркинсонизма выделяют:
I. Болезнь Паркинсона (она составляет около 70-80% всех регистрируемых случаев).
II. Вторичный (симптоматический) паркинсонизм (около 15%) включает следующие варианты: лекарственный, токсический, постгипоксический, энцефалитический, травматический, при объемных процессах, при гидроцефалии, сосудистый.
III. Паркинсонизм при различных дегенеративных заболеваниях с поражением экстрапирамидной системы («паркинсонизм-плюс», около 10%): мультисистемные атрофии (стриатонигральная дегенерация, оливопонтоцеребеллярная дегенерация), прогрессирующий надъядерный паралич (болезнь Стила-Ричардсона-Ольшевского), кортикобазальная дегенерация, деменция с тельцами Леви, паркинсонизм-БАС-деменция, болезнь Вильсона-Коновалова, болезнь Гентингтона (ювенильный вариант Вестфаля), болезнь Фара (идиопатическая кальцификация базальных ганглиев), болезнь Альцгеймера, другие.
Основной нозологической формой паркинсонизма является болезнь Паркинсона.
Этиология БП неизвестна. В основе ее патогенеза лежит дегенерация так называемых дофаминергических нейронов. БП носит преимущественно спорадический характер, однако при наличии БП у ближайших родственников риск ее развития возрастает.
Клинические проявления БП возникают при уменьшении количества дофамина в хвостатом ядре и скорлупе не менее чем на 70%. Симптомы БП развиваются постепенно, вовлекая сперва конечности на одной стороне. Для клинической картины БП характерно сочетание гипокинезии, ригидности, тремора покоя, и постуральных нарушений.
Гипокинезия проявляется снижением двигательной активности, замедленностью движений, уменьшением амплитуды действий.
Тремор покоя в классических случаях начинается с дистальных отделов верхней или нижней конечности и напоминает движения рук «при счете монет или скатывании пилюль». В дальнейшем в тремор вовлекается гомолатеральная конечность, нижняя челюсть, противоположные конечности. Иногда отмечается постуральное дрожание рук.
Кроме двигательных нарушений, при БП части развиваются недвигательные проявления: нервно-психические расстройства; нарушения сна; вегетативные нарушения; чувствительные нарушения.
В зависимости от преобладания того или иного симптома в клинической картине БП принято выделять следующие клинические формы заболевания: дрожательную, акинетическую, а также смешанные формы — акинетико-ригидную и ригидно-дрожательную.
На поздних стадиях БП клиническая картина видоизменяется, появляются дополнительные моторные (двигательные флуктуации, лекарственные дискинезии, нарушения ходьбы, падения, застывания и акинетические кризы) и немоторные (вегетативные, когнитивные, нейропсихические) синдромы.
У больных могут возникать длительные периоды декомпенсаций — от нескольких дней до нескольких недель, а также акинетические кризы — тяжелые эпизоды акинезии, сопровождающиеся дисфагией, вегетативными нарушениями, гипертермией, олигурией, спутанностью сознания. Причинами этого могут являться: нарушение схемы приема противопаркинсонических средств, их полная отмена («лекарственные каникулы»); прием препаратов, блокирующих ДА-рецепторы (прежде всего нейролептики); обострение сопутствующих соматических заболеваний, стресс; операции, травмы, дегидратация организма.
Диагностировать БП с уверенностью можно только с помощью аутопсии. Клиническая диагностика синдрома паркинсонизма требует обязательного наличия гипокинезии и не менее одного из трех основных симптомов паркинсонизма: тремора покоя, ригидности и постуральной неустойчивости.
Проведение МРТ головного мозга является обязательным при наличии у больного синдрома паркинсонизма. Данное исследование прежде всего необходимо для дифференцирования идиопатической болезни Паркинсона и вторичного паркинсонизма, а также «паркинсонизма-плюс».
Основными направлениями лечения БП являются:
1. Фармакотерапия.
2. Медико-социальная реабилитация.
3. Лечебная физическая культура (ЛФК).
4. Нейрохирургическое лечение.
Фармакотерапия при БП направлена на нормализацию биохимического дисбаланса и требует постоянного приема лекарственных средств, так как при прекращении лечения симптомы БП возвращаются к исходному уровню.
На ранней стадии лечение БП заключается в назначении монотерапии с последующим переходом на комбинированное лечение.
На ранних стадиях заболевания общепринятым является назначение больным в возрасте до 70 лет агонистов ДА-рецепторов и ингибиторов МАО-В в виде монотерапии или сочетания.
У пациентов старше 70 лет, когда ожидаемая продолжительность жизни больного меньше, а также имеются когнитивные нарушения, терапию можно сразу начинать с ДОФА-содержащих препаратов в минимальной эффективной дозе, которую подбирают постепенно.
Холинолитики (Циклодол, Акинетон) назначаются преимущественно на ранней стадии БП — в виде монотерапии или в комбинации с другими противопаркинсоническими средствами; они преимущественно влияют на тремор покоя.
В настоящее время их назначают лишь молодым пациентам, с выраженным тремором покоя и сохранными когнитивными функциями. Высокая частота побочных эффектов и низкая эффективность по сравнению с другими группами существенно ограничивают их применение.
Препараты амантадина (Мидантан, ПК-Мерц).
Амантадины могут назначаться как при начальной стадии в виде монотерапии, так и в комбинации с другими противопаркинсоническими средствами на поздних стадиях БП. Препараты эффективны и для уменьшении степени выраженности дискинезий, вызванных приемом леводопы. Инфузионная форма амантадина сульфата (ПК-Мерц) применяется при лечении декомпенсаций и акинетических кризов при БП.
Агонисты дофаминовых рецепторов обладают способностью непосредственно стимулировать ДА рецепторы в головном мозге. Неэрголиновые агонисты ДА-рецепторов (Проноран, Мирапекс, Реквип Модутаб, Ньюпро) широко применяются на всех стадиях БП. Помимо контроля двигательных нарушений, у них выявлен антидепрессивный эффект, что очень важно, так как частота депрессивного синдрома при БП достаточно высока.
Монотерапия АДАР на ранних стадиях заболевания позволяет отсрочить назначение препаратов леводопы, а также развитие моторных флюктуаций и лекарственных дискинезий.
Ингибиторы МАО типа В (Разагилин). Назначение препаратов этой группы приводит к увеличению количества дофамина в нейронах. Также предполагается наличие у них нейропротекторного действия. Могут назначаться на ранних стадиях в виде монотерапии, а также в комбинации с леводопой.
Ингибиторы КОМТ. Ингибиторы КОМТ увеличивают биодоступность леводопы, уменьшая уровень ее неактивных метаболитов.
Ингибиторы КОМТ периферического действия не проходят ГЭБ и препятствуют метилированию леводопы в желудочно-кишечном тракте и кровеносном русле. Благодаря этому они сохраняют концентрацию леводопы на определенном уровне. К таким препаратам относится энтакапон.
Комбинация энтакапона с препаратами леводопы позволяет снизить суточную дозу ДОФА-содержащего препарата на 15–30%.
Он назначается только в комбинации с препаратами леводопы (Сталево), так как при назначении в виде монотерапии самостоятельным противопаркинсоническим эффектом не обладает.
Препараты леводопы (Мадопар, Наком, Тремонорм, Тидомет-форте, Дуэллин, Синдопа). Дофамин не проходит ГЭБ, поэтому в качестве лекарственного препарата был предложен метаболический предшественник дофамина — леводопа, которая проходит через ГЭБ и в головном мозге метаболизируется в дофамин. На сегодняшний день препараты леводопы являются наиболее эффективными лекарственными средствами, «золотым стандартом», применяющимися для лечения БП. Однако они не останавливают прогрессирование БП. Более того, в среднем после 5 лет применения ДОФА-содержащих средств у больных БП снижается их эффект, появляются двигательные флюктуации и лекарственные дискинезии.
Сроки назначения терапии препаратами леводопы зависят от степени выраженности и темпа прогрессирования заболевания, профессиональной деятельности больного, семейно-бытового статуса. В целом назначать препараты этой группы необходимо, когда имеются выраженные двигательные нарушения, которые не удается купировать другими противопаркинсоническими средствами.
Нейрохирургическое лечение.
Снижение эффективности фармакотерапии, появление моторных флюктуаций и лекарственных дискинезий являются показанием к применению нейрохирургического лечения, которое в течение последних двух десятилетий прочно заняло свое место в алгоритме ведения пациентов с БП.
В настоящее время используются три типа нейрохирургических вмешательств при БП: стереотаксические деструктивные методы (вентролатеральная таламотомия, паллидотомия, субталамотомия и их комбинация), стимуляционные методы (имплантация электродов в подкорковые структуры с последующей их хронической электростимуляцией) и внутримозговая трансплантация дофаминергических нейронов мезенцефалона эмбриона человека, эффективность которой продолжает изучаться.
Наиболее современный метод хирургического лечения БП – глубокая электростимуляция головного мозга. Процедура ГСМ состоит в имплантации электродов с 4 контактами в зоны-мишени в пределах подкорковых образований головного мозга; электроды соединяются с имплантируемым под кожу стимулятором, подающим высокочастотные электрические импульсы в стимулируемое ядро.
Медико-социальная реабилитация.
Высокая степень инвалидизации при неуклонно прогрессирующей БП, социально-экономические потери, которые несет общество обусловливают необходимость создания системы медико-социальной реабилитации, которая должна включать в себя диспансерное наблюдение больных; создание школ для пациентов и их родственников ведение обучающих программ и психотерапевтических занятий, создание общественных организаций, групп поддержки.
Большое значение имеет ЛФК, которая может подбираться индивидуально в зависимости от степени тяжести болезни у конкретного больного, занятия ЛФК в группах, танцевальная терапия, а также трудотерапия, физиотерапия.
