Что такое правило октета
Правило октетов
Правило октета (октетная теория) — предложено Г.Н. Льюисом для объяснения причин образования ковалентных химических связей. Согласно этому правилу при образовании молекул атомы удовлетворяют свою потребность в достижении 8 электронной валентной оболочки, подобной электронной конфигурации благородных газов за счет попарного обобществления своих валентных электронов. По своей важности это фундаментальное открытие Льюиса стоит в одном ряду с такими открытиями, как Периодический закон элементов и теория строения органических соединений. Широко распространенное мнение, что правило октета выполняется лишь в ограниченном числе случаев также ошибочно, как и утверждение того, что Периодический закон элементов не имеет всеобщего характера. Все примеры «невыполнения» правила октетов можно подразделить на следующие три группы:
2. Молекула образуется за счет трехцентровых связей, например KI3. В этой молекуле анион иода связан с молекулой иода трехцентровой четырехэлектронной связью. Молекула B2H6 построена за счет образования трехцентровых двухэлектронных связей Н-В-Н.
3. В образовании химических связей принимают участие d-орбитали. В этом случае правило октетов (в пределе, т.е. в случае участия всех пяти d-орбиталей) преобразуется в правило 18-электронов. Поскольку в целом ряде случаев участие d-орбиталей в образовании химических связей у некоторых элементов остается спорным вопросом, возникает иллюзия невыполнения правила октетов. Классическими примерами выполнения правила 18-электронов являются молекулы Fe(CO)5, Ni(CO)4, Co2(C)8, Fe(C5H5)2 (ферроцен).
История
В конце XIX века стало известно, что координационные структуры формируются атомами или молекулами таким образом, чтобы максимально удовлетворить валентность задействованных атомов. В 1893 Альфред Вернер показал, что число атомов или их групп, ассоциированных с центральным, часто равно 4 или 6, реже 8. В 1904 году Ричард Абегг сформулировал правило (известное как правило Абегга), утверждавшее, что максимальная разница между положительной и отрицательной валентностью элемента часто равна 8. Используя его Гилберт Ньютон Льюис в 1916 году записал правило октета для своей теории кубического атома.
Обзор
Валентная оболочка элемента полна и наиболее устойчива, если содержит 8 электронов (что является причиной низкой химической активности благородных газов).
Правило октета. Почему образуется связь?
Химическая связь — это взаимодействие атомов, осуществляемое путем обмена электронами.
Причина образования химических связей – выигрыш в энергии системы связанных атомов по сравнению с изолированными атомами.
При образовании химической связи атомы стремятся приобрести устойчивую восьмиэлектронную (или двухэлектронную) внешнюю оболочку, соответствующую строению атома ближайшего инертного газа.
Движущей силой, заставляющей атомы соединяться между собой, является стремление принять, отдать или объединить электроны с тем, чтобы получить полностью заполненную внешнюю электронную оболочку. У водорода Н и гелия Не внешняя электронная оболочка представляет собой 1s-орбиталь, для заполнения которой требуется два электрона (вспомним, что первый электронный слой не имеет р-орбиталей).

Электронная конфигурация атома особенно стабильна (иными словами, имеет минимальный запас энергии, что всегда предпочтительно), когда внешняя электронная оболочка заполнена. Поэтому атомы склонны к таким превращениям, в результате которых во внешнем слое оказывается „магическое” число электронов — восемь. Исключение составляют атомы первых двух элементов периодической системы, для которых предпочтительно образование двухэлектронной внешней оболочки.
Правило октета объясняет, почему инертные газы (группа VIIIA) гелий, неон и аргон обычно не вступают в химические реакции. Их внешняя электронная оболочка уже заполнена, следовательно нет необходимости во взаимодействии с другими атомами с целью принять, отдать или объединить электроны.
Элементы 3—7-го периодов также обычно подчиняются правилу октета (т. е. склонны к заполнению s- и р-орбиталей, хотя могут иметься d- и f-орбитали).
Согласно правилу октета большинство атомов склонно принимать, отдавать или объединять электроны с тем, чтобы создать восьмиэлектронную внешнюю оболочку.
Правило октета
Атомы стремятся отдавать или принимать электроны до тех пор, пока в их внешнем слое не станет 8 электронов.
Расположение химических элементов в периодической системе Менделеева объясняется тем, как электроны заполняют доступные энергетические уровни, или слои, в атоме. Например, благородные газы, такие как неон, ксенон и аргон, имеют во внешнем слое по 8 электронов (то есть слой заполнен) — и поэтому они неохотно вступают в химические реакции. Самое низкое энергетическое состояние (и, следовательно, самое устойчивое) в большинстве случаев имеют атомы с заполненным внешним электронным слоем. На этом и построено правила октета.
Правило октета объясняет, как атомы образуют ионы. Рассмотрим в качестве примера натрий. В его атоме 11 электронов: два во внутреннем слое, восемь в следующем и один во внешнем слое. Этот внешний электрон очень подвижен, поэтому, если атому натрия передается энергия (например, в результате столкновения с другим атомом), он легко образует ион натрия с единичным положительным зарядом. Чтобы удалить электрон с внутреннего слоя, энергии потребуется в десять раз больше, поэтому ион натрия с двойным положительным зарядом — большая редкость. Точно так же кальций, имеющий 2 электрона во внешнем слое и 8 в следующем, более низком слое, образует ион, теряя 2 электрона. То есть, когда атомы превращаются в ионы, они по строению становятся похожи на атомы благородных газов.
Правило октета помогает нам понять, как устроены химические связи. Но оно работает далеко не для всех элементов. Например, олово имеет во внешнем незаполненном слое 14 электронов, но может отдавать только 2 или 4 электрона: отрыв большего количества электронов потребовал бы непомерных затрат энергии. Поэтому олово образует ионы с положительным зарядом 2 или 4.
Правило октета — одно из тех правил, которые отражают на первый взгляд случайные закономерности, выведенные химиками из опыта и наблюдений. Однако эти закономерности легко могут быть объяснены в терминах атомной теории строения вещества.
Правило октета
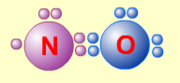
Сумма валентных электронов атомов, образующих молекулу, нечётна. Пример — молекула оксида азота NO.
В данном случае сумма валентных электронов атома азота (5) и кислорода (6) равна 11, поэтому в этой молекуле атом кислорода достигает восьмиэлектронной оболочки, а атом азота — нет. В данном случае изначально невозможно достижение обоими атомами восьмиэлектронной оболочки. Стремление атома азота заполнить свою электронную оболочку объясняет химическую реакционную способность этой молекулы.
Молекула образуется за счет трехцентровых связей, например KI3. В этой молекуле анион иода связан с молекулой иода трехцентровой четырехэлектронной связью. Аналогичные трехцентровые, но двухэлектронные связи присутствуют в молекуле B2H6.
В образовании химических связей принимают участие d-орбитали. В этом случае правило октетов (в пределе, то есть в случае участия всех пяти d-орбиталей) преобразуется в правило 18-электронов. Поскольку в целом ряде случаев участие d-орбиталей в образовании химических связей у некоторых элементов остается спорным вопросом, возникает иллюзия невыполнения правила октетов. Классическими примерами выполнения правила 18-электронов являются молекулы Fe(CO)5, Ni(CO)4, Co2(СО)8, Fe(C5H5)2 (ферроцен)и многие другие.Таким образом, главным в правиле октетов Льюиса является не число 8 (или 18), а обобщение электронов как основа образования ковалентной химической связи, и приближение за счет этого к электронной конфигурации инертного газа — восьмиэлектронной или восемнадцатиэлектронной.
Связанные понятия
В химии валентными электронами называют электроны, находящиеся на внешней (валентной) оболочке атома. Валентные электроны определяют поведение химического элемента в химических реакциях. Чем меньше валентных электронов имеет элемент, тем легче он отдаёт эти электроны (проявляет свойства восстановителя) в реакциях с другими элементами. И наоборот, чем больше валентных электронов содержится в атоме химического элемента, тем легче он приобретает электроны (проявляет свойства окислителя) в химических.
Что такое правило октета
Атомы и молекулы могут показаться слишком маленькими для изучения и понимания. Однако, несмотря на их крошечный размер, научные исследования многое показали об их поведении, в том числе о том, как атомы объединяются в молекулы. Со временем эти исследования привели к правилу октетов.
Определение правила октета
Правило октета гласит, что многие элементы имеют октет (8) электронов в их валентной (самой внешней) электронной оболочке, когда они образуют соединения. Формальное определение правила октетов от Северо-Западного университета гласит: «Атомы будут терять, приобретать или делить электроны, чтобы достичь электронной конфигурации ближайшего благородного газа (8 валентных электронов, за исключением He с 2)». Помните, что «Он» представляет гелий.
Гелий устойчив с двумя электронами, поэтому, как и другие благородные газы, гелий обычно не соединяется с другими элементами. Элементы, наиболее близкие к гелию (водород, литий и бериллий), приобретают или теряют электроны, так что во внешней электронной оболочке остаются только два электрона. Это предостережение иногда указывается как исключение из правила октетов, иногда считается частью правила октетов, а иногда называется правилом дуэтов.
Диаграммы Льюиса Дота
Точечные диаграммы Льюиса представляют число и относительные положения валентных электронов. Например, гелиевая точечная структура Льюиса показывает два валентных электрона и записывается как: He. Точечная диаграмма Льюиса для кислорода, которая имеет шесть валентных электронов, может быть записана в виде: Ö: точечная диаграмма Льюиса для бериллия может быть записана как: Be: потому что в бериллии четыре валентных электрона.
Как использовать правило октета
Правило октета гласит, что атомы будут делиться или занимать электроны, чтобы достичь числа валентных электронов ближайшего благородного газа.
Определить катион
Определить анион
Создайте точечные диаграммы Льюиса
Объединить, чтобы следовать правилу октета
Рассмотрим водород (группа I) и кислород (группа VI). Молекула кислорода с шестью электронами хочет еще два электрона. Водород имеет один валентный электрон и хочет два валентных электрона. Когда водород и кислород объединяются в воду, кислород заимствует электроны у двух атомов водорода. В формате точек Льюиса молекула воды выглядит как H: O: H с дополнительными парами точек выше и ниже символа кислорода (O), чтобы показать в общей сложности восемь электронов, окружающих O, и пару электронов для каждого водорода (H) атом. И кислород, и водород теперь имеют полные внешние валентные оболочки.
Визуализация с помощью правила октетов
Правило октетов помогает визуализировать, как атомы и молекулы объединяются, глядя на то, как они делят электроны. Например, диоксид углерода образует стабильную молекулу, деля электроны между одним атомом углерода (группа IV) и двумя атомами кислорода (группа VI). Атомы углерода и кислорода объединяются, разделяя пару электронов. Точечная диаграмма Льюиса показывает общую пару электронов в виде двойных точек между атомами, записанную как: Ö :: C :: Ö: (или: Ö = C = Ö :). Изучение точечной диаграммы Льюиса показывает, что каждый символ элемента имеет восемь валентных электронов, октет, вокруг каждого атома.
Исключения из правила октета
Помимо дуэтовой версии правила октетов, иногда встречаются два других исключения из правила октетов. Одно исключение происходит, когда элементы в рядах 3 и выше превышают восемь валентных электронов правила октета. Другое исключение происходит с элементами группы III.
Элементы III группы имеют три валентных электрона. Точечная структура бора Льюиса показывает валентные электроны бора, образующие треугольник. потому что отрицательно заряженные электроны отталкиваются или отталкиваются друг от друга. Для химического соединения бора с водородом октету требуется пять атомов водорода. Эта молекула, однако, невозможна из-за количества и расстояния между отрицательными зарядами электронов. Высокореактивная молекула образуется, когда бор (и другие элементы группы III) делят электроны только с тремя атомами водорода, образуя соединение BH3, которое имеет только шесть валентных электронов.