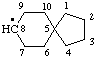Что такое радикал изобразите структурные формулы одновалентных радикалов состава c2h5 c3h7 c4h9
webHimik
подробное решение задач по химии
Напишите структурные формулы всех возможных изомерных радикалов: С2Н5, С3Н7, С4Н9, С5Н11
5. Напишите структурные формулы всех возможных изомерных радикалов: С2Н5, С3Н7, С4Н9, С5Н11.
Названия предельных радикалов линейного строения соответствуют названию алканов, в которых суффикс –ан, заменен на –ил. Радикалы разветвленного строения имеют приставки втор- или трет-, если свободная валентность находится у соответствующего атома углерода.


6. Напишите структурные формулы третичных радикалов, соответствующих 2-метилпентану и 3-метилпентану. Назовите их.
Третичный радикал имеет свободную валентность у третичного атома углерода.
Что такое радикал изобразите структурные формулы одновалентных радикалов состава c2h5 c3h7 c4h9
УРОК №2 ПО ТЕМЕ «НОМЕНКЛАТУРА АЛКАНОВ».
Изучив материал, нужно будет:
— Понятие – радикал, типы радикалов.
— Формулы и правила построения названий радикалов разного характера.
— Правила построения названий разветвлённых алканов.
— Называть алканы по имеющейся формуле.
— Строить формулы алканов разветвлённого строения по имеющемуся названию.
— Записывать формулы радикалов разного характера.
1.Радикал – это частица, обладающая не спаренным электроном, а, следовательно и неизрасходованной единицей валентности. На основе гомологического ряда алканов, можно построить и ряд радикалов, причем первичные радикалы отличаются от соответствующих им алканов, тем, что в их составе имеется на один атом водорода меньше. Очень важно выучить наизусть название первых 10 алканов и соответствующих им радикалов, так как названия представителей других классов органических соединений строятся на основе названий алканов.
Начиная с четвёртого представителя ряда алканов при построении названия углеводорода неразветвлённого строения перед основным названием добавляется буква – н, которая и говорит о том, что данный углеводород имеет неразветвлённое строение (например, н – бутан).
В приведенной ниже таблице даны формулы и соответствующие им названия для первых 10 представителей ряда алканов и соответствующих им радикалов.
Алкан
Чтобы построить название радикала, необходимо в название соответствующего алкана заменить суффикс – ан на суффикс – ил. Одновалентные углеводородные радикалы имеют общее название алкилы.
Однако помимо первичных радикалов очень часто в соединениях встречаются вторичные и третичные радикалы.
Первичный радикал – это радикал, содержащий первичный атом углерода, то есть такой атом углерода, который соединен в свою очередь лишь с одним другим атомом углерода (или тремя атомами водорода в случае радикала CH 3 –метил). Примерами первичных радикалов могут служить: C 2 H 5 – этил, C 3 H 7 – пропил и др.
Формулы некоторых вторичных, третичных радикалов, а также двух и трех валентных радикалов, наиболее часто употребляющихся приведены в таблице ниже.
Метилен
Изобутил (первичный изобутил)
двухвалентных радикалов (с двумя свободными валентностями у одного и того же атома углерода) производят заменой суффикса – ан на – илиден (исключение – радикал метилен CH 2 ). Трехвалентные радикалы имеют суффикс – илидин (исключение – радикал метин – СН).
Чтобы построить названия алканов разветвленного строения и их производных необходимо воспользоваться следующими правилами:
1. Выбирают главную цепь атомов углерода в веществе (самая длинная цепь) и нумеруют арабскими цифрами атомы углерода сверху с того конца, где ближе разветвление (к какому концу ближе в боковой цепи находятся радикалы).
2. Затем цифрами, их количеством, соответствующими приставками указывают все имеющиеся в веществе радикалы, их количество и местоположение.
3.Затем подсчитывают общее число атомов углерода в главной цепи и к уже имеющемуся названию дописывают название алкана, соответствующего числу атомов углерода в главной цепи.
Назвать алканы можно и по-другому, рассматривая их как производные метана, в молекуле которого один или несколько атомов водорода замещены на радикалы. А названия строят так: по старшинству называют все заместители, указывая их число, если они одинаковые, а за основу названия берётся слово «метан». Такая номенклатура называется рациональной.
Рассмотрим несколько приведённых ниже соединений и назовем их по систематической и рациональной (в скобках) номенклатурам.
Домашнее задание: осмыслить теоретический материал, составить формулы веществ по имеющимся названиям: 1,1,1 трихлорпентан, 2,2 диметил 3,3 дибром нонан, 1,1,6,6 тетрахлоргексан, н – декан, 2,3,5,триметил, 5 бром декан.
Углеводородный радикал
Углеводоро́дный радика́л (от лат. radix — «корень»; также — углеводородный остаток) в химии — группа атомов, соединённая с функциональной группой молекулы. Обычно при химических реакциях радикал переходит из одного соединения в другое без изменения. Но радикал и сам может содержать функциональные группы, поэтому с его «неизменностью» нужно быть осторожным: например, аминокислота аспарагиновая кислота содержит в той части молекулы, которая в общем виде рассматривается как остаток аминокислоты, ещё одну карбоксильную группу. Часто углеводородный радикал называют просто радикал, что может вызвать путаницу с таким понятием как свободный радикал. Некоторые углеводородные радикалы могут также являться функциональными группами, например, фенил (−C6H5), винил (−C2H3) и пр. Углеводородными радикалами обычно являются остатки углеводородов, которые входят в состав многих органических соединений.
Содержание
Номенклатура
Моновалентные углеводородные радикалы
Поливалентные углеводородные радикалы
Если радикал способен присоединиться к атому углерода с образованием двойной или тройной связи или присоединиться сразу к нескольким атомам углерода (т. е., имеет несколько свободных валентностей), он называется поливалентным (в конкретном случае — би-, тривалентным, и т. д.). Названия таких радикалов строятся путём присоединения к корню названия углеводорода суффикса «-илиден» или «-илидин» соответственно. Ранее исключениями из этого правила были метилен и метин (но не теперь); впрочем, применяются и эти названия.
l-соглашение
Поливалентные углеводородные радикалы также могут быть поименованы согласно l-соглашению. В этом случае название строится по схеме: [заместитель при атоме со свободной валентностью] — [порядковый номер атома со свободной валентностью] l n — [название углеводорода, который получился бы при образовании на месте свободных валентностей связей с атомами водорода]. n здесь — количество свободных валентностей, которыми обладает атом.
Примеры
Обозначение в формулах
Если не принципиально, какой углеводородный радикал находится в молекуле, то часто его обозначают просто буквой R (например, общая формула гомологического ряда спиртов — R−OH). Иногда вместо R используют символ Org. Если соединение содержит несколько разных радикалов, их обозначают R, R’, R», R 4 и т. д.
Иногда необходимо разделить ароматические, гетероциклические и алкильные радикалы. Для этого вместо символа R используют:
В органической химии нередко применяют сокращенные обозначения:
Иногда между обозначением характера радикала (t, i и др.) и остальной частью названия ставят чёрточку: t-Bu.
Структурные формулы некоторых примеров изображены здесь:
Радикал (химия)
Углеводоро́дный радика́л (от лат. radix — корень; также — углеводородный остаток) в химии — группа атомов, соединённая с функциональной группой молекулы. Обычно при химических реакциях радикал переходит из одного соединения в другое без изменения. Но радикал и сам может содержать функциональные группы, поэтому с его «неизменностью» нужно быть осторожным; например, аминокислота аспарагиновая кислота содержит в той части молекулы, которая в общем виде рассматривается как остаток аминокислоты, ещё одну карбоксильную группу. Часто углеводородный радикал называют просто радикал, что может вызвать путаницу с таким понятием как свободный радикал. Некоторые углеводородные радикалы могут также являться функциональными группами, например фенил (−C6H5), винил (−C2H3) и пр. Углеводородными радикалами обычно являются остатки углеводородов, которые входят в состав многих органических соединений.
Содержание
Номенклатура
Моновалентные углеводородные радикалы
Поливалентные углеводородные радикалы
l-соглашение
Примеры
Обозначение в формулах
Если не принципиально, какой углеводородный радикал находится в молекуле, то часто его обозначают просто буквой R (например, общая формула гомологического ряда спиртов — R−OH). Иногда вместо R используют символ Org. Если соединение содержит несколько разных радикалов, их обозначают R, R’, R», R 4 и т. д.
Иногда необходимо разделить ароматические, гетероциклические и алкильные радикалы. Для этого вместо символа R используют:
В органической химии нередко применяют сокращенные обозначения:
Иногда между обозначением характера радикала (t, i и др.) и остальной частью названия ставят чёрточку: t-Bu.
Структурные формулы некоторых примеров изображены здесь:
Применение
Тривиальные, не номенклатурные названия многих органических соединений состоят из названия углеводородного радикала и названия атомов или групп атомов, замещающих водород, например: СН3Сl — хлористый метил, C2H5Br — бромистый этил и т. д.
Первичные, вторичные, третичные и четверичные атомы углерода
Примечания
См. также
Полезное
Смотреть что такое «Радикал (химия)» в других словарях:
Химия — У этого термина существуют и другие значения, см. Химия (значения). Химия (от араб. کيمياء, произошедшего, предположительно, от египетского слова km.t (чёрный), откуда возникло также название Египта, чернозёма и свинца «черная… … Википедия
Радикал в химии — (химич. radical, radicale) слово, впервые введенное в научную химическую литературу, по видимому, Гитоном де Морво. В докладе французской Академии наук [ M émoire sur le Développement des Principes de la Nomenclature Mé thodique (18 апр. 1787).… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Радикал, в химии — (химич. radical, radicale) слово, впервые введенное в научную химическую литературу, по видимому, Гитоном де Морво. В докладе французской Академии наук [ Mémoire sur le Développement des Principes de la Nomenclature Méthodique (18 апр. 1787).… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ХИМИЯ ОРГАНИЧЕСКАЯ. НОМЕНКЛАТУРА СОЕДИНЕНИЙ — Для наименования органических соединений используется несколько систем, но ни одна из них не подходит для всех соединений. Сохранились многие тривиальные названия, которые либо применялись еще в начальный период органической химии и отражают… … Энциклопедия Кольера
ОРГАНИЧЕСНАЯ ХИМИЯ — первоначально составляла часть химии вообще и не имела особого названия; позже под О. х. стали разуметь химию веществ, встречающихся только в животном и растительном организме. Берцелиус (Berzelius) определил в 1827 г. О. х. как химию… … Большая медицинская энциклопедия
Углеводородный радикал — (от лат. radix «корень»; также углеводородный остаток) в химии группа атомов, соединённая с функциональной группой молекулы. Обычно при химических реакциях радикал переходит из одного соединения в другое без изменения. Но… … Википедия
Органическая химия — В Викисловаре есть статья «органическая химия» Органическая химия раздел химии, изучающий со … Википедия
ОРГАНИЧЕСКАЯ ХИМИЯ — наука, изучающая соединения углерода с др. элементами (органические соединения), а также законы их превращений. Назв. О. х. возникло на ранней стадии развития науки, когда предмет изучения ограничивался соед. углерода растит, и животного… … Химическая энциклопедия
Винил (радикал) — У этого термина существуют и другие значения, см. Винил (значения). Химическая структура винила Винил (от лат. vinum (vini) вино) одновалентный радикал этилена, СН=СН2. С … Википедия
Радиационная химия — область химии, охватывающая химические процессы, вызываемые действием ионизирующих излучений (См. Ионизирующие излучения) на вещество. Ионизирующей способностью обладают как электромагнитные излучения (рентгеновские лучи, γ лучи,… … Большая советская энциклопедия
Учебное пособие по органической химии. Часть1. Углеводороды
Онлайн-конференция
«Современная профориентация педагогов
и родителей, перспективы рынка труда
и особенности личности подростка»
Свидетельство и скидка на обучение каждому участнику
по органической химии
преподаватель КГБОУ СПО
«Красноярский монтажный колледж»
Учебное пособие «Органическая химия. Углеводороды» предназначено
для студентов средних специальных учебных заведений.
Материал представленный в пособии соответствует действующей
программе по химии и соответствует образовательному стандарту ФГОС СПО дисциплины «Химия» для специальностей технического профиля.
При рассмотрении тем курса органической химии использованы современные подходы, в конце каждой темы разобраны типовые задачи и приведены контрольные задания для самостоятельного решения.
Углеводороды имеют важное научное и практическое значение. Во-первых, представления о строении и свойствах этих веществ служат основой для изучения органических соединений других классов, т.к. молекулы любых органических веществ содержат углеводородные фрагменты. Во-вторых, знание свойств углеводородов позволяет понять исключительную ценность этих соединений как исходного сырья для синтеза самых разнообразных органических веществ, широко используемых человеком.
Углеводороды содержатся в земной коре в составе нефти, каменного и бурого углей, природного и попутного газов, сланцев и торфа. Запасы этих полезных ископаемых на Земле не безграничны. Однако до настоящего времени они расходуются главным образом в качестве топлива (двигатели внутреннего сгорания, тепловые электростанции, котельные) и лишь незначительная часть используется как сырье в химической промышленности. Так, до 85% всей добываемой нефти идет на получение горюче-смазочных материалов и лишь около 15% применяется как химическое сырье. Поэтому важнейшей задачей является поиск и разработка альтернативных источников энергии, которые позволят более рационально использовать углеводородное сырье.
Классификацию углеводородов проводят по следующим структурным признакам, определяющим свойства этих соединений:
Строение углеродной цепи:
Открытая (незамкнутая) цепь алифатических углеводородов может быть неразветвленной или разветвленной. Углеводороды с неразветвленной углеродной цепью называют нормальными (н-) углеводородами.
насыщенные (предельные) углеводороды (алканы и циклоалканы), в которых имеются только простые связи С-С.
ненасыщенные (непредельные), содержащие наряду с одинарными связями С-С, двойные и/или тройные связи (алкены, алкадиены, алкины, циклоалкены, циклоалкины).
АЛКАНЫ (предельные углеводороды, парафины)
Алканы – алифатические (ациклические) предельные углеводороды, в которых атомы углерода связаны между собой простыми (одинарными) связями в неразветвленные или разветвленные цепи.
Предельными, или насыщенными, эти углеводороды называют в связи с полным насыщением углеродной цепи атомами водорода.
Вещества, состав которых отличается от состава метана на целое число групп СН2 (СН2 – гомологическая разность), являются гомологами метана. Совокупность гомологов называется гомологическим рядом.

Следовательно, состав алканов соответствует общей формуле CnH2n+2.
Поэтому часто используется такое определение:
1. Гомологический ряд алканов
Алканы, имея общую формулу СnH2n+2, представляют собой ряд родственных соединений с однотипной структурой, в котором каждый последующий член отличается от предыдущего на постоянную группу атомов (-CH2-). Гомологический ряд алканов легко составить, прибавляя каждый раз к предыдущей цепочке группу -СН2—.
Суффикс -ан является характерным для названия всех алканов.
Начиная с пятого гомолога, название алкана образуется из греческого числительного, указывающего число атомов углерода в молекуле, и суффикса –ан.
повышаются температуры кипения и плавления,
алканы : от СН4 до С4Н10 – газы, от С5Н12 до С17Н36 – жидкости, далее – твердые вещества.
Имея одинаковый качественный состав и однотипные химические связи, гомологи обладают сходными химическими свойствами. Поэтому, зная химические свойства одного из членов гомологического ряда, можно предсказать химическое поведение и других членов этого ряда.
2. Строение алканов
Химическое строение (порядок соединения атомов в молекулах) простейших алканов – метана, этана и пропана – показывают их структурные формулы. Из этих формул видно, что в алканах имеются два типа химических связей:
Электронные и структурные формулы отражают химическое строение, но не дают представления о пространственном строении молекул, которое существенно влияет на свойства вещества.
Пространственное строение, т.е. взаимное расположение атомов молекулы в пространстве, зависит от направленности атомных орбиталей (АО) этих атомов.
Четыре σ-связи углерода направлены в пространстве под углом 109 о 28′, что соответствует наименьшему отталкиванию электронов. Поэтому молекула простейшего представителя алканов – метана СН4 – имеет форму тетраэдра, в центре которого находится атом углерода, а в вершинах – атомы водорода:
3. Изомерия алканов
Изомерия – явление существования соединений, которые имеют одинаковый состав (одинаковую молекулярную формулу), но разное строение.
Вещества, имеющие одинаковый состав, но различное строение, а значит и свойства называются изомерами .
Различия в порядке соединения атомов в молекулах приводят к структурной изомерии.
Причиной проявления структурной изомерии в ряду алканов является способность атомов углерода образовывать цепи различного строения. Этот вид структурной изомерии называется изомерией углеродного скелета.
Первые три члена гомологического ряда не имеют изомеров. С увеличением числа атомов углерода в составе молекул увеличиваются возможности для разветвления цепи, т.е. количество изомеров растет сростом числа углеродных атомов.
Например: алкан состава C4H10 может существовать в виде двух структурных изомеров

Структурные изомеры отличаются физическими свойствами. Алканы с разветвленным строением из-за менее плотной упаковки молекул и, соответственно, меньших межмолекулярных взаимодействий, кипят при более низкой температуре, чем их неразветвленные изомеры.
Номенклатура органических соединений – система правил, позволяющих дать название каждому индивидуальному веществу.
В настоящее время общепринятой является систематическая номенклатура ИЮПАК (IUPAC – International Union of the Pure and Applied Chemistry – Международный союз теоретической и прикладной химии).
Наряду с систематическими названиями используются также тривиальные (обыденные) названия, которые связаны с характерным свойством вещества, способом его получения, природным источником, областью применения и т.д., но не отражают его строения.
Для применения номенклатуры ИЮПАК необходимо знать названия и строение определенных фрагментов молекул – органических радикалов.
н-пропил (нормальный пропил) изопропил

н-бутил втор-бутил изобутил трет-бутил
Порядок построения названия разветвленного алкана
Выбрать в молекуле главную углеродную цепь. Во-первых, она должна быть самой длинной. Во-вторых, если имеются две или более одинаковые по длине цепи, то из них выбирается наиболее разветвленная.
Например, в молекуле есть 2 цепи с одинаковым числом (7) атомов С (выделены цветом):
В случае (а) цепь имеет 1 заместитель, а в (б) – 2. Поэтому следует выбрать вариант (б).
Пронумеровать наиболее длинную цепь, с того конца, к которому ближе расположено разветвление. Если заместители находятся на равных расстояниях от конца цепи, то нумеруют с более разветвленного конца.
С 

Назвать все радикалы (заместители), указав впереди цифры, обозначающие их местоположение в главной цепи.
С 

Назвать главную цепь углеродных атомов, т.е. соответствующий нормальный алкан.
5-метил- 3-бутил- гексан
5. Химические свойства алканов
Алканы не вступают в реакций присоединения, но возможны реакции разложения, изомеризации и замещения
Симметричность неполярных С–С и слабополярных С–Н ковалентных связей предполагает их гомолитический (симметричный) разрыв на свободные радикалы. Следовательно, для реакций алканов характерен радикальный механизм.
Поскольку гетеролитический разрыв связей С–С и С–Н в обычных условиях не происходит, то в ионные реакции алканы практически не вступают. Это проявляется в их устойчивости к действию полярных реагентов (кислот, щелочей, окислителей ионного типа: КMnO4, К2Сr2O7 и т.п.).
Алканы проявляют свою реакционную способность в основном в радикальных реакциях.
Условия проведения таких реакций: повышенная температура, действие света или радиоактивного излучения, присутствие индикаторов.
В зависимости от того, какая связь в молекуле разрывается в первую очередь, реакции алканов подразделяются на следующие типы:
С разрывом связей С–С происходят реакции разложения (крекинг алканов) и изомеризации углеродного скелета.
По связям С–Н возможны реакции замещения атома водорода или его отщепления (дегидрирование алканов).
Алканы в присутствии окислителей вступают в реакции окисления алканов с участием связей С–С и С–Н.
Крекинг – процесс термического разложения углеводородов, в основе которого лежат реакции расщепления углеродной цепи крупных молекул с образованием соединений с более короткой цепью.
Крекинг алканов является основой переработки нефти. Для осуществления этого процесса используются два способа: термический крекинг (при нагревании без доступа воздуха) и каталитический крекинг (более умеренное нагревание в присутствии катализатора).
Термический крекинг. При температуре 450–700 o С алканы распадаются за счет разрыва связей С–С (более прочные связи С–Н при такой температуре сохраняются) и образуются алканы и алкены с меньшим числом углеродных атомов.
Например: C6H14 
В общем виде этот процесс можно выразить схемой:
C n H 2n+2 
При более высокой температуре (свыше 1000 С) происходит разрыв не только связей С–С, но и более прочных связей С–Н. Например, термический крекинг метана используется для получения сажи (чистыйуглерод) и водорода:
СН4 
Каталитический крекинг проводят в присутствии катализаторов (обычно оксидов алюминия и кремния) при температуре 450 С и атмосферном давлении. При этом наряду с разрывом молекул происходят реакции изомеризации и дегидрирования.
5.2. Изомеризация алканов
Алканы нормального строения под влиянием катализаторов и при нагревании способны превращаться в разветвленные алканы без изменения состава молекул, т.е. вступать в реакции изомеpизации. В этих pеакциях участвуют алканы, молекулы которых содержат не менее 4-х углеродных атомов.
5.3. Дегидрирование алканов
При нагревании алканов в присутствии катализаторов происходит их каталитическое дегидрирование за счет разрыва связей С-Н и отщепления атомов водорода от соседних углеродных атомов. При этом алкан превращается в алкен с тем же числом углеродных атомов в молекуле:
Наряду с бутеном-2 в этой реакции образуется также бутен-1.
При t = 1500 С происходит межмолекулярное дегидрирование метана по схеме:
Эта реакция используется для промышленного получения ацетилена.
5.4. Реакции окисления алканов
При обычной температуре алканы не вступают в реакции даже с сильными окислителями (Н2Cr2O7, KMnO4 и т.п.).
При внесении в открытое пламя алканы горят. При этом в избытке кислорода происходит их полное окисление до СО2 и воды. Горение углеводородов сопровождается выделением большого количества тепла (экзотермическая реакция).
Процесс горения углеводородов широко используется для получения энергии (в двигателях внутреннего сгорания, в тепловых электростанциях и т.п.).
Уравнение реакции горения алканов в общем виде:
При горении высших алканов (n >>1) кислорода, содержащегося в воздухе, может оказаться недостаточно для их полного окисления до СО2. Тогда образуются продукты частичного окисления:
угарный газ СО (степень окисления углерода +2),
сажа (мелкодисперсный углерод, нулевая степень окисления).
Горение метана при недостатке кислорода происходит по уравнениям:
Важное значение имеет реакция взаимодействия метана с водяным паром, в результате которой, образуется смесь оксида углерода (II) с водородом – «синтез-газ»:
Эта реакция используется для получения водорода. Синтез-газ служит сырьем для получения различных углеводородов.
В определенных условиях происходит разрыв именно С-Н-связей и осуществляется замена атомов водорода на другие атомы или группы атомов.
Галогенирование алканов – реакция замещения одного или более атомов водорода в молекуле алкана на галоген. Продукты реакции называют галогеналканами или галогенопроизводными алканов. Реакция алканов с хлором и бромом идет на свету или при нагревании.
При достаточном количестве хлора реакция продолжается дальше и приводит к образованию смеси продуктов замещения 2-х, 3-х и 4-х атомов водорода:
Реакция галогенирования алканов протекает по радикальному цепному механизму.
Механизм радикального замещения
Стадия 2 – рост (развитие) цепи. Свободные радикалы, взаимодействуя с молекулами, порождают новые радикалы и развивают цепь превращений:
Стадия 3 – обрыв цепи. Радикалы, соединяясь друг с другом, образуют молекулы и обрывают цепь превращений:
Нитрование алканов (реакция Коновалова )
Реакция взаимодействия разбавленной азотной кислоты с алканами называется pеакцией нитpования. В pезультате, пpоисходит замещение атома водоpода на остаток азотной кислоты – нитpогpуппу NO2. Пpодукты pеакции называются нитpосоединениями.
Алканы выделяют из природных источников (природный и попутный газы, нефть, каменный уголь). Используются также синтетические методы.
Крекинг нефти (промышленный способ)
Гидpиpование непpедельных углеводоpодов:
Газификация твердого топлива (при повышенной температуре и давлении, катализатор Ni):
Из синтез-газа (СО + Н2) получают смесь алканов:
Синтез более сложных алканов из галогенопpоизводных с меньшим числом атомов углеpода:

( реакция Вюрца)
Из солей карбоновых кислот :
Сплавление со щелочью ( реакция Дюма)
Предельные углеводороды находят широкое применение в самых разнообразных сферах жизни и деятельности человека.
Газообразные алканы (метан и пpопан-бутановая смесь) используются в качестве ценного топлива.
Жидкие углеводоpоды составляют значительную долю в моторных и ракетных топливах и используются в качестве растворителей.
Вазелин (смесь жидких и твеpдых пpедельных углеводоpодов с числом углеpодных атомов до 25) пpименяется для пpиготовления мазей, используемых в медицине.
Нормальные предельные углеводороды средней молекулярной массы используются как питательный субстрат в микробиологическом синтезе белка из нефти.
Большое значение имеют галогенопроизводные алканов, которые используются как растворители, хладоагенты и сырье для дальнейших синтезов.
В современной нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ.
Инструкция: выберите правильный ответ.
Ответ 1: формула а
Ответ 2: формула б
Ответ 3: формула в
Ответ 4: формула г
8.2. Какие соединения относятся к гомологическому ряду метана:
Ответ 1: соединения а, в, г
Ответ 2: соединения б, г, д
Ответ 3: соединения б, в, г
Ответ 4: соединения г, д
8.3. Какие из представленных соединений являются структурными изомерами?
Ответ 1: соединения а, в, г
Ответ 2: соединения б, г, д
Ответ 3: соединения б, в, г
Ответ 4: соединения а, в, д
8.4. Укажите названия углеводородных радикалов: