Что такое разложение воды
Реакция термического разложения воды
Реакция термического разложения воды.
Уравнение реакции термического разложения воды:
Реакция термического разложения воды протекает при условии: при температуре 2000 °C.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Мировая экономика
Справочники
Востребованные технологии
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
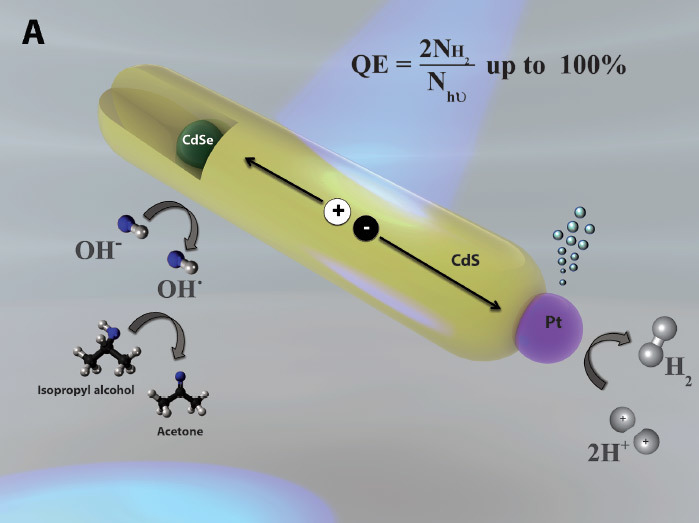
Расщепление воды с эффективностью 100%: полдела сделано
Если найти дешёвый и простой способ электролиза/фотолиза воды, то мы получим невероятно богатый и чистый источник энергии — водородное топливо. Сгорая в кислороде, водород не образует никаких побочных выделений, кроме воды. Теоретически, электролиз — очень простой процесс: достаточно пропустить электрический ток через воду, и она разделяется на водород и кислород. Но сейчас все разработанные техпроцессы требуют такого большого количества энергии, что электролиз становится невыгодным.
Теперь учёные решили часть головоломки. Исследователи из Технион-Израильского технологического института разработали метод проведения второго из двух шагов окислительно-восстановительной реакции — восстановления — в видимом (солнечном) свете с энергетической эффективностью 100%, значительно превзойдя предыдущий рекорд 58,5%.
Осталось усовершенствовать полуреакцию окисления.
Столь высокой эффективности удалось добиться благодаря тому, что в процессе используется только энергия света. Катализаторами (фотокатализаторами) выступают наностержни длиной 50 нм. Они абсорбируют фотоны от источника освещения — и выдают электроны.
В полуреакции окисления производятся четыре отдельных атома водорода и молекула О2 (которая не нужна). В полуреакции восстановления четыре атома водорода спариваются в две молекулы H2, производя полезную форму водорода — газ H2,
Эффективность 100% означает, что все фотоны, поступившие в систему, участвуют в генерации электронов.
На такой эффективности каждый наностержень генерирует около 100 молекул H2 в секунду.
Сейчас учёные работают над оптимизацией техпроцесса, который пока что требует щелочной среды с невероятно высоким pH. Такой уровень никак не приемлем для реальных условий эксплуатации.
К тому же, наностержни подвержены коррозии, что тоже не слишком хорошо.
Тем не менее, сегодня человечество стало на шажок ближе к получению неиссякаемого источника чистой энергии в виде водородного топлива.
Научная работа опубликована в журнале Nano Letters (зеркало).
Новые технологии разложения воды в США и России
Технологии получения водорода посредством электрохимического разложения воды на её составляющие не стоят на месте. Недавно учёные из Университета Хьюстона обнаружили катализатор, который значительно ускоряет процесс разложения воды на водород и кислород. Катализатор состоит из легкодоступных, недорогих материалов и работает гораздо эффективнее, чем аналогичные материалы. Ознакомившись с данной новостью, наш коллега из РГУ нефти и газа (НИУ) им. И. М. Губкина, в свою очередь, рассказал нам об отечественной разработке в этой сфере, также заслуживающей пристального внимания.
Американские исследователи из Университета Хьюстона обнаружили катализатор, который активно ускоряет реакцию разложения воды на водород и кислород и, в отличие от аналогов, состоит из легкодоступных и недорогих материалов. Для его производства не используются драгоценные металлы, и работает он намного эффективнее, чем известные катализаторы. Такой материал позволил бы решить одну из основных проблем использования воды для производства водорода как одного из наиболее перспективных источников «чистой» энергии.
«Водород — это самый “чистый” энергоноситель, которым мы располагаем на Земле, — говорит Пол Чу (Paul Chu), профессор, заведующий кафедры физики Университета Хьюстона, директор-основатель и руководитель исследовательских работ Техасского центра исследований сверхпроводимости Университета Хьюстона (Texas Center for Superconductivity at UH, TcSUH). — Вода могла бы быть бесконечным источником водорода, если бы мы научились эффективно разрывать прочную химическую связь водорода с кислородом в воде с помощью электрического тока и соответствующего катализатора».
Новый катализатор был получен исследовательской группой Пола Чу при Университете Хьюстона, в которую также входят профессор физики Жифенг Рен (Zhifeng Ren) и доцент Шуо Чен (Shuo Chen), ведущие исследователи TcSUH, научные сотрудники Хайчин Чжоу (Haiqing Zhou) и Фанг Юй (Fang Yu), а также аспиранты Джинджинг Сан (Jingying Sun) и Ран Хей (Ran He).
Катализатор, состоящий из метафосфата железа, в кристаллическом виде выращенного на электропроводящей никелевой подложке, имеющей губчатую структуру, намного более эффективен и дёшев, чем любые аналоги.
«Наш материал позволяет отлично сэкономить, и он намного более эффективен, превосходя имеющиеся катализаторы», — говорит Жифенг Рен, профессор физики Онкологического центра имени М. Д. Андерсона при Университете Хьюстона и ведущий автор статьи о результатах работы исследовательской группы Пола Чу. Катализатор также долговечен, на испытаниях он успешно проработал более 20 часов и выдержал 10 тыс. рабочих циклов. «Некоторые катализаторы обладают выдающимися характеристиками, но они стабильны только один-два часа, — рассказывает Жифенг Рен. — Такие материалы практически бесполезны».
Реакция разложения воды на водород и кислород теоретически очень проста, но на практике она представляет из себя сложный процесс, требующий двух отдельных химических взаимодействий — реакции выделения водорода и реакции выделения кислорода, каждая из которых протекает на отдельном электроде. И, хотя эффективные водородные катализаторы доступны, отсутствие недорогого и действенного кислородного катализатора создаёт учёным значительные трудности в области водородной энергетики.
Водород имеет ряд значительных преимуществ. «Водород, полученный посредством разложения воды электрохимическим процессом “водного электролиза”, считается наиболее экологически безопасным энергоносителем, способным заменить ископаемое топливо и удовлетворить растущий спрос всего человечества на электроэнергию, поскольку вода является одновременно и единственным сырьём, и “продуктом сгорания” — ведь экологичная “водородная энергия” получается путём преобразования этого химического элемента обратно в воду», — поясняют исследователи. При этом, в отличие от солнечной энергии, ветра и других видов «зелёной» энергии, водород относительно легко хранить.
В настоящее время водород получают тремя основными промышленными способами: паровой обработкой угля в специальных газогенераторах, газопаровой конверсией природного газа и электролизом воды, особенно если нужен сверхчистый водород.
При первом способе над раскалённым добела коксом (углём, нагреваемым без доступа кислорода) пропускают водяной пар, при этом из-за высокой температуры атомы водорода в воде замещаются на атомы углерода — образуется смесь угарного газа (CO) и водорода (H2), которую затем разделяют или используют как есть. Во втором случае, также при высокой температуре (около 1000 °C), осуществляется превращение метана с водяным паром, углекислым газом (CO2) или смесью водяного пара и углекислого газа в присутствии катализатора на основе никеля с добавками оксидов магния, алюминия и других металлов, причём образующуюся смесь водорода и угарного газа нужно затем дополнительно обрабатывать водяным паром. Водород также получают как побочный продукт производства хлора и гидроксидов щелочных металлов, которое осуществляется электролизом растворов их хлоридов.
Все эти методы сложны, крайне энергозатратны и связаны с выработкой вредного угарного газа, а также сажи, то есть имеют существенный «углеродный след», несмотря на то, что исходное сырьё в данных процессах сгорает относительно «чисто».
Исследовательница Шуо Чен отмечает, что известные на сегодняшний день катализаторы, ускоряющие реакцию выделения кислорода при электролизе воды, используют благородные металлы — иридий, платину или рутений. Но эти материалы дороги и недоступны.
«В своём исследовании мы обнаружили дешёвый, высокоэффективный и стабильный катализатор, основанный на широко распространённых химических элементах, который поразительным образом превосходит все благородные металлы, — подытоживает Шуо Чен. — Наше открытие может привести к гораздо более экономичному промышленному производству водорода простым электрохимическим разложением (электролизом) воды».
Отметим, что разложение воды на составные элементы может осуществляться и с помощью фотокатализа, который использует силу солнца. Однако прямое воздействие солнца на воду слишком неэффективно, так как вода поглощает лишь небольшую часть спектра солнечного излучения. Шуо Чен поясняет, что в идеале солнечные батареи будут использоваться для выработки электроэнергии, которая вместе с соответствующим катализатором позволит легко и эффективно разлагать воду для получения такого нужного человечеству химического элемента, как водород.
Отечественная технология получения водорода
Рассказывает И. В. Мещерин, к.т.н., доцент кафедры газохимии РГУ нефти и газа им. И. М. Губкина, председатель Комитета по технологическому проектированию в НОПРИЗ, президент Национальной палаты инженеров:
— Известно, что производство водорода в основном осуществляется крупнотоннажными системами с единичной объёмной производительностью в диапазоне 10–100 тыс. Нм³/ч [1]. От 1 до 5 % получаемого водорода находит применение в малотоннажных, наукоёмких отраслях промышленности: электронной, электротехнической, стекольной, фармацевтической, пищевой; выплавке металлов и сплавов высокой чистоты; синтезе химически высокоактивных веществ и других отраслях. Водород является ценным химическим реагентом, и его получение и концентрирование из топливных, остаточных, сбросных газов позволяет значительно повысить экономическую эффективность производства. Водород почти не встречается в природе в чистом виде, но потребление данного газа во всём мире неуклонно растёт. Для производства водорода необходимо специальное оборудование, отличительной чертой которого является компактность и надёжность.
Децентрализованное (то есть малотоннажное) производство водорода требует создания высокоэффективных технологий с уровнем единичной объёмной производительности в диапазоне от 10 до 1000 Нм³/ч [2].
Данный аспект в сегодняшней ситуации может иметь существенное влияние на экономическую эффективность производств, в которых используется водород. В условиях экономического кризиса поиск технологий получения водорода с меньшими затратами является актуальной задачей. В настоящий момент внутрироссийские регулируемые цены на природный газ продолжают оставаться одними из самых низких в мире, даже с учётом более чем двукратного падения цен на природный газ на европейском рынке. Одним из альтернативных решений могут быть технологии получения водорода из природного газа.
Изучение конкретной проблематики производилось сотрудниками кафедры газохимии РГУ нефти и газа (НИУ) имени И. М. Губкина в условиях завода по производству кварцевого стекла — ООО «Технокварц» в городе Гусь-Хрустальный.
Компания ООО «Технокварц» производит водород для производственных нужд с помощью блока электролизёров БЭУ-250, состоящий из шести электролизёров СЭУ-40. Этой производительности достаточно для обеспечения существующего объёма потребления водорода в технологии наплава кварцевого стекла. Целью работы являлся поиск экономически более эффективного метода получения водорода на базе ресурсов завода.
Промышленное производство кварцевого стекла связано с развитием экстремальных процессов со специфическими условиями, главным образом в космической и электронной технике, производстве чистых, особо чистых веществ, редких металлов, высокотемпературных неорганических соединений и т.п.
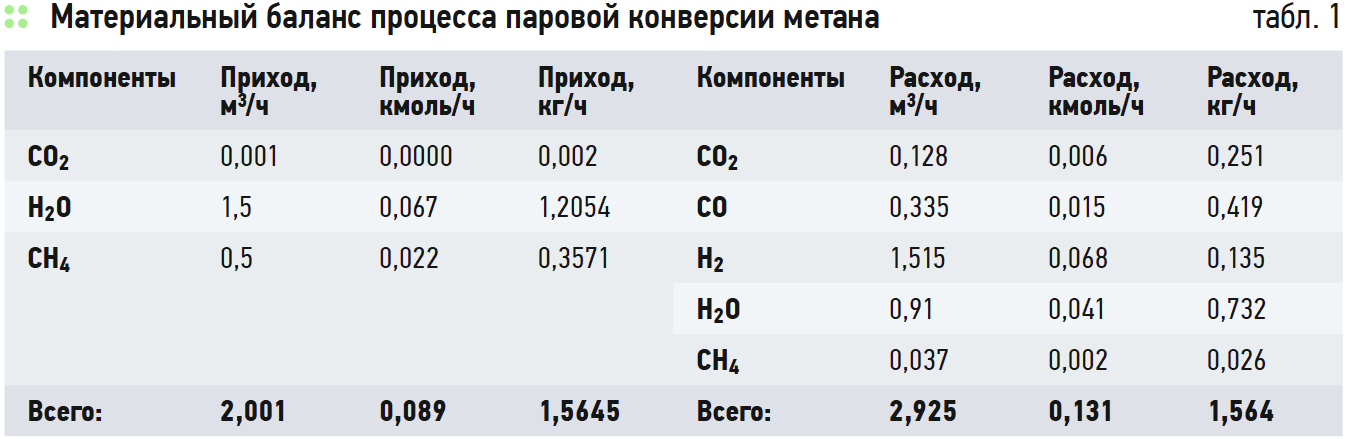
В результате анализа существующих методов получения водорода был выбран, как наиболее целесообразный, метод паровой конверсии природного газа. При помощи д.т.н., профессора М. Х. Сосны был произведён технологический расчёт блока конверсии для установки получения водорода. Входными данными послужили составы входящих потоков, их объёмы, температуры, давления, доля водяного пара, а также длина реактора, его диаметр и толщина стенки (расчёт реактора в 2016 году выполняла Мария Давыдова, технолог газохимии и магистрантка РГУ нефти и газа им. И. М. Губкина). В результате обработки полученных данных получен материальный баланс процесса (табл. 1), конверсия метана составила 92,6 %. Был также проработан вопрос изготовления реактора из кварцевого стекла.
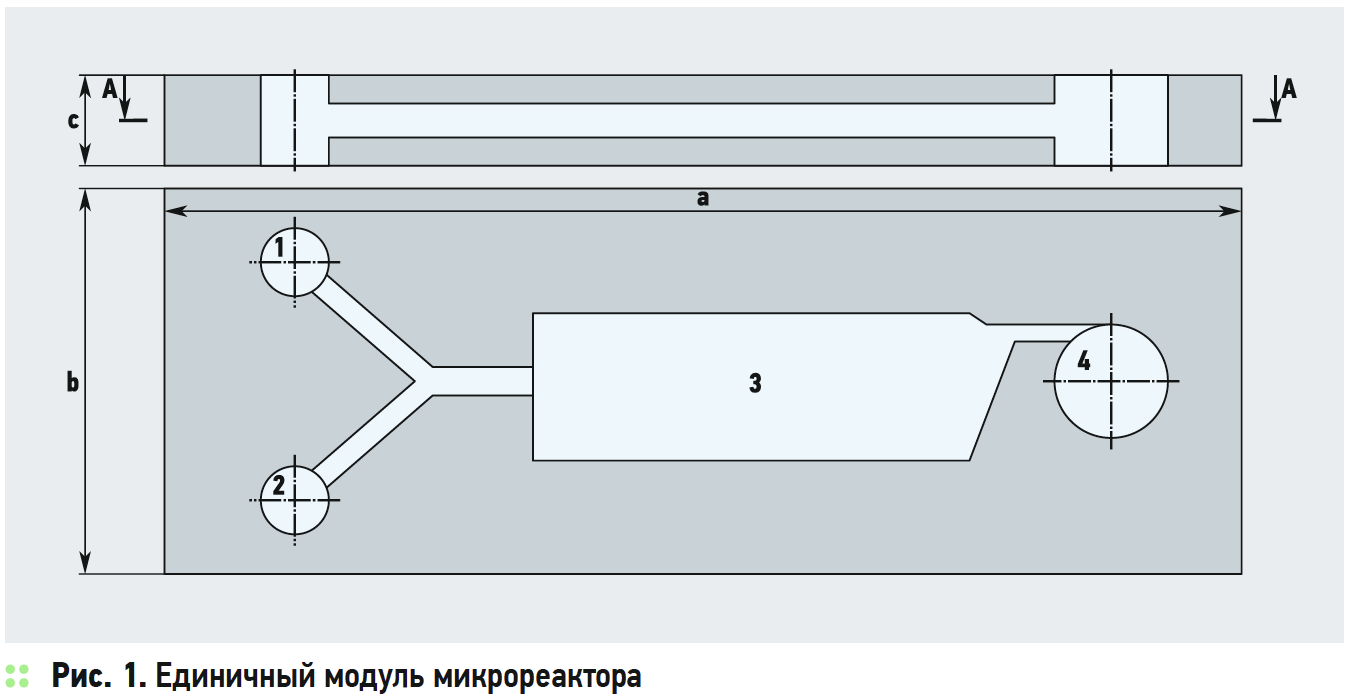
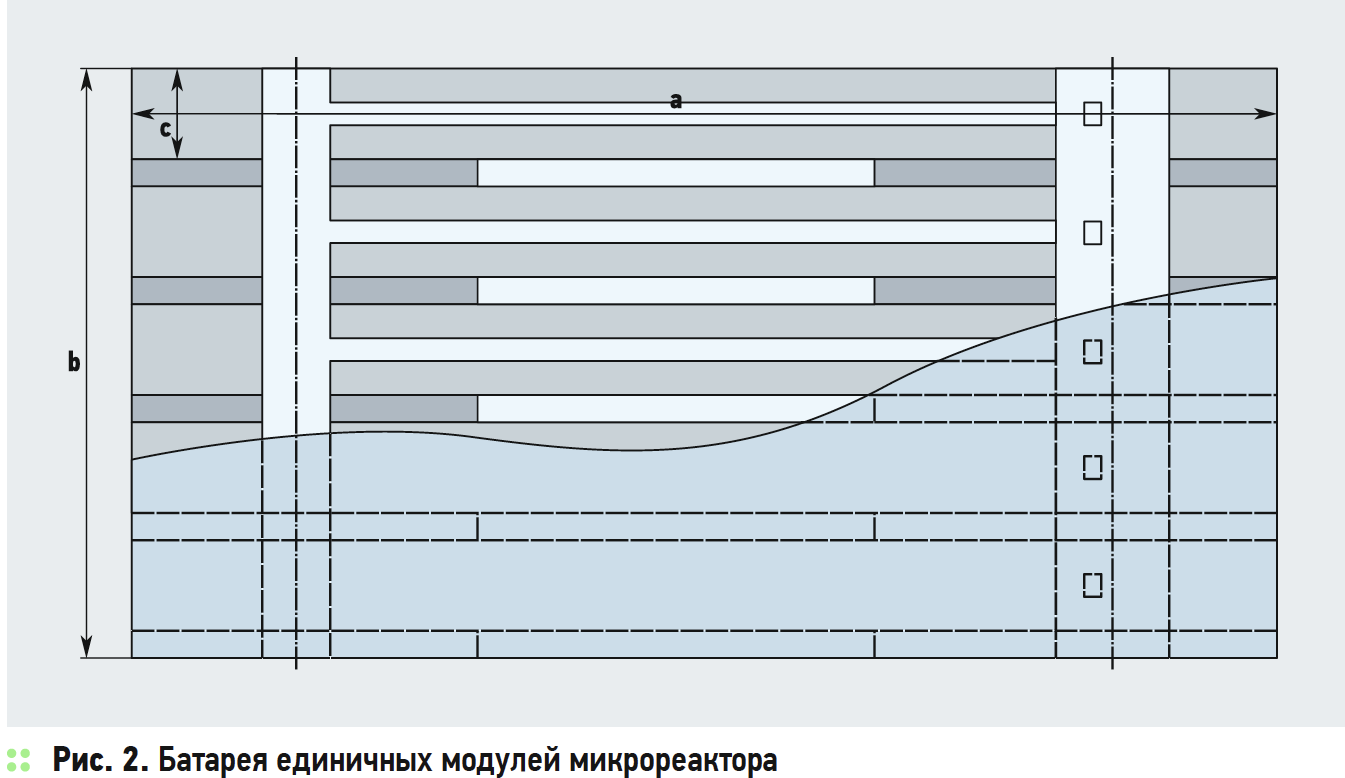
Ниже приводится эскиз гипотетического мини-, микрореактора проточного типа из кварцевого стекла в горизонтальном исполнении для проведения химических процессов. Основой реактора служит модуль, представленный на рис. 1. Зоны 1 и 2 служат для подачи исходных компонентов, реакционная зона 3 предназначена для размещения катализаторов, нагрева рабочей смеси до температуры реакции, воздействия ВЧ-, ВУФи СВЧизлучения или иного технологического воздействия. Конфигурация зоны 3 может формироваться по требованиям ведения химических реакций. Зона 4 организована как циклон для разделения и закалки продуктов реакции, в том числе и как газовая центрифуга. Единичные модули в расчётном количестве собираются в батарею, как показано на рис. 2. По усмотрению разработчиков промышленные модули могут быть спроектированы и в вертикальном исполнении цилиндрической или иной формы.
Экономическая эффективность достигается за счёт того, что используется относительно недорогой природный газ, по сравнению с дорогой электроэнергией, себестоимость оборудования из кварцевого стекла на 25–40 % меньше, чем из металла.
Возможность развития конкретной технологии и отладки её внутри предприятия открывает новый метод получения водорода для малотоннажных производств. Кроме того, появление нового перспективного ассортимента товарной продукции существенно усовершенствует технологии обработки кварцевого стекла, дополнительно будет способствовать улучшению экономических показателей кварцевого производства.
Поскольку паровая конверсия природного газа в комплексе с аппаратурным оформлением процесса является составной частью синтеза материалов по реакциям Фишера-Тропша, перед ООО «ТехноКварц» возникает перспектива нового направления — изготовление высокоэффективных минии микроканальных кварцевых реакторов для других сегментов отрасли газохимии.
Добыча водорода из воды: методы и получение в домашних условиях
Наука настолько быстро развивается, что ученые уже научились разными способами получать такой химический элемент как водород. В первую очередь, это делается для хорошей альтернативы в топливе для машин в будущем, чтобы автомобили больше не заправлять бензином. «H» станет отличной альтернативой для всего, если эта сфера поднимется на более высокий уровень. Его преимущество в экологичности!
На данный момент существует несколько способов по добыче этого элемента. Ниже будут рассмотрены все эти методы получения, а так же как добыть водород в домашних условиях.
Способы получения водорода
Методы получения веществ бывают промышленными и лабораторными. В промышленности их получают в больших объемах, а в лабораторных в небольших.
Электролизный метод
К промышленному методу относится электролиз воды. Электролиз, если объяснять просто — это разложение веществ под действием электрического тока. Сам процесс достаточно сложный.
Стоит знать, что такое электролиз, чтобы можно было разбираться дальше в этой теме. Это окислительно-восстановительный процесс, протекающий, который протекает на электродах (катиона и аниона), протекающий под действием электрического тока. Окислительно-восстановительный процесс предполагает, что после реакции несколько химических элементов из положительных станут отрицательными (анионами), и наоборот (катионами).
Разобравшись со значением названия, теперь нужно понять, как получают водород! Электролиз — 1 из самых простых способов.
Берется емкость. В нее заливается сода с водой. Внутрь кладутся 2 электрических элемента. 1 должен быть анодом (плюс), а второй (минус). Затем через содовый раствор пропускается электрический ток. Под действием тока водород отправляется к катоду, а вода (Н2О) к аноду.
Восстановление водяного пара металлами
Что происходит в этом случае? Металл взаимодействует с водой при нагревании. Чтобы жидкость превратилась в пар ее нужно нагреть минимум до 100 градусов. Металл+вода = реакция замещения. Образуется оксид и газообразный водород. Но вступать в такие реакции для образования впоследствии водорода могут далеко не все элементы металлов. Существует химическая таблица, в которой химические вещества расположены друг за другом в порядке уменьшения концентрации (слева направо). Все вещества, находящиеся после водорода (Н) не могут вступать в реакции замещения и, соответственно, не имеют возможности впоследствии образовывать газообразный водород.
Как получить нужный элемент?
Выделение водорода происходит следующим образом (с научной точки зрения):
В начале был цинк и вода. Этот металл может участвовать в реакциях, т.к. он активнее водорода (находится левее). В результате Zn вытеснил Н из Н2О, встав на его место. Водород же остался «одиноким», простым веществом, выделившись в газообразном состоянии.
Точно такой же пример можно привести с магнием:
Из метана
Метан — органическое соединение (главный компонент природного газа). При окислении метана при наличии кислорода и воды при нагревании образуется углекислый газ(2СО2) и газ-водород (6Н2). Оба газа на выходе бесцветные, не имеющие вкуса и запаха.
Такую смесь необходимо разделить на отдельные компоненты (очистить водород от примесей углекислого газа). Для этого 2СО2 пропускают через известковую воду Са(ОН)2. Углекислый газ пропускают через бесцветную жидкость. В результате образуется нерастворимый остаток карбоната кальция. Н пройдет через воду без изменений. После пропускания известковая жидкость мутнеет. Это происходит из-за остаточных явления после 2СО2.
Восстановление водяного пара коксом
Кокс — это уголь (С). При взаимодействии кокса с водяным паром (с водой при нагревании) образуется оксид угарного газа и газообразный водород. Этот метод, в первую очередь, используется для получения Н. Этот способ используется для синтеза многих других веществ. Такую реакцию называют синтез-газ, т.е. получение 2-х газообразных элементов.
Мембранная сепарация
Тоже очень интересный метод выведения газообразного неметалла. Процесс довольно простой в описании.
СО (угарный газ), Н2О(воду) и СО2 (углекислый газ) пропускают через палладиевые решетки. Они состоят палладиево-серебряного сплава. Только 3 элемента могут пройти сквозь решетку. На выходе ученые получают 99% долгожданный водород.
Способ адсорбции
Для него в работу берутся твердые вещества (всем привычный активированный уголь). Его задача поглотить собой газовые смеси, чтобы на выходе получить Н2. Конечно, в работе также используют циклические адсорбенты (молекулярные сита), позволяющие в дальнейшем выделиться нужному веществу.
Свое название метод получил из-за адсорбентов — тех самых твердых веществ.
Взаимодействие металлов с разбавленными кислотами
Данный метод уже относится к лабораторному, т.е. на выходе уже не получится такого большого количества водорода.
Все та же реакция замещения. Металл может вступать в реакцию замещения, образуя соль кислоты и образуется газообразный Н. Отличия в том, что на место воды в химической формуле стоят кислоты (разбавленные):
Mg + H2SO4 (серная кислота разбавленная) = MgSO4 + H2
Чаще всего в лаборатории используют цинк и магний, поэтому именно эта химическая формула наиболее популярна.
Электролиз воды
Последний способ, которым добывают водород — электролиз воды. Реакция происходит очень просто. Вода под действием электрического тока расщепляется на отдельные простые элементы воды и водорода. Отсюда и название (электролиз):
Это все способы получения водорода! Далее вы узнаете, как можно самостоятельно, своими руками создать настоящий прибор-генератор для получения Н2.
Добыча водорода в условиях домашнего хозяйства
Хоть получение водорода и кажется чем-то нереальным, его можно получить у себя дома на кухне. Но для этого вам понадобится электролизер. Без него никак! Ниже представлена инструкция, как его сделать!
P.S. В самом конце, когда вы уже запустите свое устройство — водород будет выделяться в воде в виде пузырьков, скапливающихся на ее поверхности!
Выбор электролизера
Электролизер — это емкость, в которую заливается содовый раствор и помещаются 2 электрода. Т.е. это основа, где в будущем будут получать водород. Для домашнего эксперимента нет смысла рассматривать сложные конструкции, требующие наличие разных инструментов, у большинства людей которых просто нет.
Также, на кухне мало у кого найдутся колбы для перемещения воды по ним, металлические крюки и прочие материалы. Поэтому ниже будет представлен способ, как можно собрать настоящий электролизер из простых инструментов, продающихся в стройматериалах. Перед началом работы ознакомьтесь с техникой безопасности!
Изготовление аппарата своими руками
Самый легкий и примитивный способ, как можно получить водород в домашних условиях — это с помощью электролиза. Чтобы создать генератор — ничего особенного не понадобится.
Следуйте пошаговой инструкции.
Теперь вы знаете, как сделать устройство для получения Н. Но стоит помнить о технике безопасности!