Что такое развернутая реакция агглютинации
Что такое развернутая реакция агглютинации
Простые реакции обычно включают два компонента — Аг и AT. К простым реакциям относят РА, реакции преципитации (РП) в жидкостях и гелях, реакции пассивной гемагглютинации (РПГА) и опсоно-фагоцитарные реакции. Простыми реакциями считают и косвенные (трёхком-понентные) реакции, в состав которых входят реагирующие системы (животные, эритроциты и т.д.), например, реакции нейтрализации (РН) возбудителя, РН Аг и реакции торможения гемагглютинации (РТГА).
Реакция агглютинации (РА)
Реакция агглютинации (РА) [от лат. agglutinatio, склеивание] позволяет выявить корпускулярные Аг, точнее Аг, локализованные на поверхности сравнительно крупных частиц (микроорганизмы, клетки различного происхождения). Механизм РА описывает «теория решётки», согласно которой двухвалентное AT взаимодействует одним активным центром с детерминантой одной молекулы Аг, а другим — с детерминантой второй молекулы Аг (рис. 10-13).
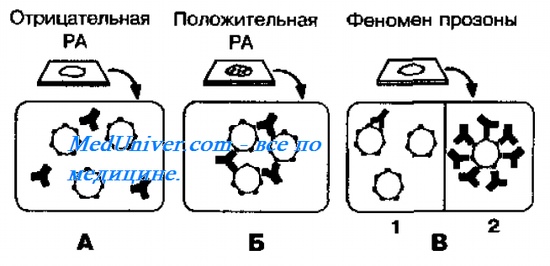
В результате подобного взаимодействия образуется агглютинат. Его формирование невозможно при дефиците или избытке AT. Реакция агглютинации проявляется склеиванием корпускулярных Аг под воздействием AT (агглютининов) и реализуется в изотоническом растворе электролита, например 0,9% раствора NaCl. В реакции агглютинации также можно определять и содержание AT в сыворотке крови больных, например, брюшным тифом (реакция Видаля) или бруцеллёзом (реакция Райта).
Что такое развернутая реакция агглютинации
Развернутая реакция агглютинации ( РА ). Для определения AT в сыворотке крови больного ставят развёрнутую реакцию агглютинации ( РА ). Для этого к серии разведений сыворотки крови добавляют диагностикум — взвесь убитых микроорганизмов или частицы с сорбированными Аг. Максимальное разведение, дающее агглютинацию Аг, называют титром сыворотки крови.
Разновидности реакции агглютинации ( РА ) для выявления AT — кровяно-капельная проба на туляремию (с нанесением диагностикума на каплю крови и появлением видимых белёсых агглютинатов) и реакция Хаддльсона на бруцеллёз (с нанесением на каплю сыворотки крови диагностикума, окрашенного генциановым фиолетовым).
Ориентировочная реакция агглютинации ( РА )
Для идентификации выделенных микроорганизмов ставят ориентировочную РА на предметных стёклах. Для этого к капле стандартной диагностической антисыворотки (в разведении 1:10, 1:20) добавляют культуру возбудителя. При положительном результате ставят развёрнутую реакцию с увеличивающимися разведениями антисыворотки.
Реакцию считают положительной, если агглютинацию наблюдают в разведениях, близких к титру диагностической сыворотки.
О-Аг. Соматические О-Аг термостабильны и выдерживают кипячение в течение 2 ч. При взаимодействии с AT образуют мелкозернистые агрегаты.
Н-Аг. Н-Аг (жгутиковые) термолабильны и быстро разрушаются при 100 °С, а также под действием этанола. В реакциях с Н-антисывороткой через 2 ч инкубации образуют рыхлые крупные хлопья (образованы бактериями, склеившимися жгутиками).
Vi-Ar брюшнотифозных бактерий относительно термостабилен (выдерживает температуру 60-62 °С в течение 2 ч); при инкубации с Vi-антисывороткой образуется мелкозернистый агглютинат.
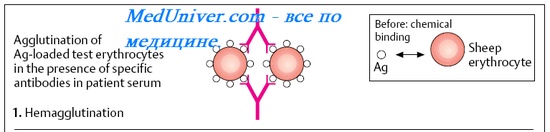
Реакции прямой гемагглютинации
Простейшая из подобных реакций — агглютинация эритроцитов, или гемагглютинация, применяемая для определения групп крови в системе AB0. Для определения агглютинации (или её отсутствия) используют стандартные антисыворотки с анти-А и анти-В-агглютининами. Реакция называется прямой, так как исследуемые Аг — естественные компоненты эритроцитов.
Общие с прямой гемагглютинацией механизмы имеет вирусная гемагглютинация. Многие вирусы способны спонтанно агглютинировать эритроциты птиц и млекопитающих, их добавление к суспензии эритроцитов вызывает образование агрегатов из них.
Что такое развернутая реакция агглютинации
Эти реакции называются непрямыми (пассивными), так как при их проведении используют Аг (или AT), искусственно сорбированные на поверхности различных корпускулярных частиц.
Реакция непрямой, или пассивной, гемагглютинации (РНГА, РПГА) — одна из наиболее чувствительных серологических реакций. Основана на способности AT взаимодействовать с Аг, фиксированными на различных эритроцитах, которые при этом агглютинируют. Для большей стабильности диагностикумов эритроциты формалинизируют.
Обратная РНГА применяется для выявления Аг в сыворотке крови; для этого на эритроцитах фиксируются не Аг, a AT. Реакции этого типа широко применяют для диагностики инфекционных болезней, установления беременности, выявления повышенной чувствительности к лекарствам и т.д.
Реакция торможения пассивной гемагглютинации (РТПГА) — дальнейшее развитие РНГА; в некотором смысле контролирует её специфичность. В отличие от РНГА, включает три компонента; Аг, AT и Аг (AT), адсорбированные на эритроцитах. Первоначально Аг реагирует с AT (стандартная антисыворотка), затем в смесь вносят эритроциты, сенсибилизированные аналогичным Аг (или AT). Если при взаимодействии Аг с AT в системе не остаются свободные AT (или Аг), то агглютинации эритроцитарного диагностикума не наблюдают.
Иммунологические методы исследования в лабораторной практике
Преимущества иммунологического метода исследования.
Серологические реакции различаются по способности выявлять отдельные классы антител. Реакция агглютинации, например, хорошо выявляет lgM-антитела, но менее чувствительна для определения lgG-антител. Реакции связывания комплемента и гемолиза, которые требуют участия комплемента, не выявляют антитела, не присоединяющие комплемент, например lgA-антитела и lgE-антитела. В реакции нейтрализации вирусов участвуют лишь антитела, направленные против антигенных детерминант поверхности вириона, связанных с патогенностью. Чувствительность иммунулогических методов превосходит все другие методы исследования антигенов и антител, в частности радиоиммунный и иммуноферментный анализы позволяют улавливать присутствие белка в количествах, измеряемых в нанограммах и даже в пикограммах.
С помощью предложенного способа определяют группу и проверяют безопасность крови (гепатит В и ВИЧ-инфекция). При трансплантации тканей и органов, иммунологический метод позволяет определять совместимость тканей и тестировать методы подавления несовместимости. В судебной медицине используют реакцию Кастеллани для определения видовой специфичности белка и реакцию агглютинации для определения группы крови.
Иммунологические методы широко применяют в лабораторной диагностике инфекционных болезней. Этиологию заболевания устанавливают также на основании прироста антител к возбудителю в сыворотке крови реконвалесцента по сравнению с пробой, взятой в первые дни болезни. На основе исследования изучают иммунитет населения по отношению к массовым инфекциям, например к гриппу, а также оценивают эффективность профилактических прививок.
Развитию иммунологических методов способствовало создание моноклональных антител, продуцируемых гибридомой, полученной в результате слияния иммунокомпетентной клетки В-лимфоцита и клетки миеломы мышей. Моноклональные антитела несут только одну химически однородную популяцию антител, комплементарную специфической детерминанте антигена, что позволяет осуществлять тонкую дифференциацию белков. Развитие иммунологического метода исследования идет как по линии совершенствования реагентов (чистоты антигенов и антител), так и по линии создания автоматизированных систем постановки реакций и их инструментального учета.
Виды реакций метода иммунологического исследования.
В зависимости от их механизма и учета результатов, иммунологический метод исследования можно подразделить на 5 видов реакции.
1.Реакции, основанные на феномене агглютинации.
Агглютинация представляет собой склеивание клеток или отдельных частичек — носителей антигена с помощью иммунной сыворотки к этому антигену.
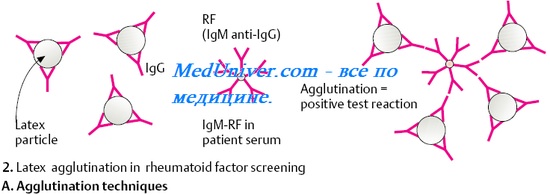
Реакция агглютинации бактерий с использованием соответствующей антибактериальной сыворотки относится к наиболее простым серологическим реакциям. Взвесь бактерий добавляют к различным разведениям испытуемой сыворотки крови и через определенное время контакта при t 37° регистрируют, при каком наивысшем разведении сыворотки крови происходит агглютинация. Реакцию агглютинации бактерий используют для диагностики многих инфекционных болезней: бруцеллеза, туляремии, брюшного тифа и паратифов, бациллярной дизентерии, сыпного тифа.
Реакции агглютинации для определения группы крови и резус-фактора основаны на взаимодействии аллоантител (изоантител) и антигенов эритроцитов. Антитела против резус-фактора являются неполными, они не способны к прямой реакции с резус-положительными эритроцитами, поэтому для их обнаружения используют реакцию Кумбса, основанную на выявлении неполных антител с помощью антиглобулиновых сывороток. К эритроцитам известной специфичности добавляют исследуемую сыворотку крови, а вслед за этим антиглобулиновую сыворотку против lgG (непрямая реакция Кумбса). Fab-фрагменты неполных антител исследуемой сыворотки крови присоединяются к эритроцитам, а к свободным Fc-фрагментам этих антител присоединяются антитела против lgG, и происходит агглютинация эритроцитов.
Реакция пассивной или непрямой гемагглютинации (РПГА, РНГА). В ней используют эритроциты или нейтральные синтетические материалы (например, частицы латекса), на поверхности которых сорбированы антигены (бактериальные, вирусные, тканевые) или антитела. Их агглютинация происходит при добавлении соответствующих сывороток или антигенов. Эритроциты, сенсибилизированные антигенами, называют антигенным эритроцитарным диагностикумом и используют для выявления и титрования антител. Эритроциты, сенсибилизированные антителами, называют иммуноглобулиновыми эритроцитарными диагностикумами и применяют для выявления антигенов.
Реакцию пассивной гемагглютинации используют для диагностики заболеваний, вызванных бактериями (брюшной тиф и паратифы, дизентерия, бруцеллез, чума, холера и др.), простейшими (малярия) и вирусами (грипп, аденовирусные инфекции, вирусный гепатит В, корь, клещевой энцефалит, крымская геморрагическая лихорадка и др.), а также для определения некоторых гормонов, выявления повышенной чувствительности больного к лекарственным препаратам и гормонам, например пенициллину и инсулину.
Реакция торможения гемагглютинации (РТГА) основана на феномене предотвращения (торможения) иммунной сыворотки гемагглютинации эритроцитов вирусами, используется для выявления и титрования противовирусных антител. Она служит основным методом серодиагностики гриппа, кори, краснухи, эпидемического паротита, клещевого энцефалита и других вирусных инфекций, возбудители которых обладают гемагглютинирующими свойствами, например, для серодиагностики клещевого энцефалита, в лунки панели разливают двукратные разведения сыворотки больного на щелочном боратном буферном растворе. Затем добавляют определенное количество, обычно 8 АЕ (агглютинирующих единиц), антигена клещевого энцефалита и после 18 ч экспозиции при t 4° вносят взвесь гусиных эритроцитов, приготовленную на кислом фосфатно-буферном растворе. Если в сыворотке крови больного есть антитела к вирусу клещевого энцефалита, то антиген нейтрализуется и агглютинация эритроцитов не происходит.
2.Реакции, основанные на феномене преципитации.
Преципитация происходит в результате взаимодействия антител с растворимыми антигенами. Простейшим примером реакции преципитации является образование в пробирке непрозрачной полосы преципитации на границе наслоения антигена на антитело. Широко применяют различные разновидности реакции преципитации в полужидких гелях агара или агарозы (метод двойной иммунодиффузии по Оухтерлоню, метод радиальной иммунодиффузии, иммуноэлетрофорез), которые носят одновременно качественный и количественный характер. В результате свободной диффузии, в геле антигенов и антител в зоне оптимального их соотношения образуются специфические комплексы — полосы преципитации, которые выявляют визуально или при окрашивании. Особенностью метода является то, что каждая пара антиген-антитело формирует индивидуальную полосу преципитации, и реакция не зависит от наличия в исследуемой системе других антигенов и антител.
Для постановки двойной иммунодиффузии наливают слой растопленного геля на стеклянную пластинку и после затвердевания вырезают лунки диаметром 1,5–3 мм. В расположенные по кругу лунки помещают исследуемые антигены, а в центральную лунку — иммунную сыворотку известной специфичности. Диффундируя навстречу друг другу, гомологичные сыворотки и антигены образуют преципитат.
При радиальной иммунодиффузии (по методу Манчини), иммунную сыворотку вносят в агар. Антиген, помещенный в лунки, диффундирует через агар, и в результате преципитации с иммунной сывороткой, вокруг лунок образуются непрозрачные кольца, внешний диаметр которых пропорционален концентрации антигена. Метод используют для определения классов иммуноглобулинов, а модификации метода можно применять для определения противомикробных антител, относящихся к различным классам иммуноглобулинов.
Иммуноэлектрофорез основан на усилении миграции в геле антигенов и антител путем помещения пластины геля с реагентами в электрическое поле. При этом достигается разделение антигенов и антител на компоненты в соответствии с их подвижностью и зарядом.
Разновидностью иммуноэлектрофореза является радиоиммунофорез. В этом случае после электрофоретического разделения антигенов в канавку, вырезанную параллельно движению антигенов в геле, наливают сначала меченную радиоактивным йодом иммунную сыворотку против определяемых антигенов, а затем иммунную сыворотку против lgG-антител, которая преципитирует образовавшиеся комплексы антитела с антигеном. Все несвязавшиеся реагенты вымывают, а комплекс антиген-антитело обнаруживает методом авторадиографии.
3.Реакции с участием комплемента.
В качестве комплемента используют свежую сыворотку крови морской свинки, основанную на способности субкомпонента комплемента Clq и затем других компонентов комплемента присоединяться к иммунным комплексам.
Реакция связывания комплемента (РСК) позволяет титровать антигены или антитела по степени фиксации комплемента комплексом антиген-антитело. Эта реакция состоит из двух фаз: взаимодействия антигена с испытуемой сывороткой крови (исследуемая система) и взаимодействия гемолитической сыворотки с эритроцитами барана (индикаторная система). При положительной реакции в исследуемой системе происходит связывание комплемента, и тогда при добавлении сенсибилизированных антителами эритроцитов, гемолиза не наблюдается. Реакцию применяют для серодиагностики сифилиса (реакция Вассермана), вирусных и бактериальных инфекций.
Реакция радиального гемолиза эритроцитов может протекать в геле. Взвесь эритроцитов барана помещают в агарозный гель с комплементом; в застывшем на стекле слое делают лунки и вносят в них гемолитическую сыворотку. Вокруг лунок в результате радиальной диффузии антител образуется зона гемолиза, радиус которой прямо пропорционален титру сыворотки. Если сорбировать на эритроцитах какой-либо антиген, например гликопротеиновый гемагглютинин вируса гриппа, краснухи или клещевого энцефалита, то можно воспроизвести феномен гемолиза иммунными сыворотками к этим вирусам. Реакцию радиального гемолиза в геле применяют в диагностике вирусных инфекций. Она характеризуется простотой постановки, нечувствительностью к сывороточным ингибиторам, позволяет титровать сыворотки крови по диаметру зоны гемолиза, не прибегая к серийным разведениям.
Иммунное прилипание. Эритроциты, тромбоциты и другие клетки крови имеют на поверхности рецепторы к третьему компоненту комплемента (СЗ). Если к антигену (бактериям, вирусам и др.) добавить соответствующую иммунную сыворотку и комплемент, то образуется комплекс антиген-антитело, покрытый СЗ-компонентом комплемента. Эту реакцию применяют при изучении ряда вирусных инфекций (клещевого энцефалита, денге), которые сопровождаются иммунопатологическими процессами и циркуляцией в крови вирусных антигенов в комплексе с антителами.
Основана на способности антител нейтрализовать некоторые специфические функции макромолекулярных или растворимых антигенов, например активность ферментов, токсины бактерий, болезнетворность вирусов. В бактериологии эту реакцию используют для обнаружения антистрептолизинов, антистрептокиназы и антистафилолизинов. Реакцию нейтрализации токсинов можно оценивать по биологическому эффекту, так, например, титруют антистолбнячные и антиботулинические сыворотки. Смесь токсина с антисывороткой, введенная животным, не вызывает их гибели. Различные варианты реакции нейтрализации применяют в вирусологии. При смешивании вирусов с соответствующей антисывороткой и введении этой смеси животным или в клеточные культуры, патогенность вирусов нейтрализуется и при этом животные не заболевают, а клетки культур не подвергаются деструкции.
5.Реакции с использованием химических и физических меток (ИФА).
Иммунофлюоресценция заключается в использовании меченых флюорохромом антител, точнее, иммуноглобулиновой фракции антител lgG. Меченое флюорохромом антитело образует с антигеном комплекс антиген-антитело, который становится доступным наблюдению под микроскопом в УФ-лучах, возбуждающих свечение флюорохрома. Реакцию прямой иммунофлюоресценции используют для изучения клеточных антигенов, выявления вируса в зараженных клетках и обнаружения бактерий и риккетсий в мазках. Так, для диагностики бешенства, отпечатки кусочков мозга животных, подозреваемых на вирусоносительство, обрабатывают люминесцирующей антирабической сывороткой. При положительном результате, в цитоплазме нервных клеток выявляются глыбки ярко-зеленого цвета. На обнаружении антигенов вирусов в клетках отпечатков со слизистой оболочки носа основана экспресс-диагностика гриппа, парагриппа и аденовирусной инфекции.
Более широко применяют метод непрямой иммунофлюоресценции, основанный на выявлении комплекса антиген-антитело с помощью люминесцирующей иммунной сыворотки против lgG-антител и используемой для обнаружения не только антигенов, но и титрования антител. Метод нашел применение в серодиагностике герпеса, цитомегалии, лихорадки Ласса. Препараты с наслоенной исследуемой сывороткой крови помещают в термостат при t 37° для образования иммунных комплексов, а затем, после отмывания несвязавшихся реагентов, выявляют эти комплексы меченой люминесцирующей сывороткой против глобулинов человека. Применяя меченые иммунные сыворотки против lgM- или lgG-антител, можно дифференцировать тип антител и обнаруживать ранний иммунный ответ по наличию lgM-антител.
Иммунофлюоресценцию широко используют не только в бактериологии, вирусологии, паразитологии, но и в иммунопатологии для обнаружения антител к тканевым антигенам человека.
Иммуноферментные или энзим-иммунологические методы основаны на использовании антител, конъюгированных с ферментами, главным образом пероксидазой хрена или щелочной фосфатазой. Чтобы обнаружить соединение меченых антител с антигеном, добавляют субстрат, разлагаемый присоединенным к lgG ферментом, с окрашиванием в желто-коричневый (пероксидаза) или желто-зеленый (фосфатаза) цвет. Используют также ферменты, разлагающие не только хромогенный, но и люмогенный субстрат. В этом случае при положительной реакции появляется свечение. Подобно иммунофлюоресценции, иммуноферментный метод применяют для обнаружения антигенов в клетках или титрования антител на антигенсодержащих клетках.
Наиболее популярной разновидностью иммуноферментного метода является иммуносорбция. На твердом носителе, которым могут быть целлюлоза, полиакриламид, декстран и различные пластмассы, сорбируют антиген. Чаще носителем служит поверхность лунок микропанелей. В лунки с сорбированным антигеном вносят исследуемую сыворотку крови, затем меченую ферментом антисыворотку и субстрат. Положительные результаты учитывают по изменению цвета жидкой среды. Для обнаружения антигенов, на носитель сорбируют антитела, затем вносят в лунки исследуемый материал и проявляют реакцию меченой ферментом антимикробной сывороткой. Повышению чувствительности иммунофлюоресцентного и иммуноферментного методов способствует введение в систему реакции авидина и биотина.
Радиоиммунологический метод основан на применении радиоизотопной метки антигенов или антител. Является наиболее чувствительным методом определения антигенов и антител, используется для определения гормонов, лекарственных веществ и антибиотиков, для диагностики бактериальных, вирусных, риккетсиозных, протозойных заболеваний, исследования белков крови, тканевых антигенов. Первоначально он был разработан как специфический метод измерения уровня циркулирующих в крови гормонов. Тест-системой являлись меченый радионуклидом гормон (антиген) и антисыворотка к нему. Если к такой антисыворотке добавить материал, содержащий искомый гормон, то он свяжет часть антител, при последующем внесении меченого титрованного гормона с антителами свяжется уменьшенное по сравнению с контролем его количество. Результат оценивают по сопоставлению кривых связанной и несвязанной радиоактивной метки. Эта разновидность метода носит название конкурентной реакции. Существуют и другие модификации радиоиммунологического метода.
Иммуногистологические методы предназначены для определения антигенов на поверхности или внутри клетки, например для обнаружения маркеров лимфоцитов и иммунокомплексов при гломерулонефритах и других заболеваниях почек. В этой реакции для выявления антигенов пользуются или иммунофлюоресценцией, или иммуноферментными конъюгатами с пероксидазой. Количество специфических антигенов определяют по интенсивности окрашивания. Иногда используют автоматическую регистрацию с помощью спектрофотометра.
Научная электронная библиотека
Морозова В. С., Габрильянц О. А., Мягкова М. А.,
3.2.5. Метод латексной агглютинации
Метод латексной агглютинации (ЛА) – это иммунологический метод, основанный на агрегации модифицированных латексных частиц, происходящей вследствие афинного взаимодействия антиген-антитело.
Реакцию латексной агглютинации возможно провести несколькими способами. Различают прямую и конкурентную реакцию латексной агглютинации (в различных источниках так же встречаются названия «торможение реакции латексной агглютинации» или «обратная реакция латексной агглютинации»).
Реакцию прямой ЛА используют для определения поливалентных антигенов. Схема протекания прямой реакции латексной агглютинации показана на рис. 23.
Рис. 23. Схема протекания прямой латексной агглютинации:
а – агглютинация полимерных частиц, на которые иммобилизованы антитела, с молекулами низкомолекулярного антигена;
б – агглютинация полимерных частиц,
на которые иммобилизован антиген, с молекулами антител
При необходимости выявлять в растворе аналит антигенной природы, на полимерные микросферы иммобилизуют антитела, как это представлено на рис. 23 а. При необходимости выявлять в растворе аналит антительной природы, на полимерные микросферы иммобилизуют антигены, как это представлено на рис. 23 б.
Реакцию конкурентной латексной агглютинации используют для определения моновалентных антигенов, например, гаптенов. В этом случае антитела вступают в конкурентную реакцию со свободными антигенами и с антигенами, конъюгированными на носителе. Схема протекания обратной реакции латексной агглютинации показана
на рис. 24.
Рис. 24. Схема протекания реакции обратной латексной агглютинации:
а – в анализируемом растворе присутствует низкомолекулярный аналит, который конкурирует за сайты связывания с иммобилизованными на поверхности полимерных частиц антигенами. Антитела преимущественно связываются
со свободными антигенами с образованием низкомолекулярных;
б – а анализируемом растворе отсутствует аналит, свободные антитела связываются с иммобилизованными на поверхности полимерных частиц антигенами. Агглютинация наблюдается
Преимущества метода латексной агглютинации при скрининге наркотических веществ заключаются в следующем:
● возможность использования минимальных объемов исследуемого материала,
● возможность проведения больших партий анализов,
● быстрота проведения реакции (2–10 минут),
● простота и доступность для любых лабораторий,
● не требуется специальное оборудование и высококвалифицированный персонал,
● невысокая стоимость исследования.
Реакция латексной агглютинации считается положительной при наблюдении агглютинации микрочастиц суспензии вследствие смешивания компонентов реакционной системы. Агглютинация проявляется в слипании и осаждении полимерных частиц из первоначально стабильной суспензии. Результат латексной агглютинации выявляется простым визуальным наблюдением: раствор мутнеет или выпадает творожистый осадок белого цвета или реже – окрашенный (рис. 25).
Рис. 25. При положительной реакции на пластинках образуются видимые невооруженным глазом агглютинаты, которые затем увеличиваются в размере, а в пробирках выпадает осадок. В микропланшетах агглютинация проявляется в виде равномерного покрытия частицами поверхности лунки, тогда как в контроле на дне лунки образуется точечный латексный преципитат
При наблюдении реакции ЛА визуальным способом анализ проводят на стеклянных или полистирольных пластинках, в пробирках или 96-луночных микропланшетах с U-образными лунками, в которых смешивают равные объемы тестируемых сывороток в последовательных двукратных разведениях и латекс-теста и через определенное время (от нескольких минут до 5 часов) наблюдают реакцию.
Главное неудобство визуального наблюдения ЛА состоит в том, что часто бывает трудно точно определить конечную точку агглютинации, так как белый цвет полимерной суспензии или осадка плохо воспринимается глазом. Окрашивание латекса в голубой, красный, желтый, зеленый и другие цвета, а так же введение в микрочастицы флуоресцентных меток, позволяет преодолеть этот недостаток и облегчает наблюдение РЛА.
Результат РЛА носит только качественный характер. Для получения полуколичественных результатов (оценка степени агглютинации) используют титры. То есть количество антител в иммунной сыворотке или в других жидкостях в реакции агглютинации по выявлению антител оценивается их титром. Под титром антител понимают то наибольшее разведение сыворотки или иной жидкости, при котором реакция антиген-антитело все еще учитывается.
Для количественной оценки агглютинации применяют различные инструментальные методы. Среди них оптические методы: турбидиметрия (по изменению оптической плотности измеряют потерю интенсивности светового луча, прошедшего через суспензию частиц), нефелометрия (в этом случае анализируется интенсивность света, рассеянного под углом Q к падающему потоку; обычно, Q = 90°), сканирующая лазерная микроскопия и др.
В практике скрининга наркотических веществ используется качественный вариант метода ЛА из-за удобства и возможности проведения теста в «полевых» условиях неспециалистом. Разработаны тест-системы для определения основных групп наркотических веществ в моче [18, 19].