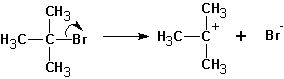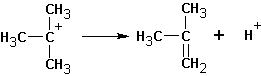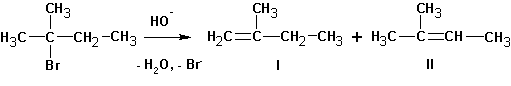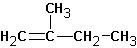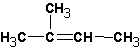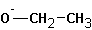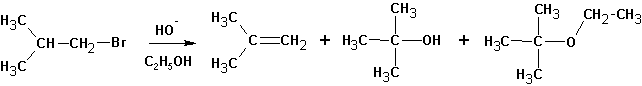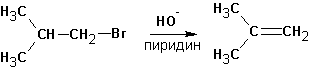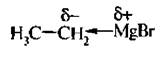Что такое реакции элиминирования
Что такое реакции элиминирования
РЕАКЦИИ ЭЛИМИНИРОВАНИЯ (Е1, Е2)
Реакции элиминирования являются конкурентно протекающими с реакциями нуклеофильного замещения у насыщенного атома углерода SN 1 и SN 2. Направление реакции в сторону Е1 или Е2 зависит от ряда факторов:
-структура атакующего нуклеофила;
-основность атакующей частицы;
Мономолекулярное элиминирование Е1.
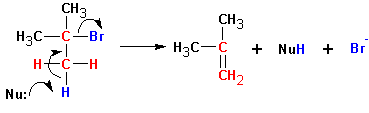
Схема реакции совпадает со схемой мономолекулярного замещения до момента образования карбониевого катиона, т.е. отсоединения уходящей группы:
Далее протекает либо реакция замещения, либо (в зависимости от среды и атакующей частицы) отщепление протона и образование продукта элиминирования:
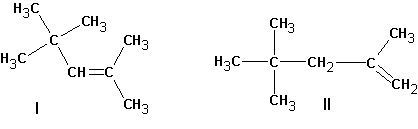
В этом случае предпочтительно образование алкена ( II ).
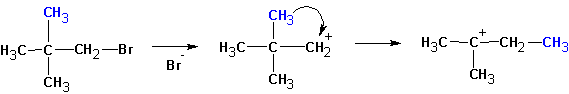
Особенностями реакций SN 1 и Е1 является тенденция к перегруппировке образовавшегося карбкатиона:
Бимолекулярное элиминирование Е2.
Механизм реакции общих этапов с реакцией SN 2 не имеет. Обычно протекает транс- элиминирование по схеме:
Влияние структурных факторов:
Влияние атакующей частицы.
Соответственно, протеканию нуклеофильного замещения способствуют слабоосновные реагенты, подобные иодид- или ацетат-ионам.
Отщепление также преобладает над замещением при повышенных температурах.
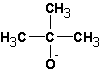
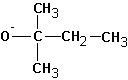
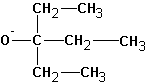
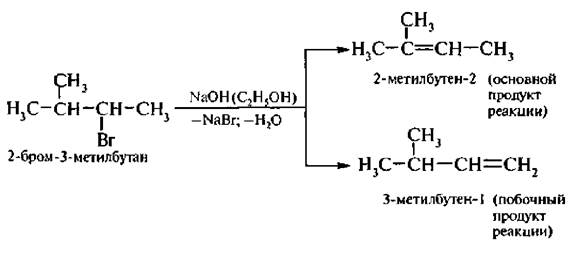
В случае алкилгалогенидов с различными алкильными остатками существует возможность образования двух алкенов:
количество продукта отщепления, %
Большой объем уходящей группы приводит к тому, что основание атакует более доступный атом водорода крайней метильной группы.
Состав продуктов Е2-реакции трет-амилбромида (см. выше) с алкоголятами калия.
количество продукта отщепления, %
В данном случае большой объем атакующего основания приводит к тому, что легче отщепляются (в виде протона) более доступные крайние атомы водорода.
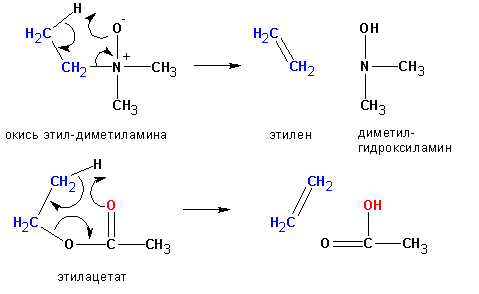
Реакции отщепления Е2 происходит наиболее легко в том случае, если молекула может принять такое пространственное расположение, когда уходящие группы Н и Х расположены в транс-положении:
Некоторые реакции отщепления, сходные с пиролизом окисей аминов, протекают по цис- направлению. Уходящая группа в таких случаях одновременно является основанием, отщепляющим протон:
Изменение природы растворителя может приводить к получению разных продуктов. Так, реакция изобутилбромида со спиртовой щелочью приводит к образованию ряда продуктов:
Судя по образовавшимся продуктам, протекают реакции SN 1 (наблюдается перегруппировка углеводородного скелета и образование всех возможных продуктов замещения) и конкурирующая с ними Е1. Протекание реакции Е2 маловероятно, но не исключено. Продуктов реакции SN 2 не обнаруживается вовсе:
А та же самая реакция в среде пиридина (или третичных аминов) протекает только с элиминированием:
Этому явлению есть одно объяснение. Протекание реакции SN 2 затруднено в обоих растворителях из-за стерических препятствий. Способность спирта сольватировать анионы (протонный растворитель) во-первых облегчает протекание реакции SN 1, во-вторых- несколько снижает нуклеофильную силу и основность гидроксил-иона. В случае пиридина или третичных аминов (которые совершенно не сольватируют анионы, но зато хорошо связывают протон и катионы и к тому же являются слабыми нуклеофилами) создаются почти исключительные условия для протекания реакций элиминирования и, вероятно, по механизму Е2.
Реакции элиминирования
Элиминирование (от лат. elimino — изгоняю) — это отщепление от молекулы органического соединения атомов или атомных групп без замены их другими.
Примечания
 Химические реакции в органической химии Химические реакции в органической химии | |
|---|---|
| Реакции замещения | Реакции нуклеофильного замещения · Реакции электрофильного замещения · Реакции радикального замещения |
| Реакции присоединения | Реакции нуклеофильного присоединения · Реакции электрофильного присоединения · Реакции радикального присоединения · Реакции синхронного присоединения |
| Реакции элиминирования | Реакции гетеролитического элиминирования · Реакции перициклического элиминирования · Реакции радикального элиминирования |
| Реакции перегруппировки | Нуклеофильные перегруппировки · Электрофильные перегруппировки · Радикальные перегруппировки |
| Реакции окисления и восстановления | Реакции окисления · Реакции восстановления |
| Прочее | Именные реакции в органической химии |
Полезное
Смотреть что такое «Реакции элиминирования» в других словарях:
Реакции нуклеофильного замещения — (англ. nucleophilic substitution reaction) реакции замещения, в которых атаку осуществляет нуклеофил реагент, несущий неподеленную электронную пару.[1] Уходящая группа в реакциях нуклеофильного замещения называется нуклеофуг. Все … Википедия
Реакции замещения — (англ. substitution reaction) химические реакции, в которых одни функциональные группы, входящие в состав химического соединения, меняются на другие группы. Реакции замещения обозначают английской буквой «S». Общий вид реакций… … Википедия
Реакции присоединения — (англ. addition reaction) в органической химии так называются химические реакции, в которых одни химические соединения присоединяются к кратным (двойным или тройным) связям другого химического соединения. Присоединение может… … Википедия
Реакции электрофильного замещения — (англ. substitution electrophilic reaction) реакции замещения, в которых атаку осуществляет электрофил частица, заряженная положительно или имеющая дефицит электронов. При образовании новой связи уходящая частица электрофуг … Википедия
Реакции нуклеофильного присоединения — (англ. addition nucleophilic reaction) реакции присоединения, в которых атаку на начальной стадии осуществляет нуклеофил частица, заряженная отрицательно или имеющая свободную электронную пару. На конечной стадии образующийся… … Википедия
Реакции радикального замещения — (англ. substitution radical reaction) реакции замещения, в которых атаку осуществляют свободные радикалы частицы, содержащие один или несколько неспаренных электронов. Реакции радикального замещения обозначают SR. Содержание 1… … Википедия
Реакции электрофильного присоединения — (англ. addition electrophilic reaction) реакции присоединения, в которых атаку на начальной стадии осуществляет электрофил частица, заряженная положительно или имеющая дефицит электронов. На конечной стадии образующийся… … Википедия
Реакции радикального присоединения — (англ. addition radical reaction) реакции присоединения, в которых атаку осуществляют свободные радикалы частицы, содержащие один или несколько неспаренных электронов. При этом радикалы могут атаковать как другие радикалы, так и… … Википедия
Реакции синхронного присоединения — реакции присоединения, в которых атака на оба атома кратной связи осуществляется одновременно. Другое название реакций этого типа реакции циклоприсоединения, так как конечным продуктом таких реакций являются циклические субстраты. Существует две… … Википедия
ЭЛИМИНИРОВАНИЯ РЕАКЦИИ — (от лат. «elimino» выношу за порог, удаляю), химические реакции, в ходе которых от молекулы (см. МОЛЕКУЛА) отщепляются два атома (см. АТОМ) или группа атомов. Различают мономолекулярное (см. МОНОМОЛЕКУЛЯРНЫЕ РЕАКЦИИ) (Е1) и бимолекулярное (см.… … Энциклопедический словарь
Реакции элиминирования
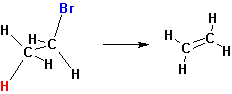
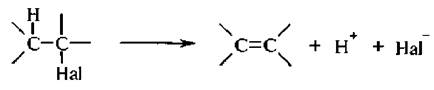
Реакции элиминирования сопровождаются отщеплением галоге-новодорода от галогеналкана и приводят к образованию алкенов.
Поскольку отщепление водорода происходит от β-атома углерода, то такие реакции называются β- или 1.2-элиминированием.
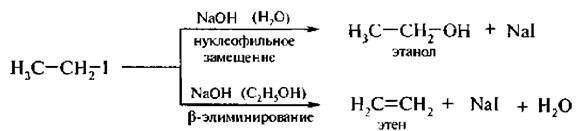
Реакции элиминирования (Е) и нуклеофильного замещения (SN2) конкурируют друг с другом, но в определенных условиях каждая из них может стать доминирующей. Отщепление галогеноводорода от галогеналкана становится основным процессом в присутствии нуклеофильных реагентов, обладающих высокой основностью. К ним относятся спиртовые растворы гидроксидов щелочных металлов или алкоголяты щелочных металлов. Элиминированию способствуют также повышение температуры реакционной смеси и концентрации реагентов. Так, при взаимодействии йодэтана с водным раствором щелочи основным направлением реакции является нуклеофильное замещение, а продуктом реакции – этиловый спирт. При использовании спиртового раствора щелочи доминирующим процессом становится реакция элиминирования, продуктом реакции – этилен.
Реакции элиминирования галогеналкаиов могут протекать по мономолекулярному (E1) и бимолекулярному (Е2) механизмам.
Механизм Е2 (бимолекулярное элиминирование).
В реакции отщепления по механизму Е2 наиболее легко вступают первичные галогеналканы.
Реакция отщепления, протекающая по бимолекулярному механизму, требует присутствия основания, идет волну стадию с образованием переходного состояния, в формировании которого принимаютучастие молекулы двух реагентов. И поэтому скорость такой реакции зависит от концентрации обоих реагентов. Процессы разрыва и образования связей в переходном состоянии происходят синхронно,
В отличие от механизма SN2 в механизме Е2 частица с неподеленной парой электронов или несущая отрицательный заряд действует не как нуклеофил, а как основание, атакуя атом водорода при β-углеродном атоме.
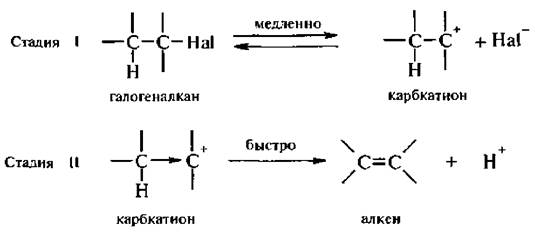
Механизм E1 (мономолекулярное элиминирование).
Наиболее легко происходит элиминирование поданному механизму у третичных галогеналканов. Реакция не требует основания как реагента, но для ее протекания необходим ионизирующий растворитель. Процесс является двустадийным.
Стадией, определяющей скорость реакции, является образование карбкатиона. Вторая стадия включает в себя стабилизацию карбкатиона путем отщепления протона.
Если в молекуле галогеналкана имеется несколько альтернативных путей отщепления галогеноводорода, то реализуется тот из них, при котором двойная связь образуется у наиболее замешенного атома углерода, то есть вместе с галогеном уходит водород от наименее гидрогенизированного соседнего атома углерода.
Эта закономерность получила название правила Зайцева;
Взаимодействие с металлами
При взаимодействии галогеналканов с такими металлами, как магний, образуются магнийорганические соединения – реактивы Гриньяра:
Магнийорганические соединения являются сильными нуклеофильными реагентами и сильными основаниями. Их активность обусловлена полярностью связи углерод-магний:
При каталитическом гидрировании галогеналканов или действии на них водорода в момент выделения, а также йодоводородной кислотой происходит замещение атома галогена водородом:
Что такое реакции элиминирования
Алкилгалогениды. Реакции нуклеофильного замещения.
Реакции элиминирования
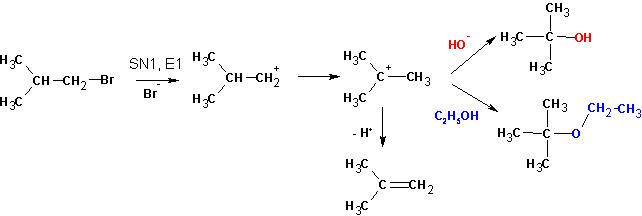
Как было ранее подчеркнуто, параллельно с SN1-замещением в третичных галогеналканах протекает реакция элиминирования, приводящяя к образованию алкенов. В то же время, реакции SN2 тоже осложняются элиминированием, причем в некоторых случаях это становится основным процессом. Так, действием на вторичные и первичные галогеналканы спиртовыми растворами щелочей или алкоголятов щелочных металлов получают непредельные углеводороды. И в том, и в другом случае происходит отщепление молекулы галогеноводорода от двух соседних углеродных атомов.
При протекании реакции по механизму SN1 промежуточный катион может быть атакован нуклеофилом не только по электрофильному центру (катионному атому углерода), но также по одному из соседних атомов водорода (в этом случае нуклеофил считается основанием). Это связано с тем, что на соседних атомах углерода наведен небольшой положительный заряд, что дезэкранирует водородные атомы, облегчая их отщеплению при подходе основания.
Как и в реакции SN1, лимитирующей стадией данного превращения является образование карбокатиона, что происходит при участии одной молекулы. Поэтому его называют реакцией мономолекулярного отщепления (элиминирования) и обозначают символом Е1.
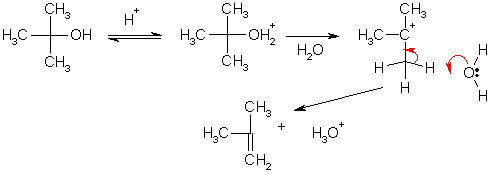
По механизму Е1 легко протекает дегидратация третичных спиртов. Например образование изобутилена из трет-бутилового спирта происходит в результате нагревания с 15%-ной серной кислотой.
Третичные галогеналканы при 40 °С в спирте реагируют по мономолекулярным механизмам замещения и отщепления параллельно, при этом среди продуктов реакции преобладает тот алкен, в молекуле которого при двойной связи находится большее количество заместителей. Эта закономерность имеет общий характер и называется правилом Зайцева. Такую ориентацию элиминирования можно объяснить сравнительной термодинамической стабильностью этиленовых углеводородов. В соответствии с величинами теплот гидрирования алкенов, их устойчивость тем выше, чем больше заместителей присутствует при двойной связи.
Когда в молекуле субстратов присутствует большое количество электроноакцепторных заместителей, постулируется другой механизм мономолекулярного β-элиминирования. Сначала, в результате отщепления протона, быстро образуется стабилизированный карбанион, а на второй стадии происходит отщепление галогенид-иона. Лимитирующей является стадия образования карбаниона, который является сопряженным основанием исходному субстрату. Поэтому механизм обозначается E1CB. Этот механизм реализуется, например, в реакции дегидрофторирования 1,1-дихлор-2,2,2-трихлорэтана.
Реакцию отщепления галогеноводорода от вторичных и первичных галогеналканов можно представить как синхронный процесс, происходящий при действии нуклеофила, который в этих условиях выполняет роль основания.
В этом случае реакция протекает при участии двух молекул и относится к бимолекулярным (Е2). При наличии альтернативных положений возможного элиминирования протона реакция идет так, что он, как в третичных галогеналканах, отщепляется преимущественно от более замещенного атома углерода (правило Зайцева).
Для описания реакции дегидратации первичных спиртов предложен Е2-механизм. Так, этанол сначала образует с серной кислотой моноэтилсульфат, который вступает далее в реакцию элиминирования при участии молекулы воды по синхронному механизму.
Напротив, при термолизе или обработке сильными основаниями тетраалкиламмониевых оснований доминирует менее замещенный алкен. Такие реакции называют протекающими по правилу Гоффмана.
Объяснение различной ориентации отщепления состоит в структуре переходного состояния.
Легко видеть, что в E1cB – переходном состоянии ориентация отщепления определяется легкостью отрыва протона, которая связана с поляризуемостью связи С-Н в направлении углерода. При этом, чем меньше алкильных (донорных) заместителей находится при этом атоме, тем легче разрывается связь С-Н под действием основания. Поэтому в том случае, когда ПС реакции по структуре ближе к карбаниону, т.е. когда уходящая группа является сильным электроноакцептором, среди продуктов преобладает менее замещенный алкен (реализуется правило Гофмана).
Нужно отметить, что реакции, протекающие по механизму Е2 являются не только регио-, но и стереоселективными. В большинстве случаев анти-элиминирование является более предпочтительным по сравнению с син-элиминированием, т.к. энергетический барьер реакции отщепления из более стабильной заторможенной конформации А обычно ниже такового из менее стабильной заслоненной конформации Б.
Предпочтительность анти-перипланарного расположения H и Hal в большинстве реакций Е2-элиминирования подтверждается экспериментальными фактами о реакционной способности галогеналканов, в которых свободное вращение вокруг связи С-С невозможно. Так, при действии этилата натрия в спирте на метилхлорид (условия Е2-реакции) в результате транс-элиминирования образуется ментен-2, несмотря на то, что альтернативный ментен-3 (продукт Зайцева) более стабилен.
Что такое реакции элиминирования
Алкилгалогениды. Реакции нуклеофильного замещения.
Реакции элиминирования
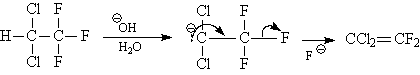
До сих пор мы рассматривали такие реакции элиминирования, в ходе которых происходило отщепление фрагментов неорганического продукта от двух соседних атомов углерода, т.е. b-элиминирование. Однако, в определенных условиях отщепление элементов молекулы галогеноводорода возможно от одного и того же атома углерода. Такие реакции называют a-элиминированием и приписывают им механизм, который предполагает быстрое депротонирование молекулы субстрата и последующее медленное отщепление галогенид-иона. В этой стадии участвует одна частица – карбанион, который является сопряженным основанием субстрату. Поэтому механизм реакции называются мономолекулярным элиминированием с участием сопряженного основания и обозначают E1CB. Например, в известной реакции Реймера-Тимана (формилирование фенолов в щелочной среде) участвует промежуточная частица CCl2, называемая дихлоркарбеном. Его генерируют действием сильных оснований на хлороформ, который при этом теряет молекулу хлороводорода по механизму E1CB.
Существуют и другие способы получение карбенов, например, каталитическое разложение диазоалканов.
Карбены отличаются высокой реакционной способностью и склонны выступать в качестве электрофилов, как в вышеприведенном примере, а также присоединяться к кратным связям, образуя производные циклопропана.
Реакции элиминирования всегда конкурируют с реакциями замещения и преобладание того или иного процесса зачастую сильно зависит от условий и структуры субстрата Так, сильные основания направляют реакцию в большей степени по пути отщепления нежели замещения. При этом, особенно для первичных субстратов, предпочтительными механизмами оказываются Е2 и Е1CB по сравнению с Е1.При использовании одного и того же нуклеофила (основания) более полярных растворителях реакция SN2 преобладает над Е2. При прочих равных условиях третичные галогеналканы, спирты, их эфиры и т.д. в большей степени подвергаются отщеплению, чем вторичные и первичные, т.е. реакции Е1 в большей степени конкурируют с реакциями SN1, чем реакции Е2 с реакциями SN2. Такому течению процесса способствуют повышенная температура и отсутствие сильных нуклеофилов в смеси (например, нагревание трет-бутилхлорида в спирте или трет-бутанола в серной кислоте). Сильнощелочная среда также способствует элиминированию HHal из третичных галогеналканов, а не замещению, что может быть связано с реализацией механизма E2.
Образование металлорганических соединений
Металлоорганических соединений образуются в результате замещения галогена металлом. Прямой путь, т.е. взаимодействие металла с галогенидом, не всегда дает положительные результаты и иногда замещение проводят взаимодействием галогенопроизводного не с металлом, а с другим, более активным, металлоорганическим соединением.
Натрий- и литийорганические соединения отличаются наиболее высокой реакционной способностью, они самовозгораются при соприкосновении с кислородом воздуха. В связи с этим их получают и работают с ними исключительно в инертной атмосфере (азот, аргон), при низких температурах.
В лабораторной практике часто используют смешанные магнийорганические соединения, называемые реактивами Гриньяра. Они достаточно стабильны, не требуют, как правило, для работы с ними специальных условий и, в то же время, обладают весьма высокой реакционной способностью.
Реакция Вюрца при образовании магнийорганических соединений наблюдается лишь в тех случаях, когда используют очень активное галогенопроизводное, например, аллилхлорид. Напротив, при взаимодействии алкилгалогенидов с натрием она является основным процессом.