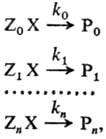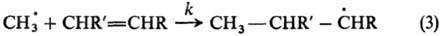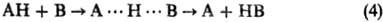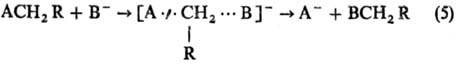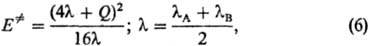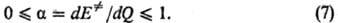Что такое реакционная способность
Реакционная способность
Полезное
Смотреть что такое «Реакционная способность» в других словарях:
реакционная способность — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN reactivenessreactivity … Справочник технического переводчика
Реакционная способность — характеристика химической активности вещества (материала), обусловленная активностью атомов и молекул, оцениваемая относительной константой скорости реакций. [Ушеров Маршак А. В. Бетоноведение: лексикон. М.: РИФ Стройматериалы. 2009. – 112… … Энциклопедия терминов, определений и пояснений строительных материалов
реакционная способность — rus реакционная способность (ж) eng reactivity fra réactivité (f) deu Reaktionsfähigkeit (f) spa reactividad (f) … Безопасность и гигиена труда. Перевод на английский, французский, немецкий, испанский языки
реакционная способность — cheminis reaktyvumas statusas T sritis Standartizacija ir metrologija apibrėžtis Medžiagos gebėjimas reaguoti. atitikmenys: angl. chemical activity; reactivity vok. Reaktionsfähigkeit, f; Reaktionsvermögen, n rus. реакционная способность, f pranc … Penkiakalbis aiškinamasis metrologijos terminų žodynas
реакционная способность — reaktyvumas statusas T sritis chemija apibrėžtis Medžiagos gebėjimas reaguoti. atitikmenys: angl. chemical activity; reactivity rus. реакционная способность … Chemijos terminų aiškinamasis žodynas
РЕАКЦИОННАЯ СПОСОБНОСТЬ — характеристика относительной хим. активности молекул, атомов, ионов, радикалов. Для количеств. оценки Р. с. рассматривают реакционные серии, т. е. ряды однотипных р ций, проводимых в одинаковых условиях, напр.: (стандартная р ция) где Х общая… … Химическая энциклопедия
реакционная способность целлюлозы к вискозообразованию — Показатель качества вискозной и кордной целлюлоз, характеризующий их пригодность для производства вискозных волокон, пленок и корда, определяемый по фильтруемости приготовленного из целлюлозы вискозного раствора и выражаемый минимальным… … Справочник технического переводчика
реакционная способность топлива — [reactive capacity] понятие, объединяющее свойства горючести и реактивности твердого топлива. Горючестью называется реакционная способность по отношению к кислороду, она определяется по скорости выгорания стандартных образцов угля или кокса при… … Энциклопедический словарь по металлургии
РЕАКЦИОННАЯ СПОСОБНОСТЬ КОКСА — характеристика скорости взаимодействия углерода кокса с углекислым газом в доменном, ваграночном и генераторном процессах. Реакционную способность кокса определяют газификацией кокса в струе СО2 при 950 1100°С. Оценку реакционной способности… … Металлургический словарь
Относительная реакционная способность фенолов — Фенолы Число активных атомов водорода Реакционная способность* 1, 3, 5 Ксиленол 3 7,8 м Крезол 3 2,9 … Химический справочник
РЕАКЦИОННАЯ СПОСОБНОСТЬ
характеристика относительной хим. активности молекул, атомов, ионов, радикалов. Для количеств. оценки Р. с. рассматривают реакционные серии, т. е. ряды однотипных р-ций, проводимых в одинаковых условиях, напр.: (стандартная р-ция)
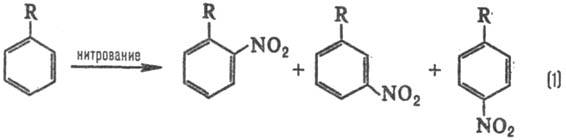
Типичные реакционные серии. Простейшая ситуация возникает при анализе изомерного состава продуктов р-ции. В р-ции электроф. замещения в ароматич. ряду в зависимости от заместителя R образуются те или иные изомеры, напр. при нитровании:
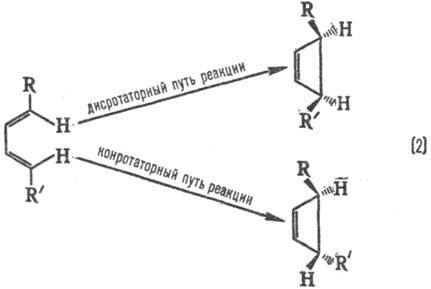
Стереохим. направленность перипиклич. р-ций определяется Вудворда-Хофмаиа правилами, напр.:
При дисротаторном пути р-ции заместители R и R’ в продукте будут расположены по одну сторону плоскости цикла, при конротаторном пути-по разные стороны. Эксперимент показывает, что термич. циклизация производных бутадиена происходит по конротаторному пути, а фотохим. циклизация-по дисротаторному пути.
В примерах (1) и (2) нет необходимости в количеств. кинетич. измерениях, Р. с. определяется по относит. выходу изомеров. Пример широкой реакц. серии-р-ции радикального присоединения по двойной связи:
Р. с. характеризуется отношением константы скорости kк константе скорости k 0 р-ции с этиленом (R, R’ = Н) (см. табл.). Аналогичные кинетич. измерения сделаны для р-ций присоединения метильного радикала к ароматич. молекулам и для р-ций присоединения др. радикалов.
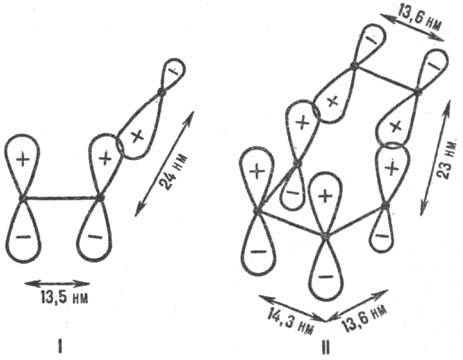
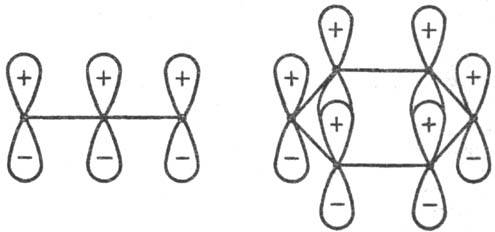
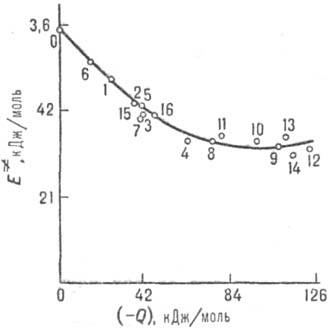
Энергия стабилизации. Для относит. оценки . в реакц. сериях важна концепция делокализации электронов в переходном состоянии (активир. комплексе) р-ции (М. Эванс, 1939). Согласно этой концепции, электронное строение мн. реакц. центров подобно строению сопряженных открытых и циклических я-электронных систем (рис. 1). Открытое переходное состояние радикальной р-ции типа (3) подобно p-электронной системе аллильного радикала (рис. 1, I), а «циклическое» переходное состояние согласованной р-ции Дильса-Альдера (этилен + бутадиен) по строению напоминает бензол (рис. 1, И). p-Электроны заместителей R и R’ включаются в общую делокализованную систему электронов. Относит. мерой энергии активации р-ции, а следовательно и Р. с., может служить энергия стабилизации переходного состояния (энергия делокализации), т. е. разность между энергией сопряженной системы p-электронов переходного состояния и энергией p-электронов в изолир. реагентах. Энергию стабилизации можно рассчитать полу-эмпирическими методами квантовой химии, напр. методом Хюккеля. Вычисляя энергию стабилизации, можно предсказывать Р. с. хим. соединения во мн. р-циях (иллюстрации см. на рис. 2).
Концепция граничных орбиталей. Оценки Р. с. особенно просты, если использовать возмущений теорию. В распространенном варианте теории возмущений энергия стабилизации представляется в виде суммы вкладов от взаимод. между мол. орбиталями реагентов. Наиб. вклад в сумму дают, как правило, взаимод. граничных орбиталей, т. е. высших заполненных электронами и низших незаполненных орбиталей; согласно К. Фукуи (1952), существенны только эти вклады (см. Граничных орбиталей теория). Концепцию граничных орбиталей часто применяют в качестве основы для обсуждения Р. с.
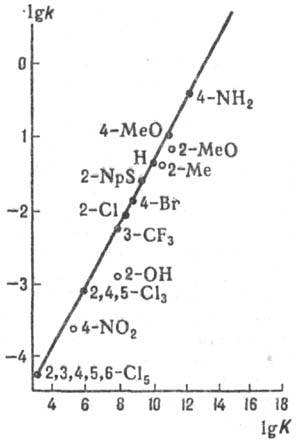
Альтернантные системы. Качеств. подход, не обязательно использующий теорию возмущений, сформулирован для класса сопряженных систем, наз. альтернант-ными. Они образованы из одинаковых атомов (обычно углерода) и не содержат нечетных циклов (см. Альтернантные углеводороды).Для таких систем в рамках Хюккеля метода можно без всяких вычислений выявить нек-рые общие закономерности. Так, введение полярного заместителя приводит к чередованию положит. и отрицат. изменений электронной плотности в сопряженной углеродной цепи относительно незамещенного углеводородного соед. (закон альтернирующей полярности, Ч. Коул-сон, Г. Лонге-Хиггинс, 1947). Этот вывод теории позволяет объяснить правила ориентации в ароматич. ряду (р-ция 1).
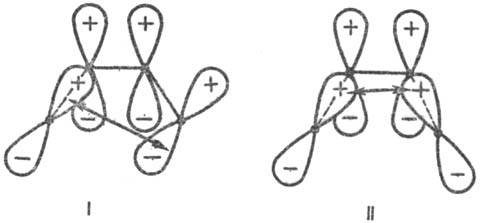
Для циклич. переходного состояния (активир. комплекса) существенно, каким образом замыкаются новые связи: в фазе или в противофазе, т. е. имеют ли атомные орбитали реагентов в области макс. перекрывания одинаковые или противоположные знаки (рис. 1 и 3). В первом случае взаимод. наз. связывающим, во втором-разрых-ляющим. В зависимости от числа атомных орбиталей в сопряженной системе активир. комплекса, электронного состояния реагирующей системы и характера вновь возникающих взаимодействий, энергия замыкания цикла м. б. как положительной, так и отрицательной, причем ее знак определяется без вычислений. В частности, при циклизации производных бутадиена (р-ция 2) в основном электронном состоянии переходное состояние стабилизируется замыканием связей посредством разрыхляющих взаимод. (перекрывание в противофазе, рис. 3), делая энергетически выгодным конротаторный путь термич. р-ции. В первом электронном возбужденном состоянии циклич. переходное состояние стабилизируется связывающим взаимод. (перекрывание в фазе), что соответствует дисротаторному пути. Эти общие положения позволяют предсказывать закономерности Р. с. согласованных электроциклич. р-ций (Р. Вуд-ворд, Р. Хофман, 1965).
Рис. 3. Переходные состояния р-ции циклизации производных бутадиена. I-конротаторный путь р-ции (орбитали вновь образующейся связи перекрываются в протпвофазе); II-дисротаторный путь р-ции (орбитали перекрываются в фазе). Обозначения те же, что и на рис. 1. Стрелки указывают области наилучшего перекрывания атомных орбиталей реакц. центра.
Индексы Р. с. применимы в тех случаях, когда хим. перестройка затрагивает в осн. p-электронные системы реагентов. Если же наряду с p-электронной системой значительно перестраиваются и s-связи реагентов, применение p-электронного приближения мало эффективно. В подобных случаях, а также если в реагирующих системах вообще нельзя выделить систему p-электронов, изменения энергий активации р-ций, составляющих реакц. серию, оцениваются с помощью полуэмпирич. или неэмпирических методов квантовохим. вычислений в рамках разл. моделей р-ции, учитывающих все валентные электроны. В результате получают индексы Р. с., к-рые при подходящем выборе модели удовлетворительно коррелируют с кинетич. изменениями. Такое квантовохим. описание утрачивает качеств. наглядность p-электронной модели.
(В и А-радикалы или анионы; А
РЕАКЦИОННАЯ СПОСОБНОСТЬ
РЕАКЦИОННАЯ СПОСОБНОСТЬ, характеристика относительной хим. активности молекул, атомов, ионов, радикалов. Для количеств. оценки реакционной способности рассматривают реакционные серии, т.е. ряды однотипных р-ций, проводимых в одинаковых условиях, напр.: (стандартная р-ция)
Типичные реакционные серии. Простейшая ситуация возникает при анализе изомерного состава продуктов р-ции. В р-ции электроф. замещения в ароматич. ряду в зависимости от заместителя R образуются те или иные изомеры, напр. при нитровании:
Стереохим. направленность перипиклич. р-ций определяется Вудворда-Хофмаиа правилами, напр.:
При дисротаторном пути р-ции заместители R и R’ в продукте будут расположены по одну сторону плоскости цикла, при конротаторном пути-по разные стороны. Эксперимент показывает, что термич. циклизация производных бутадиена происходит по конротаторному пути, а фотохим. циклизация-по дисротаторному пути.
В примерах (1) и (2) нет необходимости в количеств. кинетич. измерениях, реакционная способность определяется по относит. выходу изомеров. Пример широкой реакц. серии-р-ции радикального присоединения по двойной связи:
Р еакционная способность характеризуется отношением константы скорости k к константе скорости k 0 р-ции с этиленом (R, R’ = Н) (см. табл.). Аналогичные кинетич. измерения сделаны для р-ций присоединения метильного радикала к ароматич. молекулам и для р-ций присоединения др. радикалов.
Концепция граничных орбиталей. Оценки реакционной способности особенно просты, если использовать возмущений теорию. В распространенном варианте теории возмущений энергия стабилизации представляется в виде суммы вкладов от взаимод. между мол. орбиталями реагентов. Наиб. вклад в сумму дают, как правило, взаимод. граничных орбиталей, т.е. высших заполненных электронами и низших незаполненных орбиталей; согласно К. Фукуи (1952), существенны только эти вклады (см. Граничных орбиталей теория). Концепцию граничных орбиталей часто применяют в качестве основы для обсуждения реакционной способности.
Альтернантные системы. Качеств. подход, не обязательно использующий теорию возмущений, сформулирован для класса сопряженных систем, наз. альтернант-ными. Они образованы из одинаковых атомов (обычно углерода) и не содержат нечетных циклов (см. Альтернантные углеводороды). Для таких систем в рамках Хюккеля метода можно без всяких вычислений выявить нек-рые общие закономерности. Так, введение полярного заместителя приводит к чередованию положит. и отрицат. изменений электронной плотности в сопряженной углеродной цепи относительно незамещенного углеводородного соед. (закон альтернирующей полярности, Ч. Коул-сон, Г. Лонге-Хиггинс, 1947). Этот вывод теории позволяет объяснить правила ориентации в ароматич. ряду (р-ция 1).
Для циклич. переходного состояния (активир. комплекса) существенно, каким образом замыкаются новые связи: в фазе или в противофазе, т.е. имеют ли атомные орбитали реагентов в области макс. перекрывания одинаковые или противоположные знаки (рис. 1 и 3). В первом случае взаимод. наз. связывающим, во втором-разрых-ляющим. В зависимости от числа атомных орбиталей в сопряженной системе активир. комплекса, электронного состояния реагирующей системы и характера вновь возникающих взаимодействий, энергия замыкания цикла м. б. как положительной, так и отрицательной, причем ее знак определяется без вычислений. В частности, при циклизации производных бутадиена (р-ция 2) в основном электронном состоянии переходное состояние стабилизируется замыканием связей посредством разрыхляющих взаимод. (перекрывание в противофазе, рис. 3), делая энергетически выгодным конротаторный путь термич. р-ции. В первом электронном возбужденном состоянии циклич. переходное состояние стабилизируется связывающим взаимод. (перекрывание в фазе), что соответствует дисротаторному пути. Эти общие положения позволяют предсказывать закономерности реакционной способности согласованных электроциклич. р-ций (Р. Вудворд, Р. Хофман, 1965).
Рис. 3. Переходные состояния р-ции циклизации производных бутадиена. I-конротаторный путь р-ции (орбитали вновь образующейся связи перекрываются в протпвофазе); II-дисротаторный путь р-ции (орбитали перекрываются в фазе). Обозначения те же, что и на рис. 1. Стрелки указывают области наилучшего перекрывания атомных орбиталей реакц. центра.
(В и А-радикалы или анионы; А···H···В-делокализован-ная структура переходного состояния) и р-ции нуклеоф. замещения S N 2:
Корреляции такого рода часто описывают уравнением Маркуса:
В отличие от квантовохим. теорий, объясняющих реакционную способность исходя из электронного строения реагентов, соотношение (6) и др. ур-ния такого типа основаны на анализе изменений структуры ППЭ в реакц. серии. Рассматривают смещение положения переходного состояния на координате реакции в зависимости от заместителей. Положение переходного состояния характеризуется безразмерной величиной а, к-рая может принимать значения между нулем (положение реагентов на координате р-ции) и единицей (положение продуктов на координате р-ции). В рамках простейших моделей ППЭ
Влияние среды на реакционную способность. Совр. развитие теории реакционной способности связано с изучением влияния среды на р-ции, протекающие в конденсир. фазе. (См. также Реакции в растворах). Согласно классич. подходу (С. Глесстон, К. Лейдлер, Г. Эйринг, 1941), определяют изменения энергии начального состояния реагентов и переходного состояния под влиянием среды (р-рителя) в рамках теории активир. комплекса. Роль среды сводится к созданию дополнит. потенциала, модифицирующего ППЭ соответствующей р-ции в газовой фазе. Этот потенциал м.б. учтен в совр. квантовохим. расчете. Модификация ППЭ потенц. полем среды м. б. очень велика для р-ций с переносом заряда в полярном р-рителе, напр. S N 2.
С принципиальной точки зрения наиб. интересны такие хим. р-ции, к-рые сопровождаются перестройкой среды. Их изучение требует от теории явного рассмотрения координат, связанных с изменениями, происходящими в среде. Иногда координата перестройки среды дает осн. вклад в координату р-ции на энергетич. пов-сти вблизи седловой точки, соответствующей переходному состоянию. Это означает, что потенц. барьер преодолевается в осн. за счет движения частиц среды. Типичная модельная р-ция такого типа-внешне-сферный перенос электрона окружении ионов (см. Одноэлектронный перенос). Перенос электрона фиксируется изменением состояния среды (переход из состояния I в состояние II).
Предполагается, что перенос электрона происходит при фиксир. расстоянии между ионами и не учитываются (в простейшем случае) структурные изменения в лигандном
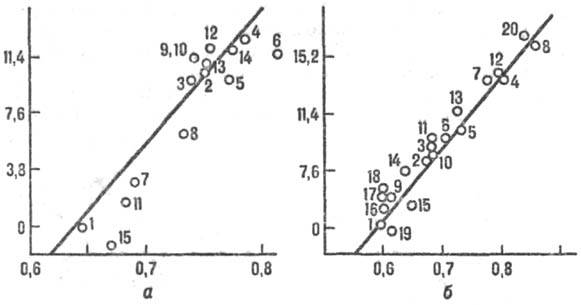
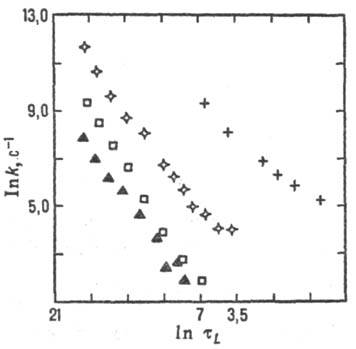
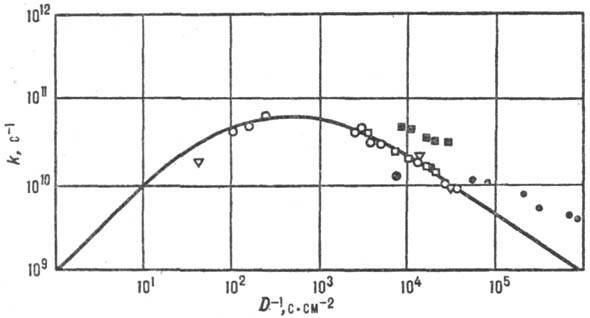
Для р-ций в полярном р-рителе состояние среды характеризуется ее поляризацией, связанной со средней величиной и ориентацией дипольных моментов молекул р-рителя. Поляризация среды (дипольный момент, отнесенный к единице объема), если среда равновесна, определяется распределением электрич. зарядов в хим. подсистеме и изменяется вместе с ним. Для внешнесферного переноса электрона координата перестройки среды есть коллективная переменная-величина, выражающаяся через поляризацию среды. В более сложных (и химически более интересных) ситуациях координаты перестройки среды и внутр. координаты хим. подсистемы рассматриваются на равных основаниях, т.е. энергетич. пов-сть строится в пространстве координат обоих типов. При этом возможны неравновесные эффекты: если движение системы по координате перестройки среды более медленное, чем движение по «химической» координате, среда не успевает подстроиться под «химическое» движение. Тогда имеет место неравновесная сольватация переходного состояния и теория активир. комплекса не применима, поскольку она основана на предположении о равновесном распределении энергии в переходном состоянии. Реакционная способность в таких системах коррелирует с динамич. характеристиками среды. Для р-ций с перераспределением заряда в полярном р-рителе динамич. характеристикой среды является время т L продольной электрич. релаксации (рис. 6). Если же электрич. взаимодействие хим. подсистемы со средой не столь существенно, на первый план выступают эффекты, зависящие от гидродинамич. вязкости h среды или от коэф. диффузии D (рис. 7), обратно пропорционального вязкости ( h
Рис. 6. Корреляция между константами скорости k и временами продольной диэлект-рич. релаксации т L (р-ция переноса электрона между комплексами рутения и метилвио-летом в глицерине; значки разл. формы относятся к разл. лигандам в комплексе рутения).
Рис. 7. Корреляция между константами скорости k и козф. диффузии D (фото-хим. изомеризации стильбена в газовой и жидкой фазах при разных давлениях). Значки разл. формы отвечают разным средам; сплошная линия—расчет по ур-нию Крамерса.
Изложенные общие принципы описания влияния среды на реакционную способность перспективны для применения к хим. р-циям, протекающим в сложных системах, напр. биологических.
Разобранные примеры свидетельствуют о многообразии проблем, связанных с реакционной способностью. Для простейших реакц. серий достаточны элементарные квантовохим. рассуждения (р-ции 1 и 2). В более сложных случаях для понимания закономерностей реакционной способности необходимо привлекать динамич. подходы (см. Динамика элементарного акта) и методы статистич. физики (пример 8 и рис. 6). Вся совокупность этих проблем и применяемых при их решении методов составляет содержание совр. теории хим. р-ций.
Лит.: Базилевский М. В., Метод молекулярных орбит и реакционная способность органических молекул, М., 1969; Вудворд Р., Хоффман Р., Сохранение орбитальной симметрии, пер. с англ., М., 1971; Гаммет Л., Основы физической органической химии, пер. с англ., М., 1972; Дыоар М. Дж., Догерти Р., Теория возмущений молекулярных орбиталей в органической химии, пер. с англ., М., 1977; Салем Л., Электроны в химических реакциях, пер. с англ., М., 1985; Базилевский М. В., Колдобский С. Г., Тихомиров В. А., «Успехи химии», 1986, т. 55, в. 10, с. 1667-98; The chemical physics of solvation, pt A, ed. by R. R. Dogonadze [a. o.], pt C, ed. by A. A. Kornyshev and I. Ulstrup, Amst, 1985 88. М. В. Базилевский.
Реакционная способность
Реакционная способность — характеристика химической активности вещества (материала), обусловленная активностью атомов и молекул, оцениваемая относительной константой скорости реакций.
[Ушеров-Маршак А. В. Бетоноведение: лексикон. М.: РИФ Стройматериалы.- 2009. – 112 с.]
Рубрика термина: Общие термины
Полезное
Смотреть что такое «Реакционная способность» в других словарях:
реакционная способность — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN reactivenessreactivity … Справочник технического переводчика
реакционная способность — rus реакционная способность (ж) eng reactivity fra réactivité (f) deu Reaktionsfähigkeit (f) spa reactividad (f) … Безопасность и гигиена труда. Перевод на английский, французский, немецкий, испанский языки
реакционная способность — cheminis reaktyvumas statusas T sritis Standartizacija ir metrologija apibrėžtis Medžiagos gebėjimas reaguoti. atitikmenys: angl. chemical activity; reactivity vok. Reaktionsfähigkeit, f; Reaktionsvermögen, n rus. реакционная способность, f pranc … Penkiakalbis aiškinamasis metrologijos terminų žodynas
реакционная способность — reaktyvumas statusas T sritis chemija apibrėžtis Medžiagos gebėjimas reaguoti. atitikmenys: angl. chemical activity; reactivity rus. реакционная способность … Chemijos terminų aiškinamasis žodynas
Реакционная способность — характеристика химической активности веществ, учитывающая как разнообразие реакций, возможных для данного вещества, так и их скорость. Например, благородные металлы (Au, Pt) и инертные газы (Не, Ar, Kr, Xe) химически инертны, т. е. у них… … Большая советская энциклопедия
РЕАКЦИОННАЯ СПОСОБНОСТЬ — характеристика относительной хим. активности молекул, атомов, ионов, радикалов. Для количеств. оценки Р. с. рассматривают реакционные серии, т. е. ряды однотипных р ций, проводимых в одинаковых условиях, напр.: (стандартная р ция) где Х общая… … Химическая энциклопедия
реакционная способность целлюлозы к вискозообразованию — Показатель качества вискозной и кордной целлюлоз, характеризующий их пригодность для производства вискозных волокон, пленок и корда, определяемый по фильтруемости приготовленного из целлюлозы вискозного раствора и выражаемый минимальным… … Справочник технического переводчика
реакционная способность топлива — [reactive capacity] понятие, объединяющее свойства горючести и реактивности твердого топлива. Горючестью называется реакционная способность по отношению к кислороду, она определяется по скорости выгорания стандартных образцов угля или кокса при… … Энциклопедический словарь по металлургии
РЕАКЦИОННАЯ СПОСОБНОСТЬ КОКСА — характеристика скорости взаимодействия углерода кокса с углекислым газом в доменном, ваграночном и генераторном процессах. Реакционную способность кокса определяют газификацией кокса в струе СО2 при 950 1100°С. Оценку реакционной способности… … Металлургический словарь
Относительная реакционная способность фенолов — Фенолы Число активных атомов водорода Реакционная способность* 1, 3, 5 Ксиленол 3 7,8 м Крезол 3 2,9 … Химический справочник