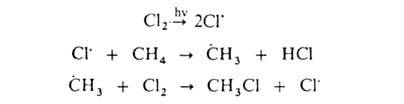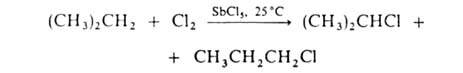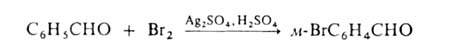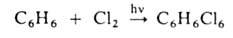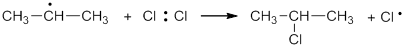Что такое реакция галогенирования
ГАЛОГЕНИРОВАНИЕ
ГАЛОГЕНИРОВАНИЕ (галоидирование), введение галогена в молекулу орг. соединения. Осуществляют путем р-ций замещения (заместительное галогенирование) или присоединения (присоединительное галогенирование).
Заместительное галогенирование. При действии галогенов на насыщ. углеводороды (металепсия) процесс протекает при инициировании светом по свободнорадикальному цепному механизму, напр.:
По свободнорадикальному механизму идет также галогенирование углеводородных цепей жирноароматич. соединений. В присут. к-т Льюиса р-ция протекает по электроф. механизму, напр.:
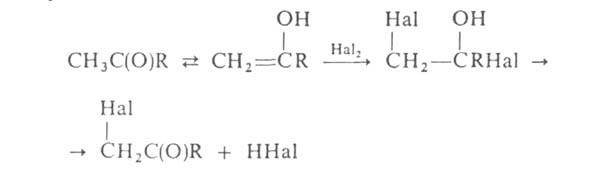
Галогенирование алифатич. карбоновых к-т в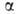
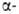
Замещение атомов Н на F с образованием полифторзамешенных соед. проводят путем электрохим. фторирования в безводном HF (р-ция Саймонса), действием CoF3 и др.
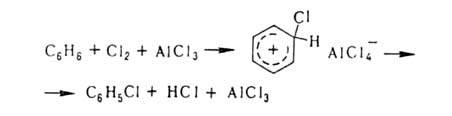
Заместительное галогенирование в ядро ароматич. и гетероароматич. соед. протекает по механизму электроф. замещения; обычно его осуществляют с использованием катализаторов (гл. обр. апротонных или протонных к-т), напр.:
Если в ядре этих соед. присутствуют пассивирующие заместители, процесс можно проводить действием катиона галогена, образующегося из молекулярного галогена и соли Ag в среде сильной протонной к-ты (р-ция Биркенбаха-Губо-Уотерса), напр.:
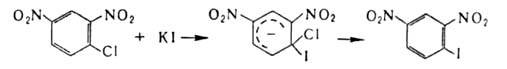
В ароматич. ряду для получения галогензамсщеиных используют замену групп NH2 на С1, Вr или I каталитич. разложением соответствующих солей диазония в присут. порошка Сu (Гаттермана-Коха реакция)или действием солей Сu (Зандмепера реакция), а на F-разложением гидрофторидов диазония (Шимана реакция). Для галогенирования ароматич. и гетероароматич. соед. используют также р-цию замещения (в т.ч. обмен галогенов), протекающую по механизму присоединения-отщепления с промежут. образованием анионных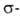
Присоединительное галогенирование. К ароматич. и гете-роароматич. соед. галоген присоединяется, как правило, по радикальному механизму под действием света или при нагр., напр.:
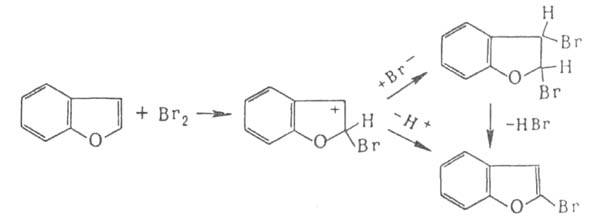
Если цикл активирован, р-ция может протекать по ионному механизму, к-рый включает стадию присоединения аниона галогена к промежуточно образующемуся в процессе электроф. замещения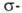
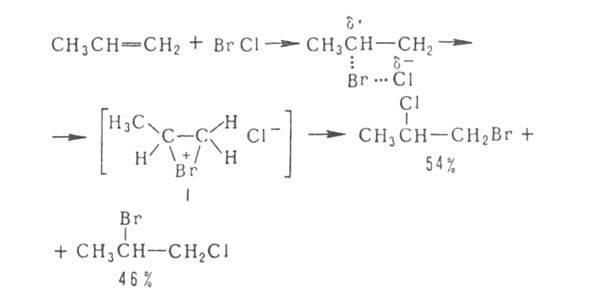
Присоединение галогенов по кратной связи происходит по электроф. или радикальному механизму. Его можно осуществлять действием галогсноводородов (см. Гидрогалогенирование), межгалогенных соед. (напр., ClBr, СП) или гипогалогенитов. В случае электроф. присоединения может нарушаться правило Марковникова, что обусловлено образованием промежут. мостикового катиона ф-лы I, напр.:
Иногда галогенирование (заместительное и присоединительное) проводят действием галогеноводородов (НС1 или НВr) и окислителя (т. наз. окислительное галогенирование). Р-цию осуществляют в жидкой или газовой фазе (окислители соотв. Н2О2 и О2) в присут. соли Си на пемзе. См. также Галоформная реакция, Фторирование органических соединений.
===
Исп. литература для статьи «ГАЛОГЕНИРОВАНИЕ» : Тереитьев А. П., Яновская Л. А., в кн.: Реакции и методы исследования органических соединений, кн. 6, М., 1957, с. 7-342; Кнунянц И. Л., Сокольский Г. А., там же, с. 343-87; Бюлер К., Пирсон Д., Органические синтезы, пер. с англ.. М., 1973, с. 374-468; Эфрос Л. С, Горелик М. В., Химия и технология промежуточных продуктов. Л., 1980; Чамберс Р. Д., Джеймс С. Р, в кн.: Общая органическая химия, пер. с англ., т. 1, М., 1981, с. 622-719. Л. И. Беленький
Страница «ГАЛОГЕНИРОВАНИЕ» подготовлена по материалам химической энциклопедии.
Что такое реакция галогенирования
Химия
3.4. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола)
Механизм реакции галогенирования алканов
Механизмом реакции называют детальное описание химической реакции, которое включает элементарные стадии. Галогенирование алканов относится к реакциям цепногосвободнорадикального замещения (SR). Следует вспомнить, что свободный радикал – это атом или группа атомов, имеющих неспаренный (нечетный) электрон.
Общепринятый механизм галогенирования алканов может быть описан тремя основными стадиями:
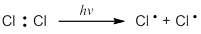
Инициирование (зарождение цепи). Под действием УФ-облучения (ультрафиолетовое облучение) или при нагревании происходит гомолитический разрыв связи в молекуле хлора и она распадается на атомы:
Развитие цепи (цепь последовательных взаимодействий свободных радикалов и неактивных молекул, в результате которых образуются новые молекулы и новые радикалы).
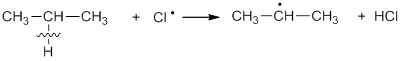
Образовавшиеся на первой стадии радикалы (атомы хлора) атакуют молекулы алканов, отрывая у них атом водорода:
Образовавшиеся алкильные радикалы (в нашем случае это радикал изопропил) сталкиваются с молекулами галогена и гомолитически разрушают их. При этом получаются новые радикалы галогена и образуется алкилгалогенид:
Обрыв цепи (соединении радикалов друг с другом с образованием неактивных молекул).
Столкновение двух короткоживущих частиц маловероятно, но все же оно иногда происходит и приводит к обрыву какой-либо стадии реакции:
В результате последней реакции образуется 2,3-диметилбутан. Это побочный продукт реакции.
Галогенирование алканов – пример цепной реакции. Цепная реакция включает ряд стадий, на каждой из которых образуется реакционноспособная частица, вызывающая следующую стадию.