Что такое реакция разложения в химии
Реакции разложения
При выполнении различных заданий ЕГЭ по химии (например, задачи 34 или задания 32 «мысленный эксперимент») могут пригодиться знания о том, какие вещества при нагревании разлагаются и как они разлагаются.
Рассмотрим термическую устойчивость основных классов неорганических веществ. Я не указываю в условиях температуру протекания процессов, так как в ЕГЭ по химии такая информация, как правило, не встречается. Если возможны различные варианты разложения веществ, я привожу наиболее вероятные, на мой взгляд, реакции.
Разложение оксидов
При нагревании разлагаются оксиды тяжелых металлов:
2HgO = 2Hg + O2
Разложение гидроксидов
Как правило, при нагревании разлагаются нерастворимые гидроксиды. Исключением является гидроксид лития, он растворим, но при нагревании в твердом виде разлагается на оксид и воду:
2LiOH = Li2O + H2O
Гидроксиды других щелочных металлов при нагревании не разлагаются.
Гидроксиды серебра (I) и меди (I) неустойчивы:
2AgOH = Ag2O + H2O
2CuOH = Cu2O + H2O
Гидроксиды большинства металлов при нагревании разлагаются на оксид и воду.
В инертной атмосфере (в отсутствии кислорода воздуха) гидроксиды хрома (III) марганца (II) и железа (II) распадаются на оксид и воду:
Большинство остальных нерастворимых гидроксидов металлов также при нагревании разлагаются:
Разложение кислот
При нагревании разлагаются нерастворимые кислоты.
Некоторые кислоты неустойчивы и подвергаются разложению в момент образования. Большая часть молекул сернистой кислоты и угольной кислоты распадаются на оксид и воду в момент образования:
В ЕГЭ по химии лучше эти кислоты записывать в виде оксида и воды.
Азотистая кислота на холоде или при комнатной температуре частично распадается уже в водном растворе, реакция протекает обратимо:
При нагревании выше 100 о С продукты распада несколько отличаются:
Азотная кислота под действием света или при нагревании частично обратимо разлагается:
Разложение солей
Разложение хлоридов
Хлориды щелочных, щелочноземельных металлов, магния, цинка, алюминия и хрома при нагревании не разлагаются.
Хлорид серебра (I) разлагается под действием света:
2AgCl → Ag + Cl2
Хлорид аммония при нагревании выше 340 о С разлагается:
Разложение нитратов
Нитраты щелочных металлов при нагревании разлагаются до нитрита металла и кислорода.
Видеоопыт разложения нитрата калия можно посмотреть здесь.
Нитраты магния, стронция, кальция и бария разлагаются до нитрита и кислорода при нагревании до 500 о С:
При более сильном нагревании (выше 500 о С) нитраты магния, стронция, кальция и бария разлагаются до оксида металла, оксида азота (IV) и кислорода:
Нитраты металлов, расположенных в ряду напряжений после магния и до меди (включительно) + нитрат лития разлагаются при нагревании до оксида металла, диоксида азота и кислорода:
Нитраты серебра и ртути разлагаются при нагревании до металла, диоксида азота и кислорода:
Нитрат аммония разлагается при небольшом нагревании до 270 о С оксида азота (I) и воды:
При более высокой температуре образуются азот и кислород:
Разложение карбонатов и гидрокарбонатов
Карбонаты натрия и калия плавятся при нагревании.
Карбонаты лития, щелочноземельных металлов и магния разлагаются на оксид металла и углекислый газ:
Карбонат аммония разлагается при 30 о С на гидрокарбонат аммония и аммиак:
Гидрокарбонат аммония при дальнейшем нагревании разлагается на аммиак, углекислый газ и воду:
Гидрокарбонаты натрия и калия при нагревании разлагаются на карбонаты, углекислый газ и воду:
Гидрокарбонат кальция при нагревании до 100 о С разлагается на карбонат, углекислый газ и воду:
При нагревании до 1200 о С образуются оксиды:
Разложение сульфатов
Сульфаты щелочных металлов при нагревании не разлагаются.
Сульфаты алюминия, щелочноземельных металлов, меди, железа и магния разлагаются до оксида металла, диоксида серы и кислорода:
Сульфаты серебра и ртути разлагаются до металла, диоксида серы и кислорода:
Разложение фосфатов, гидрофосфатов и дигидрофосфатов
Эти реакции, скорее всего, в ЕГЭ по химии не встретятся! Гидрофосфаты щелочных и щелочноземельных металлов разлагаются до пирофосфатов:
Ортофосфаты при нагревании не разлагаются (кроме фосфата аммония).
Разложение сульфитов
Сульфиты щелочных металлов разлагаются до сульфидов и сульфатов:
Разложение солей аммония
Некоторые соли аммония, не содержащие анионы кислот-сильных окислителей, обратимо разлагаются при нагревании без изменения степени окисления. Это хлорид, бромид, йодид, дигидрофосфат аммония:
Cоли аммония, образованные кислотами-окислителями, при нагревании также разлагаются. При этом протекает окислительно-восстановительная реакция. Это дихромат аммония, нитрат и нитрит аммония:
Видеоопыт разложения нитрита аммония можно посмотреть здесь.
Разложение перманганата калия
Разложение хлората и перхлората калия
Хлорат калия при нагревании разлагается до перхлората и хлорида:
4KClO3 → 3KClO4 + KCl
При нагревании в присутствии катализатора (оксид марганца (IV)) образуется хлорид калия и кислород:
2KClO3 → 2KCl + 3O2
Перхлорат калия при нагревании разлагается до хлорида и кислорода:
Реакции разложения
Фактором, вызывающим разложение, могут являться различные физические воздействия. Соответственно, выделяют различные виды реакций разложения:
См. также
Примечания
Полезное
Смотреть что такое «Реакции разложения» в других словарях:
Энергия активации реакции разложения H2O2 — Условия реакции Энергия активации, кДж/моль некаталитическая 76 катализатор Pt 57 катализатор каталаза 29 … Химический справочник
РАЗЛОЖЕНИЯ РЕАКЦИИ — РАЗЛОЖЕНИЯ РЕАКЦИИ, химические реакции, при которых из одного сложного вещества (см. СЛОЖНОЕ ВЕЩЕСТВО) образуется несколько более простых веществ (см. ПРОСТОЕ ВЕЩЕСТВО). Реакции разложения, являясь эндотермическим процессом, часто сопровождаются… … Энциклопедический словарь
РЕАКЦИИ — (1) связей силы воздействия тел на точки механической системы, в которых стесняется свобода её движения. Р. связей возникают (согласно закону Ньютона) как пассивные силы противодействия при наличии активных сил, действующих на механические связи… … Большая политехническая энциклопедия
Разложения реакции — Реакции химические, в которых из одного вещества образуются два или более веществ. Например, окись ртути при нагревании разлагается на ртуть и кислород: 2HgO = 2Hg + O2; хлористое серебро при действии света разлагается на серебро и хлор:… … Большая советская энциклопедия
Реакции химические — Химическая реакция превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются … Википедия
Реакции химические — превращения одних веществ в другие, отличные от исходных по химическому составу или строению. Общее число атомов каждого данного элемента, а также сами химические элементы, составляющие вещества, остаются в Р. х. неизмененными; этим Р. х … Большая советская энциклопедия
Химические реакции — Этим термином называется тот процесс, во время которого взятые тела превращаются в новые, ранее не существовавшие. В русском языке мы имеем два слова для выражения этого понятия: X. взаимодействие и X. превращение. Из них нужно отдать… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ЦЕПНЫЕ РЕАКЦИИ — ЦЕПНЫЕ РЕАКЦИИ, хим. реакции, каждый элементарный акт к рых с определенной, отличной от нуля вероятностью влечет за собой еще один элементарный акт. Этот второй акт с той же вероятностью повлечет за собой третий и т. д. Средняя длина (число… … Большая медицинская энциклопедия
Топохимические реакции — Реакции химические, происходящие на границе раздела твёрдых фаз. Примеры Т. р.: дегидратация кристаллогидратов, восстановление окислов, термический распад азидов тяжёлых металлов и т.д. Особенности Т. р.: 1) они начинаются не во всём… … Большая советская энциклопедия
Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Реакции разложения
Урок 28. Химия 8 класс
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Реакции разложения»
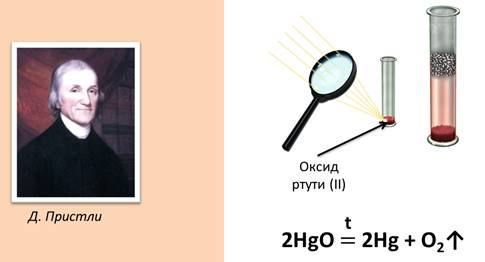
Еще в 1774 г. английский химик Дж. Пристли, используя стеклянную двояковыпуклую линзу (большое увеличительное стекло), направил сконцентрированный ею пучок солнечных лучей на оксид ртути (II) и получил кислород. Запишем уравнение этой реакции: 2HgO 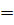
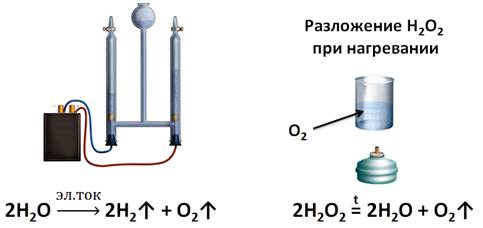
В настоящее время реакции разложения широко распространены. Например, разложение воды происходят в специальном устройстве – электролизёре. При электролизе воды получают чистый кислород.
2Н2О 
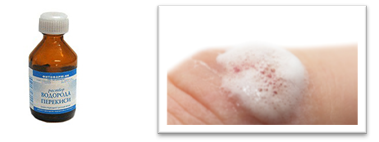
Однако, для получения кислорода в лаборатории, используют пероксид водорода (Н2О2). Если подогреть небольшое количество пероксида водорода, не доводя его до кипения, кислород выделяется очень медленно. Об этом можно судить, если поднести к пробирке, где собирался кислород, тлеющую лучинку.
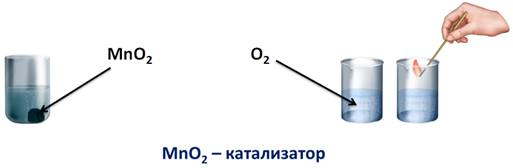
Для того чтобы она вспыхнула, кислорода в данном случае недостаточно, т.е. реакция идет с небольшой скоростью. Но если, в пероксид водорода добавить порошка оксида марганца (IV), то реакция пойдет очень быстро, кислород интенсивно выделяется в виде газа, и если поднести тлеющую лучинку, то она вспыхнет из-за большого количества кислорода. В данном случае, можно говорить о большой скорости реакции. Т.е. скорость реакции – это быстрота ее протекания или быстрота превращения одних веществ в другие. Вторая реакция пошла гораздо быстрее первой. В первом случае мы нагревали пероксид водорода, а во втором – использовали вещество – оксид марганца (IV), именно оно ускорило химическую реакцию. Его называют катализатором.
Катализатор – это вещество, ускоряющее химическую реакцию, но само при этом остается неизмененным.
Доказать, что оксид марганца (IV) не расходуется в реакции очень просто. В результате разложения пероксида водорода образуется вода, если к ней долить еще некоторую порцию пероксида водорода, то реакция опять протекает так же бурно, т.е. оксид марганца (IV) остался в результате реакции неизменным.
В жизни мы тоже используем перекись водорода, обрабатывая раны. При этом происходит тоже бурное выделение кислорода. А сам процесс идет с помощью биологического катализатора – фермента каталазы. Т.е. ферменты – биологические катализаторы белковой природы. Большинство процессов в живых организмах протекает благодаря ферментам. Ферменты используются в стиральных порошках для удаления крови, белков, чая; с помощью ферментов варят пиво, изготавливают сыры, лекарственные средства.
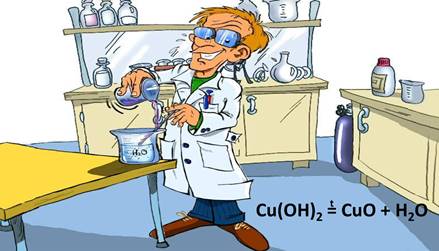
Рассмотрим еще несколько примеров реакций разложения. Если в пробирке на пламени спиртовки подогреть студенистый осадок гидроксида меди (II), то он начинает чернеть из-за образовавшегося оксида меди (II).
Это тоже реакция разложения: из одного сложного вещества – гидроксида меди (II) образовалось два новых – оксид меди (II) и вода.
В промышленности для получения негашеной извести – СаО – и углекислого газа используют реакцию разложения известняка, основу которого составляет карбонат кальция.
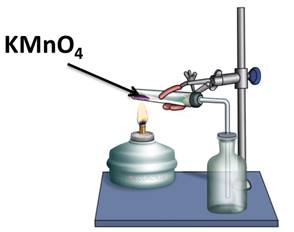
В лаборатории для получения кислорода используют реакцию разложения перманганата калия – KMnO4 – «марганцовки».
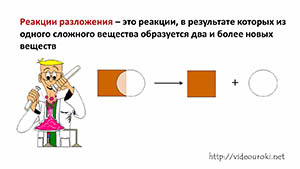
В данной реакции из одного сложного вещества образовалось два сложных и одно простое. Из этого можно сделать вывод, что реакции разложения – это реакции, в результате которых из одного сложного вещества образуется два и более новых веществ.
Классификация химических реакций
Темы кодификатора ЕГЭ: Классификация химических реакций в органической и неорганической химии.
В ходе химической реакции разрушаются химические связи, и образуются новые.
Химические реакции классифицируют по разным признакам. Рассмотрим основные виды классификации химических реакций.
Классификация по числу и составу реагирующих веществ
По составу и числу реагирующих веществ разделяют реакции, протекающие без изменения состава веществ, и реакции, протекающие с изменением состава веществ:
1. Реакции, протекающие без изменения состава веществ (A → B)
К таким реакциям в неорганической химии можно отнести аллотропные переходы простых веществ из одной модификации в другую:
Sромбическая → Sмоноклинная.
2. Реакции, протекающие с изменением состава
Как правило, в названии таких реакций есть приставка «де». Реакции разложения в органической химии происходят, как правило, с разрывом углеродной цепи.
2KI + Cl2 → 2KCl + I2.
Замещаться могут как отдельные атомы, так и молекулы.
В органической химии реакции замещения — это такие реакции, в ходе которых часть органической молекулы замещается на другие частицы. При этом замещенная частица, как правило, соединяется с частью молекулы-заместителя.
По числу частиц и составу продуктов взаимодействия эта реакция больше похожа на реакцию обмена. Тем не менее, по механизму такая реакция является реакцией замещения.
AB + CD = AC + BD
К реакциям обмена относятся реакции ионного обмена, протекающие в растворах; реакции, иллюстрирующие кислотно-основные свойства веществ и другие.
Пример реакции обмена в неорганической химии — нейтрализация соляной кислоты щелочью:
NaOH + HCl = NaCl + H2O
Пример реакции обмена в органической химии — щелочной гидролиз хлорэтана:
Классификация химических реакций по изменению степени окисления элементов, образующих вещества
По изменению степени окисления элементов химические реакции делят на окислительно-восстановительные реакции, и реакции, идущие без изменения степеней окисления химических элементов.
В неорганической химии к таким реакциям относятся, как правило, реакции разложения, замещения, соединения, и все реакции, идущие с участием простых веществ. Для уравнивания ОВР используют метод электронного баланса (количество отданных электронов должно быть равно количеству полученных) или метод электронно-ионного баланса.
В органической химии разделяют реакции окисления и восстановления, в зависимости от того, что происходит с органической молекулой.
Реакции окисления в органической химии — это реакции, в ходе которых уменьшается число атомов водорода или увеличивается число атомов кислорода в исходной органической молекуле.
Реакции восстановления в органической химии — это реакции, в ходе которых увеличивается число атомов водорода или уменьшается число атомов кислорода в органической молекуле.
Классификация реакций по тепловому эффекту
По тепловому эффекту реакции разделяют на экзотермические и эндотермические.
Экзотермические реакции — это реакции, сопровождающиеся выделением энергии в форме теплоты (+Q). К таким реакциям относятся почти все реакции соединения.
Исключения — реакция азота с кислородом с образованием оксида азота (II) — эндотермическая:
Реакция газообразного водорода с твердым йодом также эндотермическая:
Экзотермические реакции, в ходе которых выделяется свет, называют реакциями горения.
Также экзотермическими являются:
Эндотермические реакции — это реакции, сопровождающиеся поглощением энергии в форме теплоты (— Q). Как правило, с поглощением теплоты идет большинство реакций разложения (реакции, требующие длительного нагревания).
Также эндотермическими являются:
Классификация химических реакций по агрегатному состоянию реагирующих веществ (по фазовому составу)
Для классификации реакций по фазовому состоянию полезно уметь определять фазовые состояния веществ. Это достаточно легко сделать, используя знания о строении вещества, в частности, о типах кристаллической решетки.
Вещества с ионной, атомной или металлической кристаллической решеткой, как правило твердые при обычных условиях; вещества с молекулярной решеткой, как правило, жидкости или газы при обычных условиях.
Обратите внимание, что при нагревании или охлаждении вещества могут переходить из одного фазового состояния в другое. В таком случае необходимо ориентироваться на условия проведения конкретной реакции и физические свойства вещества.
Таким образом, паровая конверсия метана — гомогенная реакция.
Классификация химических реакций по участию катализатора
Катализатор — это такое вещество, которое ускоряет реакцию, но не входит в состав продуктов реакции. Катализатор участвует в реакции, но практичсеки не расходуется в ходе реакции. Условно схему действия катализатора К при взаимодействии веществ A + B можно изобразить так: A + K = AK; AK + B = AB + K.
В зависимости от наличия катализатора различают каталитические и некаталитические реакции.
Все реакции, протекающие с участием в клетках живых организмов, протекают с участием особых белковых катализаторов — ферментов. Такие реакции называют ферментативными.
Более подробно механизм действия и функции катализаторов рассматриваются в отдельной статье.
Классификация реакций по способности протекать в обратном направлении
Обратимые реакции — это реакции, которые могут протекать и в прямом, и в и обратном направлении, т.е. когда при данных условиях продукты реакции могут взаимодействовать друг с другом. К обратимым реакциям относятся большинство гомогенных реакций, этерификация; реакции гидролиза; гидрирование-дегидрирование, гидратация-дегидратация; получение аммиака из простых веществ, окисление сернистого газа, получение галогеноводородов (кроме фтороводорода) и сероводорода; синтез метанола; получение и разложение карбонатов и гидрокарбонатов, и т.д.
Необратимые реакции — это реакции, которые протекают преимущественно в одном направлении, т.е. продукты реакции не могут взаимодействовать друг с другом при данных условиях. Примеры необратимых реакций: горение; реакции, идущие со взрывом; реакции, идущие с образованием газа, осадка или воды в растворах; растворение щелочных металлов в воде; и др.