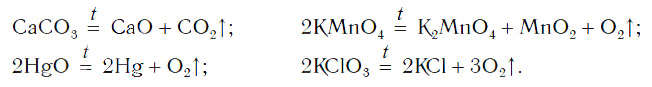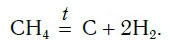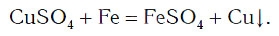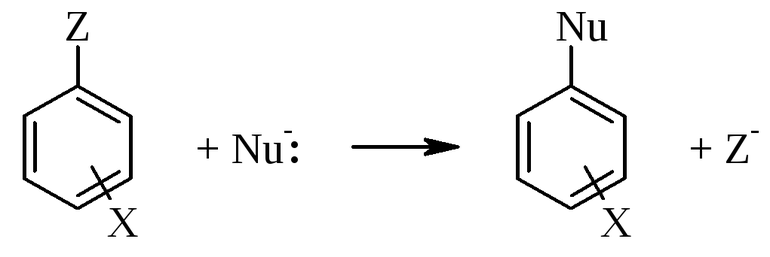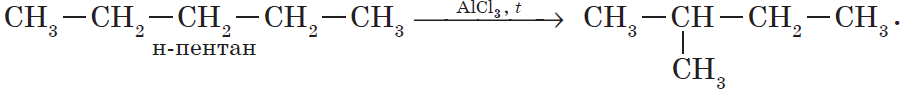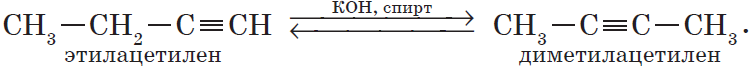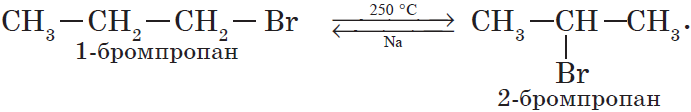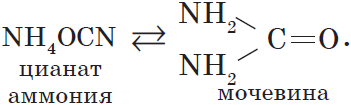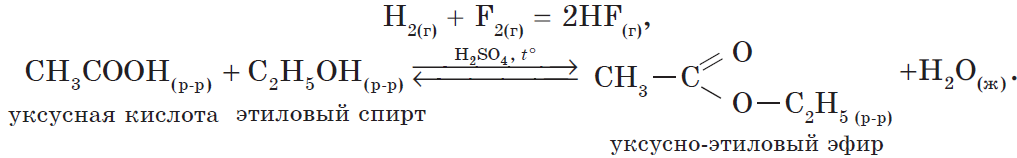Что такое реакция замещения кратко
Урок 13. Типы химических реакций
В уроке 13 «Типы химических реакций» из курса «Химия для чайников» мы узнаем о типах химических реакций; подробно рассмотрим каждый тип и научимся их различать.
Мир химических реакций весьма разнообразен. Самые различные химические реакции постоянно происходят в природе, осуществляются человеком. Можно ли классифицировать химические реакции? Что положить в основу их классификации? Сущность всякой химической реакции состоит в превращении веществ: разрушаются исходные вещества и образуются продукты реакций, меняется число и состав исходных веществ и продуктов реакции. Характер этих изменений и положен в основу классификации химических реакций.
Реакции соединения
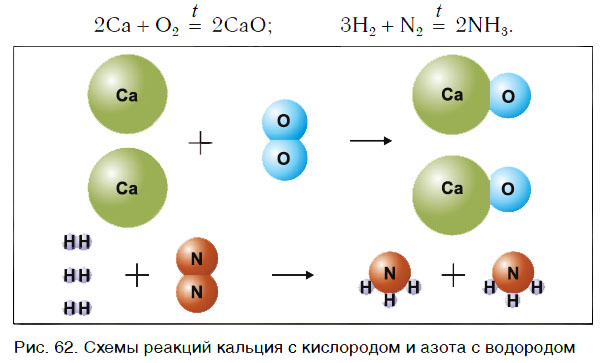
Рассмотрим уравнения следующих реакций (рис. 62):
Чем сходны данные реакции между собой? Тем, что в результате взаимодействия двух веществ получается только одно вещество. Такие реакции получили название реакций соединения.
Реакции соединения — это реакции, в результате которых из двух или нескольких веществ образуется одно новое сложное вещество.
В одних случаях из двух простых веществ получается одно сложное, в других — соединяются два и более простых или сложных веществ:
Реакции разложения
Рассмотрим уравнения следующих реакций:
Можно заметить, что из одного сложного вещества получается два или более новых веществ. Это реакции разложения. В них могут образовываться как простые, так и сложные вещества.
Реакции разложения — это реакции, в результате которых из одного сложного вещества образуется несколько новых веществ.
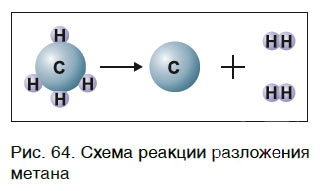
Для начала реакции разложения обычно необходимо нагреть исходные вещества. Например, негашеную известь CaO в промышленности получают нагреванием известняка CaCO3, реакция разложения происходит при температуре около 1000 °С. К такому типу реакций относится и реакция разложения метана CH4 (рис. 64) — составной части природного газа:
Реакции замещения
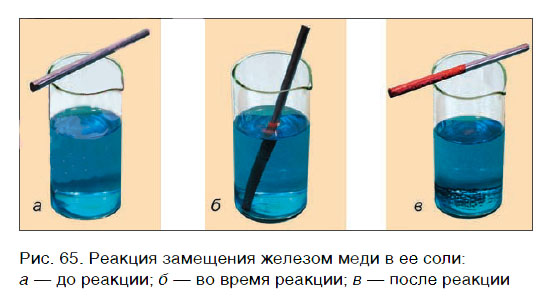
А могут ли взаимодействовать между собой два вещества: одно простое и одно сложное? Проверим это на опыте. В раствор медного купороса опустим небольшой кусочек железа — кнопку, гвоздь, канцелярскую скрепку с хорошо очищенной поверхностью. Через 2—3 мин извлечем железо из раствора и увидим, что на его поверхности образовался темно-красный налет меди. В химическую реакцию вступили простое (Fe) и сложное (CuSO4) вещества, и образовались новое простое (Cu) и новое сложное (FeSO4) вещества:
Из опыта и уравнения химической реакции хорошо видно, что атомы железа заместили атомы меди в сложном веществе (рис. 65). Такие химические реакции относятся к реакциям замещения.
Реакции замещения — это реакции, в результате которых атомы простого вещества замещают атомы одного из элементов в сложном веществе.
Для протекания таких реакций необходимо соблюдать некоторые особые условия. Не все простые вещества обязательно должны взаимодействовать со сложными веществами. В дальнейшем при изучении химии вы познакомитесь с этими условиями, а также с другими типами химических реакций.
Краткие выводы урока:
Надеюсь урок 13 «Типы химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Общие сведения
Все вещества принято разделять на два вида. Химические тела, образованные атомами одного химического реагента, называют простыми. Например, железо, в состав которого входят молекулы, образованные атомами Fe. Тела, состоящие из атомов разных элементов, относят к сложному виду — например, серная кислота. Состоит H2SO4 из молекул, образующихся атомами водорода, серы и кислорода.
В процессе химических взаимодействий новые вещества получаются только из тех атомов, которые имелись в исходном состоянии. Для того чтобы понять, по каким признакам происходит классификация химических реакций, следует рассмотреть несколько уравнений.
Медь, взаимодействуя с кислородом, образует оксид меди два: 2Cu + O2 — 2CuO. При смешении сульфата меди и гидроксида натрия образуется синий гидроксид меди и сульфат натрия: CuSO4 + 2NaOH — Cu (OH)2 + Na2SO4. Оксид гидраргиума распадается на двухвалентный кислород и ртуть: 2HgO — 2Hg + O2. Кальций, соединяясь с углекислым газом, образует карбонат: CaO +CO2 — CaCO3. Цинк при смешении с серной кислотой вытесняется ею: Zn + H2SO4 — ZnSO4 + H2, гидроксид железа распадается на трёхвалентное железо и воду: 2Fe (OH) — Fe2O3 + 3H2O.
Таким образом, различные реакции можно объединить в группы по количеству, составу и качеству исходных веществ и продуктов. Всего их существует четыре вида:
Впервые высказал предположение о классификации реакций Д. И. Менделеев. Судить об их прохождении можно по изменению цвета, выпадению осадка, выделению газа, образованию свечения.
Механизмы взаимодействия
Протекание реакций замещения в органической химии описывают механизмами. Под ними понимают процесс детального изучения всех стадий и промежуточных веществ, а также природы взаимодействия реагентов между собой. Ими описывают характер разрыва связей и изменение энергии при переходе из начального состояния в конечное.
Механизмы замещения характеризуют по наиболее часто используемой классификации Ингольда, основоположником многих понятий органической химии. По его таблице, реакцию замещения (S) разделяют по составу частиц входящих во взаимодействия. Она бывает:
Это удобная классификация, хотя они и не учитывает молекулярность соединений. Её альтернативной является разделение по Июпаку. Оно реже используется и основано на описании базовых актов создания и уничтожения связей. Предложена классификация была в 1988 году. Июпак утверждал, что использование классификации Ингольда вызывает двусмысленные ситуации, когда одно объяснение может использоваться для разного замещения, например, одностадийного ароматического замещения и двустадийной реакции алифатического атома углерода.
В его описании используются символы A и D, пишущиеся слитно при отщеплении и разделенные плюсом, если стадии происходят отдельно. Нижние индексы обозначают тип реакции. Такое описание обычно громоздкое, поэтому в учебной литературе редко когда приводится.
Электрофильные и нуклеофильные
Самое важное, что нужно знать об электрофильных реакциях, это то, что существует два варианта разрыва связи: монополярная и гетерополярная. В первом случае электронная пара разрушающегося соединения не разрывает связь с атомом углерода. Например, вещество, для которого характерна реакция замещения, метан: H3CH — H3C +H, то есть из предельного углеводорода образуется отрицательно заряженный карбанион, а электронная пара остаётся у атома углерода.
Карбанионы могут быть разной гибридизации sp2 и sp3. Чем больше их устойчивость, тем у них ниже способность к реакциям. Определяется она степенью делокализации заряда у атома углерода. Устойчивость уменьшается в ряду: фенил — винил — циклопропил — метил. Самая слабая у вторичного и третичного карбаниона (разделение происходит по количеству связей углерода).
Нуклеофильная реакция будет протекать при разрушении углеродной связи. В этом случае электронная пара отсоединяется. Образуется углеродный ион с положительным зарядом. Формула записи будет соответствовать виду: H3C: Cl — H3C+: Cl-. Образуемый элемент носит название карбкатион. Электронная пара теряет атом углерода. Положительный заряд находится в sp2-гибридизации, то есть, меняет своё валентное состояние на более энергетически выгодное. Устойчивость карбкатионов определяется степенью делокализации. Она увеличивается в ряду метил — катион — первичный — вторичный — третичный.
Радикальные реакции
Затормозить свободнорадикальные реакции можно ингибиторами или инициаторами, так как они очень реакционноспособные частицы. В качестве ингибиторов выступает кислород, йод, полифенол, амин и другие соединения. Есть два способа появления радикалов:
Устойчивое состояние определяется делокализацией свободной частицы, пространственным и конформационным фактором. К первичным радикалам относят: метилы, этилы, пропилы и изобутилы. К вторичным — изопропилы, втор-бутилы, а к третичным — трет-бутилы. Стабилизация возрастает от первичных к третичным.
Наиболее типичным механизмом является реакция замещения хлорирования метана:
CH 4 + Cl 2 — CH3Cl + HCl.
При радикальном замещении происходит следующее:
К более серьёзным реакциям относится взаимодействие брома с пропаном в результате термолиза: CH3CH2CH3 + Br2 — CY3CHCH3: Br + HBr. При обрыве цепи, после взаимодействия двух радикалов, образуется молекула брома. Реакция радикала с изопропилом приводит к появлению двух бром пропан, а также образованию соединение «два, три диметилбутан».
Взаимодействие с галогенами зависит от их расположения и соответствует следующему: F2 > Cl2 > Br2 > I2. С йодом реакция уже не идёт.
Типичное замещение
Различные задания на определение типа реакций начинают решать в восьмом классе. Для того чтобы решать задачи, необходимо не только правильно знать, как записать процесс, но и определить невозможный тип, а также различать вид термического процесса. Ведь протекание любой химической реакции невозможно без поглощения или выделения тепла. Такие процессы соответственно называются экзотермическими и эндотермическими.
К особенностям элементов, способных участвовать в реакции, относят:
Все эти элементы могут вступать в реакцию с образованием простого или сложного нового вещества. Во время процесса образуются новые соединения. Это происходит до тех пор, пока не иссякнут все свободные радикалы.
Примеры и онлайн-решения
Реакции замещения в своём большинстве являются окислительно-восстановительными. Примеры процессов, в которых не наблюдается изменение степени окисления, немногочисленны.
Из распространённых реакций, можно привести следующие:
Для проверки своих знаний существуют интернет-сервисы, позволяющие быстро решить любое химическое уравнение онлайн, например, chemequations.com. Пользоваться им сможет любой, даже тот, кто не умеет правильно указать обозначения химических элементов. Для работы с сайтом необходимо написать части соединения (система будет сама предлагать правильное их обозначение) и нажать «Поиск». Правильное решение будет рассчитано автоматически.
Классификация химических реакций в неорганической и органической химии
Теория к заданию 19 из ЕГЭ по химии
Классификация химических реакций в неорганической и органической химии
Химические реакции, или химические явления, — это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению.
При химических реакциях обязательно происходит изменение веществ, при котором рвутся старые и образуются новые связи между атомами.
Химические реакции следует отличать от ядерных реакций. В результате химической реакции общее число атомов каждого химического элемента и его изотопный состав не меняются. Иное дело ядерные реакции — процессы превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами, например, превращение алюминия в магний:
Классификация химических реакций многопланова, т.е. в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Рассмотрим классификацию химических реакций по различным признакам.
Классификация химических реакций по числу и составу реагирующих веществ. Реакции, идущие без изменения состава вещества
В неорганической химии к таким реакциям можно отнести процессы получения аллотропных модификаций одного химического элемента, например:
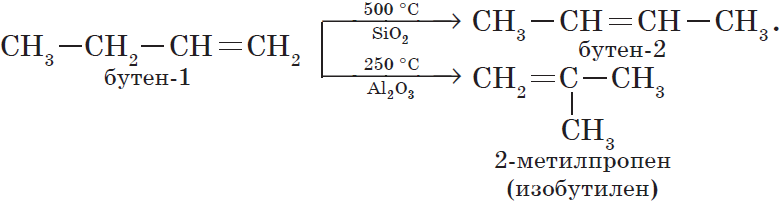
В органической химии к этому типу реакций могут быть отнесены реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например:
1. Изомеризация алканов.
Реакция изомеризации алканов имеет большое практическое значение, т.к. углеводороды изостроения обладают меньшей способностью к детонации.
2. Изомеризация алкенов.
3. Изомеризация алкинов (реакция А. Е. Фаворского).
4. Изомеризация галогеналканов (А. Е. Фаворский).
5. Изомеризация цианата аммония при нагревании.
Впервые мочевина была синтезирована Ф. Велером в 1882 г. изомеризацией цианата аммония при нагревании.
Реакции, идущие с изменением состава вещества
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
1. Реакции соединения — это такие реакции, при которых из двух и более веществ образуется одно сложное вещество.
В неорганической химии все многообразие реакций соединения можно рассмотреть на примере реакций получения серной кислоты из серы:
1) получение оксида серы (IV):
$S+O_2=SO_2$ — из двух простых веществ образуется одно сложное;
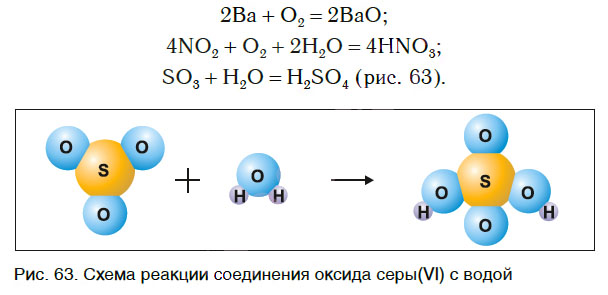
2) получение оксида серы (VI):
3) получение серной кислоты:
$SO_3+H_2O=H_2SO_4$ — из двух сложных веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты:
В органической химии реакции соединения принято называть реакциями присоединения. Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
1) реакция гидрирования — присоединение водорода:
2) реакция гидратации — присоединение воды:
3) реакция полимеризации:
2. Реакции разложения — это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
В неорганической химии все многообразие таких реакций можно рассмотреть на примере блока реакций получения кислорода лабораторными способами:
1) разложение оксида ртути (II):
$2HgO<→>↖
2) разложение нитрата калия:
$2KNO_3<→>↖
3) разложение перманганата калия:
$2KMnO_4<→>↖
В органической химии реакции разложения можно рассмотреть на примере блока реакций получения этилена в лаборатории и промышленности:
1) реакция дегидратации (отщепления воды) этанола:
2) реакция дегидрирования (отщепления водорода) этана:
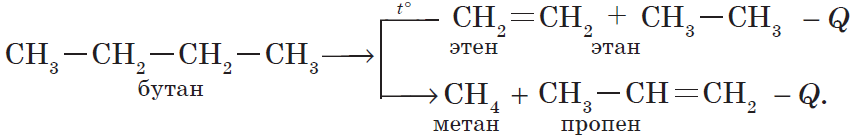
3) реакция крекинга (расщепления) пропана:
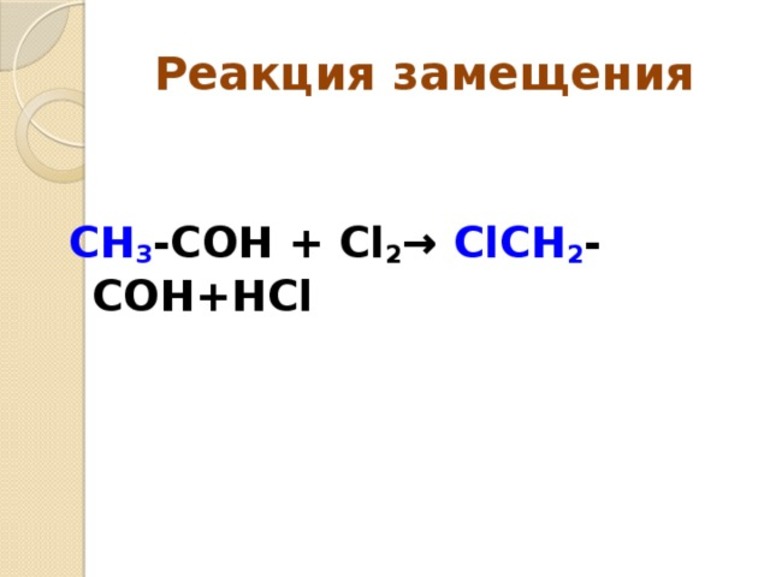
3. Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы какого-либо элемента в сложном веществе.
В неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
1) взаимодействие щелочных и щелочноземельных металлов с водой:
2) взаимодействие металлов с кислотами в растворе:
3) взаимодействие металлов с солями в растворе:
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, — способность его атомов водорода замещаться на атомы галогена:
Другой пример — бромирование ароматического соединения (бензола, толуола, анилина):
Обратим внимание на особенность реакций замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещества, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например, нитрование бензола:
Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
4. Реакции обмена — это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
В неорганической химии это может быть блок реакций, характеризующих, например, свойства щелочей:
1) реакция нейтрализации, идущая с образованием соли и воды:
2) реакция между щелочью и солью, идущая с образованием газа:
3) реакция между щелочью и солью, идущая с образованием осадка:
В органической химии можно рассмотреть блок реакций, характеризующих, например, свойства уксусной кислоты:
2) реакция, идущая с образованием газа:
3) реакция, идущая с образованием осадка:
Классификация химических реакций по изменению степеней окисления химических элементов, образующих вещества
Реакции, идущие с изменением степеней окисления элементов, или окислительно-восстановительные реакции.
К ним относится множество реакций, в том числе все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество, например:
Как вы помните, сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса:
В органической химии ярким примером окислительно-восстановительных реакций могут служить свойства альдегидов:
1. Альдегиды восстанавливаются в соответствующие спирты:
2. Альдегиды окисляются в соответствующие кислоты:
Реакции, идущие без изменения степеней окисления химических элементов.
К ним, например, относятся все реакции ионного обмена, а также:
Классификация химических реакций по тепловому эффекту
По тепловому эффекту реакции делят на экзотермические и эндотермические.
Эти реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота (II) из азота и кислорода и реакция газообразного водорода с твердым иодом:
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения, например:
Гидрирование этилена — пример экзотермической реакции:
Она идет при комнатной температуре.
Эндотермические реакции
Эти реакции протекают с поглощением энергии.
Очевидно, что к ним относятся почти все реакции разложения, например:
а) обжиг известняка:
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например:
Классификация химических реакций по агрегатному состоянию реагирующих веществ (фазовому составу)
Это реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах):
Это реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе):
Классификация химических реакций по участию катализатора
Некаталитические реакции идут без участия катализатора:
Каталитические реакции идут с участием катализатора:
Так как все биологические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы — ферментов, все они относятся к каталитическим или, точнее, ферментативным.
Классификация химических реакций по направлению
Необратимые реакции протекают в данных условиях только в од ном направлении.
К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды), и все реакции горения.
Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия-антонимы процессов:
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость лежит в основе важнейшего процесса в живом организме — обмена веществ.
Что такое реакция замещения кратко
Классификацию органических реакций проводят на основе общих для всех реакций признаков: строение и состав исходных и конечных продуктов; изменение степеней окисления реагирующих частиц; тепловой эффект реакции; ее обратимость и т.п.
Наиболее часто органические реакции классифицируют по следующим признакам:
· по конечному результату реакции (на основе сопоставления строения исходных и конечных продуктов);
· по минимальному числу частиц, участвующих в элементарной реакции;
· по механизму разрыва ковалентных связей в реагирующих молекулах.
Тип многостадийных реакций определяют по самой медленной (лимитирующей) стадии. Различные способы классификации часто сочетаются друг с другом.
1. Классификация реакций по конечному результату
В основе этой классификации лежит сопоставление числа, состава и строения исходных и конечных продуктов по уравнению реакции. В соответствии с конечным результатом различают следующие типы органических реакций:
Если процесс сопровождается изменением степени окисления атома углерода в органическом соединении, то выделяют также реакции окисления и восстановления. Окисление и восстановление органических веществ может проходить по какому-либо из названных выше типов реакций.
Атом или атомная группировка в молекуле органического соединения замещается на другой атом (или атомную группировку):
Реакции этого типа можно рассматривать как реакции обмена, но в органической химии предпочтительней термин «замещение», поскольку в обмене участвует (замещается) лишь меньшая часть органической молекулы.
C2H6 + Cl2 (на свету) → CH 3 CH 2 Cl + HCl хлорирование этана
CH 3 CH 2 Cl + KOH (водн. р-р) → CH 3 CH 2 OH + KCl щелочной гидролиз хлорэтана
В реакциях присоединения молекула органического соединения и молекула простого или сложного вещества соединяются в новую молекулу, при этом другие продукты реакции не образуются:
К реакциям присоединения относятся также реакции полимеризации:
В реакции отщепления (элиминирования) происходит отрыв атомов или атомных групп от молекулы исходного вещества при сохранении ее углеродного скелета.
· отщепление хлороводорода (при действии на хлоралкан спиртовым раствором щёлочи)
· отщепление воды (при нагревании спирта с серной кислотой)
CH3-CH2OH → CH 2 =CH 2 + H 2 O дегидратация этанола
· отщепление водорода от алкана (в присутствии катализатора)
Реакции изомеризации или перегруппировки
В органическом соединении происходит переход (миграция) отдельных атомов или групп атомов от одного участка молекулы к другому без изменения ее качественного и количественного состава:
В этом случае исходное вещество и продукт реакции являются изомерами (структурными или пространственными).
Например, в результате перегруппировки может изменяться углеродный скелет молекулы:
В результате реакции разложения из молекулы сложного органического вещества образуется несколько менее сложных или простых веществ:
К этому типу реакций относится процесс крекинга – расщепление углеродного скелета крупных молекул при нагревании и в присутствии катализаторов:
Реакции разложения при высокой температуре называют пиролизом, например:
СН4 → C + 2H2 пиролиз метана (1000 o C)
Реакции окисления и восстановления
Если атом углерода в органической молекуле окисляется (отдает электроны более электроотрицательному атому), то этот процесс относят к реакциям окисления, т.к. продукт восстановления окислителя (обычно неорганическое вещество) не является конечной целью данной реакции. И наоборот, реакцией восстановления считают процесс восстановления атома углерода в органическом веществе.
Часто в органической химии ограничиваются рассмотрением реакций окисления и восстановления как реакций, связанных с потерей и приобретением атомов водорода и кислорода.
Вещество окисляется, если оно теряет атомы H и (или) приобретает атомы O. Кислородсодержащий окислитель обозначают символом [O]:
Вещество восстанавливается, если оно приобретает атомы H и (или) теряет атомы O. Восстановитель обозначают символом [H]:
Классификация реакций по числу частиц, участвующих в элементарной стадии
По этому признаку все реакции можно разделить на диссоциативные (мономолекулярные) и ассоциативные (бимолекулярные, тримолекулярные).
· Мономолекулярные реакции – реакции, в которых участвует только одна молекула (частица):
К этому типу относятся реакции распада и изомеризации. Процессы электролитической диссоциации также соответствуют этому типу, например:
Это самый распространенный тип элементарных реакций.
· Тримолекулярные реакции – реакции типа
в которых происходит столкновение трех молекул.
Тримолекулярные реакции встречаются довольно редко. Одновременное соударение большего числа частиц маловероятно.
Классификация реакций по механизму разрыва связей
В зависимости от способа разрыва ковалентной связи в реагирующей молекуле органические реакции подразделяются нарадикальные и ионные реакции. Ионные реакции в свою очередь делятся по характеру реагента, действующего на молекулу, наэлектрофильные и нуклеофильные.
Разрыв ковалентной связи может происходить двумя способами, обратными механизмам ее образования.
Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим:
В результате гомолитического разрыва образуются сходные по электронному строению частицы, каждая из которых имеет неспаренный электрон. Такие частицы называются свободными радикалами.
Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим:
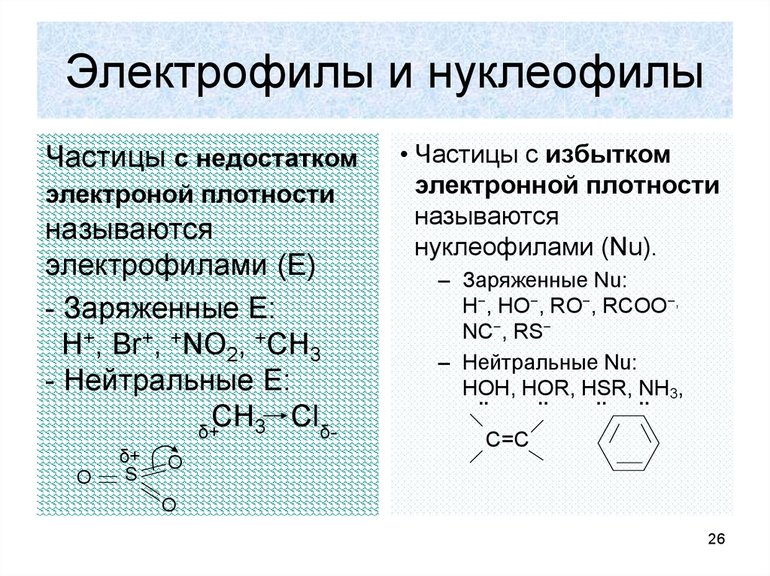
Электрофильной называется реакция, в которой молекула органического вещества подвергается действию электрофильного реагента.
Электрофильные («любящие электроны») реагенты или электрофилы – это частицы (катионы или молекулы), имеющие свободную орбиталь на внешнем электронном уровне.
CH2=CH2 + HCl → CH3CH2Cl (электрофил – H + в составе HCl)
Механизм электрофильного присоединения обозначается символом AdE (по первым буквам английских терминов: Ad – addition [присоединение], E – electrophile [электрофил]).
Катион NO2 + образуется в смеси конц. кислот HNO3 и H2SO4.
Обозначение механизма – SE (S – substitution [замещение]).
Нуклеофильной называется реакция, в которой молекула органического вещества подвергается действию нуклеофильного реагента.
Строение некоторых нуклеофильных реагентов
Благодаря подвижности π-электронов, нуклеофильными свойствами обладают также молекулы, содержащие π-связи:
(Между прочим, это объясняет, почему этилен CH2=CH2 и бензол C6H6, имея неполярные углерод-углеродные связи, вступают в ионные реакции с электрофильными реагентами).
Примеры нуклеофильных реакций
Механизм нуклеофильного замещения обозначается символом SN (по первым буквам английских терминов: S – substitution [замещение], N – nucleophile [нуклеофил]).
Обозначение механизма – AdN (Ad – addition [присоединение]).