Что такое ренатурация белка биология 9 класс
Свойства и функции белков
Основные свойства белков
Структура и свойства белков могут изменяться под влиянием разных физико-химических факторов: действие концентрированных кислот и щелочей, тяжелых металлов, изменение температуры и т. п. Одни из белков легко изменяют структуру под незначительным действием разнообразных факторов, другие – стойкие к подобным влияниям. Основные свойства белка это – денатурация, ренатурация, деструкция.
Денатурация
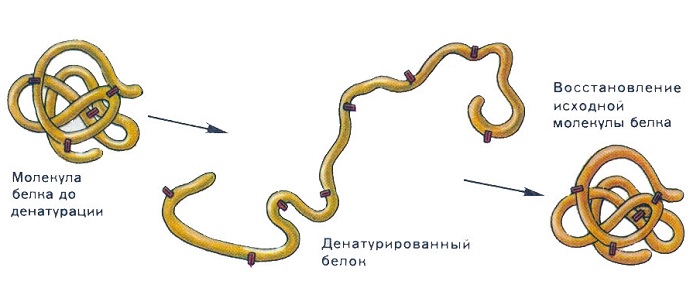
Денатурация – это процесс нарушения естественной структуры белка с сохранением пептидных связей (первичной структуры). Может быть необратимым процессом. Но при условии прекращения действия отрицательных факторов на первых стадиях белок может восстанавливать свое нормальное состояние, то есть происходит обратная денатурация – ренатурация.
Ренатурация
Ренатурация – это способность белка восстанавливать нормальную структуру после устранения действия отрицательных факторов. Выполнение некоторых функций – двигательной, сигнальной, каталитической и т. п. – у живых организмов связано с частичной обратной денатурацией белков.
Деструкция
Деструкция – это процесс разрушения первичной структуры белка. Является всегда процессом необратимым.
Функции белков
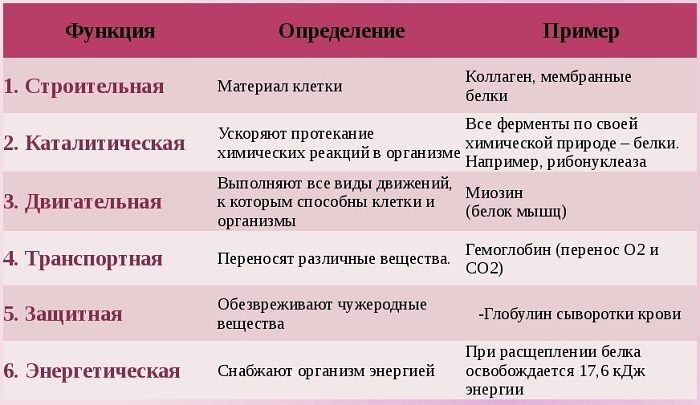
Белки выполняют следующие основные функции:
Некоторые организмы, живущие в горячих условиях, имеют белки, которые не денатурируют даже при температуре +50…90 °С.
Некоторые белки образуют сложные комплексы с пигментами, нуклеиновыми кислотами.
Презентация по биологии «Состав и строение белков» (9 класс)
Онлайн-конференция
«Современная профориентация педагогов
и родителей, перспективы рынка труда
и особенности личности подростка»
Свидетельство и скидка на обучение каждому участнику
Выбранный для просмотра документ Урок 7 Состав и строение белковt.ppt
Описание презентации по отдельным слайдам:
Д/З Вопросы с. 27 § 1.4, рт 20, 21,22
Белки ( протеины, т. е. первые ) – на их долю приходится 50 – 80% сухой массы клетки; Молекулы белков имеют большие размеры → макромолекулы, большую массу → высокомолекулярные соединения Мономерами белков являются аминокислоты ( их всего – 20 )
Н2N ──── CH ──── COOH Аминогруппа Карбоксильная (основные (кислотные свойства ) свойства) R ( радикал ) ( у всех аминокислот разный, придаёт каждой аминокислоте индивидуальные свойства) Оодинаковы у всех
1.Как называется связь, образующаяся между а/к? ( пептидная) 2.Между какими химическими элементами образуется пептидная связь? (С- одной а/к, N – второй а/к) 3.Что является побочным продуктом взаимодействия а/к? (вода) 4.Как можно ещё назвать молекулу белка? (полипептид)
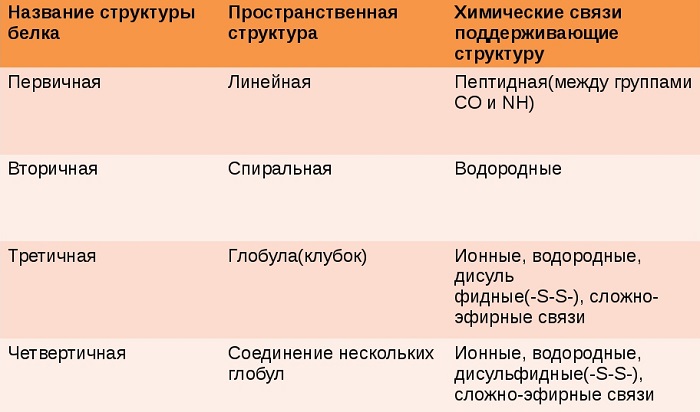
1.Первичная – цепочка последовательно расположенных а/к, связанных пептидными связями. Особенность структуры: уникальна для каждого белка
2.Вторичная – цепочка а/к закрученная в виде спирали, она образуется благодаря установлению водородных связей межу группами СО и NH, двух аминокислот, расположенных на разных витках спирали.
3.Третичная ( глобула ) – Трёхмерная упаковка полимерной цепочки, которая образуется благодаря разнообразным связям между радикалами аминокислот. Особенность структуры: в состоянии глобулы молекула приобретает биологическую активность
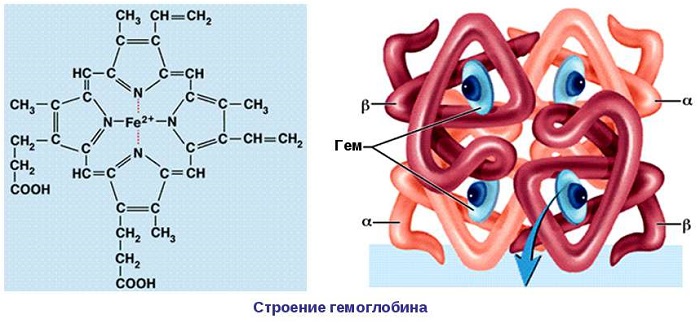
4.Четвертичная – объединение макромолекул с третичной структурой в сложный комплекс Особенность структуры: характерна не для всех белков, но гемоглобин только в такой форме может присоединять и транспортировать кислород.
1.Простые ( протеины ) – состоят только из аминокислот Примеры: иммуноглобулин, фибрин, трипсин 2.Сложные А) Б+У= гликопротеиды Б) Б+Ж= липопротеиды В) Б+НК= нуклеопротеиды
Денатурация – утрата белковой молекулой своей структурной организации. Причины: 1.изменение температуры 2.обезвоживание 3.облучение Ренатурация – процесс восстановления структуры денатурированного белка. Особенность: ренатурация возможна только если не разрушена первичная структура белка.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
Ищем педагогов в команду «Инфоурок»
Номер материала: ДБ-414540
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Школьники из Москвы выступят на Международной олимпиаде мегаполисов
Время чтения: 3 минуты
МГУ откроет первую в России магистерскую программу по биоэтике
Время чтения: 2 минуты
Время чтения: 2 минуты
Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута
Путин поручил не считать выплаты за классное руководство в средней зарплате
Время чтения: 1 минута
В Оренбурге школьников переведут на дистанционное обучение с 9 декабря
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Структура белка необычайно важна для соединений, так как все функции они выполняют, принимая определённую пространственную конфигурацию.
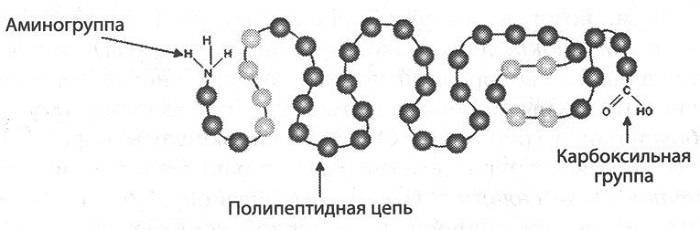
Белки – это природные полимеры, молекулы которых состоят из остатков аминокислот, соединенных амидными (пептидными) связями.
Мономерами для образования макромолекулы служат α-аминокислоты. Это соединения, содержащие аминогруппу у первого атома углерода, не считая углерод карбоксильной группы.
Таких аминокислот известно 20. Из этого количества создаётся всё многообразие белков. Некоторые аминокислоты могут образовываться в организме, их называют заменимыми. Те, которые поступают только с пищей – незаменимые. В зависимости от состава, белки делят на полноценные, содержащие незаменимые аминокислоты, и неполноценные, не содержащие незаменимые аминокислоты.
Состав, строение и функции белков очень сложные, изучает эти вопросы биология. Рассматриваются природные полимеры и в курсе химии. Состав их можно выразить формулой:
В природные полимеры входят химические элементы: углерод, кислород, водород, азот, сера. В состав некоторых соединений включены фосфор, селен железо, медь и прочие элементы.
Первичная структура белка
Последовательно соединенные друг с другом аминокислотные остатки в цепь образуют первичную структуру. Цепь образована пептидной химической связью. Этот уровень организации самый важный. Случайная замена одной аминокислоты вызывает тяжелое генетическое заболевание.
Белковые молекулы образуются в процессе биосинтеза на рибосомах. Здесь реализуется наследственная информация. Последовательность аминокислотных остатков определяется последовательностью нуклеотидов в и-РНК. Зависимость триплетов и аминокислот записана в таблице генетического кода.
Если первичный уровень организации белка задаётся правильно, остальные структуры макромолекула принимает самопроизвольно.
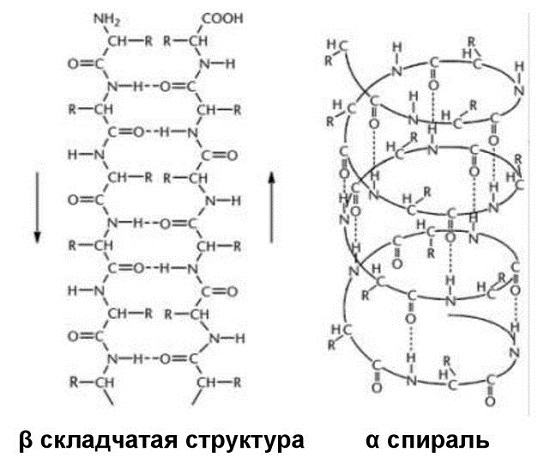
Вторичная структура белка
Свёрнутая в спираль одна или 2 полипептидные цепи образуют вторичную структуру. Её поддерживают водородные связи.
Большинство белковых молекул имеют вторичный уровень.
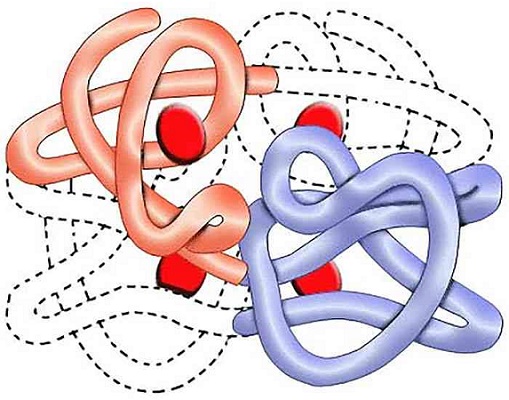
Третичная структура белка
Упаковка вторичной структуры в клубок образует третичный уровень организации.
Поддерживают данную структуру дисульфидные, солевые, сложноэфирные мостики, силы электростатического взаимодействия.
Четвертичная структура белка
Некоторые белковые единицы формируют сложные агрегаты в пространстве. Несколько упакованных в клубок белков, ориентированных относительно друг друга, создают четвертичную структуру.
Удерживаются такие агрегаты водородными связями, электростатическими и прочими взаимодействиями.
Денатурация и ренатурация белка
Природные соединения проявляют разные свойства. Одно из важнейших свойств – денатурация белка. Это разрушение пространственной организации белковых молекул. Последовательность соединения аминокислот, а значит и химический состав, не изменяется.
Пространственная конфигурация может разрушаться в результате действия разных факторов:
солей тяжёлых металлов;
механических и иных факторов.
Если первичный уровень организации белка не нарушен, может идти обратная реакция – ренатурация. Это восстановление пространственного строения молекулы. Не все природные полимеры способны к восстановлению пространственной организации.
Иногда денатурация протекает необратимо, хотя первичная структура не разрушается. Функции белки способны выполнять, находясь в определенной пространственной конфигурации.
Протеины – простые белки
К простым белкам относят высокомолекулярные соединения, состоящие только из остатков аминокислот. В них содержатся незаменимые и заменимые аминокислоты.
Протеины применяются в спортивной среде для восполнения белковой массы в организме. Используют протеиновый порошок для приготовления коктейля, в качестве добавки к пище.
Протеиновый порошок получают в результате переработки продуктов животного происхождения: молока, мяса, яиц, рыбы. Организм будет получать протеины, если просто употреблять в пищу указанные продукты. Усвоение их будет идти медленнее.
Протеиды – сложные белки
Сложными называют белки, содержащие небелковые по природе вещества. Так называемые простетические группы.
В соответствии с химическим составом и наличием групп их классифицируют:
гликопротеиды и другие.
В состав протеидов входят элементы: магний, железо, медь и другие. Примером протеидов являются гемоглобин и миоглобин. Они выполняют важнейшие функции, принимают участие в обменных процессах.
Функции белков
Белки выполняют в клетках организмов важные функции:
Что такое ренатурация белка биология 9 класс
5.5.5. Денатурация и ренатурация белков
Под денатурацией подразумевают утрату трехмерной конформации, присущей данной белковой молекуле. Это изменение может носить временный или постоянный характер, но и в том и в другом случае аминокислотная последовательность белка остается неизменной. При денатурации молекула развертывается и теряет способность выполнять свою обычную биологическую функцию. Вызывать денатурацию белков могут следующие разнообразные факторы.
Нагревание или воздействие каких-либо излучений, например инфракрасного или ультрафиолетового. Кинетическая энергия, сообщаемая белку, вызывает сильную вибрацию его атомов, вследствие чего слабые водородные и ионные связи разрываются. Белок свертывается (коагулирует).
Сильные кислоты, сильные щелочи и концентрированные растворы солей. Ионные связи разрываются, и белок коагулирует. Длительное воздействие реагента может вызвать разрыв и пептидных связей.
Тяжелые металлы. Катионы образуют прочные связи с карбоксил-анионами и часто вызывают разрывы ионных связей. Они также снижают электрическую поляризацию белка, уменьшая его растворимость. Вследствие этого находящийся в растворе белок выпадает в осадок.
Органические растворители и детергенты. Эти реагенты нарушают гидрофобные взаимодействия и образуют связи с гидрофобными (неполярными) группами. В результате разрываются и внутримолекулярные водородные связи. Использование спирта в качестве дезинфицирующего средства основано именно на том, что он вызывает денатурацию белка любых присутствующих бактерий.
Ренатурация
Иногда денатурированный белок в подходящих условиях вновь спонтанно приобретает свою нативную структуру. Этот процесс называется ренатурацией. Ренатурация убедительно показывает, что третичная структура белка полностью определяется его первичной структурой и что сборка биологических объектов может осуществляться на основе немногих общих принципов.
Что такое ренатурация белка биология 9 класс
Подробное решение параграф §8 по биологии для учащихся 10 класса, авторов Теремов А.В., Петросова Р.А. Углубленный уровень 2017
Рассмотрите рис. 33. Какие структуры белковой молекулы разрушаются при денатурации?
Степень денатурации зависит от интенсивности воздействующего фактора и может быть обратимой и необратимой. Необратимая денатурация происходит под воздействием различных химических веществ (концентрированных растворов кислот, щелочей, солей тяжёлых металлов), высоких температур, радиоактивного излучения. При этом разрушаются все структуры белка, изменяются электрические заряды его молекул, что приводит к их слипанию и сворачиванию. При температуре выше 40–50 °С многие белки сворачиваются, т. е. денатурируют необратимо. Соли лёгких металлов и разбавленные растворы кислот и щелочей вызывают обратимую денатурацию, и при снятии фактора воздействия белок восстанавливает свои свойства и функции.
1. Что такое денатурация белка? В какой последовательности при денатурации идёт разрушение структур белка? Что такое ренатурация?
Изменение структуры и потеря белком его природных свойств и структуры под воздействием каких — либо факторов называется денатурацией. Сначала разрушается слабая водородная связь в четвертичной стадии белка, далее она переходит в третичную (имеет форму глобулы), потом в двоичную (спиралевидная молекула с водородными связями) и наконец в первичную (просто цепочка с очень прочными пептидными связями).
Процесс, обратный денатурации, называют ренатурацией. Восстановление белка можно наблюдать только в том случае, если изменения не затронули его первичную структуру
2. Ионы тяжёлых металлов (ртути, мышьяка, свинца) легко вступают в реакцию с серой, образуя сульфиды. Объясните, что произойдёт с белком при взаимодействии с этими металлами. По каким связям идёт взаимодействие?
Необратимая денатурация происходит под воздействием различных химических веществ (концентрированных растворов кислот, щелочей, солей тяжёлых металлов), высоких температур, радиоактивного излучения. При этом разрушаются все структуры белка, изменяются электрические заряды его молекул, что приводит к их слипанию и сворачиванию. Разрушаются дисульфидные мостики (третичная структура), идёт взаимодействие c серосодержащими аминокислотными фрагментами
3. Почему соли тяжёлых металлов являются ядами для организма?
Большинство биоорганических веществ (белки, нуклеиновые кислоты) содержат электронно — донорные группы, включающие азот, серу, кислород. Эти группы образуют водородные связи, формирующие третичную структуру белка. Тяжелые металлы, взаимодействуя с этими группами, разрушают водородные связи в молекулах белков и нарушают третичную белковую структуру. Изменяются биологические свойства вещества (активность, транспортные свойства, процессы транскрипции и трансляции нуклеиновых кислот). В этом заключается канцерогенное и мутагенное действие тяжелых металлов.
4. Определите функции следующих белков: коллагена сухожилия, яичного альбумина, инсулина поджелудочной железы, кератина волос, тромбина крови, фиброина паутины, пепсина желудочного сока, гемоглобина, миоглобина.
коллаген сухожилия: двигательная
яичный альбумин: защитная
инсулин поджелудочной железы: ферментативная
кератин волос: строительная
тромбин крови: защитная
фиброин паутины: строительная
пепсин желудочного сока: ферментативная
5. При окислении 1 г белков выделяется столько же энергии, сколько при окислении 1 г углеводов. Почему организм использует белки как источник энергии только в крайних случаях? Ответ поясните.
Функции белков –строительная, ферментативная, транспортная, и только в крайних случаях организм использует или тратит белки на получение энергии, только тогда, когда в организм не поступают углеводы и жиры, когда организм голодает.
6. Какие виды денатурации белка вам известны? Какие факторы вызывают денатурацию? Перечертите в тетрадь и заполните таблицу.
7. Внесите в таблицу «Химический состав клетки» (см. ст. 41) сведения о белках.