Что такое репаративный процесс
Факторы риска замедленного течения репаративных процессов после деструктивного вмешательства на покровных тканях стопы

В статье обобщены сведения о заболеваниях и состояниях, оказывающих влияние на процессы нормального заживления после деструктивных вмешательств на покровных тканях стопы, представлены современные данные литературы, посвященные этим вопросам.
Abstract. The article summarizes information about diseases and conditions that affect the processes of normal healing after destructive interventions on the integumentary tissues of the foot, presents modern literature data on these issues. An inadequate assessment of the patient’s condition before a planned destructive intervention on the lower extremities can lead to a long-term non-healing wounds and dysfunction of the extremity. A destructive intervention requires attention to a number of diseases and conditions that affect normal healing processes, such as diabetes mellitus, metabolic syndrome, and immunodeficiency. Particular attention is paid to the assessment of the consistency of the blood flow of the lower extremities because chronic arterial insufficiency is one of the most significant reasons for the slow reparative processes in the foot area. The authors present their own clinical observation that illustrates the absence of normal regeneration in conditions of hyperglycemia and chronic arterial disease of the lower limbs. For citation: Kubanov A. A., Murakhovskaya E. K., Komarov R. N., Dzyundzya A. N., Vinokurov I. A. Risk factors for a delayed course of reparative processes after destructive intervention on the integumentary tissues of the foot // Lechaschy Vrach. 2021; 8 (24): 57-61. DOI: 10.51793/OS.2021.24.8.010
Резюме. В статье обобщены сведения о заболеваниях и состояниях, оказывающих влияние на процессы нормального заживления после деструктивных вмешательств на покровных тканях стопы, представлены современные данные литературы, посвященные этим вопросам. Неадекватная оценка состояния пациента перед проведением планового деструктивного вмешательства на нижних конечностях может привести к формированию длительно незаживающего раневого дефекта и нарушению функции конечности. Проведение деструктивного вмешательства требует настороженности в отношении ряда заболеваний и состояний, влияющих на процессы нормального заживления, таких как сахарный диабет, метаболический синдром, иммунодефицит. Особое внимание в статье уделено оценке состоятельности кровотока нижних конечностей в связи с тем, что хроническая артериальная недостаточность является одной из наиболее значимых причин замедленного течения репаративных процессов в области стоп. Представлено собственное клиническое наблюдение, иллюстрирующее отсутствие нормальной регенерации в условиях гипергликемии и хронической артериальной недостаточности нижних конечностей.
Cогласно профессиональному стандарту врача-дерматовенеролога необходимым умением при оказании первичной специализированной медико-санитарной помощи в амбулаторных условиях является проведение электрокоагуляции, криодеструкции и лазерной деструкции ткани кожи [1].
Перед проведением планового деструктивного вмешательства на нижних конечностях врач-дерматовенеролог, осматривающий пациента, должен уметь выявить значимые симптомы сопутствующих заболеваний, способных повлиять на процессы последующего заживления. Неадекватная оценка состояния пациента может привести к формированию длительно незаживающего раневого дефекта. Нарушение функции конечности влечет за собой временную или стойкую потерю трудоспособности и оказывает значительное влияние на здоровье и качество жизни пациента, а также ведет к повышенным затратам системы здравоохранения на лечение [2].
Скорость и качество заживления после деструктивного вмешательства зависят от таких сопутствующих заболеваний и состояний, как сахарный диабет (СД), иммунодефицит, метаболический синдром, анемии, нефропатии, тромбофилии, атеросклеротическое поражение артерий, характеризующееся нарушением притока артериальной крови, нарушение венозного оттока [2, 3]. При осмотре и обследовании пациента следует обращать внимание на проявления так называемого метаболического синдрома: ожирение, дислипидемию и артериальную гипертензию (АГ), так как их наличие напрямую и опосредованно влияет на кровообращение в нижних конечностях [2, 4]. Гипотиреоз сопровождается атерогенной дислипидемией, гипергомоцистеинемией, способствует развитию атеросклеротического поражения сосудов [5, 6]. Анемия приводит к хронической гипоксемии покровных тканей. Замедляет репаративные процессы дефицит витаминов А, С, Е и цинка. Жесткие диеты и недостаточное потребление белка приводят к снижению синтеза и прочности коллагена [2, 3, 7-9].
По состоянию на 31 декабря 2017 г. в России общая численность пациентов с СД составила 4 498 955 человек (3,06% населения страны) [10]. На фоне СД даже незначительная травматизация может сопровождаться развитием гнойно-некротических осложнений вследствие замедленной эпителизации и склонности к развитию инфекционного процесса. Неправильная лечебная тактика при наличии у пациента диабета может привести к осложненному течению заболевания и ампутации конечности [2, 3, 11].
Факторами риска развития СД 2 типа, которые следует учитывать при сборе анамнеза, являются возраст старше 45 лет, ожирение и избыточная масса тела, низкая физическая активность, наличие СД в семейном анамнезе, АГ, дислипидемия, наличие сердечно-сосудистых заболеваний. Пациента могут беспокоить жажда, полиурия, никтурия, кожный зуд, длительно не поддающиеся лечению пиодермии, грибковые инфекции. Лицам старше 45 лет с избыточной массой тела и наличием одного и более факторов риска диабета рекомендовано проводить определение уровня глюкозы плазмы натощак [4, 11].
При диабете наблюдается макро- и микроангиопатия, образование микротромбов, сладж-феномен; воспалительный компонент доминирует над репаративным. Вследствие гипергликемии базальная мембрана стенок сосудов утолщается, в ней происходит отложение иммунных комплексов. Эндотелиальная дисфункция сосудистой стенки приводит к повышению ее проницаемости для белков плазмы и атерогенных липидов, снижению кровотока и гипоксии тканей. Активация коагуляционного и сосудисто-тромбоцитарного звеньев свертывающей системы крови, снижение антикоагулянтной активности и замедление фибринолиза обусловливают тенденцию к тромбообразованию и также вносят свой вклад в нарушение микрогемодинамики. В условиях гипергликемии восстановление тканей затруднено из-за повышения уровня окислительного стресса, подавления пролиферации фибробластов, снижения синтеза коллагена, повышения активности матриксных металлопротеиназ (ММР-2, 3, 9, 13). При диабете нарушены клеточная пролиферация и высвобождение факторов роста, нарушается иннервация сосудов. Макрофаги, кератиноциты и жировые стволовые клетки секретируют сниженное количество VEGF (фактора роста эндотелия сосудов), в результате чего нарушается ветвление эндотелиальных клеток и ангиогенез. Гипергликемия приводит к снижению миграции нейтрофилов из кровяного русла в очаг повреждения, уменьшению продолжительности жизни нейтрофилов, нарушению фагоцитоза. В результате страдают процессы элиминации патогенных микроорганизмов, обуславливая высокий риск развития гнойных осложнений. У пациентов с СД выявляется генетическая предрасположенность к развитию атеросклероза. Прогрессирование заболеваний артерий нижних конечностей на фоне СД ускоряет развитие критической ишемии нижних конечностей [2, 3, 8, 9, 11, 12].
Врач-дерматовенеролог, осматривающий пациента перед деструктивным вмешательством на коже стоп, должен уметь оценить состояние артерий и вен нижних конечностей, иметь навык пальпации пульса артерий нижних конечностей, так как процессы нормального заживления значительно затрудняет наличие у пациента синдрома хронической ишемии конечности, развивающегося в условиях хронической артериальной недостаточности.
Хроническая артериальная недостаточность обусловлена облитерацией просвета артерий и характеризуется медленным прогрессирующим течением. Постепенная окклюзия артериальных сосудов приводит к тому, что гемодинамические и метаболические компенсаторные механизмы перестают предотвращать угнетение перфузии и приводят к циркуляторной гипоксии тканей дистальных отделов конечностей. Нормальное заживление требует достаточного количества кислорода, необходимого для взаимодействия многочисленных цитокинов, поддержания активности пролиферирующих клеток. В условиях ухудшающегося периферического кровообращения доставка кислорода и метаболических субстратов достаточна для поддержания жизнедеятельности клеток и базального потребления АТФ в покое, но недостаточна для ресинтеза АТФ в условиях его повышенного потребления. Для заживления требуется воспалительная реакция и дополнительный объем перфузии. В условиях присоединения инфекции кислород необходим клеткам для обеспечения реакции кислород-зависимого «респираторного взрыва», приводящего к образованию эндогенных бактерицидных веществ, и для нормальной работы фагоцитоза. Подсчитано, что для заживления раны требуется давление кислорода в тканях более 40 мм рт. ст. При длительно незаживающих ранах давление кислорода может снижаться до 5 мм рт. ст. [3, 13].
Причинами развития хронической артериальной недостаточности могут служить диабетическая ангиопатия, узелковый периартериит, болезнь Рейно, неспецифический аортоартериит, облитерирующий тромбангиит и другие системные васкулиты, а также заболевания соединительной ткани. Однако в конце двадцатого столетия основной причиной развития хронической артериальной периферической недостаточности стал атеросклероз [13].
Как правило, атеросклероз развивается у мужчин старше 40 лет, имеющих сопутствующую патологию в виде нарушения обмена веществ, АГ, гиперхолестеринемии. При облитерирующем атеросклерозе происходят системные дегенеративные изменения сосудистой стенки, когда в субинтимальном слое артерий формируются атеромы, содержащие отложения эстерифицированного и неэстерифицированного холестерина. Это обусловливает сужение артерий и ухудшение кровоснабжения тканей. Атеросклеротические изменения способствуют тромбообразованию, так как покрышка фиброзной бляшки подвержена повреждению и изъязвлению, являясь местом формирования пристеночных тромбов, при этом в зоне атерогенных формирований эндотелиальными и другими клетками вырабатываются факторы, активизирующие тромбоциты [13, 14].
Атеросклеротическое поражение, как правило, мультифокальное. Одним из локусов поражения является бедренно-подколенно-берцовый сегмент. При осмотре и опросе пациента перед деструктивным вмешательством на стопе следует обращать внимание на ключевые симптомы хронической артериальной непроходимости нижних конечностей: болезненность, дискомфорт, онемение, слабость в области мышц нижних конечностей при нагрузке и в покое (симптом перемежающейся хромоты), парестезии, гипотрофию мышечной ткани, атрофическое истончение кожи и подкожно-жировой клетчатки, сниженную температуру и бледность кожных покровов стопы, отсутствие волосяного покрова на коже конечности, гипертрофию и слоистость ногтевых пластинок [13, 15].
.png)
При наличии соответствующих жалоб и клинической картины, выявлении снижения или отсутствия пульсации артерий нижней конечности перед проведением деструктивного вмешательства на ногах следует направить пациента на консультацию сердечно-сосудистого хирурга для проведения ультразвуковой допплерографии и определения дальнейшей тактики ведения. В противном случае возможно не только замедленное заживление раны, но и полное его отсутствие с развитием хронического незаживающего раневого дефекта. В качестве примера приводим собственное клиническое наблюдение.
Пациент К., 59 лет, обратился в отделение сосудистой хирургии с жалобами на незаживающий в течение 6 месяцев дефект, возникший после краевой резекции ногтевой пластины первого пальца стопы справа вследствие лечения онихогрифоза и вросшего ногтя. При расспросе обращал внимание на дискомфорт и боли в области икроножных мышц при ходьбе, перемежающуюся хромоту до 10-50 метров. В анамнезе жизни – длительный стаж курения по одной пачке сигарет в день.
.png)
По данным лабораторных исследований отмечалось повышение уровня глюкозы плазмы натощак до 9 ммоль/л, уровень гликированного гемоглобина – 8,6 ммоль/л, дислипидемия. В общем анализе мочи, клиническом анализе крови и коагулограмме значимых отклонений от нормы не наблюдалось. По данным мультиспиральной компьютерной томографии аорты и артерий нижних конечностей (рис. 3, 4) выявлена окклюзия обеих поверхностных бедренных артерий, правой подколенной артерии, передней и задней большеберцовых артерий справа. По данным анамнеза, объективного осмотра, лабораторных и инструментальных обследований пациенту был выставлен диагноз: «Атеросклероз аорты и артерий нижних конечностей. Окклюзия обеих поверхностных бедренных, правой подколенной артерий, передней и задней большеберцовых артерий справа. Хроническая ишемия правой нижней конечности 4-й степени по классификации Фонтейна–Покровского. Впервые выявленный СД. АГ 2-й степени, II стадии, риск сердечно-сосудистых осложнений 3». Тенденция к заживлению раневого дефекта появилась только после проведенного реконструктивного вмешательства (бедренно-тибиального шунтирования справа) (рис. 5). Полное заживление раневого дефекта достигнуто через 2 месяца.
Обсуждение
Проведение деструктивного вмешательства в области покровных тканей стопы требует настороженности в отношении ряда заболеваний и состояний, влияющих на процессы нормального заживления, таких как СД, метаболический синдром, иммунодефицит. Процессы нормального заживления значительно затрудняет наличие у пациента заболеваний артерий нижних конечностей, основной причиной которых является атеросклероз. Предположить наличие у пациента заболеваний артерий нижних конечностей позволяет выявление определенных факторов риска: возраста старше 50 лет, СД, курения в анамнезе, дислипидемии, АГ, а также наследственности, отягощенной заболеваниями периферических артерий. У пациентов с повышенным риском заболеваний артерий нижних конечностей следует собрать всесторонний медицинский анамнез, обращая особое внимание на болезненность или слабость мышц нижних конечностей при нагрузке и в покое (симптом перемежающейся хромоты), парестезии. При осмотре нижних конечностей следует оценить температуру и целостность кожи, состояние волосяного покрова и ногтевых пластин, наличие гипотрофии мышц. В случае выполнения деструктивного вмешательства на стопе у пациента с заболеваниями артерий нижних конечностей возможно не только замедленное заживление раны, но и полное его отсутствие с развитием хронического незаживающего раневого дефекта [13, 15].
Заключение
Перед плановым деструктивным вмешательством на покровных тканях стопы врач-дерматовенеролог, осмат-ривающий пациента, должен уделять особое внимание признакам хронической артериальной недостаточности кровообращения нижних конечностей. При подозрении на наличие у пациента заболеваний артерий нижних конечностей следует пальпаторно оценить пульсацию в них. Отсутствие или ослабление пульсации артерий ног может говорить об их поражении в виде стеноза или окклюзии и требует более тщательной взвешенной оценки соотношения пользы и риска плановых инвазивных вмешательств на стопе, обязательной предварительной коррекции сопутствующей патологии с целью профилактики осложнений.
КОНФЛИКТ ИНТЕРЕСОВ. Авторы статьи подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
CONFLICT OF INTERESTS. Not declared.
Литература/References
* ФГБОУ ДПО РМАНПО Минздрава России, Москва, Россия
** ФГБУ «ГНЦДК» Минздрава России, Москва, Россия
*** ФГАОУ ВО Первый МГМУ им. И. М. Сеченова Минздрава России, Москва, Россия
Факторы риска замедленного течения репаративных процессов после деструктивного вмешательства на покровных тканях стопы/ А. А. Кубанов, Е. К. Мураховская, Р. Н. Комаров, А. Н. Дзюндзя, И. А. Винокуров
Для цитирования: Кубанов А. А., Мураховская Е. К., Комаров Р. Н., Дзюндзя А. Н., Винокуров И. А. Факторы риска замедленного течения репаративных процессов после деструктивного вмешательства на покровных тканях стопы // Лечащий Врач. 2021; 8 (24): 57-61. DOI: 10.51793/OS.2021.24.8.010
Теги: сахарный диабет, атеросклероз, осложнения, кровоток, заживление
Что такое репаративный процесс
Проблема профилактики осложнений со стороны послеоперационной раны, особенно гнойной природы, является одним из приоритетных направлений в современной хирургии [3, 13]. Острота вопроса определяется высокой частотой инфекционных осложнений в области оперативных вмешательств как в экстренной, так и в плановой хирургии, продолжительностью временной нетрудоспособности, а также большими экономическими потерями [1, 4, 10]. В целом частота гнойных осложнений со стороны операционной раны достаточно высокая, в частности у больных острым аппендицитом она достигает десятка процентов [6, 9]. Поэтому профилактике такого рода осложнений в наши дни придают особенно важное значение [5, 11, 12]. Остается нерешенной и проблема гнойных внутрибрюшных осложнений, в частности при несостоятельности швов кишечного анастомоза. В последние десятилетия благодаря новым лечебным схемам получены существенные успехи в решении этого сложного аспекта [7, 14]. Безусловно, решение вопроса улучшения качества репарации тканей возможно при полноценных знаниях о патогенетических механизмах срыва процесса их заживления [2, 8, 15].
Цель работы – установление сопряженности репаративного процесса и трофики тканей регенерирующих структур.
Материалы и методы исследования. В основу работы положены эксперименты на 19 взрослых беспородных половозрелых собаках обоего пола массой от 7,3 до 14,2 кг. Изучали заживление и морфофункциональное состояние тканей брюшной стенки и двухрядного инвертированного тонкокишечного анастомоза в неосложненных условиях.
Контрольные сроки наблюдения – 1, 3, 5 и 7-е сутки.
Под тиопентал-натриевым наркозом (0,04 г/кг массы) животным выполняли срединный разрез вентральной стенки брюшной полости, резекцию тонкой кишки, наложение анастомоза по типу «конец в конец» по Ламберу-Альберту. Брюшная стенка ушивалась наглухо. В контрольные сроки собакам проводили релапаротомию, биопсию тканей области лапаротомной раны и зоны анастомоза. Проводили инфузионную терапию (внутривенные введения 5 % раствора глюкозы и 0,89 % раствора хлорида натрия из расчета 50 мл/кг массы).
В процессе работы нами применялись следующие методы: экстракция липидов из тканей брюшной стенки и зоны анастомоза, изучение активности фосфолипазы А2 потенциометрическим методом, содержание малонового диальдегида (МДА) оценивали в реакции с 2-тиобарбитуровой кислотой, активность каталазы исследовали спектрофотометрическим методом. Микроскопические исследования проводили при окраске препаратов гематоксилин-эозином. Определяли кровенаполнение тканей шовного валика кишечного соустья. Физическую герметичность швов соустья определяли пневмопрессией. Полученные цифровые данные обрабатывали методом вариационной статистики с использованием критерия t Стьюдента.
Результаты исследования и их обсуждение
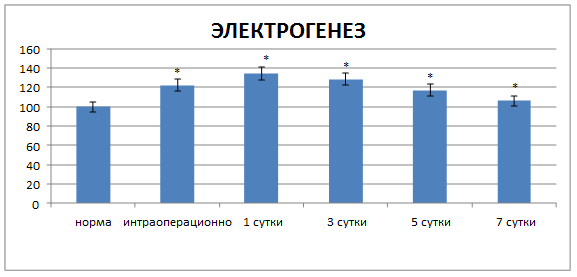
Интраоперационно после формирования межкишечного анастомоза в тканях, захваченных шовным материалом, производили редокс-метрию. Платиновый электрод помещали в ткани области соустья в пяти точках. Таким образом, регистрировали окислительно-восстановительный потенциал тканей соустья тотчас после его формирования (рис. 1).
Рис. 1. Динамика редокс-потенциала в области соустья. * – достоверность изменений относительно нормы при р 0,05), что свидетельствовало о нормализации биоэнергетических процессов. Содержание МДА в тканях по линии анастомоза было выше нормы только на 10,9 % (р
Что такое репаративный процесс
Репаративная регенерации костной ткани представляет собой восстановление после повреждения. Этот процесс имеет большое значение для практической медицины. Костная ткань уникальна, поскольку кость способна полностью восстанавливать даже значительные дефекты в отличие от всех других тканей, в которых регенерация завершается образованием соединительнотканного рубца или гипертрофией органа.
Единого определения термина «репаративная регенерация» не существует. Одни авторы утверждают, что это разновидность физиологической регенерации, которая происходит в условиях экстремальных воздействий на организм, но отличается большей интенсивностью. Другие характеризуют ее как сложный процесс, который вызван разрушением костных структур, количественно превышающий допустимые пределы физиологической регенерации и направленный на восстановление целостности и обеспечения функции.
Процессы регенерации костной ткани челюстно-лицевой области представляют собой сложное переплетение ряда общих воздействий на системном уровне и локальных изменений тканевого метаболизма, включая изменения на молекулярном уровне. В основе репаративной регенерации лежат дифференцировки клеток, их пролиферация, резорбция поврежденной ткани и новообразования кости в ходе ремоделирования, а также формирования органического внеклеточного матрикса с последующей его минерализацией.
Стадии заживления костной ткани челюстно-лицевой области
При заживлении переломов выделяют следующие четыре стадии: репаративная реакция, формирования сращений костных отломков, сращение костных отломков, функциональная перестройка костной мозоли и отломков с формированием органной структуры.
В настоящее время исследователи выделяют несколько стадий репаративной регенерации:
Катаболизм тканей, дифференциация и пролиферация клеточных элементов.
Образование и дифференциация новых тканевых структур.
Формирование сосудистых образований для питания новой ткани.
Перестройка первичного регенерата.
В первой стадии, репаративной реакции кости, различают такие фазы, как острое посттравматическое нарушение тканевого кровоснабжения, некроз клеток с дезорганизацией клеточных структур, пролиферацию нежизнеспособных мезенхимальных стволовых клеток и дифференциацию пролиферирующих клеток в направлении образования костного дифферона (мезенхимальная стволовая клетка — преостеобласт — остеобласт — остеоцит).
Острые посттравматические нарушения тканевого кровоснабжения в области перелома сопровождаются разрывом периоста, эндоста, каналов остеонов, а также костного мозга, сосудов и нервов, мышечной и соединительной тканей, окружающих кость. Данные процессы сопровождаются кровоизлияниями, отеком, макрофагальной инфильтрацией и развитием диффузных ишемических дегенеративнонекротичних изменений в тканях. Указанная фаза продолжается порядка 6-18 часов с момента перенесенной травмы.
Вторая фаза, длительностью 10-24 часов после травмы, сопровождается дезорганизацией структур костной ткани, признаками некроза и макрофагальной клеточной инфильтрацией.
В третьей фазе, которая приходится на промежуток 24-72 часа с момента перелома, на фоне восстановленного кровоснабжения наблюдается пролиферация мезенхимальных стволовых клеток, перицитов микроциркуляторного русла, периоста, эндоста с формированием остеогенной ткани. В зависимости от расположения пролиферирующих клеток выделяют периостальные (клетки периоста), эндостальные (клетки костного мозга) и интермедиарные (клетки костного мозга и сосудов центральных каналов) костные образования.
Четвертая фаза репаративной реакции сопровождается пролиферацией и дифференциацией остеогенных клеток в преостеобласты и остеобласты. Они синтезируют остеоид, который после минерализации превращается в грубоволокнистую костную ткань. Наблюдается активация остеокластов, что резорбируют некротизированную костную ткань.
На стадии формирования сращений костных отломков, которая наступает на 3-5 сутки с момента травмы, образуется костный регенерат, или мозоль, который распространяется в проксимальном и дистальном направлениях. Спустя 2-6 недель этот процесс приводит к слиянию и консолидации костных отломков.
Последняя стадия заживления перелома характеризуется образованием костных сращений, которые могут быть нескольких типов. Первичное костное сращение сопровождается прямым сращиванием отломков на уровне кортикального слоя с формированием новых остеонов. Фиброзно-хрящевое сращение характеризуется развитием в зоне перелома некроза костной и мягких тканей, вялой репаративной реакцией, развивающейся на значительном расстоянии от места перелома, и преимущественным развитием фиброзной, реже хрящевой ткани.
Сложившееся фиброзно-хрящевое сращение кости в результате длительной оссификации может замещаться костной тканью, образуя вторичное сращение костных отломков. В четвертой стадии происходит функциональная перестройка костной мозоли и сросшихся отломков с формированием органной структуры кости.
Клетки и вещества, участвующие в репаративной регенерации костной ткани
Процесс регенерации костной ткани челюстно-лицевой области происходит при участии таких клеток, как остеобласты, остеокласты или остеоциты. Ниже приведена краткая характеристика этих клеточных элементов с указанием особенностей их структуры и функций.
Остеобласты представляют собой костеобразующие клетки, которые происходят из мезенхимальных стволовых клеток. Они округлой формы, размером 20-30 мкм, с эксцентрично расположенным ядром. Эти клетки располагаются в остеогенном слое надкостницы и в периваскулярных пространствах остеонов.
Выделяют четыре типа остеобластов, участвующих в заживлении костной ткани: преостеобласты, пролиферирующие функционально активные остеобласты, созревающие с гипертрофированной эндоплазматической сетью остеобласты, а также дифференцированные малоактивные остеобласты. Основная часть остеобластов синтезируют костную ткань, пока не наступит остановка их функции с последующим превращением их в неактивные клетки.
Эти клетки выстилают поверхность вновь созданной костной ткани, и при помощи системы канальцев соединяется с остеоцитами. Определенная часть остеобластов инкапсулируется в остеоидный матрикс и дифференцируются в остеоциты.
Остеобласты имеют развитый аппарат Гольджи и митохондрии, благодаря чему синтезируют огромное количество межклеточного вещества, в частности протеины и коллагеновые волокна, которые образуют органический костный матрикс — остеоид. Остеобласты синтезируют коллаген I типа из проколлагена, который состоит из одной α2- и двух α1-полипептидных цепочек, образующих спиральную структуру.
Молекула проколлагена содержит два конечных пептида: амино- и карбокситерминальные пропептиды. После секреции проколлагена остеобластами в экстрацеллюлярное пространство эти два пропептида под влиянием энзимов отщепляются от проколлагена, который трансформирутеся в тропоколлаген.
Свободные конечные пропептиды костной ткани попадают в циркулирующую кровь, где можно определить их концентрацию иммуноферментным методом. Этот анализ очень точно указывает на количество синтезированного коллагена I типа, причем уровень аминотерминального пропептида наиболее точно характеризует его метаболизм.
Также остеобласты синтезируют неколлагеновую фракцию белков костного матрикса, которым принадлежит ведущая роль в его минерализации. Это остеокальцин, остеопонтин, остеонектин, и костный сиалопротеин.
Остеокальцин — основной неколлагеновых белок кости, который участвует в связывании кальция и гидроксиапатитов. Он оказывает хемотаксическое воздействие на остеокласты и принимает участие в резорбции кости.
Остеонектин связывает коллаген I типа и гидроксиапатит, принимает участие в образовании начального кристалла (нуклеации) при минерализации кости. Остеопонтин также связывает костные клетки с гидроксиапатитом внеклеточного пространства, но исследования последних лет указывают на участие этого белка в метастазировании опухолей путем облегчения адгезии опухолевых клеток в процессе инвазии.
Костный сиалопротеин содержит сиаловые кислоты. Он является кальцийсвязывающим гликопротеином, обеспечивающим минерализацию и стабилизации структуры коллагена.
Остеоциты, или «звездчатые клетки», имеют большое количество длинных и тонких отростков. Они делятся на три типа, характеристики которых кратко перечислены ниже:
Остеоциты I типа, продуцирующие клетки, синтезируют компоненты костного матрикса.
Остеоциты II типа, зрелые или резорбирующие клетки, участвуют в процессе остеолиза.
Остеоциты III типа, дегенерирующие клетки, располагаются на периферии остеона. Вследствие их деструкции высвобождается значительное количество лизосомальных ферментов и происходит остеолизис костной ткани.
Остеоциты имеют рецепторы к паратгормону, синтезируют остеокальцин, матриксные протеины и склеротин, который является ингибитором Wnt-сигнала в остеобластах. Главной их функцией является передача механического и химического сигналинга остеобластам, покровным клеткам и через них — остеокластам. Эта цепочка играет важную роль для запуска процессов ремоделирования кости в физиологических и в патологических условиях.
Остеокласты представляют собой многоядерные гигантские клетки, которые обеспечивают резорбцию компонентов костного матрикса. Они расположены на поверхности кости в небольших углублениях (эрозионные лакуны или лакуны Хаушипа). В местах контакта с участками резорбции кости цитоплазма остеобластов образует выросты в виде гофрированной каймы, что увеличивает площадь контакта с костью и облегчает поступление в зону резорбции биологически активных клеточных продуктов.
Также остеокласты секретируют в зону резорбции протоны и протеолитические ферменты (катепсин К, цистеинпротеазу, матриксные металлопротеиназы) и удаляют через базолатеральную мембрану продукты распада в окружающее пространство. Для осуществления такого транспорта необходимо присутствие тартратрезистентной кислой фосфатазы (ТРКФ). Существует 5 видов кислых фосфатаз, которые производятся костной тканью, селезенкой, эритроцитами, тромбоцитами и макрофагами. Все виды кислых фосфатаз ингибируются тартратом, кроме пятой изоформы, которая называется ТРКФ-5.
Остеокластогенез, остеобластогенез и ремоделирование кости
Различают следующие функциональные типы остеокластов: молодые, зрелые, функционально активные и неактивные, а также погибающие. Источником происхождения всех остеокластов являются макрофагально-моноцитарные клетки костного мозга.
Важная роль в остеокластогенезе принадлежит системе RANK / RANKL / OPG, которая была открыта в 1997 году. RANKL, экспрессируемый на поверхности остеобластов, связывается с RANK-рецептором, который расположен на мембранах клеток-предшественников остеокластов. Это запускает дифференциацию и активацию остеокластов. Взаимодействие RANKL и RANK происходит в присутствии макрофагального колониестимулирующего фактора (M-CSF), который при помощи высокоафинных трансмембранных рецепторов (c-fms) активирует внутриклеточную тирозинкиназу и стимулирует пролиферацию и дифференциацию предшественников остеокластов, мононуклеаров.
Было доказано, что активность M-CSF значительно повышается при воздействии на остеобласты паратиреоидного гормона, витамина Д3 и фактора некроза опухолей (TNF), однако снижается при воздействии OPG и эстрогенов.
Обнаружено, что продукцию остеокластов стимулирует паратиреоидный гормон. Он синтезируется паращитовидными железами. Гормон поддерживает гомеостаз кальция путем вымывания из кости во внеклеточную жидкость и усиление реабсорбции в канальцах почек. Этот гормон активирует синтез кислой фосфатазы, лактата и цитрата, и подавляет синтез коллагена и щелочной фосфатазы.
При резком повышении уровня паратгормона в крови наблюдается активация зрелых остеоцитов и резорбция кости (остеоцитарный остеолиз). При длительной гиперсекреции паратгормона усиливается остеокластогенез и снижается активность остеобластов, что также подавляет синтез коллагена. Доказано, что длительное введение малых доз паратгормона вызывает анаболический эффект, а это, наоборот, способствует созреванию хрящевой ткани. Он способствует синтезу в почках 1,25-(ОН)-2D3 под влиянием циклического АМФ из 25-(ОН)-2D3.
В отличие от паратгормона, кальцитонин, который секретируется в межфолликулярных клетках щитовидной железы, уменьшает количество и активность остеокластов в костной ткани, подавляет остеоцитарный остеолиз и уменьшает уровень кальция в крови. Кальцитонин стимулирует созревание хондроцитов в эпифизарном хряще.
Согласно зарубежным исследованиям последних лет, ведущая роль в регуляции остеобластогенеза принадлежит костным морфогенетических белкам (BMP, bone morphogenetic protein). Это группа сигнальных факторов роста (цитокины), которыеактивно стимулируют формирование энхондральной костной ткани и регулируют различные клеточные процессы (пролиферацию, дифференцировку, апоптоз, хемотаксис, ангиогенез или продукцию внеклеточного матрикса в тканях).
BMP запускают процесс образования костной ткани за счет экспрессии генов, регулирующих процессы дифференциации мезенхимальных стволовых клеток с последующим образованием клеток-остеобластов. Нарушение регуляции сигнальной системы BMP очень часто обнаруживаются при онкологических заболеваниях.
В настоящее время были описаны 47 белков подсемейства BMP, взаимодействующих со специфическими BMP-рецепторами (BMPs). В процессе межклеточных взаимодействий в костной ткани челюстно-лицевой области особенно важны следующие:
BMP2: стимулируют дифференцировку остеобластов.
BMP3: способствуют образованию новой костной ткани.
BMP7: активируют дифференцировку остеобластов и продукцию SMAD1.
BMP8a: принимают непосредственное участие в развитии кости и хряща.
В практической медицине BMP используют для стимуляции процессов заживления кости. Их вводят в костный имплантат, откуда они попадают в места перелома для улучшения остеогенеза.
Костные клетки интенсивно выделяют в межкостный матрикс трансформирующий фактор роста β1 (ТGFβ1), который активирует дифференциацию мезенхимальных стволовых клеток по остеобластическому и хондральному типу, стимулируют процессы репаративной регенерации костей, усиливают пролиферацию и синтез коллагена.
Процессы, связанные с морфогенезом клеток, регулирует также Wnt-сингалинг. Этот процесс включает белки, открытые в начале 1980-х годов как маркеры некоторых видов онкологических заболеваний. Они являются также ключевыми регуляторами процессов ремоделирования и регенерации костной ткани, дифференцировки мезенхимальных стволовых клеток.
В основе канонического пути Wnt-сигналинга в костной ткани лежит стабилизация белка цитоплазмы β-катенина. При отсутствии сигнала он неактивен и быстро разрушается. При активации β-катенина через Wnt, сам Wnt связывается с поверхностными рецепторами клеток, в качестве которых выступает трансмембранный белок Фрайзленда. В результате этого тормозится разрушения β-катенина, он накапливается в цитоплазме и после проникает в ядро. Там он взаимодействует с белками TCF / LEF, которые избирательно связываются с определенными белками-активаторами и последовательностями ДНК.
Таким путем происходит активация определенных генов, отвечающих за регенерацию костной ткани. Другой, или неканонический (β-катениннезависимый) путь Wnt-сигналинга регулирует полярность клеток, стимулирует метаболизм кальция и реорганизацию цитоскелета. Передача Wnt-сигналов стимулирует продукцию OPG. Доказано, что у человека в активации Wnt-сигналинга привлечено как минимум 22 Wnt-лигандов.
Антагонистом Wnt / β-катенинсигнального пути является склеротингликопротеид, который производится остеоцитами неповрежденной кости. Он препятствует дифференцировке MSC. При возникновении повреждений костной ткани челюстно-лицевой области остеоциты передают сигнал покровным клеткам, которые выстилают поверхность трабекулы. Под влиянием простагландинов и факторов роста, которые при этом выделяются, покровные клетки отслаиваются от поверхности кости, образуя специфический навес. Клетки навеса сочетаются с остеоцитами, с капилляром и образуют компартмент костного ремоделирования.
Недавно были открыты такие регуляторы межклеточных взаимодействий между остеобластами и остеокластами, как семафорины и их рецепторы плексины. Cемафорины образуют семейство молекул из 8 основных классов секреторных и трансмембранных белков, которые отвечают за передачу сигналов по аксонам. Они регулируют рост, развитие и функционирование клеток нервной, сердечно-сосудистой, иммунной, дыхательной, а также опорно-двигательной систем.
В частности, Semaphorin 4D (Sema4D), который является производным остеокластов, действует на мембранный рецептор Plexin-B1 на поверхности остеобластов, подавляя функцию последних. В результате наблюдается активация резорбции костной ткани. Семафорин 3В способствует активации остеокластов, а семафорин 3А, наоборот, стимулирует остеогенез. Исходя из этого, для лечения остеопении важное значение имеет ингибирование семафоринов 4D и 3В.
Важным секреторным производным остеокластов является белок SLIT3. Он стимулирует пролиферацию клеток-остеобластов благодаря активации β-катенинового пути. Аутокринная сигнализация SLIT3 ингибирует резорбцию костной ткани путем подавления дифференцировки преостеокластов. В экспериментальных исследованиях было показано, что модифицированные животные с отсутствием SLIT3 или его рецептора Robo 1 имеют низкие показатели образования костной ткани и высокую скорость ее резорбции.
Практическая оценка процессов регенерации костной ткани
Маркеры синтеза костной ткани косвенно характеризует активность остеобластов. Эти клетки принимают активное участие в формировании костной ткани, производят коллаген I типа плюс другие компоненты остеоида, участвуют в минерализации остеоида гидроксиапатитом.
Первым биохимическим маркером костного ремоделирования является фермент щелочная фосфатаза, который в 1929 году был введен в клиническую практику и сегодня применяется. Существует 4 изоформы этого фермента: костная, печеночная, кишечная и плацентарная.
Лабораторным показателем активности остеобластов является костная щелочная фосфатаза. Это гликопротеин, который принимает участие в минерализации костного матрикса. Одновременное повышение КЩФ и паратгормона может указывать на развитие остеодистрофии с высоким уровнем костного ремоделирования, а снижение этих показателей может свидетельствовать об адинамическом состоянии костной ткани челюстно-лицевой области.
Наиболее информативным маркером формирования кости является остеокальцин. Этот неколлагеновый белок костного матрикса, содержащий гидроксиапатит, может считаться специфическим для костной ткани и дентина. Он синтезируется преимущественно остеобластами и формирует внеклеточный матрикс кости.
Фракция вновь синтезированных остеокластов высвобождается в кровоток, поэтому именно этот маркер указывает на скорость ремоделирования костной ткани. Повышенный уровень паратгормона в крови подавляет активность остеобластов, продуцирующих остеокластов, и снижает концентрацию остеокластов в крови и костной ткани.
В процессе синтеза коллагена I типа остеобластами с проколлагена I типа от него в результате действия специфических ферментов отделяются амино- и карбокситерминальные фрагменты. Соотношение между количеством зрелого коллагена, откладывающегося в костный матрикс, и количеством терминальных молекул, которые поступают в кровеносное русло, должно быть равно единице. Благодаря этому по показателям АКФ, ККФ в сыворотке крови можно судить о синтетической активности остеобластов по синтезу коллагена I типа.
Следующая группа показателей костного ремоделирования — это маркеры резорбции костной ткани. Следует отметить, что они в течение суток меняют свой уровень, поэтому определять их необходимо в одно и то же время суток, лучше утром. К маркерам резорбции костной ткани относятся ферменты, участвующие в разрушении костного матрикса под влиянием остеобластов, и продукты разрушения коллагена I типа.
Это, например, тартратрезистентная кислая фосфатаза (TRAP) — металлосодержащий энзим, один из 6 изоферментов кислой фосфатазы. Он секретируется остеобластами в внеклеточную среду во время резорбции. Существуют формы TRAP-5а и 5в, но TRAP-5в синтезируется остеобластами, а TRAP-5а имеет макрофагальное происхождение. Активность TRAP-5в в плазме крови является показателем процессов резорбции кости.
Гидроксипролин является основной аминокислотой в составе коллагена. Он не считается аутоспецифичным маркером костной ткани, ведь только 50% этой аминокислоты находится в костях, а остальные 50% являются компонентом других белков, в частности эластина, ацетилхолинэстеразы и фактора комплемента С1q.
Большая часть его после разрушения коллагена окисляется в печени и только 15% выводится с мочой. Содержание гидроксипролина зависит от характера питания, возраста человека, наличия опухоли с распадом и демонстрирует циркадный ритм с пиком между 0.00 и 8.00 утра.
14% аминокислотного состава коллагена составляет оксипролин. Он синтезируется остеобластами и также является маркером костной резорбции. В наше время используют более специфические маркеры костной резорбции, такие как продукты распада коллагена I типа. К ним относятся пиридинолин (ПИД) и дезоксипиридинолин (ДПИД). Они находятся в тканях, содержащих коллаген I, II, III типа. ПИД является важным химическим соединением, но ДПИД встречается только в коллагене, поэтому его оценивают как селективный костный маркер.
Также широко применяют в медицинской практике определение показателей пептидов коллагена I типа, NTX и СTX. Уникальность этих показателей заключается в быстром росте их уровня при заболеваниях, сопровождающихся высокой резорбцией костной ткани (например, при остеопорозе, метастазах в кости), а также быстрому их снижению (в течение нескольких недель) на фоне антирезорбтивной терапии.
Следующий маркер резорбции костной ткани — это костный сиалопротеин (BSP). В процессе остеолиза (физиологического или патологического) происходит разрушение костного матрикса ферментами остеобластов с выделением в кровь сиалопротеина с соответствующим ростом лабораторных показателей BSP. Костный сиалопротеин присутствует только в зрелых остеобластах и не обнаруживается в их предшественниках, поэтому BSP может служить маркером поздней дифференцировки клеток кости.
Репаративная регенерация костной ткани челюстно-лицевой области связана с деятельностью остеогенных клеток. В основе локальной регуляции репаративной регенерации лежат несколько сигнальных путей, такие как молекулярная система RANK / RANKL / OPG, костные морфогенетические белки, Wnt-сигналинг и другие.
Остеобластогенез и остеокластогенез характеризует биохимические маркеры костного ремоделирования, определение которых позволяет установить скорость обменных процессов в костной ткани, выявлять пациентов с повышенным риском и проводить раннюю оценку эффективности назначенного лечения, прогнозировать риск возникновения осложнений, диагностировать на ранних сроках появление костных метастазов и др.
.png)
.png)